几种微生态制剂对刺参幼参生长、存活和消化酶活性的影响
郝佳1、2,吴英茜1,刘晗奇1,蔡明城1、3,张赛赛1,李世陶1, 王华1,王伟1
(1.大连海洋大学 农业部北方海水增养殖重点实验室,辽宁 大连 116023;2.大连市水产技术推广总站,辽宁 大连 116023;
3.长海县水产技术推广站,辽宁 大连 116500)
摘要:以体质量(2.00±0.52)g的刺参Apostichopus japonicus幼参为研究对象,定期将光合细菌、乳酸杆菌、芽孢杆菌、海洋红酵母4种微生态制剂及其四者的复合微生态制剂(按照终浓度比为4∶1∶4∶1的比例)添加到刺参幼参培育水体中,探讨其对刺参幼参生长、存活率和消化酶活性的影响。结果表明:养殖水体中添加不同的微生态制剂对刺参幼参的生长和存活有一定的促进作用,其中增重率和特定生长率最高出现在复合微生态制剂组,分别达到(125.97±8.26)%和(1.66±0.06)%/d,与对照组有显著性差异(P<0.05);添加微生态制剂能够显著提高刺参幼参的消化酶活性,尤其是添加将4种菌剂按适当比例复合的微生态制剂后,刺参幼参的消化酶活性与其他微生态制剂组相比有显著性差异(P<0.05)。研究表明,将4种有益菌按照一定比例复合后投放到幼参培育水体中相对于单个菌投放更能显著提高幼参消化酶的活性。
关键词: 刺参幼参;微生态制剂;生长;存活率;消化酶活性
刺参Apostichopus japonicus又称仿刺参,隶属于棘皮动物门Echinodermata、海参纲Holothuroidea、楯手目Aspidochirota、刺参科Stichopodidae、仿刺参属Apostichopus,具有极高的营养和药用价值[1],其蛋白质含量高、糖类丰富且不含胆固醇,并具有滋补强身的保健功能[2]。近年来,刺参养殖业在中国北方地区发展迅速,在山东半岛、辽宁半岛的养殖面积日益扩大,已经形成一个新的海水养殖产业[3]。微生态制剂因其良好的作用及环境友好等特点被越来越多的应用在刺参养殖过程中。
微生态制剂是从自然环境中筛选出来的微生物菌体,经培养繁殖后制成含有大量有益菌的活菌制剂,它不含任何污染物和化学有害物,对改善水质,提高养殖动物成活率和相对增长率,降低发病率,提升水产品品质,有一定的促进作用[4-8]。微生态制剂可分为单一菌微生态制剂和复合微生态制剂,前者是由单一菌种构成,后者则是由多菌种混合构成[9]。目前,用于微生态制剂的菌种较多,可用于制作海参微生态制剂的菌种有光合细菌、硝化细菌、反硝化细菌、芽孢杆菌、酵母菌、噬菌蛭弧菌、碱杆菌属、黄杆菌等[10]。本研究中,以乳酸杆菌、海洋红酵母、芽孢杆菌、光合细菌为单一菌剂和复合菌剂的主要成分,探讨了其在刺参养殖过程中的应用效果,以期为微生态制剂及其复合制剂在刺参养殖中的应用提供参考依据。
1 材料与方法
1.1 材料
试验用刺参购自辽宁省营口海参育苗厂,规格为(2.00±0.52)g。
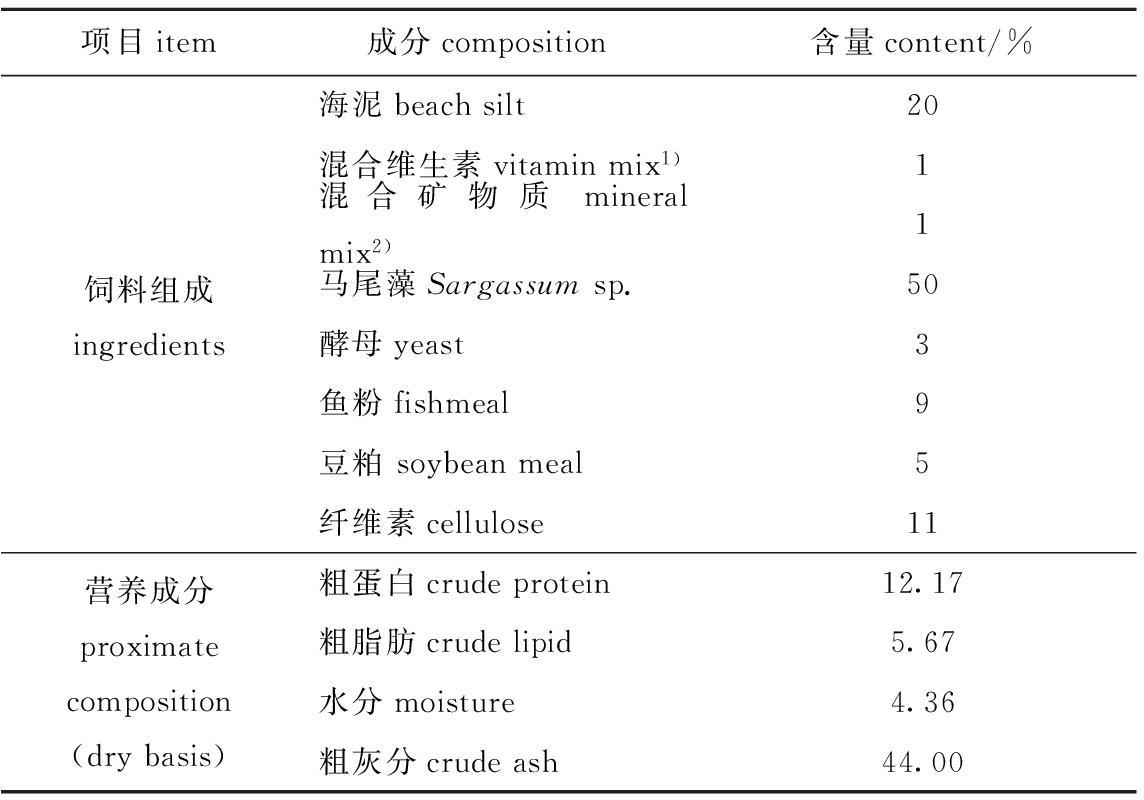
4种微生态制剂购自辽宁省大连市化工研究院,其中光合细菌和海洋红酵母活菌浓度均为6×1010 cfu/mL;枯草芽孢杆菌和乳酸菌活菌浓度均为3×1010 cfu/mL。刺参饵料是由大连海洋大学科研基地提供(配方见表1)。
注:1)维生素混合物(每kg饲料)包含维生素A 100万IU,维生素C 1万IU,维生素D3 30万IU,维生素E 8000 mg,维生素K3 1000 mg,维生素B1 2500 mg,维生素B2 1500 mg,维生素B6 1000 mg,维生素B12 20 mg,烟酸 1000 mg,泛酸钙 10 000 mg,叶酸 100 mg,肌醇 10 000 mg,载体、葡萄糖、水均小于10%
2)矿物质混合物(mg/40 g预混料)包含NaCl 107.79,MgSO4·7H2O 380.02,NaHPO4·2H2O 241.91, KH2PO4 665.20, Ca(H2PO4)·2H2O 376.70, Fe citrate 82.38,Ca lactate 907.10,Al(OH)3 0.52, ZnSO4·7H2O 9.90,CuSO4 0.28,MnSO4·7H2O 2.22,Ca(IO3)2 0.42,CoSO4·7H2O 2.77
Notes:1) Vitamin mixture ( per kg feed):Vitamin A, 1 000 000 IU; Vitamin C, 10 000 IU; Vitamin D3, 300 000 IU; Vitamin E,8000 mg;Vitamin K3, 1000 mg; Vitamin B1,2500 mg; Vitamin B2,1500 mg; Vitamin B6,1000 mg; Vitamin B12,20 mg; Niacine (Nicotic acid),1000 mg; Ca panthothenate, 10 000 mg; Folic acid,100 mg; Inositol,10 000 mg; less than 10% of carrier, glucose, and moisture
2)Mineral mixture (mg/40 g):NaCl, 107.79; MgSO4·7H2O, 380.02; NaHPO4·2H2O, 241.91; KH2PO4, 665.20; Ca(H2PO4)·2H2O,376.70; Fe citrate,82.38; Ca lactate,907.10; Al(OH)3,0.52; ZnSO4·7H2O, 9.90; CuSO4,0.28; MnSO4·7H2O, 2.22; Ca(IO3)2,0.42; CoSO4·7H2O,2.77
1.2 方法
1.2.1 不同菌种剂量配比 根据各菌种活菌浓度,同时参考厂家提供的使用浓度并根据预实验结果,确定具体的添加量,各组具体添加量见表2。其中,F组的实际添加量是根据D组中微生态制剂的原浓度,按照终浓度比为4∶1∶4∶1计算得出。
1.2.2 试验设计 试验在容积为200 L的水槽中进行,每个水槽放入规格一致、健康的刺参幼参40头,先暂养一周,以适应实验室的养殖环境。正式试验期间,对水槽连续充气,每2 d换水一次,吸底一次,每天投喂2次,投饵量为刺参质量的1.5%~2.0%,养殖周期为60 d。试验共设6组,5个试验组和1个对照组,分别记为A(对照)、B、C、D、E、F组,每组设3个平行。按照菌种添加量(表2)向各组水体中添加菌剂,换水后补加菌剂,即每2 d添加一次。
1.2.3 生产性能指标测定 试验开始前,将选取的刺参饥饿24 h,用滤纸吸干其体表水分,称量总质量,除以刺参头数测得刺参的初始体质量;养殖试验结束时,用同样方法称量刺参终末体质量。生长性能指标的计算公式为
存活率(SR,%)=(Nt/N0)×100,
增重率(BWG,%)=(Wt-W0)/W0×100,
特定生长率SGR(%/d)=(ln Wt-ln W0)/t×100。
其中:W0、Wt分别为试验初始和终末时刺参的平均体质量(g);N0和Nt分别为试验初始和终末时刺参的存活数;t为养殖时间(d)。
1.2.4 消化酶指标测定 在养殖试验结束时,从各组随机选取10头刺参,用生理盐水冲洗干净,剪开刺参体壁放出体腔液,剥离出刺参肠道,然后用滤纸吸干刺参肠道水分,取0.5 g刺参肠道同一定配比的生理盐水置于研钵中反复研磨至呈悬浊液状态,整个过程均在冰盘上操作。将研磨好的组织液在低温冷冻离心机上以1358 g离心15 min,取上清液备用。测定不同消化酶时,将上清液按照最适稀释倍数稀释后使用。
消化酶测定试剂盒均购自南京建成生物工程研究所,根据各试剂盒使用说明书,采用碘-淀粉比色法计算淀粉酶活力,采用比色法测定脂肪酶活力,采用福林-酚试剂法测定蛋白酶活力。
1.3 数据处理
试验数据用 Excel 2003软件进行初步处理,并以平均值±标准误表示。用SPSS 17.0软件进行单因素方差分析,用Duncan氏法进行多重比较,显著性水平设为0.05。
2 结果与分析
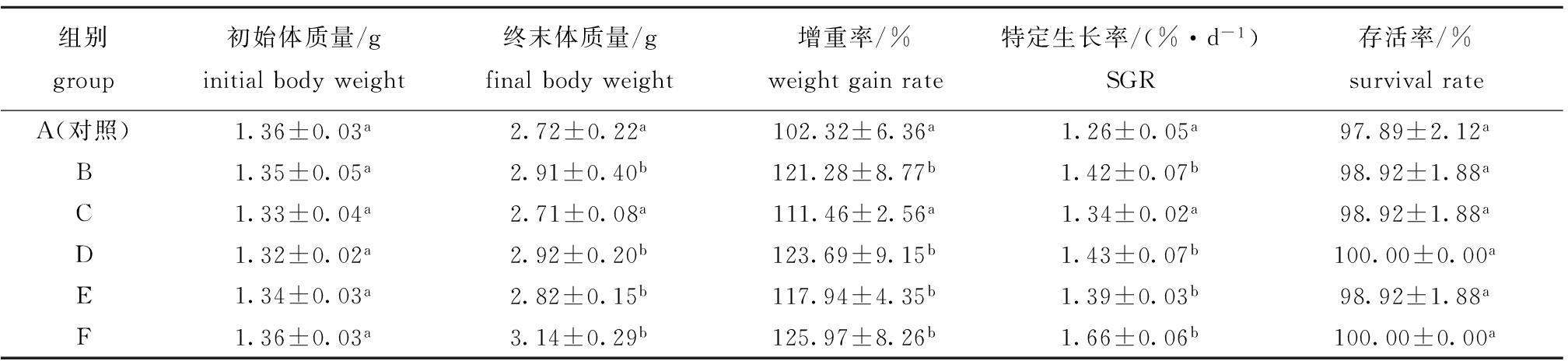
2.1 微生态制剂对幼参生长和存活率的影响
从表3可见,添加微生态制剂的试验组与对照组相比,增重率和特定增长率都有所提高,对刺参幼参的存活率也有一定的促进作用。经单因素方差分析和Duncan多重比较显示:除C组外,其他微生态制剂添加组的终末体质量、增重率和特定生长率较对照组均有显著增加(P<0.05);其中添加复合微生态制剂的F组增重率和特定生长率均高于其他微生态制剂添加组,对照组的增重率和特定生长率最低;各组幼参的存活率无显著性差异(P>0.05),其中D组和F组的存活率最高,均为100%。
注:同列中标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters within the same column are significant differences at the 0.05 probability level, and the means with the same letters within the same column are not significant differences
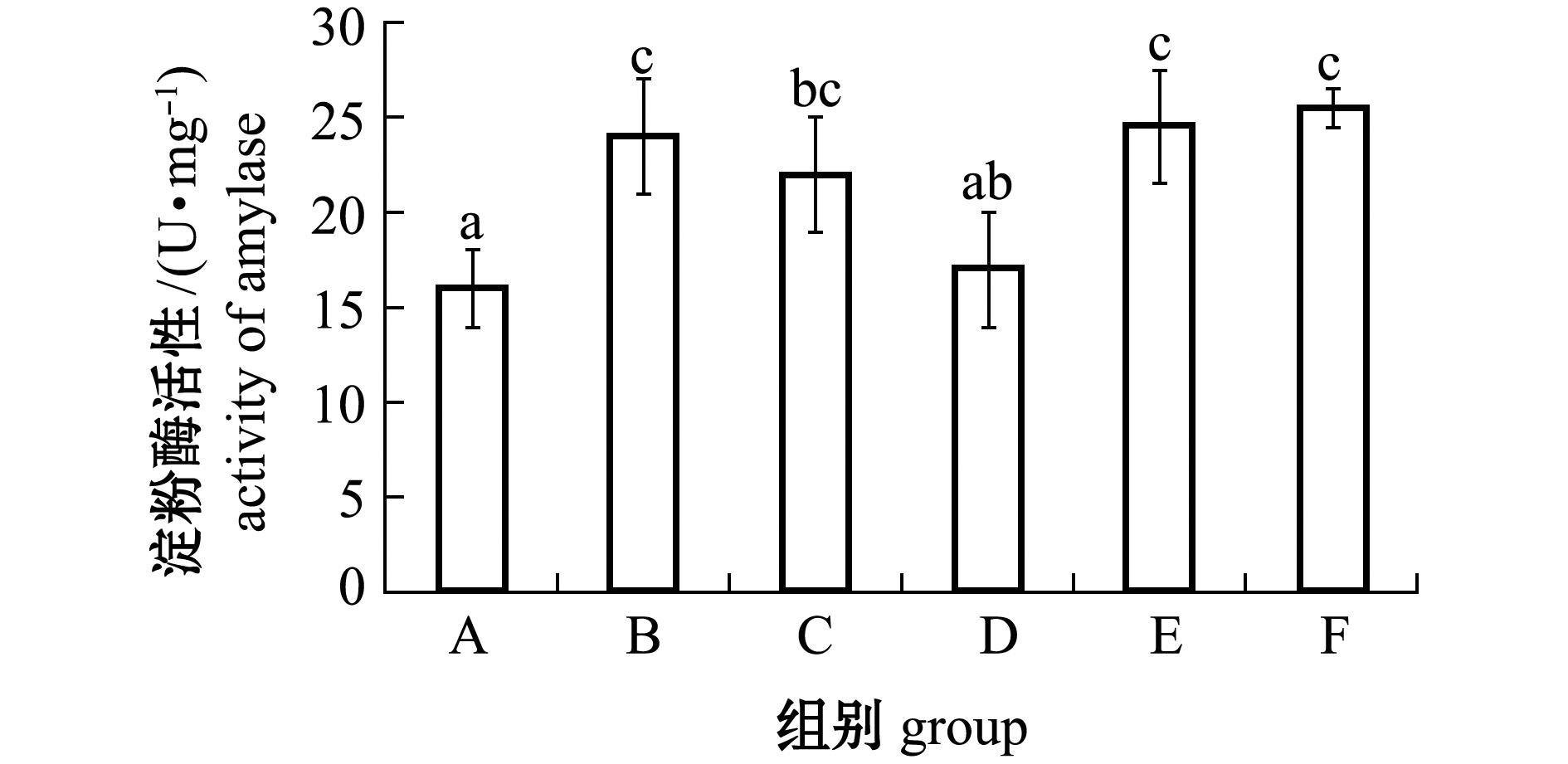
2.2 微生态制剂对幼参肠道淀粉酶活性的影响
从图1可见:各微生态制剂添加组的淀粉酶活性均比对照组高,其中添加复合微生态制剂的F组淀粉酶活性最高;除D组外,其他微生态制剂添加组的淀粉酶活性均较对照组显著提高(P<0.05),B、E、F组均显著高于D组(P<0.05)。
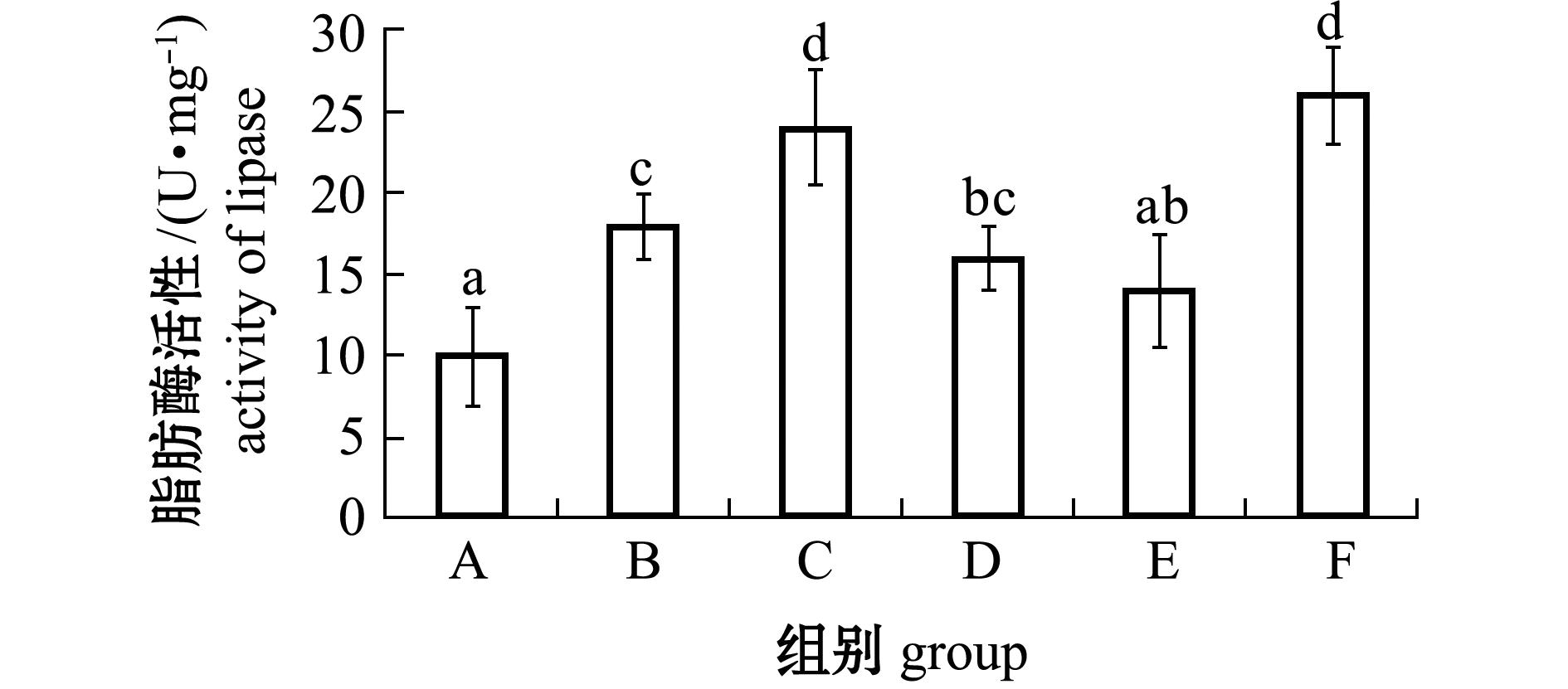
2.3 微生态制剂对幼参肠道脂肪酶活性的影响
从图2可见:各微生态制剂添加组的脂肪酶活性均比对照组高,其中添加复合微生态制剂的F组脂肪酶酶活性最高;除E组外,其他微生态制剂添加组的脂肪酶活性均较对照组显著提高(P<0.05)。
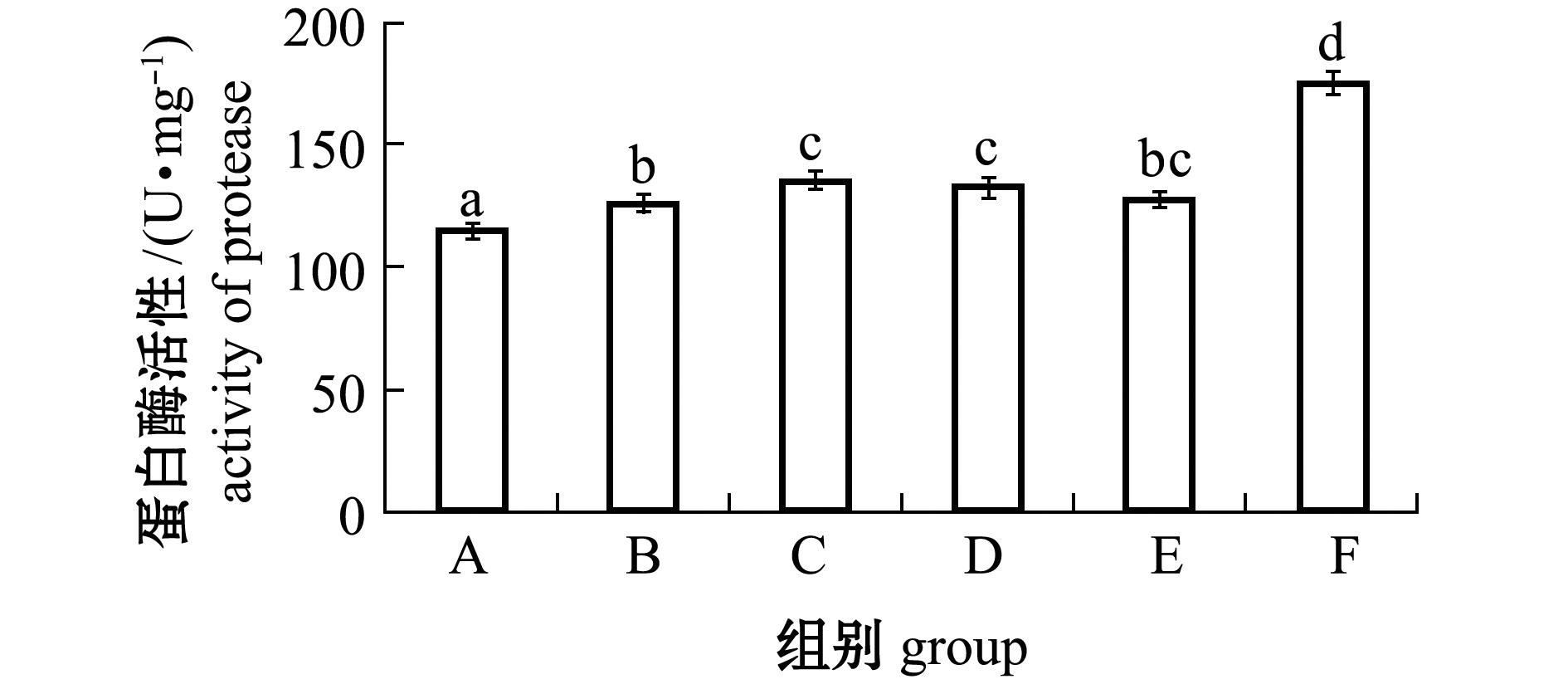
2.4 微生态制剂对幼参肠道蛋白酶活性的影响
从图3可见:添加复合微生态制剂的F组蛋白酶活性最高;各微生态制剂添加组的蛋白酶活性均较对照组显著性提高(P<0.05);而C、D、E、F组酶活性均显著高于B组(P<0.05)。
3 讨论
3.1 微生态制剂对幼参生长和存活率的影响
微生态制剂在水产动物养殖中的应用主要有两种:一是作为水质改良剂,二是作为水产动物体内微生态环境的改良剂。作为水质改良剂,于向阳等[11]在养殖水体中添加EM菌后表明,EM 菌能净化水质,分解海参粪便和大分子有机物,提高饵料利用率,提高单位水体育苗产量和成活率。而作为饲料添加剂时,华雪铭等[12]在饲料中添加0.2%的芽孢杆菌后发现,能显著促进异育银鲫的生长。与只添加芽孢杆菌不同的是,袁成玉等[13]分别向刺参基础饲料中添加光合细菌、芽孢杆菌及其二者的复合菌,结果表明,试验组刺参的特定生长率均显著大于对照组。田维熙等[14]利用光合细菌培育中国对虾,幼体成活率比对照组高出20%。本研究中,在水中添加微生态制剂的试验组与对照组成活率差异不显著,但其特定生长率却显著高于对照组(P<0.05)。说明微生态制剂对刺参幼参的生长具有良好的促进作用。其作用机制可能是因为微生态制剂进入海参体内能刺激和促进肠道有益微生物的增殖,调节肠道 pH,刺激肠道微生物的生长和活性,提高了微生物对饲料的酶解率,从而增强了海参的消化机能,提高了饲料的消化率[10]。另外,有益微生物如弧菌、假单胞菌、杆状菌和乳酸菌等,作为非机会菌能够抑制机会菌的繁殖和生长,使幼参处于健康平衡状态;在越冬阶段和成体阶段,也是通过调节和改善刺参肠道功能,进而促进刺参生长的[15]。
从微生态制剂对刺参存活率的影响来看,本试验中6个试验组无显著性差异(表3),但芽孢杆菌制剂组和复合微生态制剂组要略高于其他组,尤其是经过优化组合的复合菌,对刺参的生长、存活率等都有比较明显的促进作用,这与郝佳等[16]的研究结果相似。而袁成玉等[13]研究结果显示,投放微生态制剂组的成活率与对照组有显著性差异(P<0.05),要高出对照组将近6个百分点。这与本研究结果不同。
结合生长指标分析,乳酸杆菌、海洋红酵母、芽孢杆菌、光合细菌4种益生菌,通过有机的配合在一起,相互之间互为补充,一定程度上能够起到促进刺参生长的作用。
3.2 微生态制剂对幼参消化酶活性的影响
周围环境的改变能够影响养殖动物自身机能的适应性,酶活力的改变就是其适应方式中的一种[17]。在饲料中添加益生菌,能够显著改变养殖动物淀粉酶、脂肪酶、蛋白酶等消化酶类的活力。研究表明,益生菌在其代谢过程中会产生多种生物活性物质,这些生物活性物质能有效促进其他酶类的产生。如芽孢杆菌,其产生的酶类具有较强的蛋白酶、淀粉酶和脂肪酶活性。有研究发现,芽孢杆菌对对虾肠道中蛋白酶活性有显著影响[18]。除此之外,芽孢杆菌还具有降解饲料中复杂化合物的酶、促进肠道内营养物质的消化吸收、提高饲料利用率的作用,芽孢杆菌可产生蛋白酶、淀粉酶和脂肪分解酶,这些活性消化酶可以帮助海参提高对营养物质的消化和吸收[19]。除芽孢杆菌外,乳酸杆菌还会产生超氧化物歧化酶,具有提高养殖动物免疫力、防止毒素侵害的作用。而消化酶活力的高低直接影响动物对饲料的利用率。有研究表明,饲料成分的改变会相应影响动物消化系统的适应性。一般来说,饲料中某种成分的增加,动物机体中负责消化该成分的消化酶活力就会随着该成分的增加而增加,同时,其他消化酶的活力也会随之受到一定的影响[20-21]。本研究中,微生态制剂对刺参幼参消化酶活力有显著影响,这可能是刺参消化系统通过调节消化酶的分泌对食物中淀粉含量、蛋白质含量和脂肪含量的增多做出的反应。Pan等[22]在试验组鲤中投入芽孢杆菌制剂,并对鲤肠道蛋白酶和淀粉酶活性进行测定,结果表明,蛋白酶和淀粉酶活性分别比对照组提高了20.5%和61.9%且差异显著(P<0.05),这与本研究结果相符。关于微生态制剂投放的方式,有研究认为,直接投放于水体中更有利于提高脂肪酶的活性[23]。尽管本研究中没有探讨投放方式对于刺参消化酶活性的影响,但作者在其他试验中也发现,将微生态制剂添加到饲料中没有直接投放到水体中对刺参的促生长效果显著(另文发表)。
总之,养殖水体中添加微生态制剂可以提高刺参消化酶活性,提高成活率,促进生长。本试验结果还表明,将4种有益菌按照一定比例复合投放到幼参水体中相对于单个菌种投放,对刺参消化酶的活性影响更加明显。因此,获取最佳有益菌的配比可能将成为今后微生态制剂研究的重要方向之一。
参考文献:
[1] 廖玉麟.我国的海参[J].生物学通报,2001,35(9):12-15.
[2] 包鹏云,丁鉴锋,常亚青,等.糖萜素对海参生长性能和消化酶活性的影响[J].水生动物营养,2011(3):62-65.
[3] 单红云,王庆波,周影,等.EM菌在海参育苗中的应用[J].齐鲁渔业,2007,24(7):22-24.
[4] 毕永红,王武.微生态制剂及其在集约式水产养殖中的应用[J].水产科技情报,2008,28(1):15-18.
[5] Janaial D E,Schwinden P,Petrus J.Rheological and physico-chemical characterization of prebiotic microfilltered fermented[J].Milk Journal of Food Engineering,2010,124(7):48-53.
[6] Li Y M,Jacobson L H,Manley H,et al.Effect of abomasal prebiotic supplementation on sheep faecal microbiota[J].New Zealand Journal of Agricultural Research,2010,10(4):12-15.
[7] Wu M Y,Zhao S M,Kang J H,et al.Preparation and characterization of molecular weight fractions of glycosaminoglycan from sea cucumber Thelenata ananas using free radical[J].Depolymerization Carbohydrate Research,2010,96(12):253-256.
[8] Xu D M,Zhang X L,Li M.Freeze drying of sea cucumber coated with nanoscale[J].Silver Drying Technology,2008,15(4):78-81.
[9] Hou Q L.Role and functions of beneficial microorganisms in sustainable aquaculture[J].Bioresource Technology,2009,100(16):24-28.
[10] 巩玉辉,陈翠翠,马玉堃,等.微生态制剂在海参养殖中的应用[J].中国饲料,2012,8(5):37-39.
[11] 于向阳,宋刚.EM菌在辽西刺参育苗中的应用[J].农业技术与装备,2011,25(3):14-16.
[12] 华雪铭,周洪琪,邱小珠,等.饲料中添加芽孢杆菌和硒酵母对异育银鲫的生长及抗病力的影响[J].水产学报,2001,25(5):448-453.
[13] 袁成玉,张洪,吴垠,等.微生态制剂对幼刺参生长及消化酶活性的影响[J].水产科学,2006,26(4):125-129.
[14] 田维熙,陈俊芹,黄莉莉,等.光合细菌在对虾养殖中应用效果的研究[J].饲料研究,1995(8):4-6.
[15] 刘朝阳,孙晓庆,范士亮.有益微生物在刺参养殖中的综合应用[J].中国水产,2006,7(5):58-59.
[16] 郝佳,谢唤,沈双烨,等.不同配方EM 菌对规模化养殖刺参生长和存活的影响[J].现代农业科技,2013(11):290-293.
[17] Hassett R P,Landry M R.Seasonal changes in feeding rate,digestive enzyme activities and assimilation efficiency of Calanus pacificus[J].Marine Ecology-Progress Series,1990,62(3):203-210.
[18] 丁贤,李卓佳,陈永青,等.芽孢杆菌对凡纳对虾生长和消化酶活性的影响[J].中国水产科学,2004,11(6):580-584.
[19] 谢凤行,赵玉洁.几种微生态制剂在水产养殖中的研究进展和展望[J].天津农业科学,2006(4):18-21.
[20] Gangadhara B,Nandeesha M C,Varghese T J,et al.Effect of varying protein and lipid levels on the growth of rohu,Labeo rohita[J].Asian Fish Sci,1997,10(2):139-147.
[21] 杨代勤,严安生,陈芳,等.不同饲料对黄鳝消化酶活性的影响[J].水产学报,2003,27(6):558-563.
[22] Pan K C,Yang H B.Progress in study of mechanism of Bacillus[J].Feed Industry,1997,18(9):32-34.
[23] 冯俊荣,陈营,李秉钧.微生态制剂对牙鲆幼鱼脂肪酶的影响[J].水产科学,2008,27(2):64-66.
Effects of several types of probiotics on growth, survival and digestive
enzyme activity in juvenile sea cucumber Apostichopus japonicus
HAO Jia1,2,WU Ying-qian1,LIU Han-qi1, CAI Ming-cheng1,3,ZHANG Sai-sai1,
LI Shi-tao1,WANG Hua1,WANG Wei1
(1.Key Laboratory of Mariculture & Stock Enhancement in North China’s Sea, Ministry of Agriculture, Dalian Ocean University, Dalian 116023, China; 2.Fisheries Technical Extension Station of Dalian, Dalian 116023, China; 3.Fisheries Technical Extension Station of Changhai County, Dalian 116500, China)
Abstract: Probiotics comprised of only photosynthetic bacteria, Lactobacillus, Bacillus, and oceanic red yeast or mixture of those microorganisms at a ratio of 4∶1∶4∶1 were regularly added into the tanks where sea cucumber Apostichopus japonicus with body weight of (2.00±0.52)g was cultured to evaluate the effect of several types of probiotics on growth, survival and digestive enzyme activity in juvenile sea cucumber. The results showed that addition of the probiotics led to improve significantly the growth rate and survival(P<0.05),with the maximal weight gain (125.97±8.26)% and specific growth rate(1.66±0.06)%/d in the sea cucumber juveniles in the water supplemented with the mixture of the microorganisms, significantly higher than those in the juveniles in the control group (P<0.05). There were significantly higher digestive enzyme activities in the sea cucumber juveniles in the water supplemented with probiotics, especially supplemented with the mixture of the probiotics, than in the juveniles in the control group (P<0.05).
Key words: juvenile Apostichopus japonicus; probiotics; growth; survival rate; digestive enzyme activity
通信作者: 王伟(1978—), 男, 博士, 副教授。E-mail:wangwei@dlou.edu.cn
作者简介: 郝佳(1980—), 男, 硕士研究生。E-mail:13500792868@163.com
基金项目: 大连市科学技术基金资助项目(2011J21DW011);国家自然科学基金资助项目(41101481);辽宁省高等学校杰出青年学者成长计划(LJQ2013080)
收稿日期: 2014-07-22
中图分类号:S917.1
文献标志码:A
文章编号:2095-1388(2015)03-0248-05
DOI:10.16535/j.cnki.dlhyxb.2015.03.002