光棘球海胆壳中化学成分的分离、鉴定及其抗肿瘤活性
朱春芃
1,苑朕昱
1,宋永相
2,佟长青
1,曲敏
1,金桥
1,李伟
1
(1.大连海洋大学 食品科学与工程学院,辽宁 大连 116023;2.中国科学院热带海洋生物资源与生态重点实验室,广东省海洋药物重点实验室,中国科学院海洋微生物研究中心,中国科学院南海海洋研究所,广东 广州 510301)
摘要:采用硅胶柱色谱及薄层制备色谱等手段,从光棘球海胆Strongylocentrotus nudus壳中分离纯化出2种化合物,并对所获得的化合物经过理化性质、波谱分析和文献对照的方法进行结构鉴定,同时对所获得的化合物进行体外抗肿瘤活性测试。结果表明,从光棘球海胆壳中分离得到的2种化合物分别为棕榈酸(化合物1)和单棕榈酸甘油酯(化合物2)。体外抗肿瘤细胞活性测试表明,单棕榈酸甘油酯具有显著的抑制肿瘤细胞生长的活性,其可作为潜在的抗肿瘤药物进行进一步研究。
关键词:光棘球海胆;化学成分;结构鉴定;抗肿瘤活性
DOI:10.3969/J.ISSN.2095-1388.2015.01.016
文章编号:2095-1388(2015)01-0085-04
中图分类号:TS254.1;R284
文献标志码:A
收稿日期: 2014-05-01
基金项目: 国家海洋公益性行业科研专项(201205022-7);辽宁省教育厅科研项目(L2012256)
作者简介: 朱春芃(1988—), 女, 硕士研究生。E-mail:1434673082@qq.com
Abstract: Two compounds were isolated from shells of sea urchin Strongylocentrotus nudus by column chromatography on silica gel and thin layer chromatography and identified by spectroscopic analysis and physical-chemistry properties. The anti-tumor activity of the two compounds was evaluated by the MTT assay and SRB assay. The results showed that the two compounds were identified as palmitate(compound 1) with unsaturated double bonds and glyceroyl monopalmitate (compound 2). In vitro trials revealed that the glyceroyl monopalmitate exhibited the potent inhibitory activities against five cancer cells, indicating that this compound is considered as potential anticancer candidate for further study.
光棘球海胆
Strongylocentrotus
nudus隶属于棘皮动物门Echinodermata、海胆纲Echinoidea,是中国北方沿海养殖的重要海珍品。《本草原始》及《中药志》记载了海胆壳和棘的药用价值,因此,光棘球海胆是开发海洋药物潜在的重要来源
[1]。海胆壳中含有色素及毒素,海胆壳色素大多属于1,4-萘醌为母体的色素,棘中含有蛋白质类毒素
[2]。朱春芃等
[3]研究发现,海胆壳浸膏具有抑制金黄色葡萄球菌活性的作用,并从中鉴定出(3β)-胆甾-5-烯-3-醇及软脂酸2种化合物。高翼等
[4]从海胆壳中分离出具有抗肿瘤活性的海胆壳蛋白SUP-1A。为了进一步研究光棘球海胆壳中未知的化学成分,本研究中对光棘球海胆壳75%(体积分数)乙醇提取物的正丁醇萃取部位中的化学成分进行了提取,分离得到2种化合物,根据理化性质、波谱分析和文献对照的方法,鉴定化合物的结构,并对分离得到的2种化合物进行了体外抗肿瘤活性研究。
1 材料与方法
1.1 材料
光棘球海胆壳购自大连市长兴市场;人慢性粒细胞白血病急变细胞K562、人急性髓性细胞白血病细胞HL60、人乳腺癌细胞SKBR-3、人乳腺癌细胞MCF-7、人结肠癌细胞SW620和人结肠癌细胞HT-29均来自中国科学院上海细胞库;噻唑蓝(3-(4,5-Dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazolium bromide,MTT)、磺基罗丹明B(Sulforhodamine B, SRB)、凋亡检测试剂盒(Roche)、RPMI1640与DMEM培养液(Hyclone)购于美国Sigma公司;其他试剂为国产分析纯。
1.2 方法
1.2.1 光棘球海胆壳浸膏的提取 将光棘球海胆壳(4 kg)粉碎后,用75% EtOH热浸提2次,合并提取液,减压浓缩后得到浸膏73.45 g。将浸膏均匀分散于0.5 L水中,用石油醚反复萃取3次(0.5 L×3),合并石油醚层提取液;然后将水相部分用乙酸乙酯萃取3次(0.5 L×3),合并乙酸乙酯层提取液;最后将水相部分再用正丁醇萃取3次(0.5 L×3),合并得到正丁醇提取液,减压浓缩得到各层提取物,分别为7.44、7.48、15.39 g。
取石油醚层、正丁醇层提取物少许溶于甲醇,进行薄层层析(TLC)检测。其中显色剂为10%浓硫酸无水乙醇溶液,展开剂分别为石油醚∶乙酸乙酯(不同比例)、乙酸乙酯∶甲醇(不同比例),获得分离光棘球海胆壳石油醚层、正丁醇层提取物的洗脱条件。
通信作者: 李伟(1964—), 男, 教授。E-mail:aisingioro@hotmail.com
1.2.2 光棘球海胆壳提取物的分离 将正丁醇层提取物15.39 g溶于适量的乙酸乙酯中,再加入1.5倍样品质量的300~400目硅胶并搅拌均匀,挥发溶剂使样品充分吸附。
用300 g 300~400 目硅胶进行湿法装柱(φ2.5 cm×70 cm),先用乙酸乙酯平衡,将混有正丁醇层提取物硅胶加入到柱的上层,用乙酸乙酯∶甲醇(二者的比为100∶0,100∶1,…,10∶1,…,1∶1)的洗脱液进行梯度洗脱,每个比例进行3~5个柱体积的洗脱,分别收集洗脱液(每个组分约600 mL)。通过薄层层析法跟踪检测每个组分,并根据显色结果合并浓缩各组分,共得到8个组分,记为a、b、c、d、e、f、g、h组分(根据极性从小到大标记),对e组分进行再一次的正相硅胶柱层析,得到e
1~e
5亚组分,对e
3亚组分进行重结晶;对h组分进行薄层制备色谱层析,用荧光仪检测显示出3个条带,通过TLC检测,刮板洗脱浓缩得到h
1~h
3亚组分,对h
3亚组分进行重结晶。
1.2.3 结构鉴定 核磁共振光谱(NMR)在Bruker Avance DRX 500核磁共振仪(500/125 MHz)上进行,以四甲基硅烷(TMS)作内标。
1.2.4 体外抗肿瘤活性测定 采用MTT法及SRB法对人慢性粒细胞白血病急变细胞K562、人急性髓性细胞白血病细胞HL60、人乳腺癌细胞SKBR-3、人乳腺癌细胞MCF-7、人结肠癌细胞SW620和人结肠癌细胞HT-29进行化合物体外肿瘤细胞抑制测试
[5]。
(1)K562和HL60细胞种板。收集细胞,在1000×
g条件下离心,用PBS缓冲液将细胞清洗一次,再离心,用新鲜培养基重悬后,按照8000 cells/well,180 μL种板后加测试样品。48 h后每孔加入20 μL MTT,37 ℃下恒温孵育4 h后,离心,去除上清液,每孔加入150 μL DMSO,用酶标仪测定OD
570 nm值
[6]。
(2)SKBR-3、MCF-7、SW620、HT-29细胞种板。提前一天处理细胞,将细胞消化离心后,重悬,按照8000 cells/well,180 μL种板,24 h后加入测试样品。48 h后加入预冷的10% TCA溶液100 μL/well,4 ℃下固定1 h,之后用H
2O洗涤4次,室温下晾干。加入0.4% SRB染色液100 μL/well, 30 min后用1%乙酸洗涤4次,室温下晾干。最后,加入Tris-base碱液(10 mmol/L,pH 10.5)150 μL/well,混匀后,用酶标仪测定OD
510 nm值
[6]。
1.2.5 化合物对肿瘤细胞凋亡的影响 将HL60、SKBR-3、SW620细胞分别接种于六孔板,按1×10
6cells/孔,分别用不同浓度化合物2处理细胞24 h后,收集细胞,并用预冷PBS清洗一次,加入FITC/PI染料,避光静置20 min后,用流式细胞仪测定细胞凋亡情况
[7]。
1.3 数据处理
试验数据均以平均值±标准差表示,采用SPSS 13.0软件进行单因素方差分析和多重比较。
2 结果与分析
2.1 海胆壳中化学成分的分离纯化与结构鉴定
光棘球海胆壳浸膏的亲水性较大。正丁醇层提取物经过进一步分离,对e
3部分进行重结晶,得到e
3为单体化合物(化合物1);对h
3部分进行重结晶,并对其进行薄层层析分离,得到h
3为单体化合物(化合物2)。
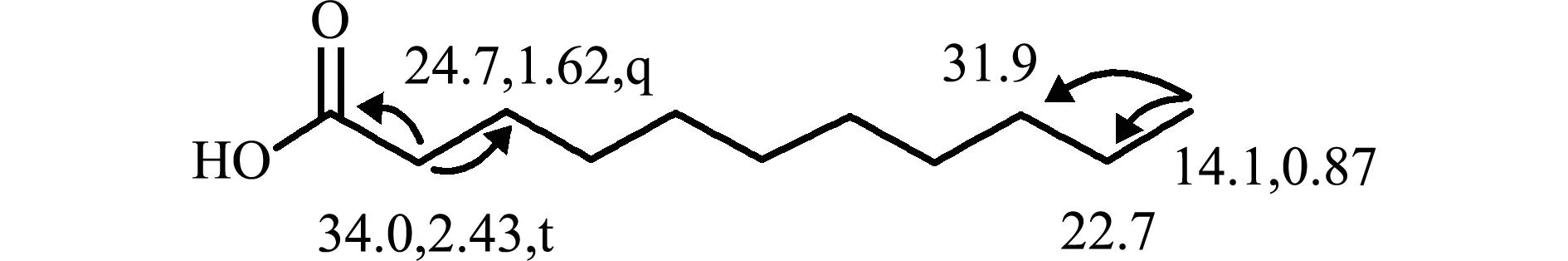
化合物1为淡黄色粉末,Liebermann-Burchard 反应呈阴性。
1H NMR(CDCl
3,500 MHz)
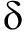 H:2.43(2H,t,J=7.5 Hz,H-2)、1.62(2H,m,H-3)、1.25(14H,overlapped,1.37-1.19,H-4~15)、0.87(3H,t,J=7.0 Hz,H-16)。
13C NMR(CDCl
3,125 MHz)
H:2.43(2H,t,J=7.5 Hz,H-2)、1.62(2H,m,H-3)、1.25(14H,overlapped,1.37-1.19,H-4~15)、0.87(3H,t,J=7.0 Hz,H-16)。
13C NMR(CDCl
3,125 MHz)
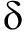 C:179.4(C-1)、34.40(C-2)、31.9(C-14)、29.7~29.6(6CH
2)、29.4、29.4、29.3、29.1、24.7(C-3)、22.7(C-15)、14.1(C-16)。结合HMBC及数据库检索,可以确定化合物1为棕榈酸(Palmitic acid),其分子式为C
16H
32O
2(图1)。
C:179.4(C-1)、34.40(C-2)、31.9(C-14)、29.7~29.6(6CH
2)、29.4、29.4、29.3、29.1、24.7(C-3)、22.7(C-15)、14.1(C-16)。结合HMBC及数据库检索,可以确定化合物1为棕榈酸(Palmitic acid),其分子式为C
16H
32O
2(图1)。
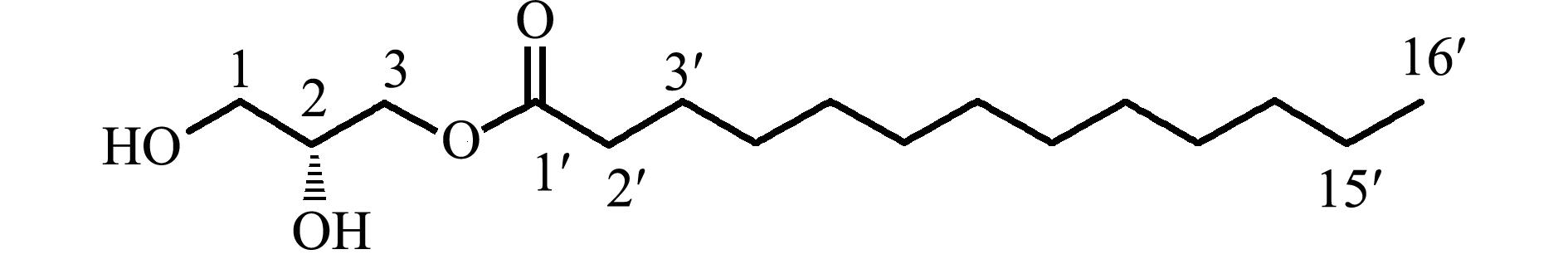
化合物2为白色针状晶体,mp 71~72 ℃,Liebermann-Burchard反应呈阴性,初步判断不是甾醇类化合物。
1H NMR(CDCl
3,500 MHz)
δ
H:5.35(1H,m,H-6)、3.52(1H,m,H-3)、1.01(3H,s,Me-19)、0.92(3H,d,J=4.0 Hz,Me-21)、0.87(6H,d,J=4.0 Hz,Me-26,27)、0.68(3H,s,Me-18)。
13C NMR(CDCl
3,125 MHz)
δ
C:174.4(C-1′)、70.3(C-2)、65.1(C-1)、63.4(C-3)、34.2(C-2′)、31.9(C-3′)、29.7、29.7、29.7(C-4′-8′)、29.6(C-9′)、29.5(C-10′)、29.4(C-11′)、29.3(C-12′)、29.1(C-13′)、24.9(C-14′)、22.7(C-15′)、14.1(C-16′)。以上波谱数据与文献报道
[8]的单棕榈酸甘油酯基本一致,故确定化合物2为单棕榈酸甘油酯(Glyceroyl monopalmitate),分子式为C
19H
38O
4(图2)。
2.2 体外抗肿瘤活性的测定
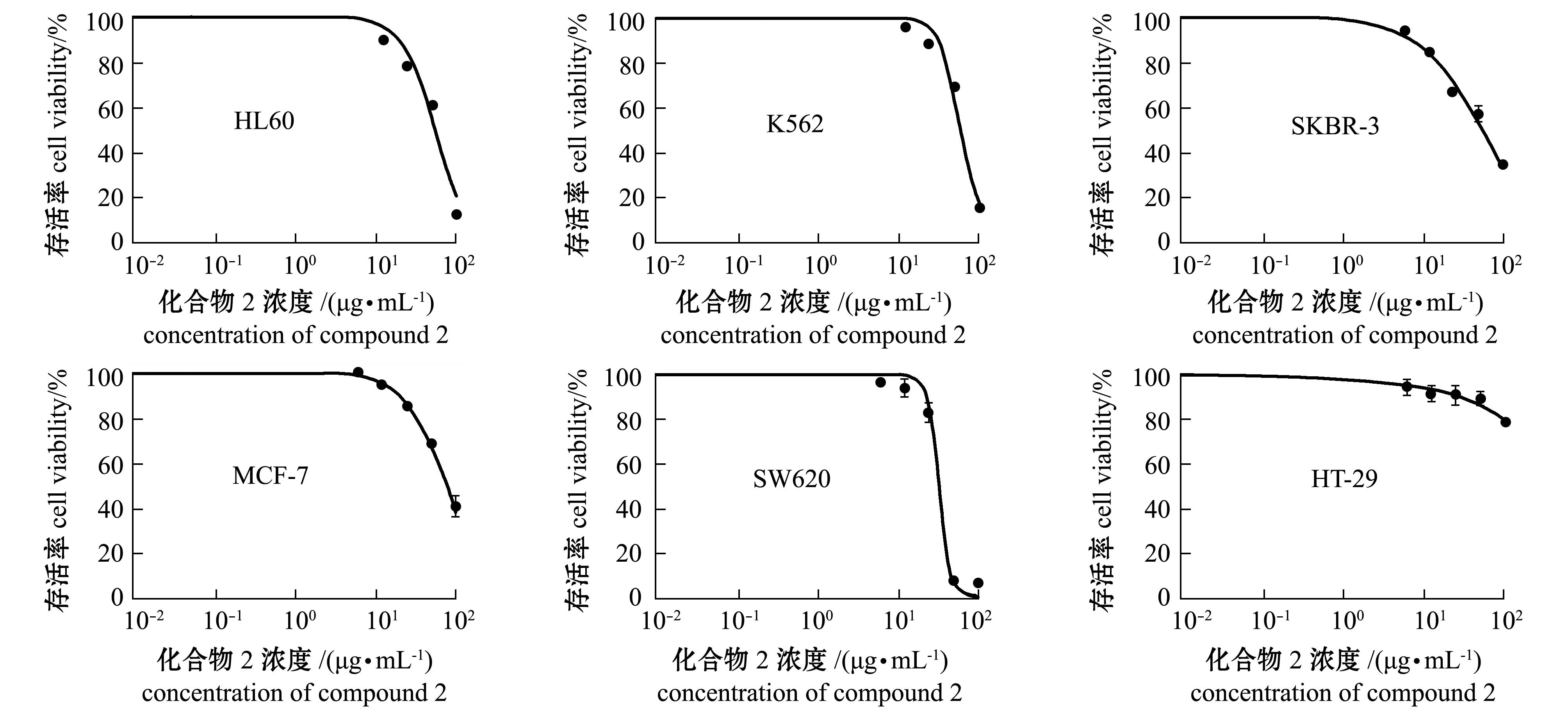
利用MTT法及SRB法研究化合物1和2对6种癌细胞生长的抑制作用。化合物1对6种癌细胞无抑制作用,化合物2对6种癌细胞活性的影响如图3所示。从图3可见,化合物2对K562、HL60、
SKBR-3、MCF-7、SW620 5种癌细胞的抑制作用均随样品浓度的升高而升高,并且具有剂量依赖性,而对HT-29细胞的活性几乎没有抑制作用。
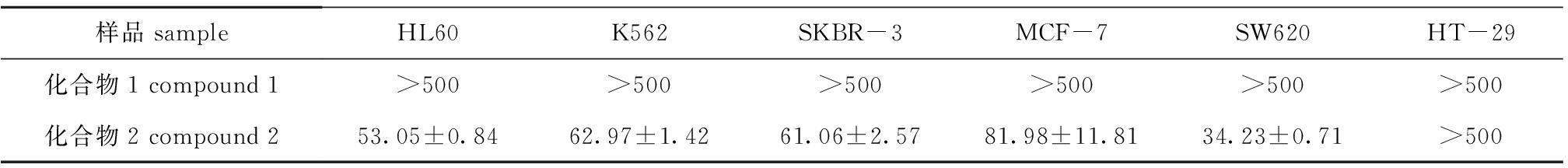
通过SPSS 17.0软件分析,得到化合物1和2对6种癌细胞48 h的50%抑制浓度(IC
50)(表1)。从表1可以看出,化合物2对SW620细胞的48 h IC
50值最小,仅为(34.23±0.71)μg/mL,说明化合物2对SW620细胞的抑制效果最显著。化合物1对6种癌细胞的48 h IC
50值均大于500 μg/mL,说明化合物1对6种癌细胞没有抑制作用。
根据化合物2对6种癌细胞的48 h IC
50值,选择值最小的3种癌细胞进一步进行细胞凋亡试验,结果如图4所示。从图4可见:随着化合物2浓度的增大,3种癌细胞的凋亡率均逐渐增大,且不同浓度间有显著性差异(
P<0.05);当化合物2浓度为150 μg/mL时,HL60、SKBR-3和SW620细胞的凋亡率均最高,分别为24.1%、17.6%、27.3%。由此可见,化合物2有显著诱导这3种癌细胞凋亡的作用,其诱导凋亡作用具有剂量依赖性。
3 讨论
对光棘球海胆壳75%(体积分数)的乙醇浸膏中正丁醇萃取部位利用薄层层析、反复硅胶柱层析、薄层制备色谱层析和重结晶等分离技术进行分离纯化,得到2个化合物,分别为棕榈酸和单棕榈酸甘油酯,这2种化合物均是首次在光棘球海胆壳中被发现。
SRB与MTT是常见的细胞计数方法。MTT法具有操作简便、敏感度高、重复性好的优点。 SRB法特别适用于大规模细胞计数,但操作较繁琐。在本研究中,根据细胞的不同,选用了不同的细胞计数方法。结果发现,单棕榈酸甘油酯对5种癌细胞(K562、HL60、SKBR-3、MCF-7、SW620)具有显著抑制作用,同时对HL60、SKBR-3和SW620细胞具有诱导细胞凋亡的作用,且有剂量依赖性。
关于酯类化合物的抗肿瘤活性有很多报道,也是目前的研究热点之一。杜磊
[8]报道了海参脑苷脂的抗肿瘤活性,海参脑苷脂可抑制HepG2、S180、95D、Caco-2和HGC-27等多种肿瘤细胞,
并且有明显的时间和剂量效应关系。弓晓杰等
[9]报道了人参皂苷M1硬脂酸酯对小鼠肝癌腹水型(HepA)细胞和小鼠胃癌(MFC)细胞生长的抑制作用。从海洋生物中寻找更高效的抗肿瘤活性成分及先导化合物是目前的研究热点
[10]。光棘球海胆壳中所含的单棕榈酸甘油酯显示了较好的抑制肿瘤细胞活性,其抗肿瘤机制需要进一步研究,以便更多地了解这类化合物作为潜在抗肿瘤药物的价值。
参考文献:
[1] 康俊霞,韩华,康永峰.海星中具有生物活性总皂苷的分离纯化[J].中国海洋药物,2012,31(5):32-36.
[2] 陆江海,李瑞声,张维汉.海胆化学和药理学研究概况[J].中国海洋药物,1994(2):38-46.
[3] 朱春芃,金枫清,曲敏,等.海胆壳中具有抑菌活性物质的分离鉴定[J].河北渔业,2013(10):26-28, 62.
[4] 高翼,奚涛,刘纯慧,等.海胆壳蛋白的分离纯化及抗肿瘤活性[J].中国天然药物,2006,4(6):464-467.
[5] 周思明,屈艳妮,张健,等.SRB法与MTT法细胞计数应用比较[J].中国现代医学杂志,2005,15(17):2615-2620.
[6] 刘洋,许建华,黄秀旺,等.3,5-(
E)-二亚苄基-
N-环丙基哌啶-4-酮类化合物的合成及体外抗肿瘤活性研究[J].中国药物化学杂志,2011,21(4):262-266.
[7] 李云磊,张荣生,李峰,等.沙蚕活性物质的分离提取及对HeLa细胞的毒性分析[J].福州大学学报:自然科学版, 2014, 42(1):149-153.
[8] 杜磊.海参和海星脑苷脂抗肿瘤及改善癌症恶病质作用的研究[D].青岛:中国海洋大学,2012.
[9] 弓晓杰,陈丽荣.人参皂苷M1硬脂酸酯抗肿瘤活性的研究[J].人参研究,2010(2):9-11.
[10] Blunt J W,Copp B R,Munro M H G,et al.Marine natural products[J].The Royal Society of Chemistry,2004,21:1-49.
Isolation, identification and anti-tumor activity of shell constituents
in sea urchin
Strongylocentrotus
nudus
ZHU Chun-peng
1, YUAN Zhen-yu
1, SONG Yong-xiang
2, TONG Chang-qing
1, QU Min
1, JIN Qiao
1, LI Wei
1
(1.College of Food Science and Engineering, Dalian Ocean University, Dalian 116023, China; 2.Key Laboratory of Marine Bio-resources Sustainable Utilization, Guangdong Key Laboratory of Marine Material Medicine, Research Center for Marine Microbes, South China Sea Institute of Oceanology, Chinese Academy of Science,Guangzhou 510301, China)
Key words:
Strongylocentrotus
nudus; constituent; structural identification; anti-tumor activity
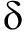 H:2.43(2H,t,J=7.5 Hz,H-2)、1.62(2H,m,H-3)、1.25(14H,overlapped,1.37-1.19,H-4~15)、0.87(3H,t,J=7.0 Hz,H-16)。
13C NMR(CDCl
3,125 MHz)
H:2.43(2H,t,J=7.5 Hz,H-2)、1.62(2H,m,H-3)、1.25(14H,overlapped,1.37-1.19,H-4~15)、0.87(3H,t,J=7.0 Hz,H-16)。
13C NMR(CDCl
3,125 MHz)
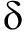 C:179.4(C-1)、34.40(C-2)、31.9(C-14)、29.7~29.6(6CH
2)、29.4、29.4、29.3、29.1、24.7(C-3)、22.7(C-15)、14.1(C-16)。结合HMBC及数据库检索,可以确定化合物1为棕榈酸(Palmitic acid),其分子式为C
16H
32O
2(图1)。
C:179.4(C-1)、34.40(C-2)、31.9(C-14)、29.7~29.6(6CH
2)、29.4、29.4、29.3、29.1、24.7(C-3)、22.7(C-15)、14.1(C-16)。结合HMBC及数据库检索,可以确定化合物1为棕榈酸(Palmitic acid),其分子式为C
16H
32O
2(图1)。