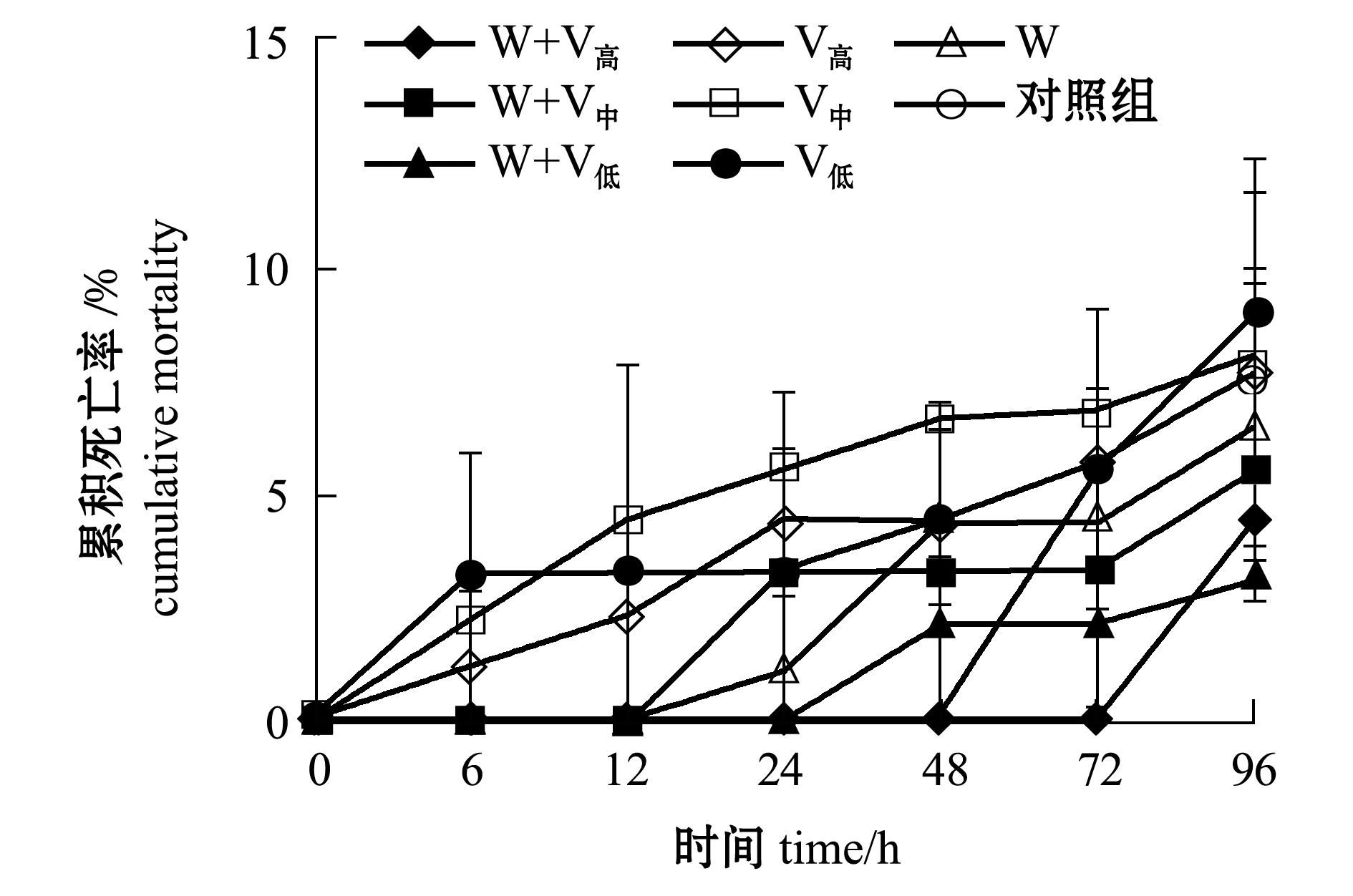
图1 温度为(19±1)℃条件下感染哈维氏弧菌和WSSV病毒凡纳滨对虾的累积死亡率
Fig.1 Cumulative mortality of Pacific white leg shrimp Litopenaeus vannamei infected with Vibrio harveyi and WSSV at (19 ±1)℃
摘要:在不同温度[(19±1)、(25±1)、(31±1)℃]条件下,研究了不同浓度哈维氏弧菌Vibrio harveyi和白斑综合症病毒(WSSV)对凡纳滨对虾Litopenaeus vannamei(体长8.12 cm±0.83 cm)的致病性。结果表明:温度为(19±1)℃时,整个试验过程中对虾死亡率均低于8.9%,各组病毒携带量低于3.9×10`4copy/g;温度为(25±1)℃时,病毒单独感染组对虾的死亡率和病毒携带量(最大值71.1%,1.9×10`5 copy/g)和高浓度继发感染组的死亡率和病毒携带量(最大值77.8%,3.2×10`6 copy/g)从试验中期开始明显高于其他组,死亡加快,病毒携带量迅速增加,单独感染细菌组死亡率随感染浓度的升高而升高(最大值为21.1%);温度为(31±1)℃时,病毒单独感染组的死亡率和病毒携带量(最大值47.8%,2.2×10`4copy/g)从试验中期开始明显低于继发感染组(最大值80.0%,6.1×10`6 copy/g),单独感染细菌组的累积死亡率随细菌浓度的升高而升高(最大值24.4%)。研究表明,温度对WSSV和哈维氏弧菌的致病力影响显著,继发感染和细菌单独感染随温度的升高致病力升高,高温和低温对WSSV的致病力有抑制作用。
关键词:哈维氏弧菌; 凡纳滨对虾; 温度;白斑综合症病毒(WSSV)
DOI:10.3969/J.ISSN.2095-1388.2015.01.011
文章编号:2095-1388(2015)01-0056-06
中图分类号:Q954.4
文献标志码:A
收稿日期: 2014-05-16
基金项目: 科技部星火计划重点项目(2010GA800008);科技部农业科技成果转化资金项目(2010GB2E200382);广东省海洋渔业科技推广专项(A201301D02)
Abstract: The pathogenicity of different concentrations of Vibrio harveyi and white spot syndrome virus (WSSV) to Pacific white leg shrimp Litopenaeus vannamei with body length of (8.12±0.83) cm was studied at water temperature of (19±1), (25±1), and (31±1)℃. Throughout the experiment, the cumulative mortality was found below 8.9% in each group and the virus carrying amount was less than 3.9×10`4 copy/g in each group at (19±1)℃. At (25±1)℃, however, the maximal cumulative mortality was 71.1%, and the virus carrying amount 1.9×10`5copy/g in the singly-infected with WSSV group, from the mid-experimental, significantly higher in the high concentrations of secondary infection group (the maximum 77.8%, 3.2×10`6 copy/g) than in the other groups (P<0.05), with higher mortality (the maximum 21.1%) and virus carrying. The maximal cumulative mortality of 47.8%,and the virus carrying amount of 2.2×10`4 copy/g were found in the singly-infected with WSSV group at (31±1)℃, significantly lower than in the secondary infection group (the maximum 80.0%,6.1×10`6 copy/g). There was increase in mortality (the maximum 24.4%) with elevated concentration of Vibrio harveyi in the singly-infected with Vibrio harveyi group. The findings indicate that the pathogenicity of Vibrio harveyi and WSSV is significantly affected by temperature, and that the pathogenicity of the secondary infections and the singly-infected with Vibrio harveyi were found to be increased with raising temperature. The pathogenicity of WSSV was shown to be inhibited by high and low temperature.
凡纳滨对虾 Litopenaeus vannamei为世界主要人工养殖对虾品种之一 [1],其养殖业已受到多种细菌病和病毒病的威胁,其中白斑综合症病毒作为一种对虾高致死性病毒,传染性强,宿主广泛,危害极大 [2]。白斑综合症暴发的原因不仅与虾体免疫水平、感染方式、病毒数量、环境因子有关 [3-4],而且还与其他病原体有关,如副溶血弧菌、哈维氏弧菌等。其中哈维氏弧菌属革兰氏阴性,呈弧状,极生单鞭毛,广泛分布于近岸温暖海洋环境中,能感染多种海洋无脊椎和脊椎动物 [5],主要感染苗期及幼体的动物,如哈维氏弧菌会引起中国对虾及凡纳滨对虾幼体发病死亡 [6-7],也会引起成虾发病死亡。陈月忠等 [8]报道,哈维氏弧菌会引起长毛对虾、日本对虾成虾发病死亡,严重制约了全球对虾养殖业的发展。本研究中,对携带白斑综合症病毒(WSSV)的凡纳滨对虾在不同温度条件下注射感染不同浓度的哈维氏弧菌,探讨哈维氏弧菌对感染WSSV的凡纳滨对虾的影响,旨在为对虾养殖业健康可持续发展提供指导。
健康凡纳滨对虾取自广东海洋大学东海岛海洋生物研究基地,体长为(8.12±0.83)cm。
试验用哈维氏弧菌 Vibrio harveyi由西北农林科技大学刘小林教授提供。
试验前将凡纳滨对虾暂养5 d,每日投喂对虾人工配合饵料2次,换水1次,日换水量接近100%。试验前随机抽取10尾对虾进行荧光定量PCR检测,检测结果为阴性。
1.2.1 WSSV粗提液的制备 取感染WSSV症状明显的凡纳滨对虾,去除甲壳,按1∶1(g∶mL)加入高盐PBS,冰浴中匀浆,将匀浆液于4 ℃下以7000 r/min离心15 min;离心后的上清液加入蔗糖至终浓度为30%(质量分数),4 ℃下以16 000 r/min超速离心50 min,弃上清,沉淀用PBS(pH 7.4)重悬,将重悬液用0.22 μm的滤膜过滤,分装后于冰箱(-80 ℃)中保存备用。
通信作者: 孙成波(1970—), 男, 博士,教授。E-mail:suncb@gdou.edu
1.2.2 菌悬液的制备 将哈维氏弧菌经接种、活化培养24 h后,用无菌PBS缓冲液稀释,制成菌悬液。
1.2.3 DNA模板提取和引物设计 参照Sun等 [9]的方法提取DNA模板,参照You等 [10]的方法设计PCR引物,并由生工生物工程(上海)股份有限公司合成。
1.2.4 标准品的制备 参照程晓燕等 [11]的方法制备重组质粒标准品,用核酸分析仪测定重组质粒的 DNA 浓度,根据下式计算重组质粒的拷贝数:
拷贝数(copy/μL)=质粒浓度(μg/μL)×10 -6×阿伏加德罗常数/重组质粒分子量。
其中:阿伏加德罗常数为6.02×10 23;重组质粒分子量=1个碱基对的平均分子量(660 g/mol)×重组质粒的总长度(bp)。
1.2.5 不同温度条件下哈维氏弧菌和WSSV对凡纳滨对虾的致病性试验 采用人工注射感染,在凡纳滨对虾第2腹节与第3腹肌之间往心脏方向注射40 μL病原缓冲液。
将试验对虾放入盛有60 L水的0.1 m 3塑料桶中,分别在温度为(19±1)、(25±1)、(31±1)℃下进行培养。试验设继发感染组、单独感染组和对照组,各组均设3个平行,每个平行放对虾30尾。其中,继发感染组先注射40 μL含1.0×10 3copy/μL WSSV病毒粗提液稀释液,一天后再分别注射40 μL浓度为1.1×10 5、1.1×10 4、1.1×10 3cfu/mL的哈维氏弧菌菌悬液,分别记为W+V 高、W+V 中、W+V 低组;单独感染组单独注射40 μL含1.0×10 3copy/μL WSSV病毒粗提液稀释液和单独注射浓度为1.1×10 5、1.1×10 4、1.1×10 3cfu/mL的哈维氏弧菌菌悬液,分别记为W、V 高、V 中、V 低组;对照组注射40 μL PBS缓冲液。试验过程中,每日投喂对虾人工配合饵料2次,24 h充气,定时吸出排泄物,日换水量为20%。及时捞出死亡对虾放入冰箱(-20 ℃)中保存。各组在感染后0、6、12、24、48、72、96 h取样保存。观察记录对虾发病及死亡情况,定期检测对虾组织中的病毒含量,并对死亡对虾进行病毒检测。
1.2.6 病毒的检测 采用荧光定量PCR方法并参考程晓燕等 [11]的方法检测病毒的含量。
2.1.1 凡纳滨对虾的死亡情况 从图1可见,温度为(19±1)℃时,单独感染不同浓度的哈维氏弧菌和WSSV与继发感染两种病原对凡纳滨对虾的累积死亡率影响不大,至试验结束各组累积死亡率均低于8.9%。

图1 温度为(19±1)℃条件下感染哈维氏弧菌和WSSV病毒凡纳滨对虾的累积死亡率
Fig.1 Cumulative mortality of Pacific white leg shrimp Litopenaeus vannamei infected with Vibrio harveyi and WSSV at (19 ±1)℃
2.1.2 凡纳滨对虾的病毒携带量 从表1可见:温度为(19±1)℃时,整个试验过程中,单独感染WSSV组对虾体内携带的病毒量在6 h时显著高于继发感染组( P<0.05);24、48 h时继发感染浓度为1.1×10 5 cfu/mL组的病毒携带量明显高于其他组( P<0.05);72 h时各组病毒携带量均很高,最大值为3.9×10 4 copy/g。
2.2.1 凡纳滨对虾的死亡情况 从图2可见:温度为(25±1) ℃时,0~24 h时各组的累积死亡率低于13.3%( P>0.05);至48 h时继发感染浓度为1.1×10 5 cfu/mL组对虾累积死亡率(34.3%)明显高于另外两个继发感染浓度组( P<0.05);至72 h时3个继发感染组和单独感染WSSV组对虾累积死亡率明显高于单独感染不同浓度细菌组,且单独感染WSSV组(62.2%)和继发感染浓度1.1×10 5 cfu/mL组(65.7%)显著高于其他组( P<0.05);
表1 温度为(19±1)℃条件下感染不同浓度哈维氏弧菌对凡纳滨对虾病毒携带量的影响(平均值±标准差)
Tab.1 Effects of infected concentrations of Vibrio harveyi on amount of virus in Pacific white leg shrimp Litopenaeus vannamei at (19±1)℃(mean±S.D.)
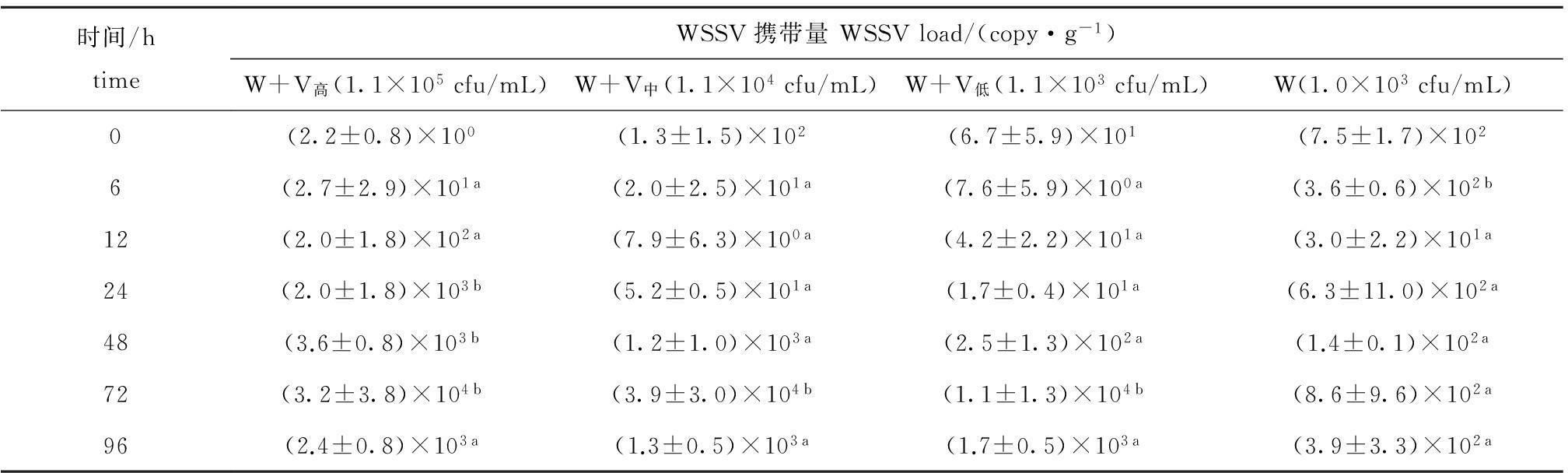
时间/htimeWSSV携带量WSSVload/(copy·g-1)W+V高(1.1×105cfu/mL)W+V中(1.1×104cfu/mL)W+V低(1.1×103cfu/mL)W(1.0×103cfu/mL)0(2.2±0.8)×100(1.3±1.5)×102(6.7±5.9)×101(7.5±1.7)×1026(2.7±2.9)×101a(2.0±2.5)×101a(7.6±5.9)×100a(3.6±0.6)×102b12(2.0±1.8)×102a(7.9±6.3)×100a(4.2±2.2)×101a(3.0±2.2)×101a24(2.0±1.8)×103b(5.2±0.5)×101a(1.7±0.4)×101a(6.3±11.0)×102a48(3.6±0.8)×103b(1.2±1.0)×103a(2.5±1.3)×102a(1.4±0.1)×102a72(3.2±3.8)×104b(3.9±3.0)×104b(1.1±1.3)×104b(8.6±9.6)×102a96(2.4±0.8)×103a(1.3±0.5)×103a(1.7±0.5)×103a(3.9±3.3)×102a
注:同行中标有不同小写字母者表示组间有显著性差异( P<0.05),标有相同小写字母者表示组间无显著性差异( P>0.05),下同
Note:The means with different letters within the same line are significant differences at the 0.05 probability level, and the means with the same letters within the same line are not significant differences, et sequentia
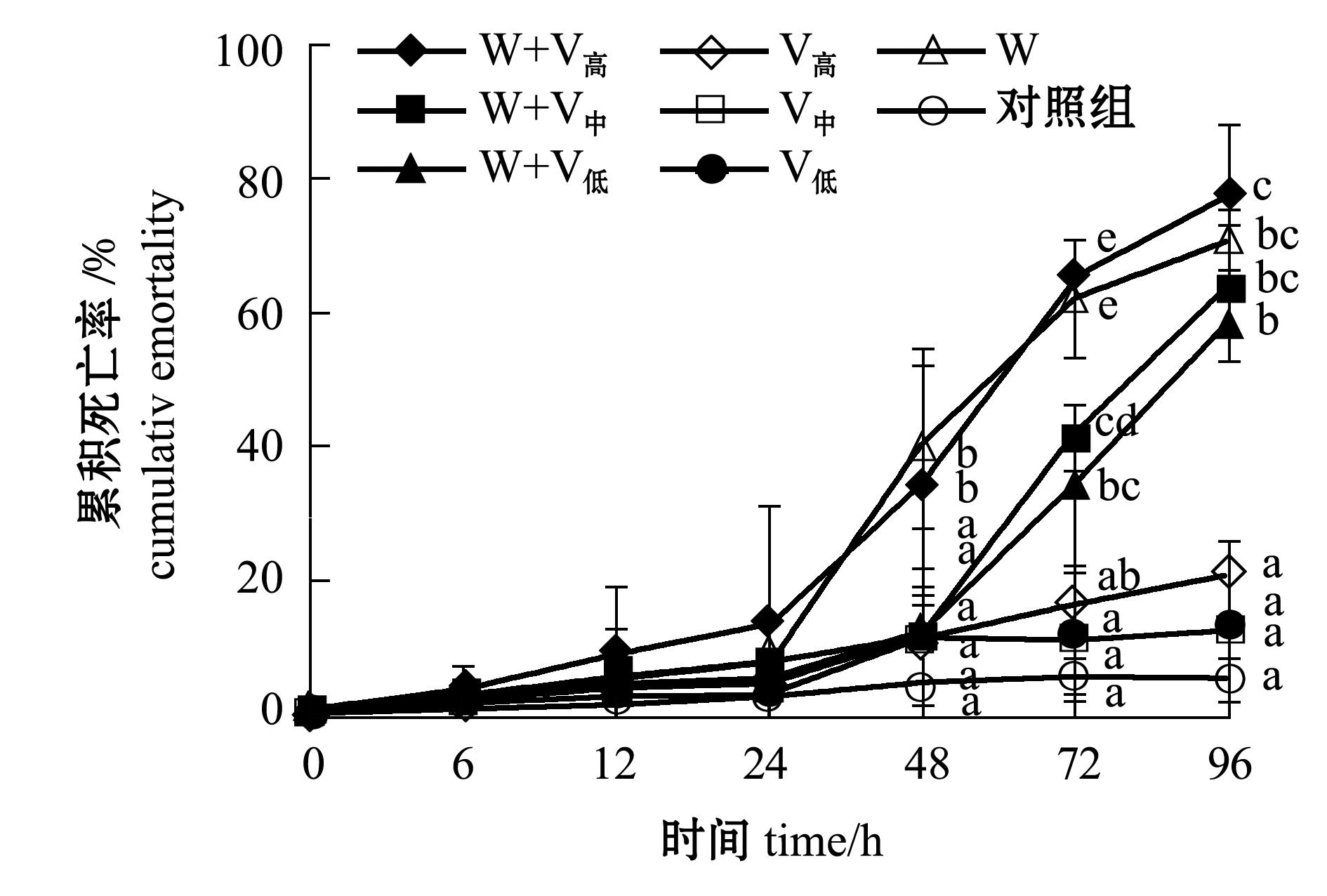
注:标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters are significant differences at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
图2 温度为(25±1)℃条件下感染哈维氏弧菌和WSSV病毒凡纳滨对虾的累积死亡率
Fig.2 Cumulative mortality of Pacific white leg shrimp Litopenaeus vannamei infected with Vibrio harveyi and WSSV at (25±1)℃
至96 h时3个继发感染组和单独感染WSSV组的累积死亡率显著高于单独感染不同浓度的细菌组( P<0.05)。
2.2.2 凡纳滨对虾的病毒携带量 从表2可见:温度为(25±1)℃时,整个试验过程中,至48 h时单独感染WSSV组对虾体内携带WSSV的病毒量显著高于3个继发感染组( P<0.05);72 h时单独感染WSSV组对虾体内携带病毒量显著低于3个继发感染组( P<0.05);96 h时继发感染浓度1.1×10 5 cfu/mL组的病毒携带量明显高于其他组( P<0.05)。
2.3.1 凡纳滨对虾的死亡情况 从图3可见:温度为(31±1)℃时,0~24 h时各组对虾的累积死亡率低于12.0%( P>0.05);至48 h时单独感染WSSV组的累积死亡率显著低于继发感染浓度1.1×10 3、1.1×10 5 cfu/mL组( P<0.05);至72 h时单独感染WSSV组累积死亡率(42.3%)明显高于单独感染细菌组( P<0.05),但明显低于3个继发感染组( P<0.05),而继发感染浓度1.1×10 5cfu/mL组的累积死亡率最大,为80.0%。
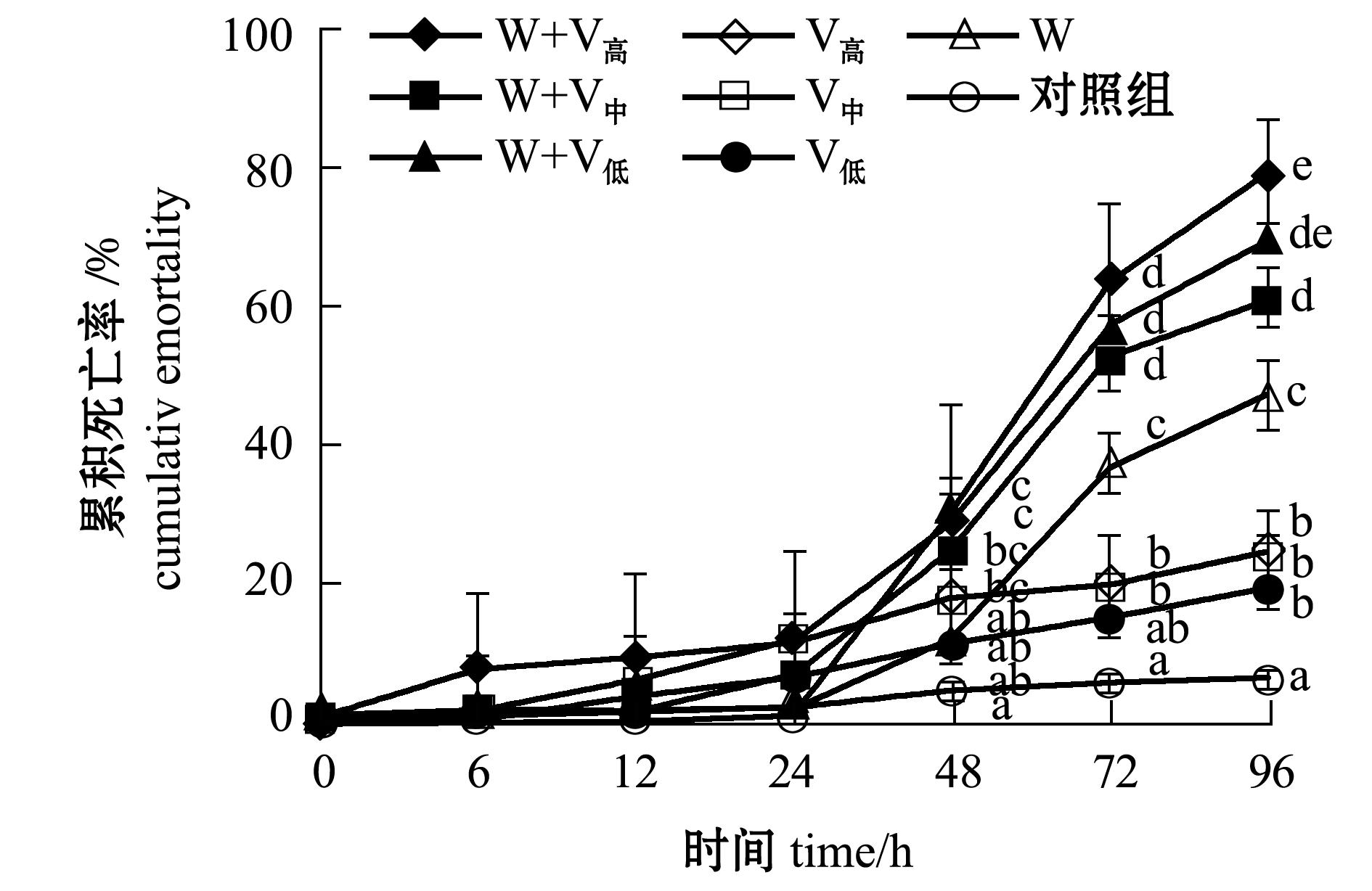
图3 温度为(31±1)℃条件下感染哈维氏弧菌和WSSV病毒凡纳滨对虾的累积死亡率
Fig.3 Cumulative mortality of Pacific white leg shrimp Litopenaeus vannamei infected with Vibrio harveyi and WSSV at (31±1)℃
2.3.2 凡纳滨对虾的病毒携带量 从表3可见:温度为(31±1)℃时,整个试验过程中,6 h时继发感染浓度1.1×10 5 cfu/mL组与其他组存在显著性差异( P<0.05);12 h时单独感染WSSV组病毒携带量显著低于浓度为1.1×10 5、1.1×10 4 cfu/mL的2个继发感染组( P<0.05),随着细菌浓度的增加病毒携带量也增加;24 h时病毒开始加快增殖,继发感染浓度1.1×10 5 cfu/mL、1.1×10 4 cfu/mL组明显高于另两组( P<0.05);48~72 h时各组病毒携带量均很高;72、96 h时单独感染WSSV组显著低于继发感染组( P<0.05)。
表2 温度为(25±1)℃条件下感染不同浓度哈维氏弧菌对凡纳滨对虾病毒携带量的影响(平均值±标准差)
Tab.2 Effects of different concentrations of Vibrio harveyi on amount of virus in infected Pacific white leg shrimp Litopenaeus vannamei at (25±1)℃(mean±S.D.)
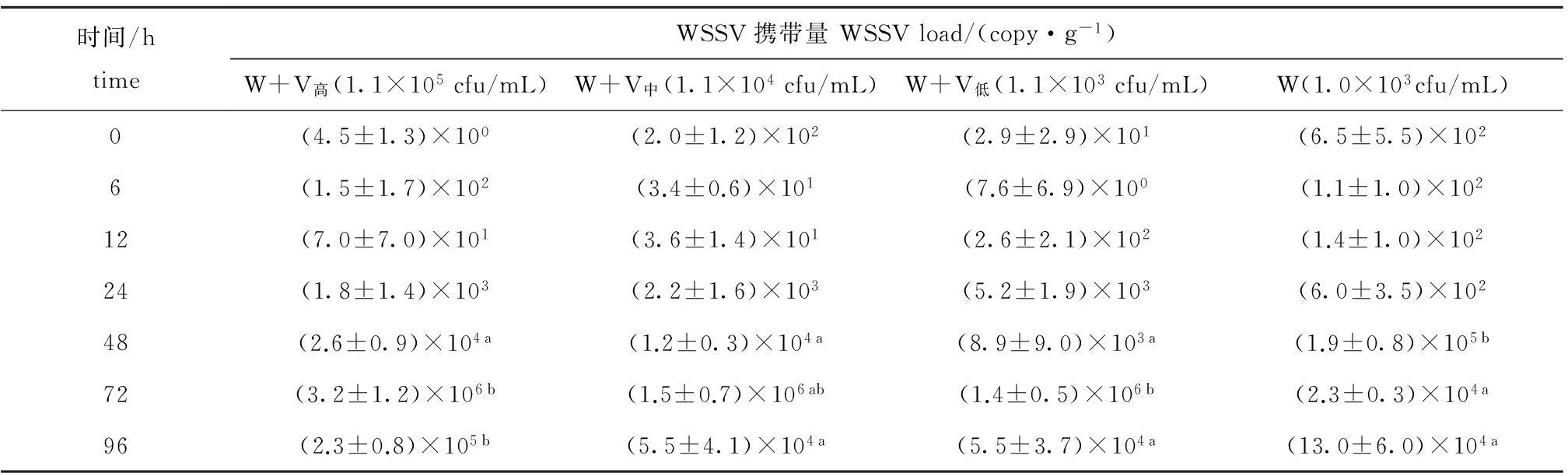
时间/htimeWSSV携带量WSSVload/(copy·g-1)W+V高(1.1×105cfu/mL)W+V中(1.1×104cfu/mL)W+V低(1.1×103cfu/mL)W(1.0×103cfu/mL)0(4.5±1.3)×100(2.0±1.2)×102(2.9±2.9)×101(6.5±5.5)×1026(1.5±1.7)×102(3.4±0.6)×101(7.6±6.9)×100(1.1±1.0)×10212(7.0±7.0)×101(3.6±1.4)×101(2.6±2.1)×102(1.4±1.0)×10224(1.8±1.4)×103(2.2±1.6)×103(5.2±1.9)×103(6.0±3.5)×10248(2.6±0.9)×104a(1.2±0.3)×104a(8.9±9.0)×103a(1.9±0.8)×105b72(3.2±1.2)×106b(1.5±0.7)×106ab(1.4±0.5)×106b(2.3±0.3)×104a96(2.3±0.8)×105b(5.5±4.1)×104a(5.5±3.7)×104a(13.0±6.0)×104a
表3 温度为(31±1)℃条件下感染不同浓度哈维氏弧菌对凡纳滨对虾病毒携带量的影响(平均值±标准差)
Tab.3 Effects of different concentrations of Vibrio harveyi on amount of virus in infected Pacific white leg shrimp Litopenaeus vannamei at(31±1)℃(mean±S.D.)

时间/htimeWSSV携带量WSSVload/(copy·g-1)W+V高(1.1×105cfu/mL)W+V中(1.1×104cfu/mL)W+V低(1.1×103cfu/mL)W(1.0×103cfu/mL)0(3.6±1.2)×101(8.5±7.0)×101(4.5±6.1)×101(3.7±2.9)×1026(3.1±1.6)×102b(1.9±0.3)×101a(2.5±3.4)×101a(1.1±1.0)×102a12(6.4±2.7)×102b(1.1±0.1)×103b(9.0±9.6)×101a(4.6±0.8)×101a24(2.3±0.9)×103b(2.2±0.8)×103b(5.4±2.7)×102a(2.8±0.6)×102a48(5.5±8.6)×104a(1.6±0.3)×104a(1.3±1.5)×104a(2.2±1.1)×104a72(6.1±9.3)×106b(1.2±1.0)×106b(8.5±5.4)×105b(1.5±1.1)×103a96(9.0±2.1)×104b(4.4±1.7)×104b(7.6±3.6)×104b(4.5±3.4)×102a
温度作为最重要的环境因子之一,不仅直接影响对虾的新陈代谢、抗病能力、进食、生存发育,而且还对病毒在对虾体内增殖有重要影响。李侃等 [12]报道,病毒在温度为21~30 ℃时增殖最快,而当温度低于20 ℃或超过30 ℃时,病毒的增殖速度受到部分抑制。Du等 [13]报道,虾体内病毒携带量在低温(10±1)℃条件下明显低于(24±1)℃条件下,说明低温可以抑制WSSV在虾体内增殖。Jira等 [14]报道,将感染WSSV的垂死小龙虾从22 ℃水温转移至16 ℃水温,可以延缓小龙虾的死亡,说明低温可以降低WSSV对小龙虾的致病性。Rahman等 [15]报道,在对虾感染WSSV前期,高温33 ℃可以延缓疾病暴发,有效降低对虾死亡率,抑制WSSV在对虾体内增殖;Du等 [16]通过试验也证明,高温(33 ℃)可以延长病虾存活时间。Sudha等 [17]将WSSV与对虾的关系分为3种:第一种为前期急性感染,机体高度感染WSSV,2~3 d时大面积死亡;第二种为急性和亚急性感染,机体中度或高度感染WSSV,7~10 d时出现高死亡率;第三种为慢性感染(潜伏感染),机体轻微感染,15~28 d时出现死亡。虾体感染细菌后会打破细胞内水与离子含量平衡,促使细胞肿大,破坏细胞氧化酶系统,供能不足,引起物质代谢障碍和细胞功能下降 [18],导致抗病能力下降,易引起二次感染。
本研究结果表明,在温度为(19±1)℃条件下,各组累积死亡率都很低,低于8.9%。病毒携带量检测结果中也发现,随着时间的延长,继发感染组病毒含量有一个升高趋势,之后有下降波动,而单独感染病毒组则没有,各组的病毒含量均低于3.9×10 4 copy/g,低于简旭凤 [19]报道的对虾濒死时病毒携带临界值1.0×10 5 copy/g,因此,感染WSSV未出现大量对虾死亡。哈维氏弧菌单独感染组中各浓度组同样未出现大量死亡,说明在低温条件下,两种病原体处于潜伏感染期。管越强 [20]报道,水温处于低温(15 ℃)对日本对虾体内WSSV的增殖有抑制作用。钟硕良等 [21]报道,当水温高于32 ℃或低于28 ℃时,哈维氏弧菌生长速度降低,仔虾累积死亡率也随之降低。本试验中也证实,在温度(19±1)℃下,不仅WSSV在凡纳滨对虾体内的增殖受到抑制,而且哈维氏弧菌在对虾体内的生长也受到影响。
在温度(25±1)℃条件下,感染哈维氏弧菌后0~24 h,细菌最高浓度继发感染组累积死亡率比其他组高,但各组均低于13.4%;至24 h时继发感染组病毒携带量均低于5.2×10 3 copy/g,但病毒携带量高于单独感染WSSV组;48 h后不同浓度继发感染组和单独感染组之间出现显著差异,单独感染WSSV组的对虾累积死亡率与最高浓度继发感染组相似,继发感染组的累积死亡率随细菌感染浓度的增加而升高,但单独感染WSSV组的死亡率明显高于另外两个浓度继发感染组的结果与丁燏等 [22]报道的继发感染累积死亡率要比单独感染高的结果不相符,可能是因为试验温度条件不同所致。目前研究较多的是哈维氏弧菌对凡纳滨对虾仔虾、日本对虾成虾致病性的研究,在低于28 ℃条件下哈维氏弧菌对凡纳滨对虾成虾的致病性有待进一步研究。至48 h时单独感染WSSV组病毒携带量比继发感染组高,但至72 h时继发感染组病毒携带量迅速增加,明显高于单独感染组。说明随着时间的延长,哈维氏弧菌对对虾组织引起损伤,对虾抗病力下降,为WSSV增殖提供了条件。
在温度(31±1)℃条件下,感染哈维氏弧菌后0~24 h,各组的累积死亡率低于12.0%,病毒携带量都低于2.3×10 3 copy/g;48 h后继发感染组累积死亡率明显高于独感染组,而且病毒携带量随着细菌感染浓度的升高而增加。单独感染WSSV组累积死亡率和病毒携带量的研究结果说明,在温度为(31±1)℃条件下可以减缓WSSV的增殖,推迟了白斑综合症暴发的时间。此结果与Vidal等 [23]报道的在高温(32.3±0.8)℃条件下可推迟携带WSSV凡纳滨对虾暴发白斑综合症的结果相符。继发感染组累积死亡率和病毒携带量的研究结果也证实了钟硕良等 [21]报道的在(31±1)℃条件下有利于哈维氏弧菌生长的结论。先感染WSSV的对虾机体已有损伤,抗病能力下降,更加有利于哈维氏弧菌的侵染,随着细菌数量的增多,对虾抗病能力下降更快,加快WSSV在对虾体内增殖,从而加速对虾死亡。陈细法等 [24]认为,携带病毒的对虾生长在良好养殖环境中,可处于潜伏感染期,但由于抗病能力下降会因外在胁迫因子变化引发病毒病。所以,给对虾注射感染细菌后,细菌随血淋巴循环扩散至全身,引起细菌大量繁殖,会加快疾病的发生。
综上,哈维氏弧菌和WSSV两种病原体在低温(19±1)℃条件下,致病力都较低,可能是低温条件不利于病原体在机体内增殖;在温度(25±1)℃条件下,WSSV对对虾的致病力高于哈维氏弧菌的致病力;在温度为(31±1)℃条件下,单独感染WSSV时,WSSV的致病力受到一定抑制,随着时间的延长,哈维氏弧菌致病力在感染后期引起WSSV致病力提高,使WSSV在对虾体内增殖加快。因此,温度调控对于对虾养殖中的病害预防有重要意义。
参考文献:
[1] 王兴强,马甡,董双林.凡纳滨对虾生物学及养殖生态学研究进展[J].海洋湖沼通报,2005(4):94-100.
[2] Flegel T W.Current status of viral diseases in Asian shrimp aquaculture[C].Israeli Journal of Aquaculture Bamidgeh,2009:229-239.
[3] 吴信忠.中国海洋病害学主流研究的进展[J].太平洋学报,2005,10:49-59.
[4] 孙成波,何建国,黎子兰,等.凡纳滨对虾和斑节对虾对 WSSV 敏感性的比较[J].湛江海洋大学学报,2006,26(3):17-20.
[5] Ramesh A,Venugopalan V.Response of enteric luminous bacteria to environmental conditions in the gut of the fish[J].Journal of Applied Bacteriology,1989,66(6):529-533.
[6] 刘问,钱冬,杨国梁,等.南美白对虾虾苗淡化期间发光病病原研究[J].集美大学学报:自然科学版,2005,9(4):300-304.
[7] Vandenberghe J,Li Y,Verdonck L,et al.Vibrios associated with Penaeus chinensis (Crustacea:Decapoda) larvae in Chinese shrimp hatcheries[J].Aquaculture,1998,169(1):121-132.
[8] 陈月忠,钟硕良,周宸.成虾发光病病原体的分离鉴定及防治技术研究[J].中山大学学报:自然科学版,2000,39:218-223.
[9] Sun Y,Li F,Xiang J.Analysis on the dynamic changes of the amount of WSSV in Chinese shrimp Fenneropenaeus chinensis during infection[J].Aquaculture,2013,376:124-132.
[10] You X X,Su Y Q,Mao Y,et al.Effect of high water temperature on mortality,immune response and viral replication of WSSV-infected Marsupenaeus japonicus juveniles and adults[J].Aquaculture,2010,305(1):133-137.
[11] 程晓艳,刘庆慧,黄倢.实时荧光定量PCR检测对虾白斑综合症病毒方法的建立[J].安徽农业科学,2010(2):14265-14267.
[12] 李侃,罗淑娅,徐丽美.温度影响对虾白斑综合症病毒增殖机制的研究[J].应用海洋学学报,2013(1):61-66.
[13] Du H,Dai W,Han X,et al.Effect of low water temperature on viral replication of white spot syndrome virus in Procambarus clarkii[J].Aquaculture,2008,277(3):149-151.
[14] Jira P,Söderhäll K,Söderhäll I.Effect of water temperature on the immune response and infectivity pattern of white spot syndrome virus (WSSV) in freshwater crayfish[J].Fish & Shellfish Immunology,2004,17(3):265-275.
[15] Rahman M M,Corteel M,Wille M,et al.The effect of raising water temperature to 33 ℃ in Penaeus vannamei juveniles at different stages of infection with white spot syndrome virus (WSSV)[J].Aquaculture,2007,272(1):240-245.
[16] Du H H,Li W F,Xu Z R,et al.Effect of hyperthermia on the replication of white spot syndrome virus (WSSV) in Procambarus clarkii[J].Diseases of Aquatic Organisms,2006,71(2):175-178.
[17] Sudha P,Mohan C,Shankar K,et al.Relationship between white spot syndrome virus infection and clinical manifestation in Indian cultured penaeid shrimp[J].Aquaculture,1998,167(1):95-101.
[18] 黄琪琰.水产动物疾病学[M].上海:上海科学技术出版社,1993.
[19] 简旭凤.白斑综合症病毒 (WSSV) 原位PCR及定量PCR检测技术的建立[D].广州:中山大学,2003.
[20] 管越强.主要环境因子对养殖对虾抗病力及白斑综合症发生的影响[D].北京:中国科学院研究生院,2003.
[21] 钟硕良,陈月忠.环境因子对发光细菌的生长及日本对虾仔虾感染死亡率的影响[J].中国水产科学,2001,8(1):41-45.
[22] 丁燏,王雷.对虾病毒病暴发前期病毒和弧菌相互作用关系[J].湛江海洋大学学报,2000,20(3):26-31.
[23] Vidal O M,Granja C B,Aranguren F,et al.A profound effect of hyperthermia on survival of Litopenaeus vannamei juveniles infected with white spot syndrome virus[J].Journal of the World Aquaculture Society,2001,32(4):364-372.
[24] 陈细法,吴定虎.对虾病毒病和细菌合并感染的病理特点和诊断价值[J].病毒学报,1997,13(2):146-150.
Pathogenicity of Vibrio harveyi and white spot syndrome virus
to Pacific white leg shrimp Litopenaeus vannamei
at different temperature
XIANG Yun 1, WU Yu-xue 1, WANG Gang 1, CHEN Zhao-ming 1, ZHANG Rui 2, SUN Cheng-bo 1,3
(1.College of Fisheries, Guangdong Ocean University, Zhanjiang 524025, China; 2.Education Example Center, Guangdong Ocean University, Zhanjiang 524025, China;3.Tropical Marine Invertebrates Aquaculture Research Center of Guangdong Colleges and Universities, Zhanjiang 524025, China)
Key words: Vibrio harveyi; Litopenaeus vannamei; temperature; white spot syndrome virus(WSSV)