引物primer序列sequence(5'-3')CYP11a1-FCTGTAGCAATGAGTCTTCCACYP11a1-RTTCAGTCTCGGCAATCCTβ-actin-FGGCATCACACCTTCTACAAβ-actin-RCAGAGTCCATCACAATACCA
摘要:采用实时荧光定量PCR技术,分析了斑马鱼Danio rerio的CYP11a1基因在成鱼4个组织和性腺发育3个时期的表达情况。结果表明:CYP11a1基因在卵巢、精巢、肌肉和脑组织中均有表达且存在差异,在脑中表达量最低(P<0.05),在卵巢、精巢、肌肉中的表达量分别为脑中表达量的204.7倍、38.9倍、17.0倍;CYP11a1基因在3个卵巢发育时期的表达量表现为先降低后升高的趋势,其在卵巢成熟期的表达量最低(P>0.05),在卵巢成熟前期、卵巢成熟后期的表达量分别为卵巢成熟期表达量的1.7倍、1.5倍;CYP11a1基因在3个精巢发育时期的表达量表现为先升高后降低的趋势,在精巢成熟期表达量最高(P<0.05),分别为精巢成熟前期、精巢成熟后期表达量的6.5倍、13.4倍。研究表明,尽管CYP11a1基因在卵巢和精巢发育过程中的表达规律不同,但CYP11a1基因在一定程度上与斑马鱼的性腺发育相关,其可能在促进斑马鱼精子成熟中发挥一定作用。
关键词:斑马鱼;CYP11a1基因;性腺发育
DOI:10.3969/J.ISSN.2095-1388.2015.01.003
文章编号:2095-1388(2015)01-0013-05
中图分类号:Q45
文献标志码:A
收稿日期: 2014-04-29
基金项目: 国家海洋公益性行业科研专项(201405003)
Abstract: The expression of CYP11a1 gene was studied and analyzed in four tissues and three development phases in gonad of zebrafish Danio rerio by quantitative Real-time PCR (qRT-PCR). It was found that the CYP11a1 gene was expressed in ovary, testis, muscle and brain, the minimum in brain(P<0.05), 204.7 times higher in ovary, 38.9 times higher in testis, and 17.0 times higher in muscle compared with that in brain, indicating that the CYP11a1 gene showed a certain extent tissue difference in expression. The qRT-PCR analysis revealed that the expression of CYP11a1 gene was found to be decreased first in the early development phases of ovary and then enhanced in the later development phases of ovary, the minimum at maturity phase(P>0.05), 1.7 times higher before sexual maturity and 1.5 times higher after sexual maturity compared with that at maturity phase. In the testis, however, the expression of CYP11a1 gene was found to be enhanced first in the early development phases of testis and then decreased in the later development phases of testis, the maximum at the sexual maturity(P<0.05), 6.5 times higher before sexual maturity and 13.4 times higher than that after the sexual maturity. The findings indicated that the expression of CYP11a1 gene was involved in gonad development and spermatogenesis in zebrafish, though the expression pattern of CYP11a1 gene was different in the ovary and the testis.
斑马鱼 Danio rerio隶属于鲤科、短担尼鱼属,是一种具有较高经济价值和观赏价值的热带观赏鱼。由于其具有果蝇、小鼠等模式生物不可比拟的优点,如繁殖能力强、体外受精、胚胎透明、发育快、性成熟周期短、可追踪整个胚胎发育过程等,因此,其特别适合作为研究生长与发育、性别决定、性别分化相关基因表达与功能的模式生物。目前,斑马鱼已被广泛应用于遗传学、生殖发育生物学、生态学等 [1]研究中。
细胞色素P450(Cytochrome P450,CYP)基因家族是一类编码参与一些内源性物质(如激素、胆固醇)和外源性物质(如药物、环境化合物)代谢的酶系超基因家族 [2]。由 CYP基因编码的CYP450酶属于血红蛋白酶类,是一类以血红素为辅基的细胞色素蛋白酶超家族,广泛存在于生物体内。斑马鱼中共存在94种 CYP基因,分布于18个基因家族,而且这些基因家族同样存在于哺乳动物中 [3]。 CYP基因家族中由 CYP1~ CYP4基因编码的酶大多与药物代谢相关,研究表明,鱼类 CYP3a等基因可能与哺乳动物中的一样,在药物代谢中起着重要作用 [4]。 CYP基因家族 CYP5~ CYP51中有32个与人类的 CYP基因同源,并且由这些基因编码的酶大多与生物体内激素代谢有关,在生物性腺发育中起一定作用,如 CYP17、 CYP19、 CYP51等。由 CYP11a1基因编码的胆固醇侧链裂解酶,简称P450scc,是一种线粒体酶 [5],其催化胆固醇为孕烯醇酮,启动生物体内类固醇激素合成的第一步,是这个合成途径的限速步骤和关键的调控位点 [6-7]。由 CYP11a1基因编码的细胞色素P450scc切断C 20/C 22之间的碳碳键,将底物缩短6个碳原子 [8]。从胆固醇到孕烯醇酮的转变过程中需要经过3次单加氧反应,2次胆固醇侧链羟基化反应,最后,C 22和C 20之间的碳键断裂,最终形成孕烯醇酮和异癸酸 [9]。
目前,国内关于斑马鱼 CYP11a1基因的研究较少。本研究中分析了斑马鱼 CYP11a1基因在不同组织及不同性腺发育时期的表达,以期探讨 CYP11a1基因在斑马鱼性腺发育不同时期的表达规律及与性腺发育、分化的相关性,旨在为进一步研究 CYP11a1基因在斑马鱼性腺发育、性别决定与性别分化中的功能提供参考。
通信作者: 仇雪梅(1964—), 女, 教授。E-mail:xmqiu@dlou.edu.cn
试验用鱼为农业部北方海水增养殖重点实验室养殖的1龄斑马鱼,体长约3 cm。日常以商品饵料(脱壳卤虫卵)为主要饵料,每日投喂2~3次,每次投喂量以斑马鱼在5 min内吃完为宜,水温控制在25 ℃左右。
1.2.1 CYP11a1基因在斑马鱼成鱼4个组织中的表达 取健康雌、雄斑马鱼成鱼各30尾,平均分为3组,取卵巢、精巢、肌肉和脑4种组织。为消除个体差异,将每组中同一组织的混合样为一个样本,放入一个去RNA酶处理的1.5 mL离心管中并立即放入液氮中,置于冰箱(-80 ℃)中保存备用。
1.2.2 CYP11a1基因在斑马鱼不同性腺发育时期的表达 依据石蜡切片判断试验鱼的性腺发育时期,并于2013年5月至11月采集样本,在性腺成熟前期、性腺成熟期、性腺成熟后期3个时期各取健康雌、雄斑马鱼各30尾,每10尾为一组,共分3组,取卵巢、精巢两种组织。为消除个体差异,将每组中同一组织的混合样为一个样本,放入一个去RNA酶处理的1.5 mL离心管中并立即放入液氮中,置于冰箱(-80 ℃)中保存备用。
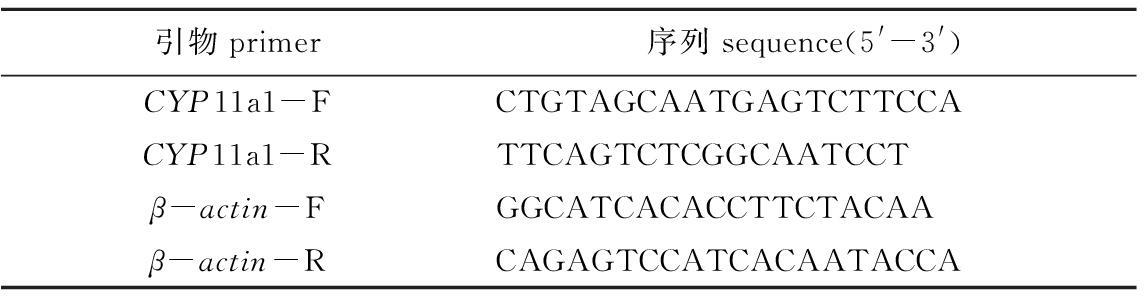
1.2.3 引物设计 以 β- actin基因作为内参基因。按照SYBR Premix Ex Taq TM ⅡKit (Tli RNaseH Plus)引物设计原则,设计 β- actin基因和 CYP11a1基因引物,并委托生工生物工程(上海)股份有限公司合成。引物信息见表1。
表1 实时荧光定量引物
Tab.1 Primers used for expression analysis by Real-time quantitative PCR

引物primer序列sequence(5'-3')CYP11a1-FCTGTAGCAATGAGTCTTCCACYP11a1-RTTCAGTCTCGGCAATCCTβ-actin-FGGCATCACACCTTCTACAAβ-actin-RCAGAGTCCATCACAATACCA
1.2.4 总RNA提取及cDNA第一条链合成 将按“1.2.1”、“1.2.2”节方法获得的样本,参照Trizol ® Reagent (Invitrogen, USA)说明书提取总RNA。用10 g/L琼脂糖凝胶进行电泳,以确定RNA的完整性,要求28 S 条带亮度是18 S条带的2倍。测定样本的OD 260 nm 和OD 280 nm 值,以确定RNA的浓度及纯度,且保证OD 260 nm/OD 280 nm 值在1.8~2.0之间。
分别从用于斑马鱼成鱼 CYP11a1基因在4种组织中表达研究的12个组织样本,以及用于斑马鱼成鱼 CYP11a1基因在3个性腺不同时期表达研究的18个样本中,取900 ng样品RNA进行cDNA第一链合成,然后根据试验需求适当稀释作为RT-PCR模板。
1.2.5 基因引物特异性的验证 通过其溶解曲线来判断实时荧光定量PCR试验中所设计引物的扩增特异性。溶解曲线由实时荧光定量PCR仪系统自动生成,如果其溶解曲线只有一个峰则证明为特异性产物扩增,否则为非特异性扩增。
1.2.6 基因引物扩增效率的验证 将斑马鱼cDNA原液按照5 1倍、5 2倍、5 3倍、5 4倍进行稀释,包括原液在内共设置5组,并以水为阴性对照,分别检测 β- actin和 CYP11a1基因引物的扩增效率以及其是否适用于实时荧光定量基因表达分析。
1.2.7 实时荧光定量PCR 试验采用ABI 7500荧光定量PCR仪(Applied Biosystems,USA)。PCR反应体系(共20 μL):SYBR Premix Ex Taq Ⅱ(Tli RNaseH Plus)(2×)10.0 μL,上、下游引物(10 μmol/L)各0.8 μL,ROX Reference Dye II(50×)0.4 μL,cDNA模板2.0 μL,用灭菌蒸馏水补至20 μL。反应条件:95 ℃下预变性30 s;95 ℃下变性5 s,55 ℃下退火34 s,共进行40个循环;95 ℃下变性15 s,60 ℃下退火1 min,95 ℃下延伸15 s。
实时荧光定量数据以2 -ΔΔC T 法处理,表达量变化以平均值±标准误差表示。为确保实时荧光定量PCR反应的准确性和可重复性,每个样品均重复测定3次。使用SPSS软件进行方差分析和多重比较,显著性水平设为0.05。
溶解曲线由实时荧光定量PCR仪系统自动生成(图1),其横坐标代表温度,纵坐标代表反应过程中生成的产物量。如图1所示,斑马鱼 β- actin引物溶解曲线在86.88 ℃时有一峰, CYP11a1引物溶解曲线在85.37 ℃时有一峰,且无杂峰,说明其特异产物单一,没有引物二聚体的产生,设计的引物适合用于实时荧光定量PCR。

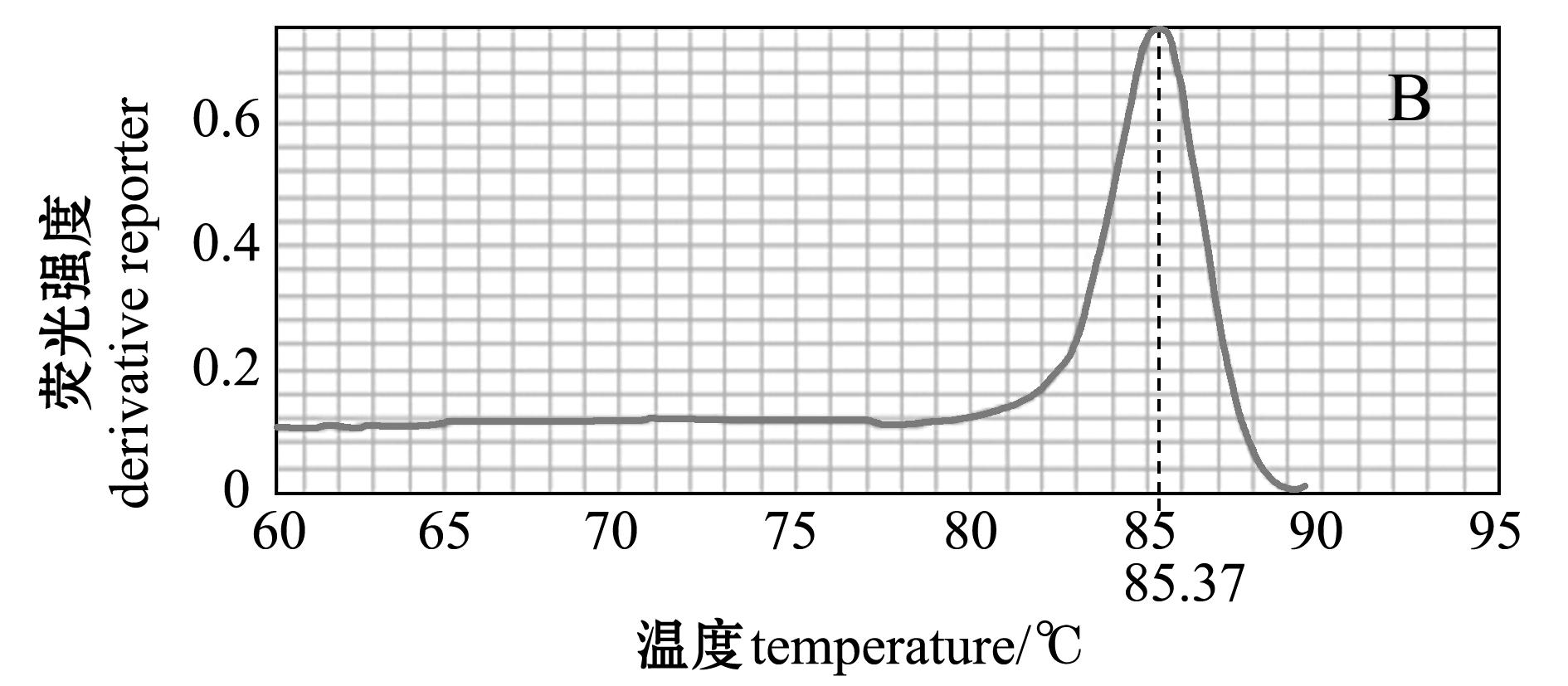
注:A为β-actin基因引物溶解曲线;B为CYP11a1基因引物溶解曲线
Note:A, melting curve of β-actin gene primer;B, the melting curve of CYP11a1 gene primer
图1 斑马鱼β-actin和CYP11a1基因引物溶解曲线
Fig.1 Melting curve of β-actin gene primer and CYP11a1 gene primer in zebrafish
标准曲线由实时荧光定量PCR仪系统自动生成(图2),其纵坐标为 C T值,横坐标代表实时荧光PCR试验中的模板量。每个样品重复测定3次,
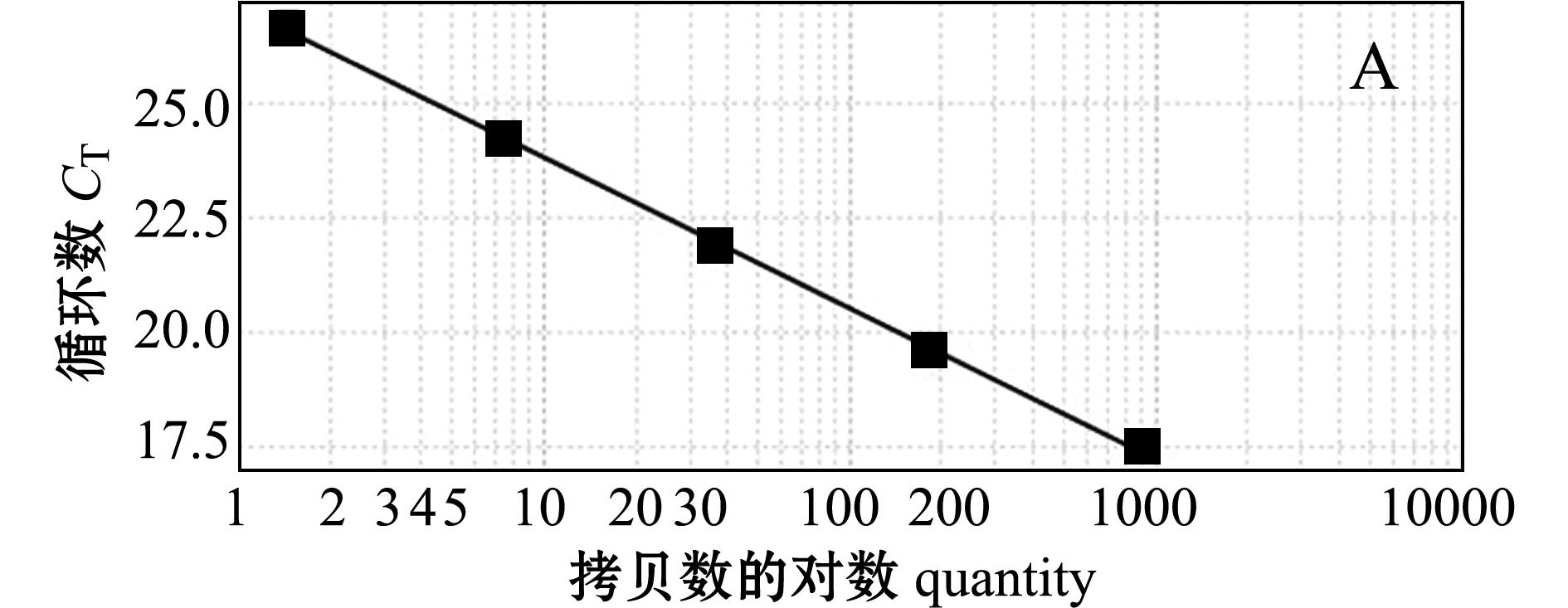
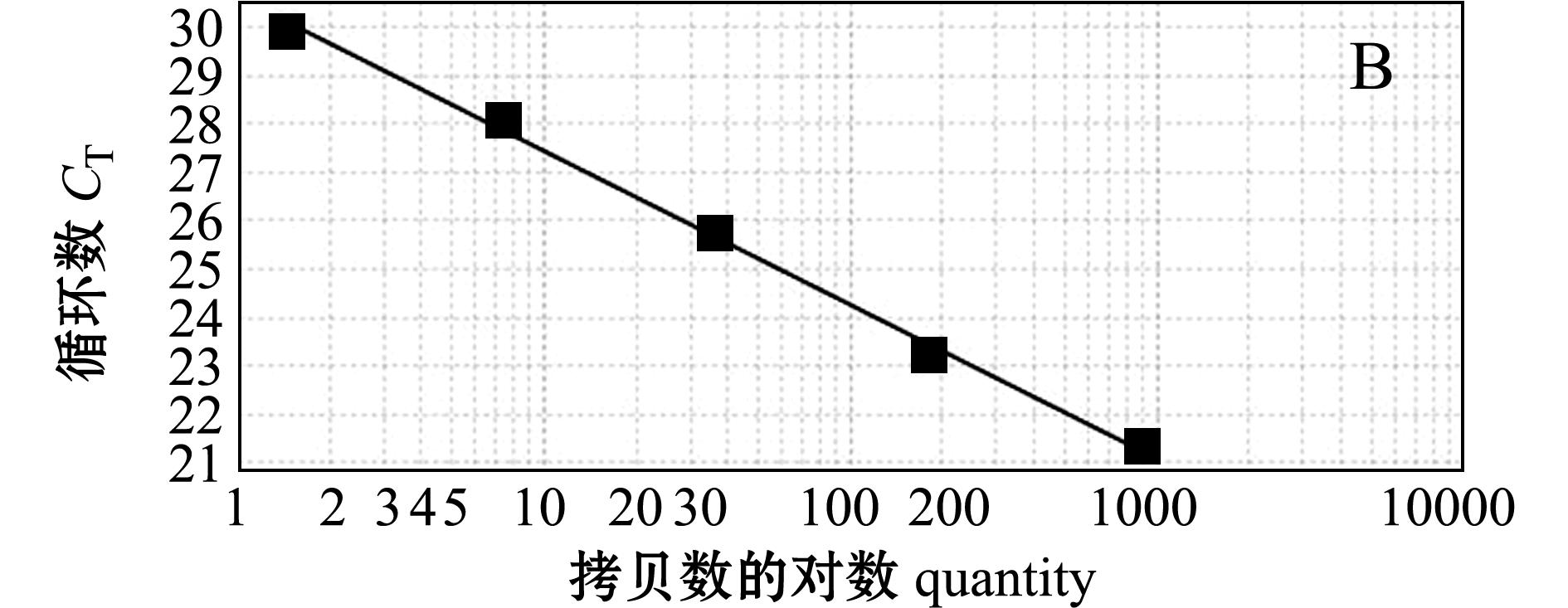
注:A为β-actin基因引物标准曲线;B为CYP11a1基因引物标准曲线
Note:A,standard curve of β-actin gene primer;B,standard curve of CYP11a1 gene primer
图2 斑马鱼β-actin及CYP11a1基因引物标准曲线
Fig.2 Standard curve of β-actin gene primer and CYP11a1 gene primer in zebrafish
得出 C T值的标准偏差为0.02~0.18。结果表明, β- actin和 CYP11a1引物扩增效率一致,这表明其可用于实时荧光定量PCR反应,可用2 -ΔΔC T 方法计算目的基因的表达量。
根据2 -ΔΔC T 方法计算每种组织中的基因表达量,结果如图3 所示。从图3可见: CYP11a1基因在卵巢、精巢、肌肉和脑4种组织中均有表达且具有一定的组织差异;在卵巢中表达量最高( P<0.01),在脑中表达量最低( P<0.05);卵巢中的表达量为脑中表达量的204.7倍,精巢中的表达量为脑中表达量的38.9倍,肌肉中的表达量为脑中表达量的17倍。
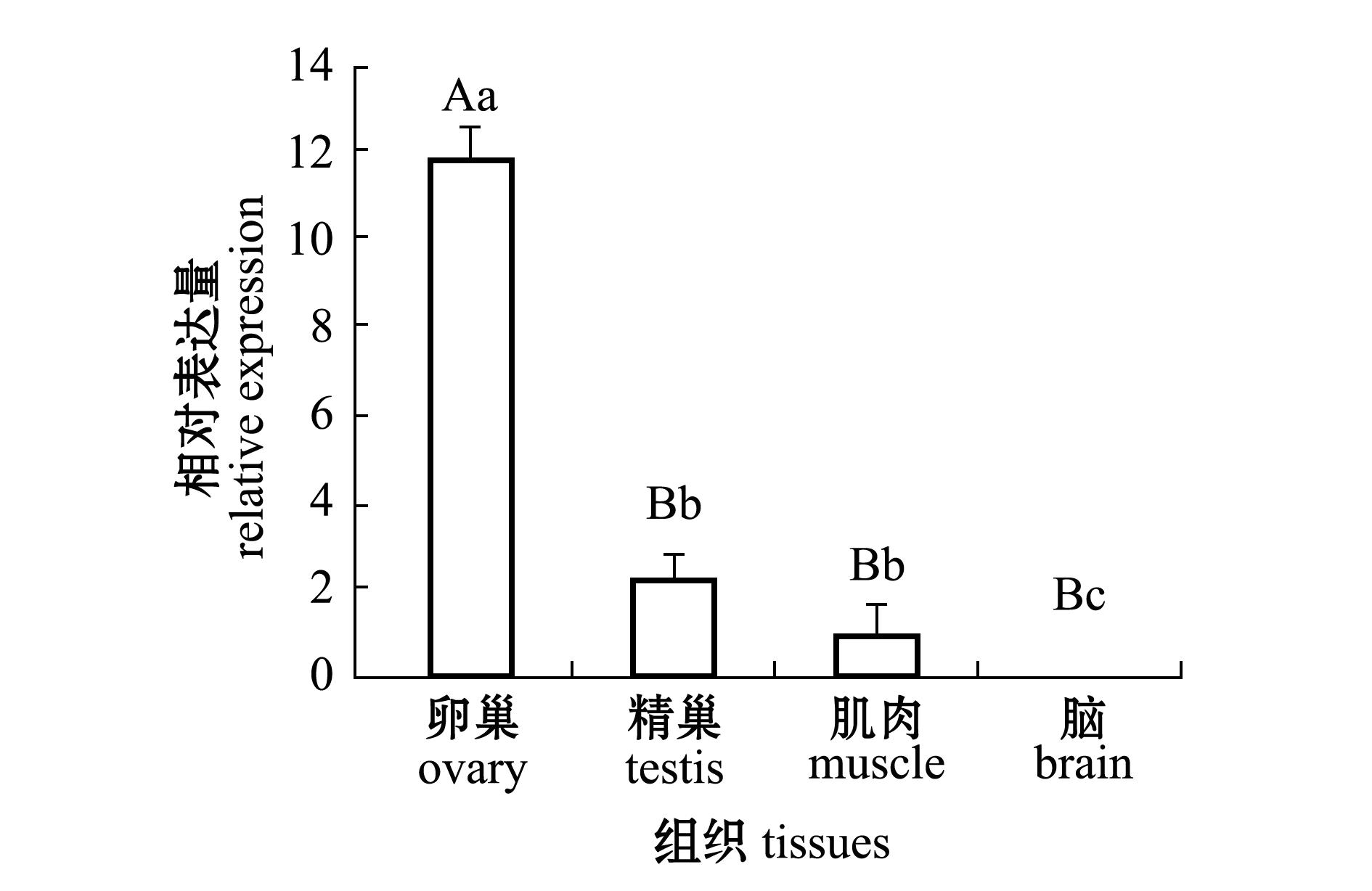
注:标有不同大写字母者表示组间有极显著性差异(P<0.01),标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05)
Note:The means with different capital letters are very significantly different at the 0.01 probability level,means with different letters being significantly different at the 0.05 probability level, and the means with the same letters are not significant differences
图3 斑马鱼CYP11a1基因在4种组织中的表达量
Fig.3 Relative expression of CYP11a1 gene in different tissues of zebrafish
从图4可见: CYP11a1在3个卵巢发育时期的表达量表现为先降低后升高的趋势,其在卵巢成熟期的表达量最低,但无显著性差异( P>0.05),在卵巢成熟前期的表达量为卵巢成熟期表达量的1.7倍,在卵巢成熟后期的表达量为卵巢成熟期表达量的1.5倍; CYP11a1在3个精巢发育时期的表达量表现为先升高后降低的趋势,在精巢成熟期表达量最高( P<0.05),为精巢成熟前期表达量的6.5倍,为精巢成熟后期表达量的13.4倍。
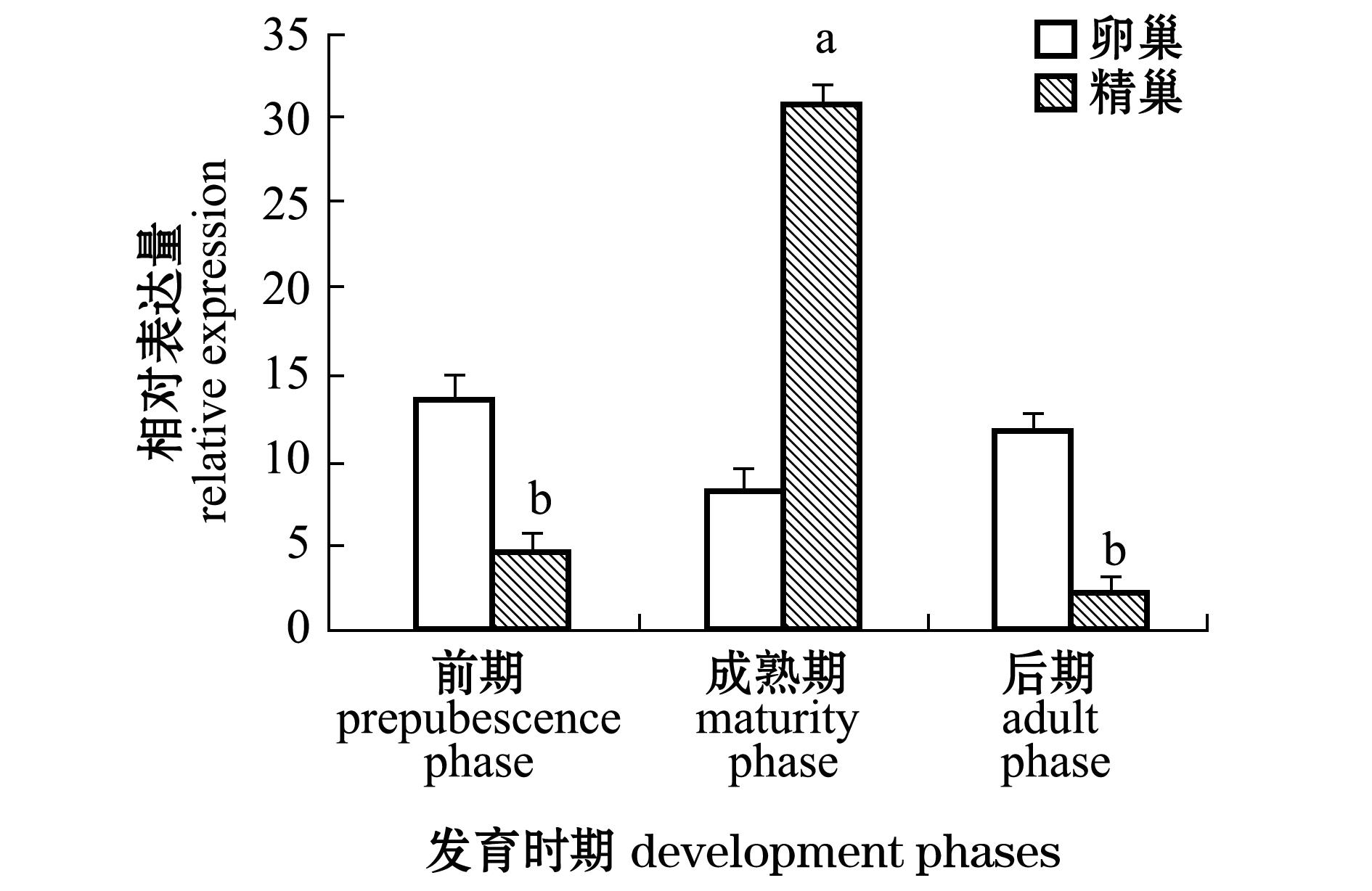
注:标有不同小写字母者表示精巢组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters are significant differences at the 0.05 probability level in testis, and the means with the same letters are not significant differences
图4 斑马鱼CYP11a1基因在不同性腺发育时期的表达
Fig.4 Relative expression of CYP11a1 gene in different developmental phases of gonads in zebrafish
斑马鱼有2个 CYP11a基因,即 CYP11a1和 CYP11a2,这两个基因位于斑马鱼25号染色体且位置相邻;与此同时,斑马鱼还有一个 CYP11b类似基因,称为 CYP11c1基因,位于斑马鱼16号染色体 [3]。
在对鱼类 CYP基因的研究中,已在斑马鱼、美洲魟 Dasyatis americana [10]、日本鳗鲡 Anguilla japonica [11]等鱼类中获得 CYP11基因。Hsu等 [12]研究显示,脊椎动物 CYP11a基因编码的胆固醇侧链裂解酶可将胆固醇转化为孕烯醇酮,而且源于母体的 CYP11a mRNA与在斑马鱼受精卵细胞迁移过程中起重要作用的孕烯醇酮的产生有关。斑马鱼 CYP11a基因敲除后可导致发育轴缩短以及外包缺陷 [3]。这些研究表明, CYP11a基因在斑马鱼早期发育具有重要作用。
研究表明,胆固醇侧链裂解酶在类固醇生成组织中高度表达,最明显的组织为肾上腺皮质、卵巢、精巢和胎盘,并且其位于线粒体内膜 [11,13-14]。斑马鱼从胚胎发育开始, CYP11a1基因就在卵黄合胞体层表达,随后在胚胎期肾原基表达,在成体肾间腺体表达 [12,15-16]。Hsu等 [12]进行的RT-PCR和整体杂交清楚地表明, CYP11a1基因在斑马鱼脑的不同部位转录表达,如端脑和下丘脑等。最近对斑马鱼脑的研究表明, CYP11a1基因在前脑,从嗅觉突触横跨到更边缘的区域(如小脑)广泛表达, CYP11a1基因转录在大脑皮层下部、下丘脑中前部、视觉上皮层显著表达 [17]。在斑马鱼成鱼中, CYP11a1基因编码的mRNA在性腺、肾和脑中均有表达 [15-16]。这与本研究中 CYP11a1基因在卵巢、精巢和脑中均有表达相一致。本研究中, CYP11a1在卵巢中的表达量高于精巢,在脑中表达量最低。
本研究中,采用实时荧光定量法研究 CYP11a1基因在不同性腺发育时期表达时, CYP11a1基因在3个卵巢发育时期的表达量表现为先降低后升高的趋势,其在卵巢成熟期的表达量最低,在卵巢成熟前期的表达量是卵巢成熟期表达量的1.7倍,在卵巢成熟后期的表达量是卵巢成熟期表达量的1.5倍; CYP11a1基因在3个精巢发育时期的表达则表现为先升高后降低的趋势,在精巢成熟期表达量最高,分别为精巢成熟前期、精巢成熟后期表达量的6.5倍、13.4倍。由此可以推断, CYP11a1基因表达在一定程度上与斑马鱼性腺(卵巢、精巢)相关,其可能在促进斑马鱼精子成熟中发挥一定作用。
本研究中,研究了斑马鱼 CYP11a1基因在不同性腺发育时期的表达,性腺发育分期较少,今后要更系统地将性腺发育按照硬骨鱼类性腺发育分期分为6个时期:Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期、Ⅴ期和Ⅵ期 [18],对试验做进一步改进,对斑马鱼 CYP11a1基因在不同性腺发育时期的表达进行更加系统和准确的研究。
参考文献:
[1] 周玉国,温海深.斑马鱼繁殖内分泌学研究进展[J].中国实验动物学报,2007,15(6):465-469.
[2] 黄俊勇,冷欣夫.细胞色素P450酶系的研究进展[J].昆虫知识,1991,28(5):308-312.
[3] Goldstone J V,McArthur A G,Kubota A,et al.Identification and developmental expression of the full complement of cytochrome P450 genes in zebrafish[J].BMC Genomics,2010,11:643-664.
[4] 贾娴,胡琳琳,房文红,等.异育银鲫各组织器官中细胞色素P450药酶活性的比较[J].大连海洋大学学报,2011,26(1):74-78.
[5] Lieberman S,Greenfield N J,Wolfson A.A heuristic proposal for understanding steroid genic processes[J].Endocr Rev,1984,5:128-148.
[6] Stone D,Hector O.Studies on ACTH action in perfused bovine adrenals:aspects of progesterone as an intermediary in corticosteroidogenesis[J].Arch Biochem Biophys,1955,54:121-128.
[7] Koritz S B,Kumar A M.On the mechanism of action of adrenocorticotropic hormone:the stimulation of the activity of enzymes involved in pregnenolone synthesis[J].J Biol Chem,1970,245:152-159.
[8] Lieberman S,Lin Y Y.Reflections on sterol side-chain cleavage process catalyzed by cytochrome P450(scc)[J].Journal Steroid Biochem Mol Biol,2001,78:1-14.
[9] Miller W L.Disorders of androgen biosynthesis[J].Semin Reprod Med,2002,20:205-216.
[10] Nunez S,John M.Translation of the putative cDNA encoding cholesterol side chain cleavage cytochrome P450 (CYP11A) of the southern stingray[J].Gene,1997,187:123-129.
[11] Kazeto Y,Ijiri S,Adachi S,et al.Cloning and characterization of a cDNA encoding cholesterol side-chain cleavage cytochrome P450(CYP11A1):tissue distribution and changes in the transcript abundance in ovarian tissue of Japanese eel, Anguilla japonica,during artificially induced sexual development[J].Journal of Steroid Biochemistry & Molecular Biology,2006,99:121-128.
[12] Hsu H J,Liang M R,Chen C T,et al.Pregnenolone stabilizes microtubules and promotes zebrafish embryonic cell movement[J].Nature,2006,439:480-483.
[13] Churchill P F,deAlvare L R,Kimura T.Topological studies of the steroid hydroxylase complexes in bovine adrenocortical mitochondria[J].J Biol Chem,1978,253:4924-4929.
[14] Mitani F,Shimizu T,Ueno R,et al.Cytochrome P-450 beta and P-450 scc in adrenal cortex:zonal distribution and intramitochondrial localization by the horseradish peroxidase-labeled antibody method[J].J Histochem Cytochem,1982,30:1066-1074.
[15] Hu M C,Hsu H J,Guo I C,et al.Function of CYP11A1 in animal models[J].Mol Cell Endocrinol,2004,215:95-100.
[16] Hsu H J,Hsiao P,Kuo M W,et al.Expression of zebrafish CYP11A1 as a maternal transcript and in yolk syncytial layer[J].Gene Expr Patterns,2002,2:219-222.
[17] Diotel N,Do Rego J L,Anglade I,et al.Activity and expression of steroidogenic enzymes in the brain of adult zebrafish[J].Eur J Neurosci,2011,34:45-56.
[18] 张贤芳,张耀光,王志坚.硬骨鱼类的卵巢发育和卵子发生研究综述[J].海南师范学院学报:自然科学版,2006,19(1):70-74.
Expression of CYP11a1 in different developmental phases of
gonad in zebrafish Danio rerio
CHEN Xiao-hong, QIU Xue-mei, HAO Wei-wei, WANG Xiu-li
(Key Laboratory of Mariculture & Stock Enhancement in North China’s Sea, Ministry of Agriculture, Dalian Ocean University, Dalian 116023, China)
Key words: Danio rerio; CYP11a1 gene; gonadal development