摘要:采用原核表达方法高效表达红鳍东方鲀Takifugu rubripes防御素db-1基因,并获得该基因的重组表达产物。通过RT-PCR扩增获得红鳍东方鲀防御素db-1基因成熟肽编码序列,将其连入pET32a+载体,构建原核表达载体pET32a-mDB-1,然后将其转入至大肠杆菌表达菌株Rosetta(DE3)感受态细胞中,经IPTG诱导目的基因表达,通过SDS-PAGE和Western Blotting检测该蛋白,并利用Ni-NTA亲和层析纯化该蛋白,最后以Anti-Mus defensin Beta2抗体为探针的Elisa反应鉴定该蛋白。结果表明:红鳍东方鲀db-1基因在大肠杆菌中高效表达,并纯化得到了这种重组防御素融合蛋白。本研究中提供了一种简单、高效获取重组防御素蛋白的方法,可为其应用和生产提供支持。
关键词:红鳍东方鲀;防御素;原核表达;Elisa分析
DOI:10.3969/J.ISSN.2095-1388.2015.01.001
文章编号:2095-1388(2015)01-0001-05
中图分类号:S965.225
文献标志码:A
收稿日期: 2014-04-28
基金项目: 国家海洋公益性行业科研专项(201405003)
Abstract: The cloning and prokaryotic expression of defensin db-1 gene were studied and the recombinant protein of defensin db-1 gene was obtained in redfin puffer Takifugu rubripes by RT-PCR. The mature peptide coding sequences of defensin db-1 gene was inserted into the plasmid pET-32a+ to construct the prokaryotic expression vector pET32a-mDB-1, which was transformed into Escherichia coli competent cells Rosetta(DE3) and was expressed after induced by IPTG. The protein expression was detected by SDS-PAGE gel electrophoresis and Western Blotting, and the expressed fusion proteins were purified by affinity chromatography with Ni-NTA. Finally, the fusion proteins were identified by the Elisa with the probe of goat Anti-Mus Defensin Beta2 antibody. The defensin db-1 gene was found to be expressed effectively in E.coli, and the recombinant protein has been purified and obtained confidently. The findings provided a simple and efficient way to get the recombinant defensin protein, and a support for the production and application of this protein.
近年来,水产养殖业中抗生素滥用现象十分严重,诱发了“超级细菌” [1]等多抗性细菌和抗生素残留等一系列问题,对人类的健康以及生态平衡造成了严重影响。因此,开发生产新型的抗菌、抗病原微生物制品具有深远的意义。
防御素(defensin)是机体非特异性免疫的重要组成部分,是一种富含半胱氨酸的小分子阳离子多肽,相对分子质量为2000~6000。根据其分子内二硫键的不同,将其分为α-防御素、β-防御素、θ-防御素、昆虫防御素和植物防御素 [2]。防御素广泛存在于动植物体内,在抵抗体外病原微生物入侵方面起着重要作用,对细菌 [3]、真菌 [4]和包膜病毒 [5]等具有广谱抗性。鱼类的防御素对革兰氏阴性菌和阳性菌都有较好的抑菌杀菌功效 [6],同时还可以增强鱼体的免疫反应 [7],提高免疫力。鱼类防御素本身是一种鱼源多肽,无耐药性 [8],也不会引发生态问题,是海洋鱼类中值得开发的一种资源。然而,从鱼体中直接提取该蛋白操作复杂、成本高、产量少,不能大规模产业化生产,限制了此类蛋白的拓展应用前景。
本研究中,通过原核表达方法在大肠杆菌中高效表达红鳍东方鲀 Takifugu rubripes防御素 db-1基因,可快速、高效、大量获得这种重组防御素蛋白,该蛋白可作为杀菌抑菌制剂和免疫增强剂,为鱼类的健康养殖、可持续发展奠定基础。
试验用健康红鳍东方鲀取自大连海洋大学农业部北方海水增养殖重点实验室。
试验用 Taq酶,限制性内切酶 NcoI和 XhoI,T4 DNA连接酶,pMD-19T载体,DNA DL2000 Maker,蛋白Maker等均购自宝生物(TaKaRa)公司;pET32a+原核表达载体和Rosetta(DE3)感受态细胞由本实验室保藏;DH5α感受态细胞以及Ni-NTA柱等购自北京全式金公司;反转录试剂盒,鼠抗His-Tag抗体、HRP-兔抗鼠IgG,Western Bloting膜封闭液,沉淀型TMB显色液等均购自北京天根(Tiangen)公司;Anti- Mus Defensin Beta2抗体(羊源)、HRP-羊抗鼠IgG购自上海华壹生物公司;切胶回收试剂盒购自OMEGA Bio-Tek公司;其他常规试剂由本实验室提供。
1.2.1 红鳍东方鲀总RNA的提取 采集红鳍东方鲀新鲜皮肤组织样本,迅速冻存于液氮中,于冰箱(-80 ℃)中保存备用。采用Trizol法提取红鳍东方鲀皮肤组织总RNA。
通信作者: 仇雪梅(1964—), 女, 教授。E-mail:xmqiu@dlou.edu.cn
1.2.2 红鳍东方鲀防御素蛋白编码区(CDS)片段的扩增 根据GenBank中红鳍东方鲀防御素基因(GI:295293014)序列和pET32a+载体多克隆位点序列,设计特异性引物:
DB-1cF:5′ATGGCCTCTTACCGAGCT 3′;
DB-1cR:5′TCATAGAAAATGAGACACGCAG 3′。
以红鳍东方鲀皮肤总RNA为模板,用反转录试剂盒合成cDNA第一链;以cDNA第一链为模板,用DB-1cF/DB-1cR引物PCR扩增防御素CDS片段。
1.2.3 原核表达载体pET32a-mDB-1的构建 根据红鳍东方鲀防御素基因CDS序列和pET32a+载体多克隆位点序列,设计特异性引物:
![]() GCACTTGTCCAAGCCTGAG3′(划线部分为
NcoI酶切位点);
GCACTTGTCCAAGCCTGAG3′(划线部分为
NcoI酶切位点);
![]() TCAGCAGCACTGGA-AGCCTT3′(划线部分为
XhoI酶切位点)。
TCAGCAGCACTGGA-AGCCTT3′(划线部分为
XhoI酶切位点)。
以cDNA第一链为模板,用mDBeF/mDBeR引物PCR扩增防御素成熟肽编码区mDB-1片段。将pET32a+载体和mDB-1片段同时用 NcoI和 XhoI进行双酶切,对双酶切产物分别进行切胶回收,并将两种切胶回收的基因片段用T4 DNA连接酶于16 ℃下连接过夜;将连接产物转化至大肠杆菌DH5α感受态细胞中,涂布于平板(含100 μg/mL氨苄青霉素)上筛选,用下列通用引物对单克隆菌液进行PCR鉴定:
pETF19:5′TACCGACGACGACGACAAG 3′;
pETR19:5′TCTCAGTGGTGGTGGTGGT 3′。
将阳性菌株送生工生物工程(上海)股份有限公司进行测序。
1.2.4 转化pET32a-mDB-1载体菌株的诱导表达及SDS-PAGE凝胶电泳检测 将测序正确的重组表达质粒pET32a-mDB-1转入大肠杆菌表达菌株Rosetta(DE3)感受态细胞中,并筛选单克隆菌株;挑取单克隆菌株扩大培养至菌液OD 600 nm为0.6左右,加入终浓度为0.5 mmol/L的IPTG,于28 ℃下诱导4 h;参照张峰 [9]的SDS-PAGE凝胶电泳方法检测。
1.2.5 融合蛋白的Western Blotting鉴定 参照潘秋丽 [10]的Western Blotting方法,将经IPTG诱导的菌体蛋白上样10 μL进行SDS-PAGE凝胶电泳,然后将电泳凝胶切下进行电转印,再将凝胶中的蛋白转至NC膜上。转印条件为:100 mA下电转印2 h,取出转印NC膜,进行封闭、抗体孵育和显色,最后拍照。
1.2.6 目的融合蛋白的分离纯化和Elisa检测 根据Ni-NTA柱试剂盒提供的方法,将100 mL经IPTG诱导后的菌液进行纯化。最后将纯化的产物进行SDS-PAGE凝胶电泳检测和蛋白浓度测定。根据李川等 [11]的Elisa操作方法,将纯化后得到的目的融合蛋白加入酶标板孔中,以200倍稀释的Anti- Mus Defensin Beta2多克隆抗体进行Elisa检测,最后用酶标仪测定OD 450 nm值。
采用Trizol法提取红鳍东方鲀皮肤组织总RNA,经琼脂糖凝胶电泳检测,结果见图1,总RNA中28 S、18 S RNA条带清晰,且28 S条带亮度是18 S条带的2倍。以此总RNA为模板反转录合成cDNA第一链,并用PCR扩增防御素DB-1成熟肽区域片段mDB-1,经琼脂糖凝胶电泳检测,结果见图2,PCR扩增出120 bp左右的目的片段。
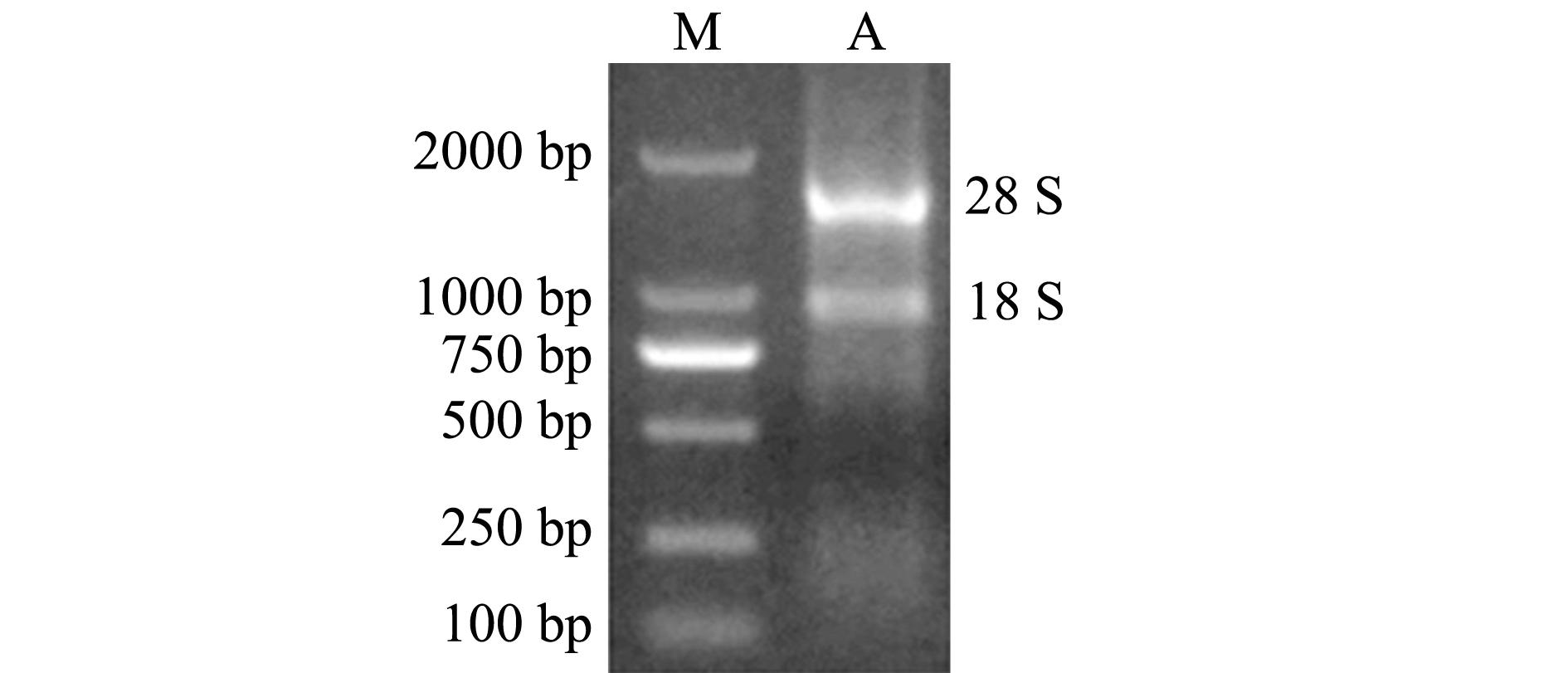
注:M为DL2000 Maker;A为总RNA
Note:M,DL2000 Maker; A,the total RNA
图1 红鳍东方鲀皮肤总RNA的琼脂糖凝胶电泳图
Fig.1 Agarose gel electrophoresis of the total RNA in skin of redfin puffer Takifugu rubripes
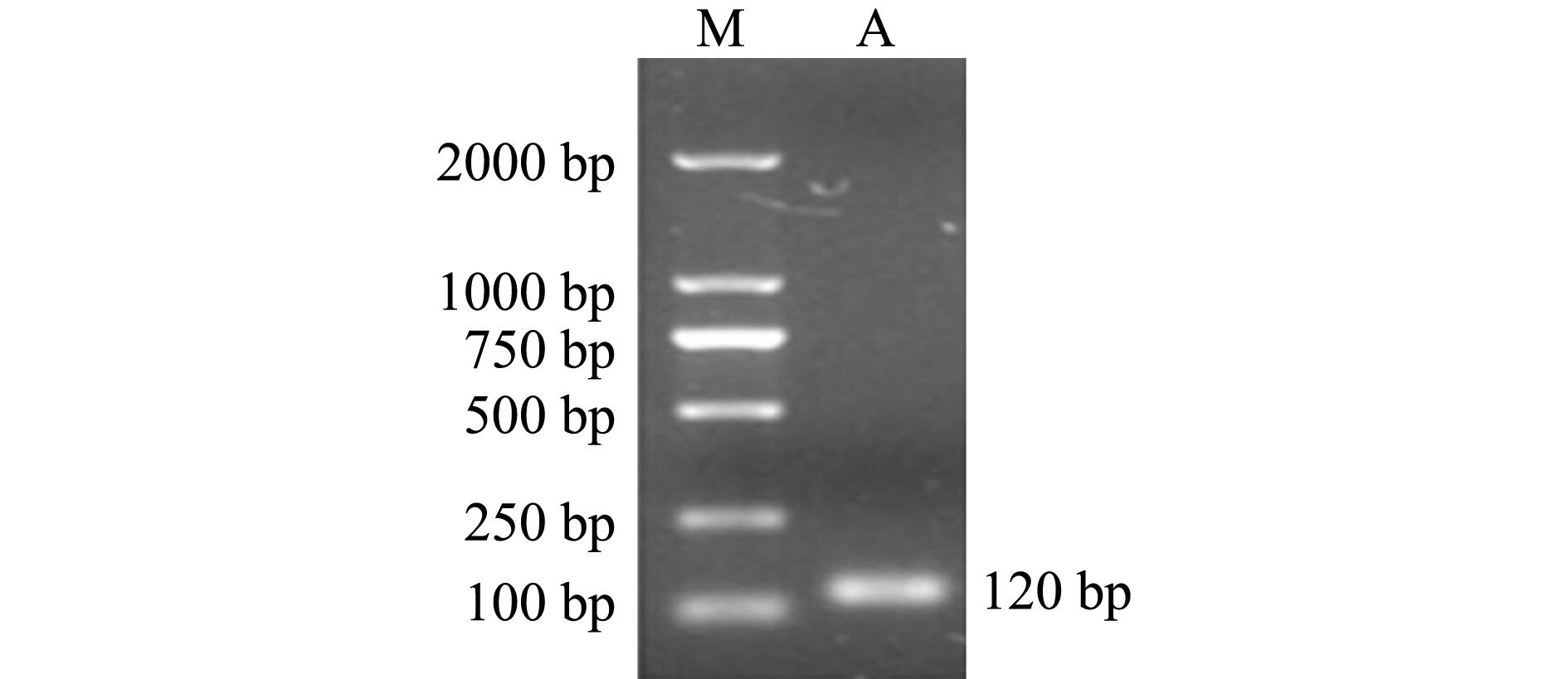
注:M为DL2000 Maker; A为mDB-1片段
Note:M,DL2000 Maker; A,mDB-1 fragment
图2 红鳍东方鲀防御素mDB-1片段琼脂糖凝胶电泳图
Fig.2 Agarose gel electrophoresis of defensin gene mDB-1 fragment in redfin puffer Takifugu rubripes
通过对红鳍东方鲀防御素 db-1基因的PCR扩增及测序,结果显示,红鳍东方鲀防御素 db-1基因CDS为210 bp,编码66个氨基酸(图3)。通过生物信息学软件分析,结果显示,编码氨基酸中1~26号为信号肽区域,30~61号为成熟肽区域,成熟肽相对分子质量 M w=3370, pI=8.30。在GenBank数据库和Uniprot数据库中对成熟肽基因序列和氨基酸序列进行Blast比对分析,结果显示,该基因位于红鳍东方鲀第15号染色体(GI:351059498),属于β-防御素家族,其中该防御素成熟肽氨基酸序列与大西洋鳕鱼 Gadus morhua β-防御素 [5]和虹鳟 Oncorhynchus mykiss β防御素-1 [6]相似性都高达97%。通过Swiss-modle同源建模分析,其分子结构中含有3个反向平行β折叠结构,为β-防御素典型结构 [2](图4)。

图3 红鳍东方鲀防御素基因db-1的CDS和氨基酸序列
Fig.3 CDS and amino acid sequences of defensin db-1 gene from redfin puffer Takifugu rubripes

注:黄色为3个反向平行β折叠结构;A为红鳍东方鲀防御素DB-1三维结构;B为人β-防御素106(SMTL id:2lwl.1)三维结构
Note:There are three antiparallel β-strands(the yellow parts);A, three dimensional structures of defensin DB-1 from redfin puffer Takifugu rubripes; B, three dimensional structures of beta-defensin 106 (SMTL id:2lwl.1) from humans
图4 红鳍东方鲀防御素DB-1蛋白同源建模分析
Fig.4 Homology modeling analysis of defensin DB-1 protein from redfin puffer Takifugu rubripes
将 pET32 a+载体和扩增的 mDB-1片段进行双酶切后的片段用 T4 DNA酶连接,连接后的质粒转入至 DH5 α感受态细胞中进行筛选,用通用引物 pETF19/ pETR19对筛选的单克隆菌液进行 PCR检测,结果见图5。取阳性单克隆菌落进行测序验证,结果显示,菌检 PCR中有156 bp左右的条带,为阳性克隆,且测序结果与设计序列一致,说明 mDB-1片段成功连入 pET32 a+载体, pET32 a- mDB-1载体构建成功。
对成功转入 pET32 a- mDB-1载体的单克隆菌株和成功转入 pET32 a+载体的单克隆菌株、 Rosetta( DE3)菌株进行扩大培养后,分别进行0.5 mmol/ L IPTG 诱导(28 ℃, 4 h),然后对诱导菌体进行 SDS- PAGE凝胶电泳检测和 Western Blotting鉴定。结果显示:转入 pET32 a- mDB-1载体的单克隆菌株在相对分子质量为21 700处有一特异性蛋白条带,而对照转入 pET32 a+载体的单克隆菌株在22 600处有一特异性蛋白条带,空对照 Rosetta( DE3)菌株则没有这两个条带。经 Western Blotting免疫印迹表明,重组蛋白内 His的标签得到表达,重组载体得到正确表达(图6)。
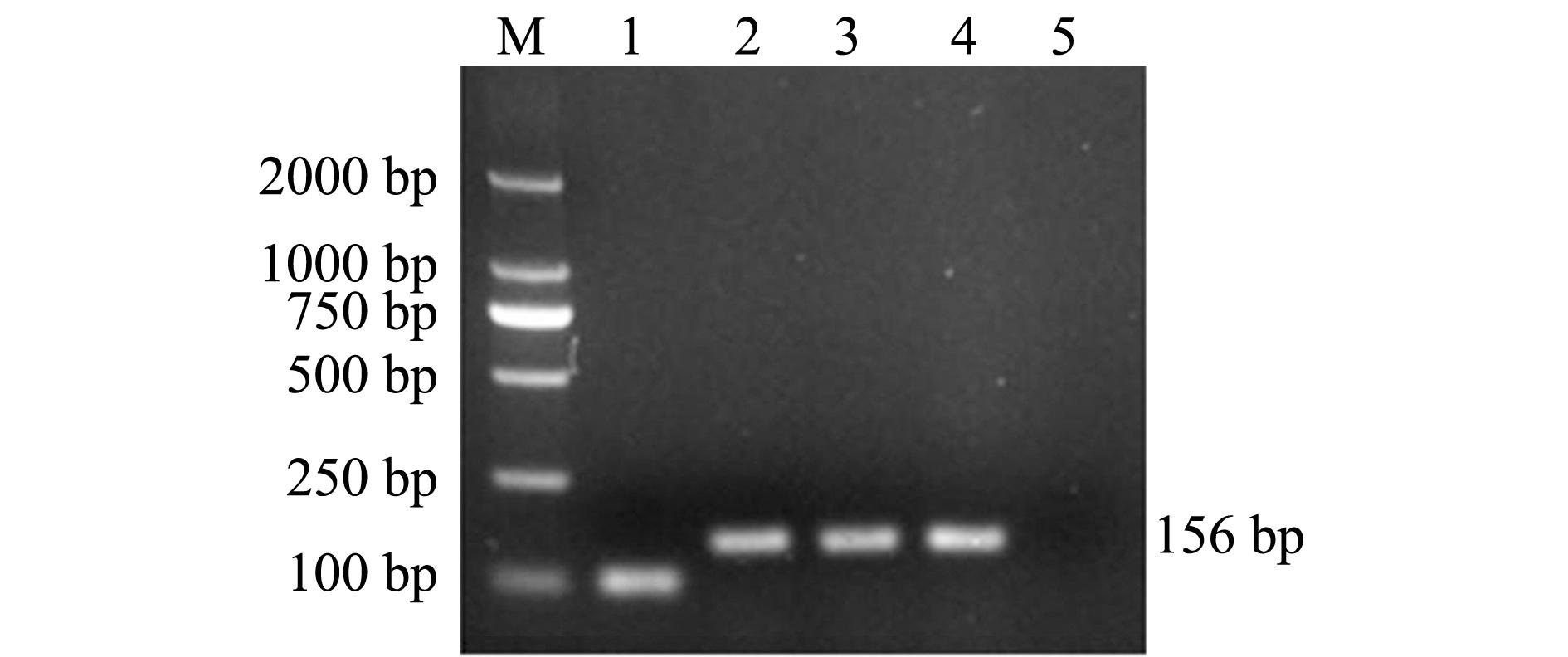
注:M为DL2000 Maker;1为pET32a+载体扩增片段,为假阳性克隆;2~4为阳性克隆;5为阴性对照
Note:M,DL2000 Maker;1,the PCR amplified fragment from pET32a+, a false positive strain;2-4, positive strains;5, negative control
图5 筛选单克隆菌株的PCR检测结果
Fig.5 PCR detection of the screened monoclonal
strains
利用重组蛋白内含有的 His标签,对目的融合蛋白进行纯化,纯化后的蛋白经透析过夜后,进行 SDS- PAGE凝胶电泳检测(图7),经测定,纯化后的融合蛋白浓度为0.64 ng/ μL。
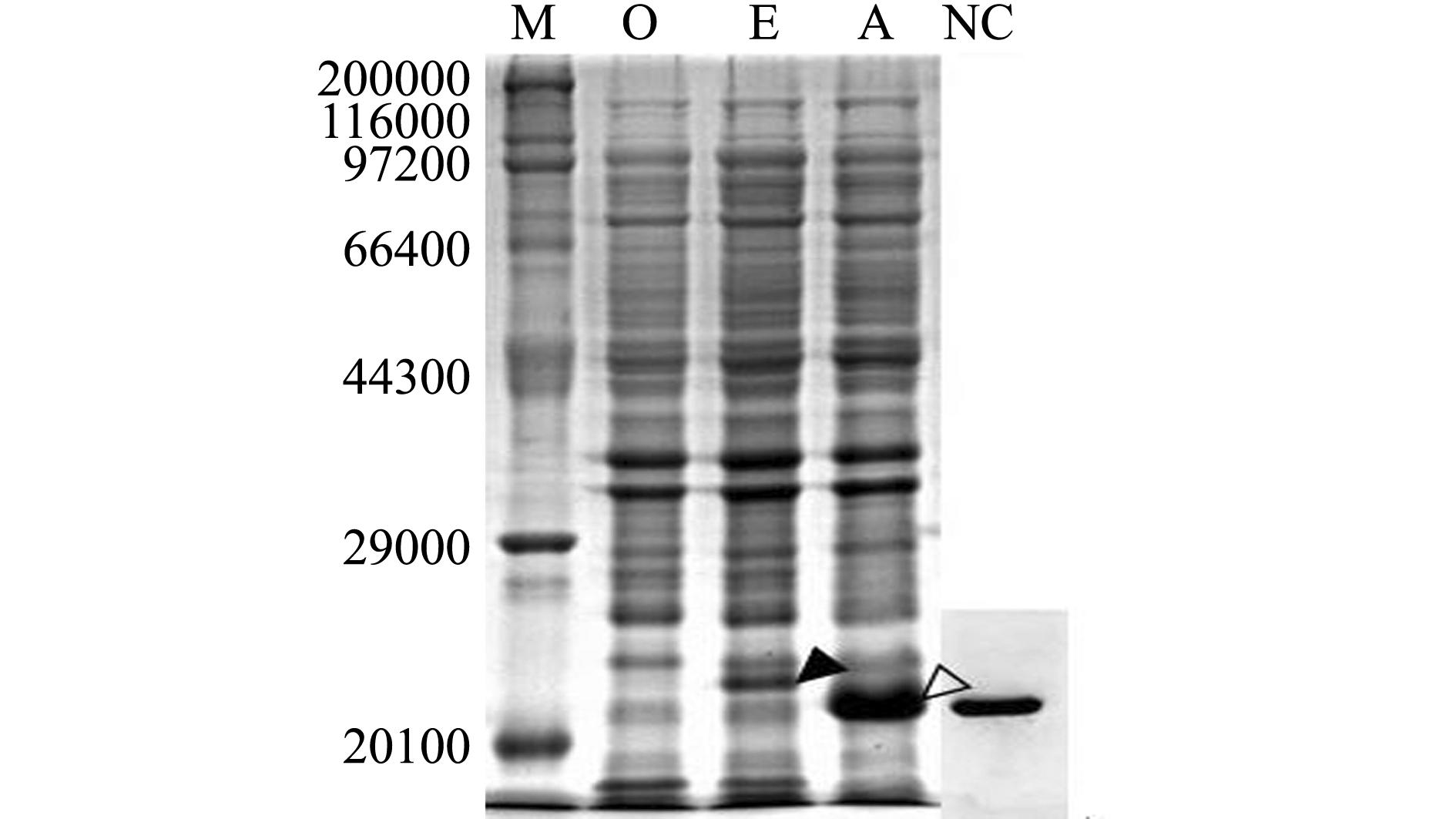
注:M为蛋白Maker;O为空的Rosetta(DE3)菌株菌体蛋白;E为导入pET32a+载体的Rosetta(DE3)菌株菌体蛋白;A为导入pET32a-mDB-1的Rosetta(DE3)菌株菌体蛋白;NC为融合蛋白的Western Blotting检测结果
Note:M,protein maker; O,the protein of Escherichia coli Rosetta(DE3) strain; E,the protein of Rosetta(DE3) strain transformating pET32a+ vector; A,the protein of Rosetta(DE3) strain transformating pET32a-mDB-1vector; NC,the Western Blotting of fusion protein
图6 融合蛋白12% SDS-PAGE凝胶电泳检测及Western Blotting鉴定结果
Fig.6 Detection of the fusion protein by 12% SDS-PAGE gel electrophoresis and Western Blotting
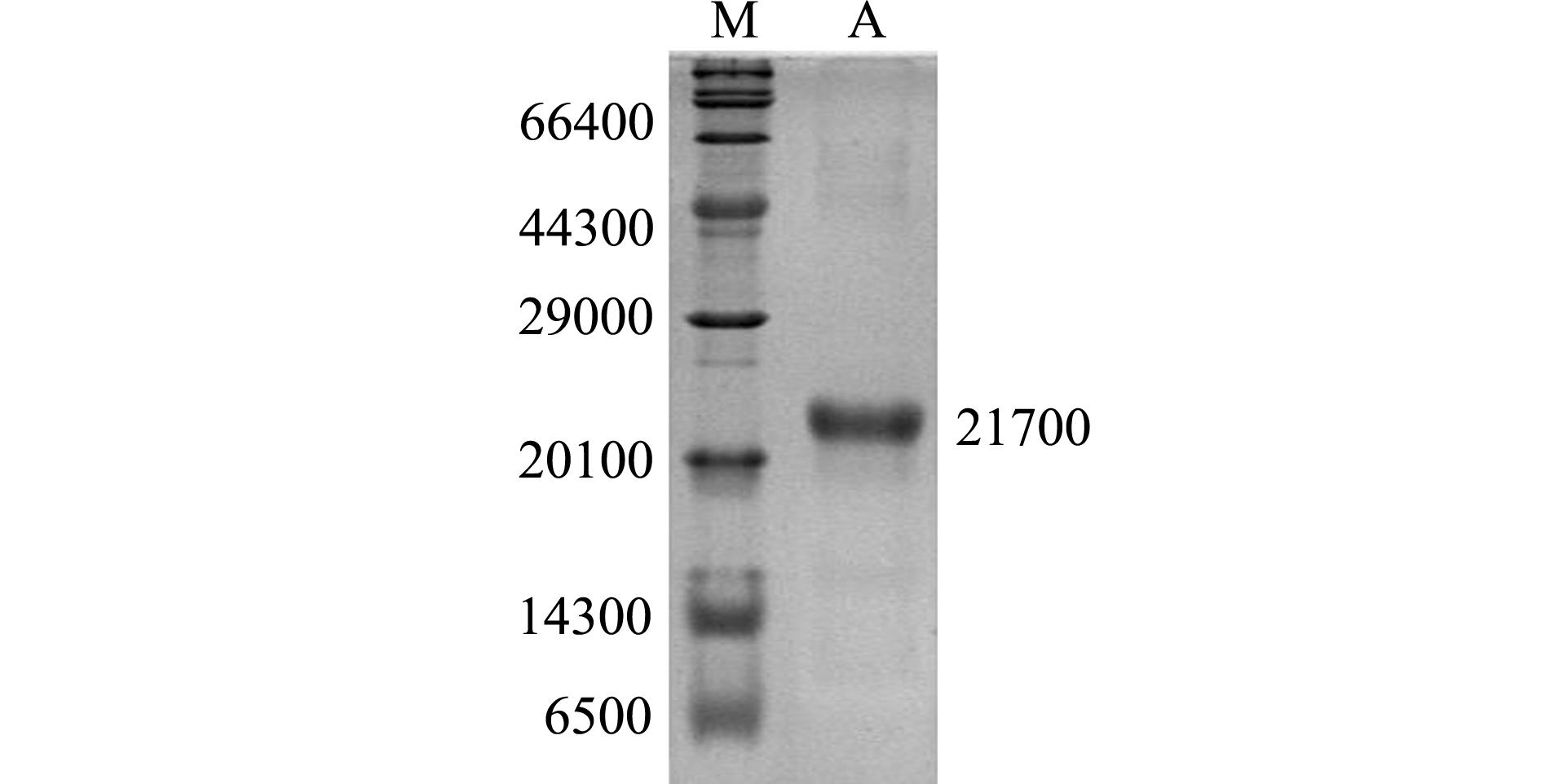
注:M为蛋白Maker;A为Ni-NTA柱纯化后的蛋白
Note:M,protein Maker; A,the purified protein by Ni-NTA
图7 经纯化的融合蛋白15% SDS-PAGE凝胶电泳结果
Fig.7 The 15% SDS-PAGE gel electrophoresis of the purified fusion protein
以 Anti-Mus Defensin Beta2抗体为一抗,以 HRP-羊抗鼠 IgG为二抗,进行直接 Elisa反应,检测结果呈阳性 [图8( a) ],且随融合蛋白浓度的增加呈递增趋势 [图8( b) ],说明目的融合蛋白为防御素蛋白,防御素db-1基因表达成功。
防御素成熟肽蛋白为阳离子蛋白,分子内普遍含有3~4个二硫键,这对其结构稳定和行使功能十分重要 [12]。作为一种具有杀菌抑菌作用的抗菌肽,原核表达将会对宿主菌产生细胞毒性作用。本研究中采用融合表达的方法,将 mDB-1片段接入 pET32 a+原核表达载体中,使目的蛋白与载体表达的硫氧还原蛋白 TrxA进行融合表达,表达融合蛋白分子变大,对其功能的发挥起到一定的限制作用。同时, TrxA蛋白为阴离子蛋白(pI=4.67),不仅可以中和目的蛋白的电荷,避免目的蛋白对宿主菌的毒害作用,而且还有利于目的蛋白内二硫键的形成。通过融合表达方法在抗菌类多肽表达方面已有很多先例,丛潇 [13]、李华 [14]分别通过融合表达方法表达了海鲈Lateolabrax japonicus和鲤Cyprinus carpio L.抗菌肽 Hepcidin;苏丽娜等 [15]将驯鹿 β防御素-1基因与 pET32 a+载体连接,融合表达了该蛋白; Cipakova等 [16]利用轻酶解肌球蛋白在低离子强度条件下沉降、高离子强度条件下溶解的特性,将轻酶解肌球蛋白的 C端片段与 β-防御素在大肠杆菌中融合表达,使表达蛋白在大肠杆菌胞内沉降并以包涵体形式存在,从而避免了表达的 β-防御素对宿主菌的影响。另外,钟志霞等 [17]采用融合表达和多拷贝串联表达方式对人 β-防御素2进行了原核表达。
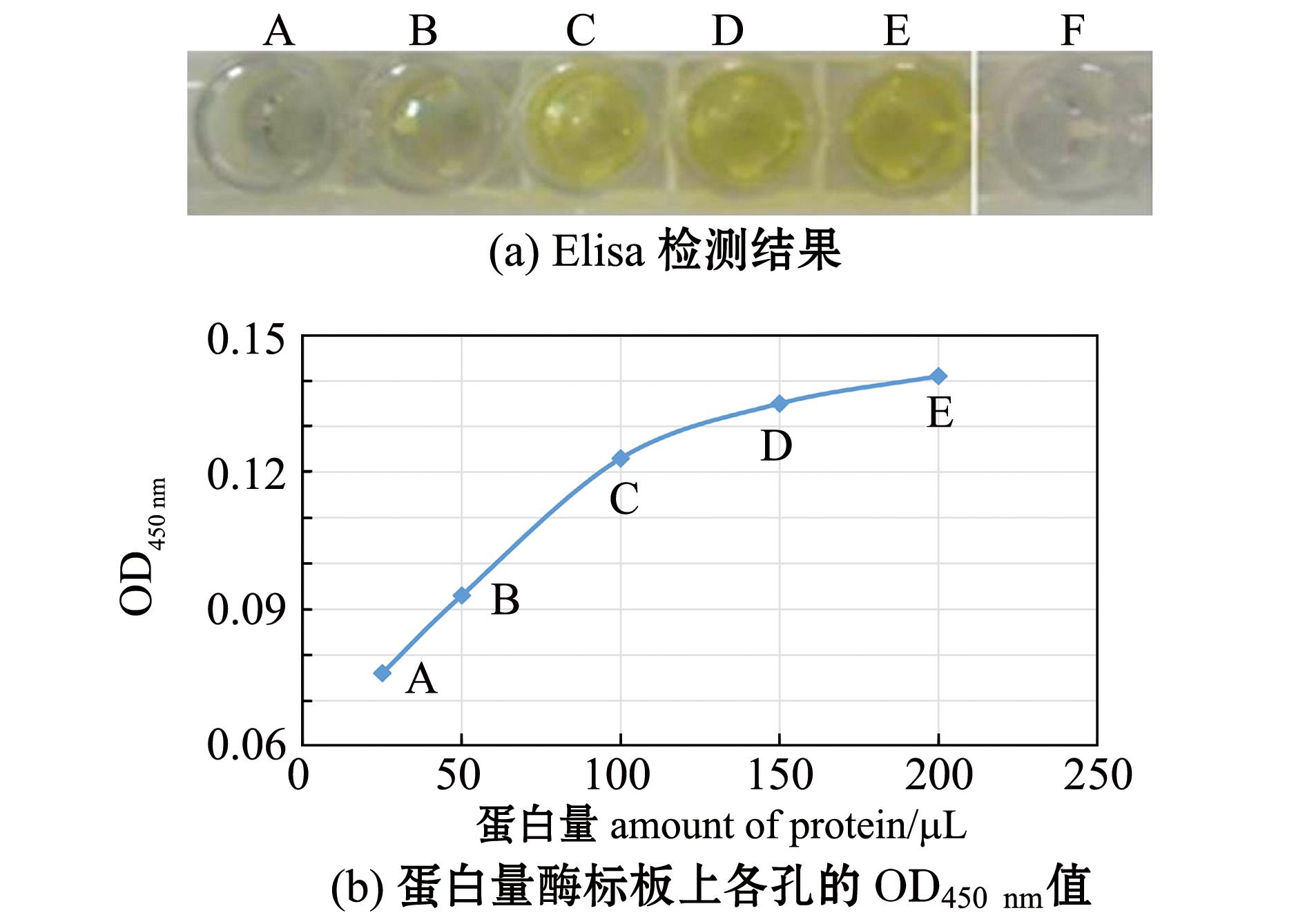
注:A孔为25 μL纯化蛋白稀释至200 μL,B孔为50 μL纯化蛋白稀释至200 μL,C孔为100 μL纯化蛋白稀释至200 μL,D孔为150 μL纯化蛋白稀释至200 μL,E孔为200 μL纯化蛋白,F孔为0.5 ng/μL牛血清蛋白阴性对照
Note:A,25 μL purified protein is diluted to 200 μL; B, 50 μL purified protein is diluted to 200 μL; C,100 μL purified protein is diluted to 200 μL; D,150 μL purified protein is diluted to 200 μL; E,200 μL purified protein; F, the negative control with 0.5 ng/μL bovine serum albumin(BSA)
图8 目的融合蛋白的Elisa检测结果
Fig.8 Elisa analysis of the target fusion protein
对于表达的融合蛋白的检测,通常采用 Western Blotting方法 [1]检测,但是 Western Blotting只能证明目的基因按照正确的翻译框架翻译,不能够直接证明翻译出的蛋白具有正确的结构。因此,本研究中利用抗原与抗体之间的特异性反应,通过以抗防御素 β2抗体为探针的 Elisa反应,进一步证明了表达的融合蛋白为防御素蛋白。
防御素作为一种小分子阳离子稳定多肽,具有显著的抗细菌、抗真菌和抗病毒活性,可以直接作为杀菌抑菌剂,其作用机制与传统抗生素有本质上的不同,因此,不会残留,无耐药性,也不会引发生态问题。另一方面,根据防御素可增强机体免疫反应、提高免疫力的作用,可将其作为免疫增强剂,如作为饲料添加剂,可提高畜禽成活率和抗病能力。防御素独特的作用机制和稳固的分子结构,为多肽类药物的开发提供了一个理想的分子骨架和模板 [18],为新型药物和材料的开发可提供借鉴。
参考文献:
[1 ] 黄希,苏绍玉.“后抗生素时代”——“超级细菌”新德里金属 β-内酰胺酶 I型 [J].中国实用护理杂志,2013,29:61-62.
[2 ] 余兴邦,郭锁链,乌翠兰,等.防御素研究进展 [J].动物医学进展,2006,27(8):47-51.
[3 ] 王猛,马艳平,刘永生,等. β-防御素研究进展 [J].安徽农业科学,2009,37:3561-3563.
[4 ] Mehra T, Kö berle M, Braunsdorf C, et al. Alternative approaches to antifungal therapies[J]. Exp Dermatol,2012, 21(10):778-782.
[5 ] 朱元军,李明远.防御素抗 HIV作用 [J].国际病毒学杂志,2006,13(1):2-5.
[6 ] Nikolaidis N, Ruangsri J, Kitani Y. A novel beta- defensin antimicrobial peptide in Atlantic cod with stimulatory effect on phagocytic activity[J]. PLoS One,2013,8: e62302.
[7 ] 周联,俞瑜.防御素与先天性免疫及获得性免疫 [J].国外医学:免疫学分册,2005,28(2):68-72.
[8 ] 付蓝宝,于嘉林,刘伟华,等.防御素的生物学特性及其抗病基因工程 [J].遗传,2011,33(5):512-519.
[9 ] 张峰.牙鲆 γ干扰素相关基因的表达分析及其原核表达研究 [D].大连:大连海洋大学,2011.
[10 ] 潘秋丽.牙鲆三个白介素基因的半定量表达谱及白介素6的原核表达研究 [D].大连:大连海洋大学,2011.
[11 ] 李川,谭亚娣,陈颖钰,等.牛 IFN- γ原核表达、单克隆抗体制备及其 ELISA检测方法的建立 [J].生物工程学报,2007,23(1):40-45.
[12 ] 叶星,白俊杰.抗菌肽的研究及其在水产上的应用前景 [J].大连水产学院学报,2000,15(4):274-279.
[13 ] 丛潇.海鲈头肾 cDNA文库的构建及 Hepcidin抗菌肽基因的克隆与表达 [D].济南:山东师范大学,2008.
[14 ] 李华.鲤鱼抗菌肽 Hepcidin的基因克隆、表达及其功能的研究 [D].济南:山东师范大学,2010.
[15 ] 苏丽娜,杨银凤,景岚,等.驯鹿 β-防御素-1( reBD-1)基因的原核表达及蛋白活性的鉴定 [J].畜牧兽医学报,2011,42(11):1638-1642.
[16 ] Cipakova I, Hostinova E, Gasperik J, et al. High level expression and purification of a recombinant hBD21 fused to LMM protein in Escherichia coli [J]. Protein Expr Purif,2004,37(1):207-212.
[17 ] 钟志霞,阮红,范立梅,等.人 β-防御素2在大肠杆菌中的高效表达和纯化 [J].浙江大学学报:医学版,2006,35(6):585-589.
[18 ] 李涛,杨银凤.防御素的研究进展 [J].内蒙古农业大学学报:自然科学版,2009,30(1):321-324.
Cloning and prokaryotic expression of defensin db-1
gene from redfin puffer Takifugu rubripes
XU Jin, QIU Xue- mei, GAO Chang- fu, WANG Xiu- li
( Key Laboratory of Mariculture & Stock Enhancement in North China’ s Sea, Ministry of Agriculture, Dalian Ocean University, Dalian 116023, China)
Key words: Takifugu rubripes; defensin; prokaryotic expression; Elisa analysis