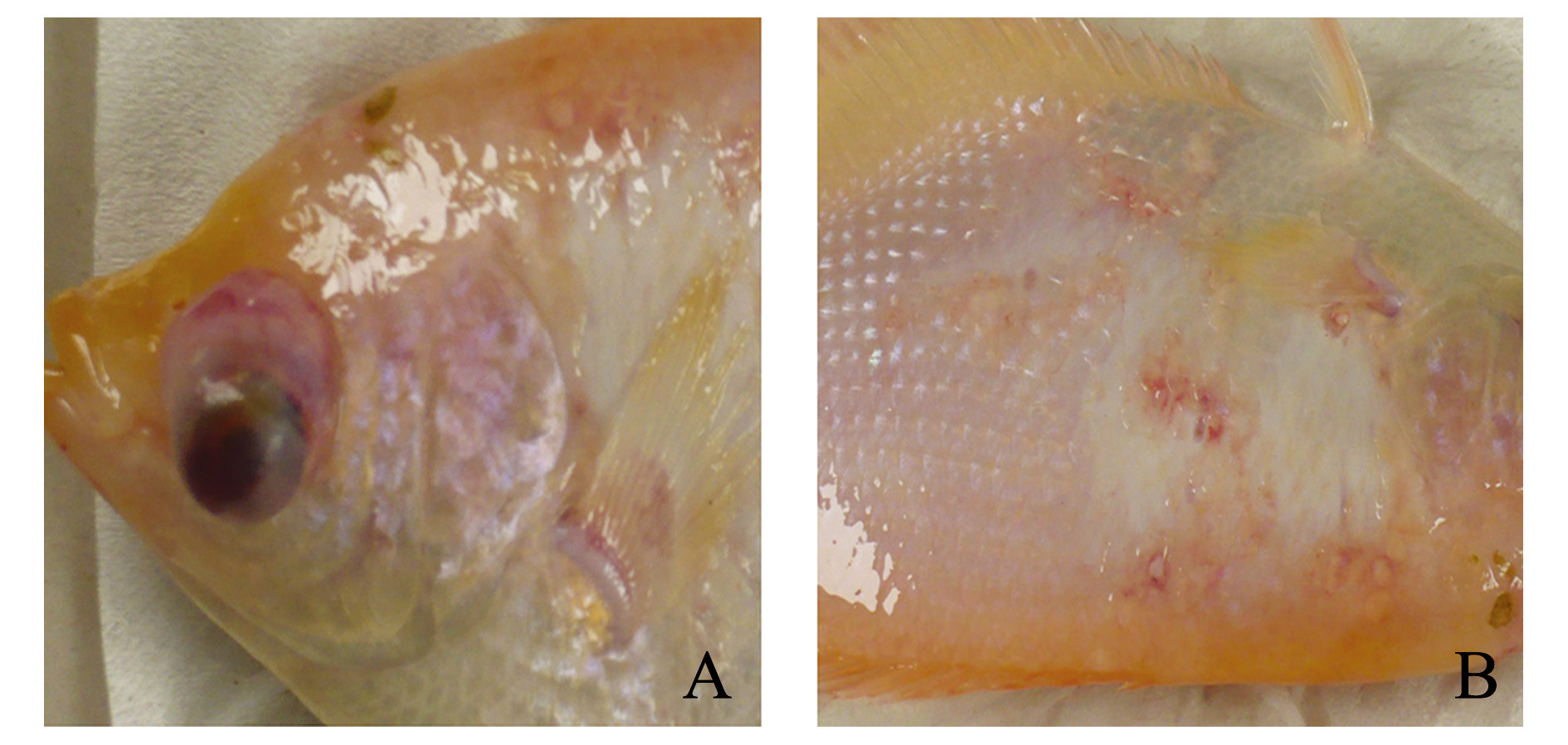
注: A 眼球突出; B 鱼体红斑
Note: A,exophthalmos;B,spiloplaxia
图1 患“突眼病”长丝鲈的临床症状
Fig.1 Clinical symptoms of giant gourami Osphronemas goramy
摘要:从患“突眼病”长丝鲈Osphronemasgoramy肾脏中分离到1株优势菌CSL1,分别以腹腔注射、划伤浸泡和直接浸泡3种方式进行人工回归感染试验。结果表明: CSL1菌株能感染长丝鲈,且毒力较强,腹腔注射0.2 mL菌液(菌浓度为1×108cfu/mL)可导致受试长丝鲈66.7%死亡,划伤浸泡感染(菌浓度为1×108cfu/mL)死亡率达100%,直接浸泡感染(菌浓度为1×108cfu/mL)无死亡,被感染长丝鲈出现与自然感染相同的症状;对菌株CSL1进行形态特征观察和主要理化特性分析,初步鉴定为豚鼠气单胞菌Aeromonascaviae;进一步选用16S rRNA对该菌进行分子鉴定,将序列结果进行Blast分析并构建进化树,结果显示,16S rRNA基因与GenBank上登录的豚鼠气单胞菌的相应序列具有很高的同源性,进化树聚为一支;综合生理生化与分子鉴定结果,判定所分离的菌株为豚鼠气单胞菌;药敏试验显示,该菌株对左氟沙星、诺氟沙星、恩诺沙星、氧氟沙星、庆大霉素、卡那霉素、妥布霉素、吡哌酸8种药物高度敏感,对阿齐霉素、新霉素和强力霉素3种药物中度敏感,对新生霉素、萘啶酸、氨卞青霉素、青霉素、阿莫西林、甲氧卞啶、链霉素、复方新诺明8种药物具有耐药性。研究表明,长丝鲈“突眼病”的病原菌为豚鼠气单胞菌,其药敏结果可为防治该病提供用药参考,庆大霉素是治疗由豚鼠气单胞菌引起的各种养殖鱼类相关疾病的普适药物。
关键词:长丝鲈;突眼病;豚鼠气单胞菌;药敏试验
长丝鲈Osphronemasgoramy又名丝足鲈,隶属于长丝鲈科Osphrone midae、长丝鲈鱼属Osphronemas,在中国俗称红招财、财神鱼、招财鱼,是热带淡水鱼类,兼具食用价值和观赏价值[1-4]。长丝鲈尾鳍、臀鳍和全身为金黄色,有金属光泽,在光照下能散发出金黄色的光芒。因其腹鳍有2条较硬的长丝延伸至尾鳍,故得名长丝鲈,在观赏鱼市场具有广阔的养殖前景。长丝鲈的规模化养殖产生了巨大的经济效益,但病害频发,严重制约着长丝鲈养殖业的可持续发展。
目前,关于长丝鲈的研究主要集中在育苗、养殖和增加其自身观赏性等方面,在病害控制方面的研究较少,仅见对长丝鲈红斑病[5]和结节病[6]的研究报道。在养殖生产中,长丝鲈“突眼病”是一种较为常见的疾病,该病的临床症状主要表现为两眼外凸,眼球周围红肿、发炎,犹如龙眼核,鱼体有点状红斑,偶尔会随伴全身性水肿,并且死亡率很高。目前对鱼类“突眼病”的研究还很少,仅见对金鱼[7]和罗非鱼[8]“突眼病”的研究报道。本研究中,对某观赏鱼养殖场长丝鲈“突眼病”的致病菌进行了研究,从自然发病的长丝鲈肾脏内分离出优势生长菌株,经人工回归感染试验,研究该菌株的致病力,通过对其主要理化特性、系统发育学等分析对该菌株进行鉴定,同时对病原菌进行药物敏感性试验,研究结果可为防治长丝鲈“突眼病”提供理论依据。
1.1材料
试验用患病长丝鲈于2013年取自天津市某观赏鱼养殖场。
仪器与试剂主要有:LB培养基、药敏纸片、梅里埃全自动细菌鉴定仪、生化培养箱、PCR仪、电泳仪和凝胶成像系统。
1.2方法
1.2.1 症状的观察 先观察鱼体的活力、游动能力、溜边等情况,再观察体表、头部、鳍部等有无溃烂、出血等,然后剪下鳃盖观察鳃丝情况,最后解剖,观察肝脏、肾脏和肠道等有无病变。
1.2.2 细菌的分离与培养 用体积分数为70%的酒精棉将皮肤表面消毒,解剖后,用无菌接种环取肝脏和肾脏,划线接种于LB培养基平板上,置于35 ℃恒温生化培养箱中培养24 h;挑取优势菌落,重新划线接种于LB培养基平板上,于35 ℃恒温生化培养箱中培养24 h。
1.2.3 生化鉴定 采用梅里埃全自动细菌鉴定仪与生化微量反应管相结合的方法对纯化的CSL1菌落进行生化鉴定。
1.2.4 16S rRNA基因序列的测定与系统进化树的构建 (1) PCR模板DNA的制备。将菌株CSL1于35 ℃液体培养基中培养24 h,按照细菌基因组DNA提取试剂盒(天根生化科技有限公司)的方法提取基因组DNA。
(2)序列分析及系统发育树的构建。利用细菌16S rRNA通用引物:正向引物F(5′ AGAGTTTGATCCTGGCTCAG 3′)和反向引物R(5′ GGTTACCTTGTTACGACTT 3′)扩增目的基因。引物由生工生物工程(上海)股份有限公司合成,以分离菌株CSL1的基因组DNA为模板,采用PCRmixed试剂盒(天根生化科技有限公司)进行PCR反应。反应程序:95 ℃下变性3 min;94 ℃下变性30 s,55 ℃下退火30 s,72 ℃下延伸2 min,共进行32个循环;最后在72 ℃下再延伸10 min,4 ℃下保存。取6 μL产物在含Goldview染色剂的15 g/L琼脂糖凝胶上进行电泳,电泳结束后将凝胶放入成像系统,观察结果。PCR扩增产物送生工生物工程(上海)股份有限公司进行序列测定。将菌株CSL1的16S rRNA 基因序列与GenBank中已知核酸序列进行比对,选取同源性比较高的序列,用ClusterX软件进行比对,使用Mega 4.0软件构建系统进化树。
1.2.5 药敏试验 药敏试验采用KB纸片法[9],将菌液浓度调至1×108cfu/mL,吸取菌液200 μL,在无菌条件下用涂布棒均匀涂于LB培养基平板上。取药敏纸片贴于LB琼脂培养基表面,置于35 ℃培养箱中培养24 h,记录各药敏纸片的抑菌圈直径。依据《现代诊断学手册》[10]中药敏试验抑菌圈直径的判定标准,判断致病菌对药物的敏感程度。
1.2.6 人工感染试验 采用注射、划伤浸泡和浸泡3种感染方式进行人工回归感染试验,每组6尾鱼,每种感染方式设1个对照组。注射感染组菌浓度为1×108cfu/mL,注射剂量为0.2 mL/尾;划伤浸泡感染组采用灭菌手术刀片划伤皮肤,在浓度为1×108cfu/mL的菌液中浸泡30 min;浸泡感染组直接在浓度为1×108cfu/mL的菌液里浸泡30 min。试验进行两周, 每天观察并记录鱼的发病和死亡情况[11],并进行细菌分离和鉴定,方法同“1.2.2”和“1.2.3”节。
2.1典型症状
发病长丝鲈临床症状主要表现为两眼外凸,眼球周围红肿、发炎,鱼体有红斑(图1),偶尔会随伴全身性的水肿。

注: A 眼球突出; B 鱼体红斑
Note: A,exophthalmos;B,spiloplaxia
图1 患“突眼病”长丝鲈的临床症状
Fig.1 Clinical symptoms of giant gourami Osphronemas goramy
2.2细菌形态特征
从患“突眼病”长丝鲈肾脏中分离到1株优势菌,命名为CSL1,该菌株在LB培养基上可见有圆形、隆起、光滑、湿润的菌落,直径约2 mm。
2.3细菌生化鉴定
对纯化的菌落采用梅里埃全自动生化鉴定仪鉴定,用普通微量生化管进行补充鉴定。其中生化项目葡萄糖产气、硫化氢、七叶苷和VP试验由微量生化管补充得出,其他生化项目由全自动细菌鉴定仪得出(表1)。根据该菌株的形态特征和主要理化特征,初步鉴定为豚鼠气单胞菌。
2.4药敏试验
在19种抗菌药物中,CSL1菌株对左氟沙星、诺氟沙星、恩诺沙星、氧氟沙星、庆大霉素、卡那霉素、妥布霉素、吡哌酸8种药物高度敏感,约占药物总数的42.1%;对阿齐霉素、新霉素和强力霉素3种药物中度敏感,约占药物总数的15.8%;对新生霉素、萘啶酸、氨卞青霉素、青霉素、阿莫西林、甲氧卞啶、链霉素、复方新诺明8种药物不敏感,约占药物总数的42.1%(表2)。
表1菌株CSL1的生化鉴定结果
Tab.1BiochemicalidentificationofstrainCSL1

生化项目testitem结果result生化项目testitem结果result生化项目testitem结果result柠檬酸盐利用+戊酸盐同化-辛二酸盐同化-衣康酸盐同化-4-羟基-苯甲酸盐同化-丝氨酸同化+组氨酸同化+3-羟基-苯甲酸盐同化-蔗糖+D-麦芽糖+D-蜜二糖-L-鼠李糖-D-甘露醇+2-酮基葡萄糖-脯氨酸+阿拉伯糖+肌醇-N-乙酰-葡萄糖胺+乙酸盐+糖原+丙二酸盐-3-羟基-丁酸盐-L-岩藻糖-D-核糖+丙酸盐同化-癸酸盐+ 葡萄糖产气-D-山梨醇-丙氨酸同化+硫化氢-水杨素+5-酮基葡糖酸盐-七叶苷+DL-乳酸盐同化+D-葡萄糖+VP试验-
注:+表示阳性;-表示阴性
Note: + denotes positivity; - denotes negativity
表2菌株CSL1的药物敏感试验结果
Tab.2AntibioticssensitivetestofstrainCSL1
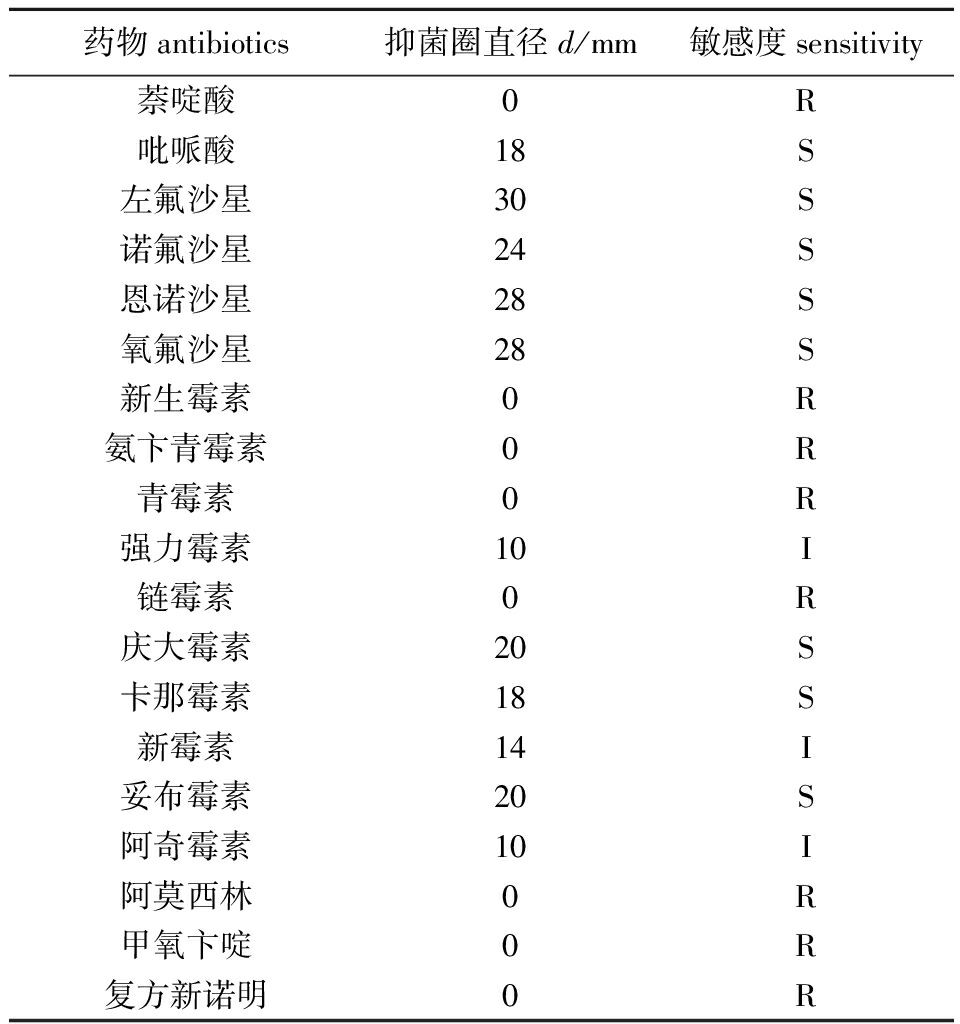
药物antibiotics抑菌圈直径d/mm敏感度sensitivity萘啶酸0R吡哌酸18S左氟沙星30S诺氟沙星24S恩诺沙星28S氧氟沙星28S新生霉素0R氨卞青霉素0R青霉素0R强力霉素10I链霉素0R庆大霉素20S卡那霉素18S新霉素14I妥布霉素20S阿奇霉素10I阿莫西林0R甲氧卞啶0R复方新诺明0R
注: S表示高度敏感(d>15 mm); I表示中度敏感(10 mm≤d≤15 mm); R表示低度敏感或不敏感(0 mm≤d<10 mm)
Note: S denotes high sensitivity (d>15 mm); I denotes moderate sensitivity (10 mm≤d≤15 mm); R denotes low or no sensitivity(0 mm≤d<10 mm)
2.5系统进化树
CSL1菌株的16S rRNA基因序列长度为1417 bp(图2),将菌株的16S rRNA基因序列在NCBI上通过Blast进行同源性比对,结果检索出为气单胞菌属的16S rRNA基因序列,选取同源性较高的序列采用邻接法构建菌株系统进化树(图3),CSL1在系统进化树上与豚鼠气单胞菌(登录号:KF835804、X60408、KJ650079)聚为一支。结合生理生化反应,确定从患“突眼病”的长丝鲈体内分离的菌株为豚鼠气单胞菌Aeromonascaviae。
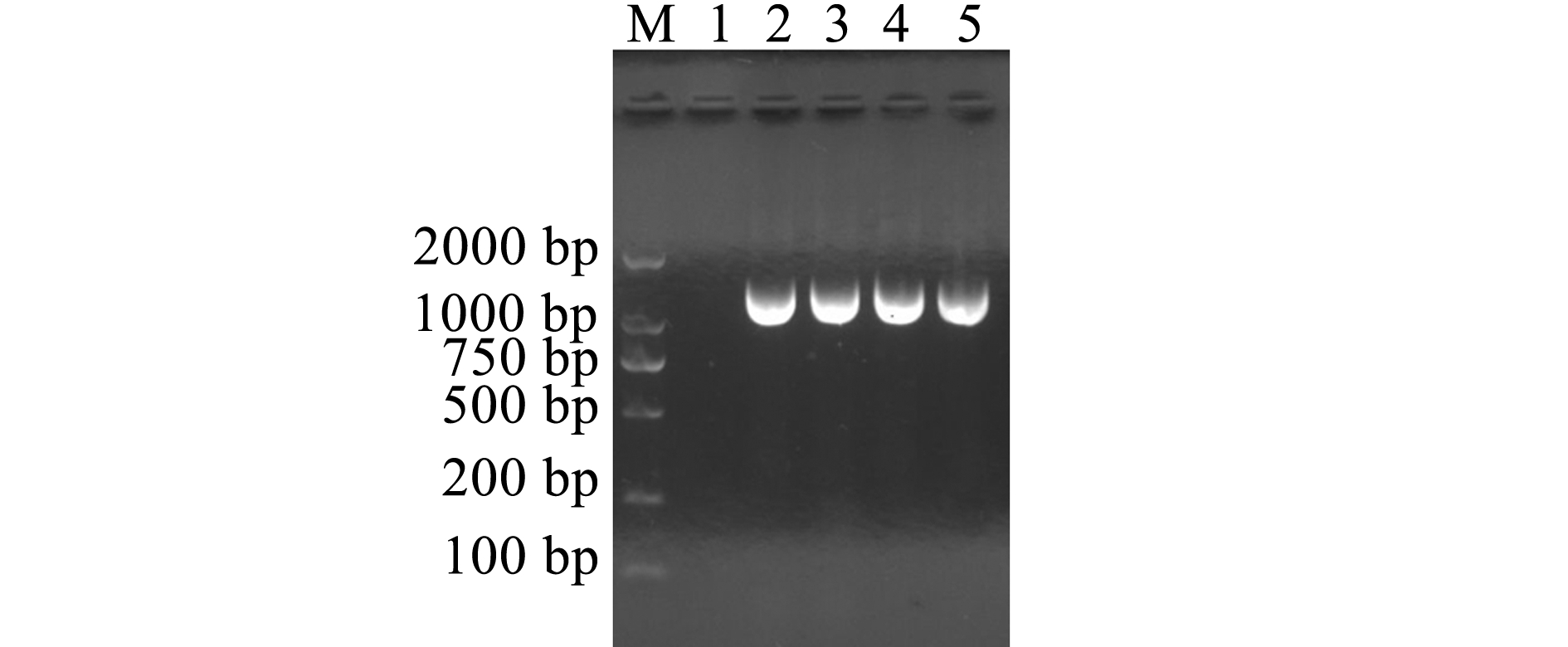
注:M为DNA标准;1 空白对照;2~5 CSL1 4个样品的16S rRNA 基因PCR扩增
Note: M,DNA Marker; 1,blank control;2-5, PCR amplification of 16S rRNA gene in strain CSL1 in four samples
图2 菌株CSL1 16S rRNA基因的PCR扩增
Fig.2 PCR amplification of 16S rRNA gene in strain CSL1
2.6人工感染试验结果
注射组,5 d后开始有个别鱼死亡并出现典型症状,14 d后死亡率为66.7%,而注射对照组鱼无死亡;划伤浸泡组同样出现典型症状,死亡率为100%,而划伤对照组死亡率为16.7%,没有出现与感染组相同的症状,可能与划伤比较严重有关;浸泡感染组和浸泡对照组鱼无死亡(表3)。
从具有典型症状的病鱼肾脏中分离出同样形态的菌株,经鉴定为豚鼠气单胞菌,证实豚鼠气单胞菌为引起长丝鲈“突眼病”的病原菌。
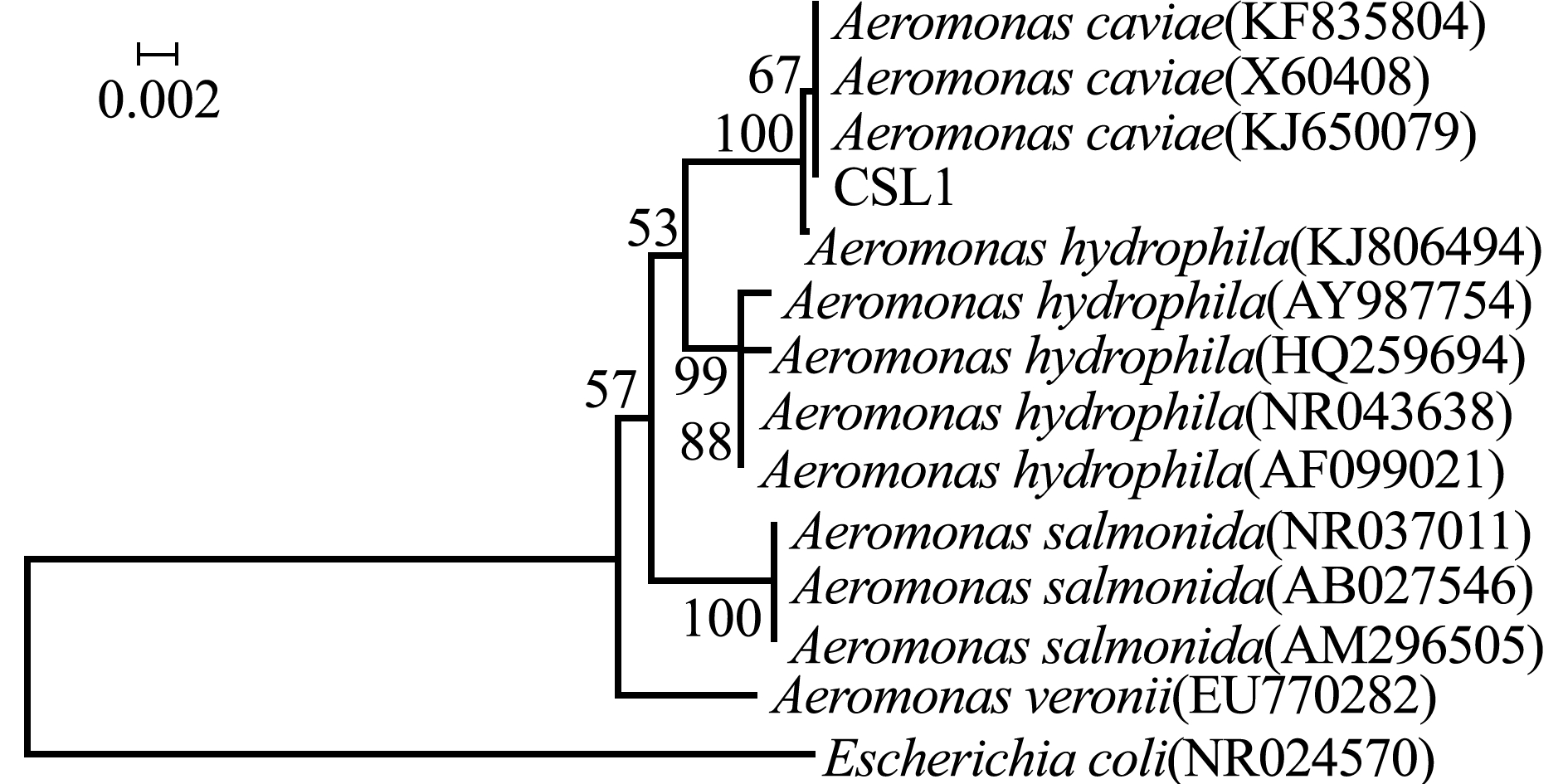
图3 CSL1 16S rRNA基因序列发育进化树
Fig.3 Phylogenetic tree based on 16S rRNA sequence of CSL1
表3人工感染试验结果
Tab.3ResultsofartificialinfectiontestinstrainCSL1
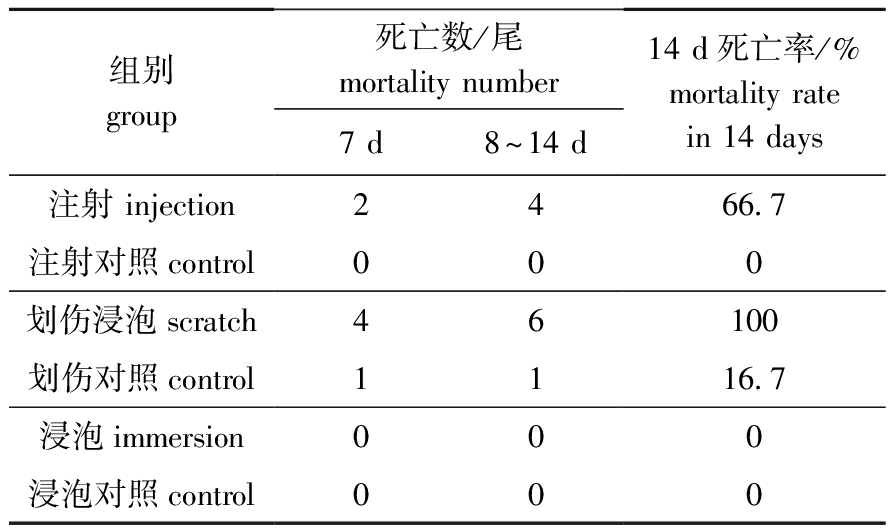
组别group死亡数/尾mortalitynumber7d8~14d14d死亡率/%mortalityratein14days注射injection2466 7注射对照control000划伤浸泡scratch46100划伤对照control1116 7浸泡immersion000浸泡对照control000
关于长丝鲈的疾病报道相对较少,仅有诺卡氏菌引起长丝鲈红斑病以及结节病的报道。引起鱼类“突眼病”的因素较多,如营养不良、氨氮过高,以及病毒、细菌的感染等。对于由细菌引起的鱼类“突眼病”的研究较少,仅见由鲁氏不动杆菌引起的金鱼“突眼病”和由假单胞菌属引起的红罗非鱼“突眼病”的报道,但与长丝鲈“突眼病”的病原菌不相同,由此可见,多种细菌感染均可以引起鱼类“突眼病”,不同的病原菌可以导致相同的症状出现,这也是鱼病诊断比较困难的原因之一。
豚鼠气单胞菌是一种条件性致病菌,宿主范围比较广,危害多种水产养殖动物。鱼类主要症状表现为败血症,樊海平等[12]报道了欧洲鳗鲡败血症,李小波等[13]报道了丰产鲫细菌性败血症,曹海鹏等[14]报道了西伯利亚鲟鱼细菌性败血症。此外,还能引起鲤竖鳞病[15]和出血病[16]、鲢鳙打印病[17]、虹鳟皮肤溃烂病[18]、南方鲇体表溃疡病[19]、观赏金鱼出血病[20]等。Jagoda等[21]从淡水观赏鱼体内分离到气单胞菌属,其中包括豚鼠气单胞菌。豚鼠气单胞菌也可引起其他水产动物的疾病,如虾[22-23]、甲鱼[24]、中华鳖[25]、中华绒螯蟹[26]等。豚鼠气单胞菌不仅可以感染水产动物,还可感染哺乳动物和人类,人感染豚鼠气单胞菌可患急性肠胃炎,引起腹泻[13]。
药物敏感试验结果显示,在常用的19种抗菌药物中,豚鼠气单胞菌对8种药物敏感性高,所以使用左氟沙星、诺氟沙星、恩诺沙星、氧氟沙星、庆大霉素、卡那霉素、妥布霉素、吡哌酸效果较好,是治疗因豚鼠气单胞菌引起的长丝鲈“突眼病”的有效药物。从金鱼体内分离到的豚鼠气单胞菌对四环素、庆大霉素、氯霉素等高度敏感[20],从欧洲鳗鲡体内分离到的豚鼠气单胞菌对庆大霉素、氟哌酸等高度敏感[12],从虹鳟体内分离的豚鼠气单胞菌对氯霉素、环丙沙星、庆大霉素、复方新诺明等药物高度敏感[18]。不同鱼体内分离到的豚鼠气单胞菌对药物的敏感性也不尽相同,可能与豚鼠气单胞菌的宿主、地理分布和试验中选择的药物种类等有关,但大部分豚鼠气单胞菌菌株对庆大霉素都高度敏感,因此,庆大霉素是治疗由豚鼠气单胞菌引起的各种养殖鱼类相关疾病的普适药物。但养殖生产中用药需要进一步考虑用药浓度、用药方式和环境污染等问题。
人工感染试验结果显示,划伤浸泡感染组的死亡率最高,注射感染组死亡率略低于划伤浸泡组,直接浸泡感染组无感染现象发生。健康长丝鲈体表无破损,浸泡时间相对短,较难引发感染。本研究中分析了长丝鲈“突眼病”的症状,并经过细菌分离、生化鉴定、16S rRNA分子鉴定和人工感染试验,确认豚鼠气单胞菌为引起长丝鲈“突眼病”的病原菌,并对该病原菌进行了药敏试验。此研究填补了长丝鲈“突眼病”研究的空白,为防治长丝鲈“突眼病”提供了参考。
参考文献:
[1] 魏于生,齐彩霞,魏志宇,等.长丝鲈的生物学及其人工繁殖[J].淡水渔业,2002, 32(2):21-23.
[2] 白东清,魏东,马树敏,等.长丝鲈血液部分生理生化指标测定[J].安徽农业科学,2010,38(2):755-757.
[3] 陈永乐,朱新平,刘毅辉.丝足鲈的形态特征与核型[J].水产学报,2002,26(4):375-378.
[4] 孙砚胜,孙向军,史东杰,等.红招财工厂化养殖的技术及效益分析[J].水产科技情报,2010,37(1):50-52.
[5] 林伟,彭新亮,杨治国.招财鱼红斑病病原——诺卡氏菌的分离与鉴定[J].信阳农业高等专科学校学报,2012,22(2):99-101.
[6] 徐晓丽,李贺密,邵蓬,等.丝足鲈致病性诺卡氏菌的鉴定及系统发育分析[J].水产科学,2013,32(11):657-661.
[7] 邹文政,纪荣兴,莫英军.金鱼“突眼病”病原的初步研究[J].集美大学学报:自然科学版,2003,8(1):12-15.
[8] 纪荣兴,黄少涛,邹文政,等.红罗非鱼“突眼病”病原的初步研究[J].集美大学学报:自然科学版,2000,5(2):29-33.
[9] 徐叔云,卞如濂,陈修.药理实验方法学[M].北京:人民卫生出版社,2002:1651-1654.
[10] 王淑娟.现代诊断学手册[M].北京:北京医科大学、中国协和医科大学联合出版社,1995:511-522.
[11] 徐祥, 李华,叶仕根,等.杂交鲟嗜水气单胞菌病的组织病理学研究[J].大连海洋大学学报,2014,29(3):227-231.
[12] 樊海平,曾占壮,余培建,等.由豚鼠气单胞菌引起的欧洲鳗鲡败血症[J].水产学报,1999,23(3):313-318.
[13] 李小波,黄文芳.丰产鲫细菌性败血病的研究:Ⅰ.病原分离与鉴定[J].微生物学通报,2003,30(5):56-60.
[14] 曹海鹏,杨先乐,王玉洁,等.鲟源致病性豚鼠气单胞菌的分离及其生长特性[J].动物学杂志,2007,42(6):1-6.
[15] 安利国,傅荣恕,邢维贤,等.鲤竖鳞病病原及其疫苗的研究[J].水产学报,1998,22(2):136-142.
[16] 韩英,刘敏,姜艳平.鲤鱼出血病病原的研究和药敏试验[J].东北农业大学学报,2005,36(5):593-597.
[17] 陈翠珍,张晓君,房海,等.鲢鳙打印病豚鼠气单胞菌主要特性及系统发育学分析[J].中国农学通报,2006,22(5):455-459.
[18] 丁雷,岳永生,宋憬愚.虹鳟皮肤溃烂病的病原菌研究[J].淡水渔业,2002,32(3):28-30.
[19] 汪开毓,肖丹,贺扬,等.南方鲇(Silurusmeridionalis)豚鼠气单胞菌溶血素的分离、纯化与致病性研究[J].海洋与湖沼,2012,43(6):1122-1127.
[20] 许信刚,伊岚,王高学.观赏金鱼豚鼠气单胞菌的分离鉴定及防治[J].西北农业学报,2006,15(1):40-42.
[21] Jagoda S S,Wijewardana T G,Arulkanthan A,et al.Characterization and antimicrobial susceptibility of motile aeromonads isolated from freshwater ornamental fish showing signs of septicaemia[J].Dis Aquat Organ,2014,109(2):127-137.
[22] 樊海平,孟庆显,俞开康.中国对虾败血病病原菌(气单胞菌)的致病性与生物学性状[J].水产学报,1994,18(1):32-38.
[23] Saejung C,Hatai K,Sanoamuang L.The in-vitro antibacterial effects of organic salts,chemical disinfectants and antibiotics against pathogens of black disease in fairy shrimp of Thailand[J].J Fish Dis,2014,37(1):33-41.
[24] 余旭平,马有智.甲鱼病原性豚鼠气单胞菌的分离鉴定[J].中国兽医学报,1997,17(5):460-462.
[25] 孙红祥,舒妙安.中华鳖溶血性腹水病病原菌的分离鉴定及药敏性研究[J].浙江大学学报:农业与生命科学版,2000,26(2):177-180.
[26] 徐海圣,黄立峰,王淑霞.中华绒螯蟹豚鼠气单胞菌的分离和鉴定[J].浙江大学学报:农业与生命科学版,2001,27(6):677-681.
Abstract:A dominant bacterium CSL1 was isolated from kidney of giant gouramiOsphronemasgoramywith exophthalmic disease, and artificial infection, morphological and physiological, and chemical experiments were carried out by intraperitoneal injection and immersion. The intraperitoneal injection of the bacterium(0.2 mL of bacterium,1×108cfu/mL) showed 66.7% mortality in the tested giant gourami, immersion of the injured fish with the bacterium(1×108cfu/mL) led to 100% mortality, and 0 mortality, and the same symptoms as the naturally infected giant gourami were found in the immersion of the fish with the bacterium(1×108cfu/mL). The bacterial morphology, physiology and biochemistry assays revealed that the isolated bacterium was preliminarily determined to beAeromonascaviae. The 16S rRNA gene was cloned, sequenced and analyzed in the bacterium by a molecular method. Blast and phylogenetic tree showed that 16S rRNA gene shared high similarity with its counterpart ofA.caviaefound in GenBank, indicating that the bacterium isolated was a strain ofA.caviae. The drug sensitivity test showed that the isolated bacterium was highly sensitive to eight kinds of antibiotics including levofloxacin, norfloxacin, enrofloxacin, ofloxacin, gentamycin, namycin, tobramycin, and pipemidic acid, intermediate sensitive to azithromycin,neomycina, and doxycycline, and resistant to eight kinds of antibiotics including novobiocin, nalidixin, ampicillin, penicillin, amoxicillin, trimethoprim, streptomycin,and sulfamethoxazole. The findings indicated that the pathogenic bacterium of exophthalmic disease in giant gourami wasA.caviae, and provided reference to preventing and curing the disease, gentamicin being a reference drug for treating the cultured fish related diseases caused byA.caviae.
Key words:Osphronemasgoramy; exophthalmic disease;Aeromonascaviae; drug sensitivity test
DOI:10.3969/J.ISSN.2095-1388.2014.06.015
文章编号:2095-1388(2014)06-0624-05
收稿日期:2014-08-26
基金项目:国家“星火计划”项目(2011GA610002);天津市科技计划项目(12ZCZDNC01100,14ZXNZNC00046);天津市应用基础及前沿技术研究计划项目(11JCYBJC08800)
中图分类号:S943
文献标志码::A