复方磺胺甲噁唑在松浦镜鲤体内的药动学及残留消除规律
韩冰1、2,杨洪波1、2,王荻1,卢彤岩1
(1.中国水产科学研究院 黑龙江水产研究所,黑龙江 哈尔滨 150070;2.上海海洋大学 水产与生命学院,上海 201306)
摘要:采用高效液相色谱法,研究了以50 mg/kg(体质量)的剂量在口灌给药条件下,复方磺胺甲噁唑(甲氧苄啶∶磺胺甲噁唑=1∶5)在松浦镜鲤CyprinuscarpioSongpu体内的药动学与残留消除规律。结果表明:单次给药后,甲氧苄啶在血浆和肌肉中的药时关系符合一级吸收一室开放模型,在肝胰脏和肾中的药时关系符合一级吸收二室开放模型,磺胺甲噁唑在血浆、肌肉、肝胰脏和肾中的药时关系符合一级吸收二室开放模型;每天一次连续5 d给药后,甲氧苄啶于第15天开始低于0.05 mg/kg,磺胺甲噁唑于第9天开始低于0.10 mg/kg。研究表明,在本试验条件下,建议休药期不低于15 d。
关键词:松浦镜鲤;复方磺胺甲噁唑;药动学;药物残留
松浦镜鲤CyprinuscarpioSongpu是中国水产科学研究院黑龙江水产研究所在德国镜鲤选育系F4代基础上,采用混合选择方法选育3代后培育出的新品种,具有体型好、背部高而厚、生长快、抗寒力强、繁殖力高、体表基本无鳞等特点,是中国当今淡水名优品种重点开发对象之一。
复方磺胺甲噁唑(Sulfonamides,SAs)又名复方新诺明,是磺胺类药物磺胺甲噁唑(Sulfamethoxazole,SMZ)与磺胺增效剂甲氧苄啶(Trimethoprim,TMP)按5∶1的比例混合组成的制剂。因其具有抗菌谱广、抗菌活性大、性质稳定、吸收迅速、价格低廉等优点,对水产动物的疖疮病、细菌性烂鳃病、竖鳞病、打印病、细菌性败血症等治疗效果良好,被广泛应用于水产养殖生产中。目前,关于复方磺胺甲噁唑在水产动物中的药动学研究不多[1-6],并且细菌菌株对磺胺类药物容易产生耐药性已经得到广泛认同[7-8]。摄食含磺胺类药物残留的食物后会在人体内蓄积,当药物蓄积到一定浓度时会对人体机能产生损害,可产生过敏、尿结晶、造血紊乱和致癌等毒性反应[9-10]。因此,磺胺类药物在动物源性食品中的残留越来越受到重视。中国农业行业标准NY 5070—2002《无公害食品水产品中渔药残留限量》规定,水产品中甲氧苄啶残留的最高限量为50 μg/kg,磺胺类药物残留的总量不得超过100 μg/kg。本研究中,对复方磺胺甲噁唑在松浦镜鲤体内的药动学以及残留消除规律进行研究,旨在了解用药效果与用药安全之间的关系,科学地指导松浦镜鲤养殖中复方磺胺甲噁唑的合理使用。
1材料与方法
1.1材料
试验用松浦镜鲤体质量为(89.57±13.91)g,由黑龙江水产研究所呼兰试验基地提供。试验在自动循环水鱼缸中进行,试验期间持续充气,水温保持在(20±0.5)℃。试验鱼暂养7 d,期间投喂全价基础饲料。
试验药品有:甲氧苄啶标准品,含量为99.5%(德国Dr.Ehrenstorfer,批号10121);磺胺甲噁唑标准品(德国Dr.Ehrenstorfer,批号10405)含量为99.5%;复方磺胺甲噁唑粉(北京鑫洋水产高新技术有限公司,批号20120506)100 g中含8.33 g SMZ和1.67 g TMP;二氯甲烷(A.R)、乙腈(HPLC)、冰乙酸(HPLC)、正己烷(HPLC)等均为市售分析纯。
试验仪器主要有戴安U-3000高效液相色谱仪(ThermoFisher公司)、3K15离心机(Sigma公司)、FJ 200-S调速混匀器(上海标准模型厂)、T-214电子天平(赛多利斯仪器系统有限公司)、MD200-2氮吹仪(杭州奥盛仪器有限公司)。
1.2方法
1.2.1 给药方法与样品的采集
(1)药动学试验。以有效成分50 mg/kg(体质量)的剂量单次对松浦镜鲤口灌复方磺胺甲噁唑粉混悬液(30%乙醇配制),于停药后第0.25、0.50、0.75、1.0、1.5、2、4、6、8、12、24、36、48、72 h随机选取6尾试验鱼,采集血(经3‰肝素钠抗凝后离心吸取血浆)、肝胰脏、肾、肌肉组织样品,编号后保存于冰箱(-20 ℃)中备用。
(2)残留量试验。以有效成分50 mg/kg(体质量)的剂量,每天一次,连续5 d对松浦镜鲤口灌复方磺胺甲噁唑粉混悬液(用30%乙醇配制),于停药后第1天至第15天每天随机选取6尾试验鱼,采集血(经3‰肝素钠抗凝后离心吸取血浆)、皮、肌肉等可食用组织,编号后保存于冰箱(-20 ℃)中备用。
1.2.2 标准储备液的配制 准确称取甲氧苄啶和磺胺甲噁唑标准品各0.004 g,分别溶于20 mL流动相中,各自配制成200 μg/mL的标准储备液,于4 ℃下避光保存。使用时用流动相稀释成所需浓度的标准溶液。
1.2.3 样品的前处理
(1)血浆样品。从冰箱(-20 ℃)中取出血浆样品,于室温下自然解冻后摇匀,精确吸取200 μL于2 mL离心管中,然后加入1 mL甲醇,震荡2 min,以10 000 r/min离心5 min,吸取上清液于10 mL离心管中。剩余残渣再加入1 mL甲醇重复提取,震荡2 min,以10 000 r/min离心5 min,合并上清液于上述离心管中,重复此步骤一次。将含有3次提取液的10 mL离心管于40 ℃下用氮气吹干,残渣用1 mL流动相溶解,加入1 mL正己烷除脂,震荡2 min,以8000 r/min离心3 min,下层液过0.22 μm有机相滤头后待测。
(2)肝胰脏、肾、皮、肌肉组织样品。准确称取1 g组织放入50 mL离心管中,加入4 mL二氯甲烷,以15 000 r/min匀浆30 s,再用3 mL二氯甲烷清洗刀头30 s,合并提取液于上述离心管中,震荡2 min,以8000 r/min离心5 min,吸取全部上清液于15 mL离心管中。剩余残渣加入4 mL二氯甲烷重复提取,震荡2 min,以8000 r/min离心5 min,合并上清液于上述15 mL离心管中,重复此步骤一次。将含有3次提取液的15 mL离心管于40 ℃下用氮气吹干,残渣用1 mL流动相溶解,加入1 mL正己烷除脂,震荡2 min,以5000 r/min离心3 min,下层液过0.22 μm有机相滤头后待测。
1.2.4 色谱条件 色谱柱为Waters Spherisorb ODS2-C18柱(4.6 mm×250 mm,5 μm),柱温为30 ℃;流动相为乙腈∶1%乙酸溶液∶0.4%乙酸铵溶液=20∶40∶40(体积比),流速为1.0 mL/min;进样量为20 μL,紫外检测波长为270 nm。
1.2.5 标准曲线的绘制 准确移取甲氧苄啶标准储备液,依次稀释成100、50、10、5、1、0.5、0.1、0.05 μg/mL的标准工作液;准确移取磺胺甲噁唑标准储备液,依次稀释成100、50、10、5、1、0.5、0.1、0.05 μg/mL的标准工作液。过0.22 μm有机相滤头后通过HPLC-UV进行测定。以峰面积为纵坐标,质量浓度为横坐标绘制标准曲线,分别求出回归方程和相关系数。
1.2.6 回收率和精密度的测定 每种组织(血浆、皮、肝胰脏、肾、肌肉)的回收率试验均设置3个浓度组,每个浓度组组织中药物的添加水平分别为Ⅰ(1 mg/kg或mg/L TMP+5 mg/kg或mg/L SMZ)、Ⅱ(2 mg/kg或mg/L TMP+10 mg/kg或mg/L SMZ)、Ⅲ(10 mg/kg或mg/L TMP+50 mg/kg或mg/L SMZ)。取1 g空白组织,各组添加标准液的总体积均为1 mL,每种浓度设置3个重复,静置一段时间后,按照样品前处理的方法处理后进行测定。
各试验组在同一天内分别测定3次,在一周内不同天测定3次,计算不同浓度下样品的相对标准偏差,计算日内和日间精密度。
1.3数据处理
标准曲线、药-时曲线和消除曲线采用Microsoft Excel软件绘制;药动学模型拟合及参数计算使用3P97软件处理。
2结果
2.1标准曲线与最低检测限
应用本试验建立的检测方法,TMP和SMZ的最低检测限均为0.01 mg/L。以标准溶液质量浓度为横坐标x,以峰面积为纵坐标y,绘制标准曲线。结果表明:TMP和SMZ在0.05~100 mg/L范围内线性关系良好,经计算其相关指数(R2)均为0.9999,线性回归方程分别为y=0.4218x-0.0069和y=1.0512x-0.0811。
2.2回收率与精密度
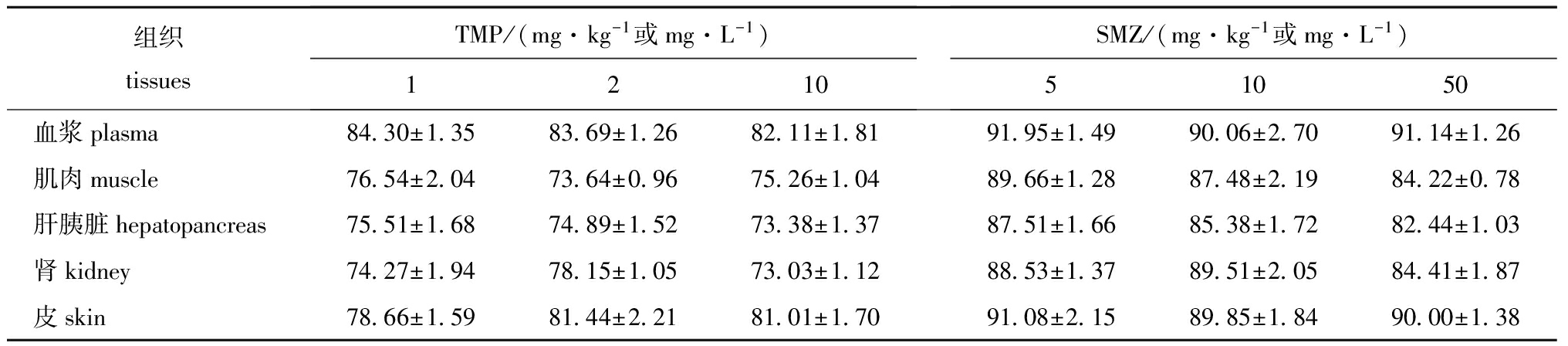
本试验条件下,在Ⅰ、Ⅱ、Ⅲ 3个质量浓度添加水平下,TMP和SMZ在各组织中的平均回收率分别为73%~84%、82%~92%(表1)。测得的日内精密度为2.27%±0.69%,日间精密度为4.02%±0.77%。
2.3药时曲线与主要药动学参数
TMP在鲤血浆、肌肉中的药时关系符合一级吸收一室开放模型,其代谢方程分别为
C血=1.656(e-0.083t-e-1.318t),
C肌=6.560(e-0.079t-e-0.297t)。
TMP在肝胰脏、肾中的药时关系符合一级吸收二室开放模型,其代谢方程分别为
C肝=45.674e-0.418t+5.850e-0.061t-51.524e-1.052t,
C肾=20.673e-0.076t+0.352e-0.001t-21.025e-0.751t。
SMZ在鲤血浆、肌肉、肝胰脏和肾中的药时关系均符合一级吸收二室开放模型,其方程分别为
C血=395.318e-0.520t+4.618e-0.014t-
399.936e-0.605t,
C肌=73.281e-0.320t+4.298e-0.016t-
77.579e-0.532t,
C肝=98.828e-0.474t+0.229e-0.019t-
99.057e-1.197t,
C肾=21.215e-0.387t+0.215e-0.033t-
21.430e-1.540t。
各采样时间点,不同组织中TMP及SMZ含量的变化如图1所示。
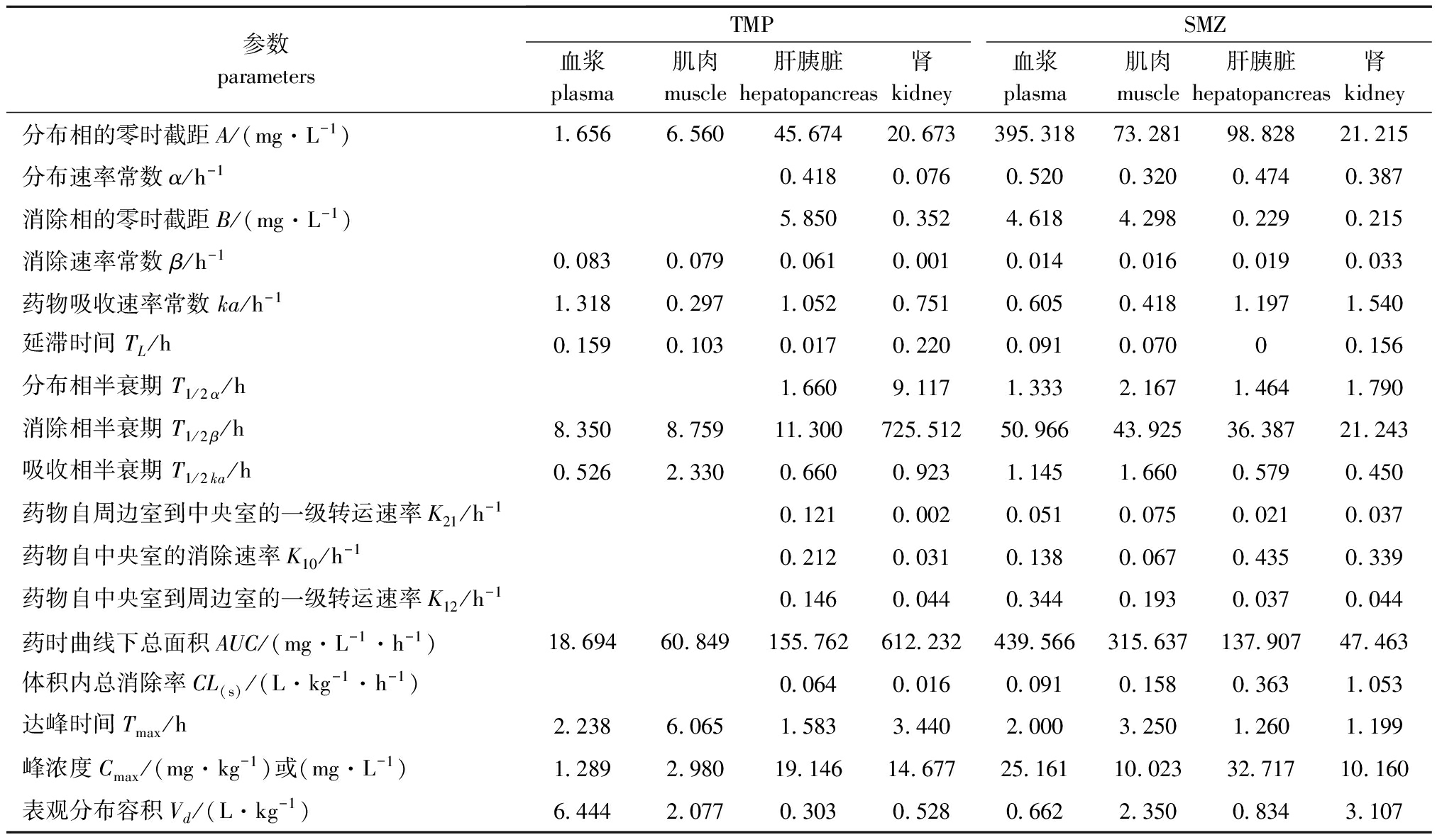
TMP和SMZ在松浦镜鲤体内主要药代动力学参数如表2所示。
表1TMP和SMZ在不同组织中的平均回收率
Tab.1Recoveryoftrimethoprim(TMP)andsulfamethoxazole(SMZ)indifferenttissues%
组织tissuesTMP/(mg·kg-1或mg·L-1)1210SMZ/(mg·kg-1或mg·L-1)51050血浆plasma84 30±1 3583 69±1 2682 11±1 8191 95±1 4990 06±2 7091 14±1 26肌肉muscle76 54±2 0473 64±0 9675 26±1 0489 66±1 2887 48±2 1984 22±0 78肝胰脏hepatopancreas75 51±1 6874 89±1 5273 38±1 3787 51±1 6685 38±1 7282 44±1 03肾kidney74 27±1 9478 15±1 0573 03±1 1288 53±1 3789 51±2 0584 41±1 87皮skin78 66±1 5981 44±2 2181 01±1 7091 08±2 1589 85±1 8490 00±1 38
2.4残留消除规律
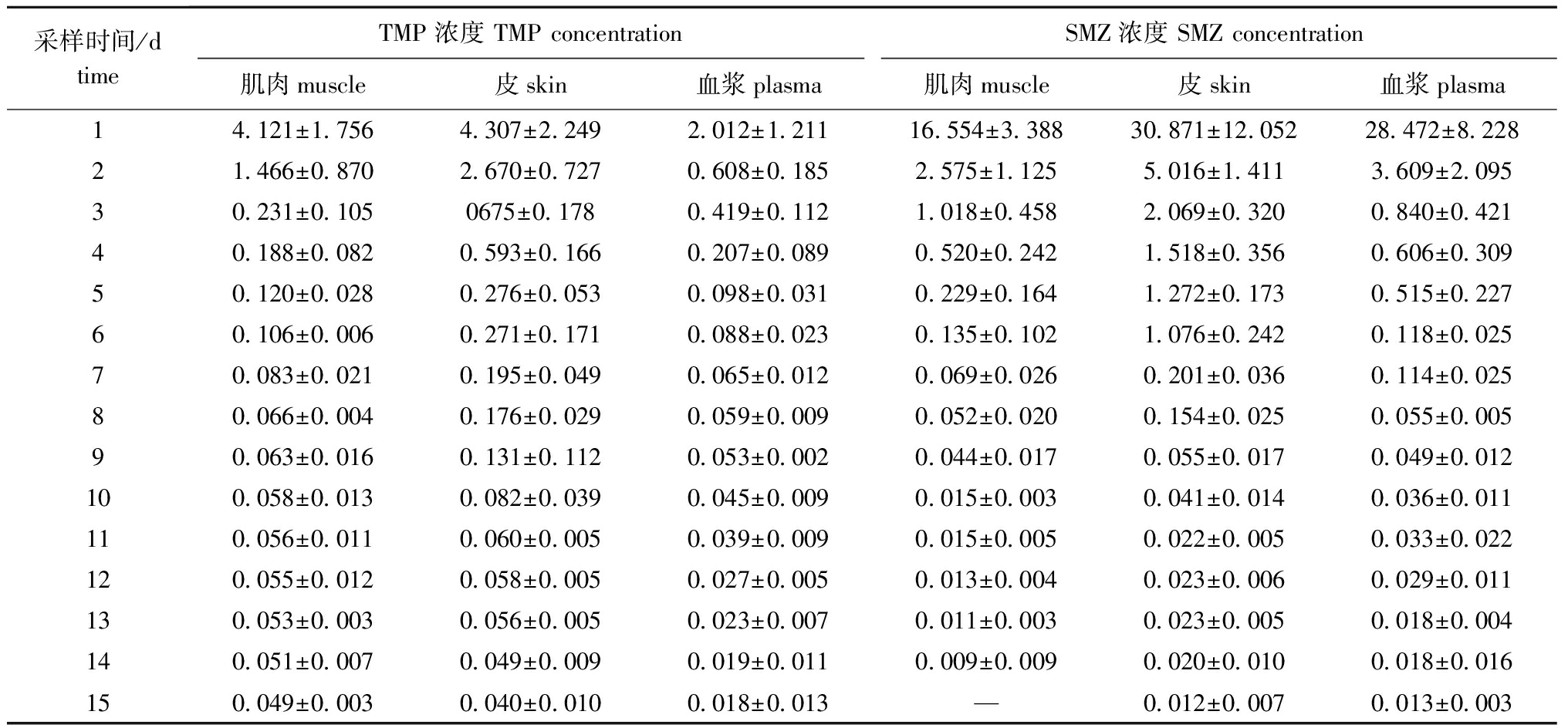
各采样时间点,TMP和SMZ在不同组织中的质量浓度见表3。由表3可以看出,在停止给药24 h后,SMZ在松浦镜鲤体内的残留量仍然维持在较高的水平,并且高于TMP在相应各组织中的残留量。随着停药时间的延长,SMZ在松浦镜鲤体内的消除要快于TMP,并于停药后第8天开始在各组织中的残留量低于TMP,于第9天开始低于0.10 mg/kg。而TMP在肌肉和皮中的残留量降到0.06 mg/kg后,消除开始极其缓慢。最终,TMP在各组织中的残留量于停药后第15天开始低于0.05 mg/kg。
表2TMP和SMZ在松浦镜鲤体内主要药代动力学参数
Tab.2PharmacokineticparametersofTMPandSMZinSongpumirrorcarpCyprinuscarpioSongpuafteroraladministration
参数parametersTMPSMZ血浆plasma肌肉muscle肝胰脏hepatopancreas肾kidney血浆plasma肌肉muscle肝胰脏hepatopancreas肾kidney分布相的零时截距A/(mg·L-1)1 6566 56045 67420 673395 31873 28198 82821 215分布速率常数α/h-10 4180 0760 5200 3200 4740 387消除相的零时截距B/(mg·L-1)5 8500 3524 6184 2980 2290 215消除速率常数β/h-10 0830 0790 0610 0010 0140 0160 0190 033药物吸收速率常数ka/h-11 3180 2971 0520 7510 6050 4181 1971 540延滞时间TL/h0 1590 1030 0170 2200 0910 07000 156分布相半衰期T1/2α/h1 6609 1171 3332 1671 4641 790消除相半衰期T1/2β/h8 3508 75911 300725 51250 96643 92536 38721 243吸收相半衰期T1/2ka/h0 5262 3300 6600 9231 1451 6600 5790 450药物自周边室到中央室的一级转运速率K21/h-10 1210 0020 0510 0750 0210 037药物自中央室的消除速率K10/h-10 2120 0310 1380 0670 4350 339药物自中央室到周边室的一级转运速率K12/h-10 1460 0440 3440 1930 0370 044药时曲线下总面积AUC/(mg·L-1·h-1)18 69460 849155 762612 232439 566315 637137 90747 463体积内总消除率CL(s)/(L·kg-1·h-1)0 0640 0160 0910 1580 3631 053达峰时间Tmax/h2 2386 0651 5833 4402 0003 2501 2601 199峰浓度Cmax/(mg·kg-1)或(mg·L-1)1 2892 98019 14614 67725 16110 02332 71710 160表观分布容积Vd/(L·kg-1)6 4442 0770 3030 5280 6622 3500 8343 107
表3TMP和SMZ在松浦镜鲤3种组织中的残留浓度
Tab.3ResidualconcentrationsofTMPandSMZinthreetissuesofSongpumirrorcarpCyprinuscarpioSongpu
mg/kg or mg/L
采样时间/dtimeTMP浓度TMPconcentrationSMZ浓度SMZconcentration肌肉muscle皮skin血浆plasma肌肉muscle皮skin血浆plasma14 121±1 7564 307±2 2492 012±1 21116 554±3 38830 871±12 05228 472±8 22821 466±0 8702 670±0 7270 608±0 1852 575±1 1255 016±1 4113 609±2 09530 231±0 1050675±0 1780 419±0 1121 018±0 4582 069±0 3200 840±0 42140 188±0 0820 593±0 1660 207±0 0890 520±0 2421 518±0 3560 606±0 30950 120±0 0280 276±0 0530 098±0 0310 229±0 1641 272±0 1730 515±0 22760 106±0 0060 271±0 1710 088±0 0230 135±0 1021 076±0 2420 118±0 02570 083±0 0210 195±0 0490 065±0 0120 069±0 0260 201±0 0360 114±0 02580 066±0 0040 176±0 0290 059±0 0090 052±0 0200 154±0 0250 055±0 00590 063±0 0160 131±0 1120 053±0 0020 044±0 0170 055±0 0170 049±0 012100 058±0 0130 082±0 0390 045±0 0090 015±0 0030 041±0 0140 036±0 011110 056±0 0110 060±0 0050 039±0 0090 015±0 0050 022±0 0050 033±0 022120 055±0 0120 058±0 0050 027±0 0050 013±0 0040 023±0 0060 029±0 011130 053±0 0030 056±0 0050 023±0 0070 011±0 0030 023±0 0050 018±0 004140 051±0 0070 049±0 0090 019±0 0110 009±0 0090 020±0 0100 018±0 016150 049±0 0030 040±0 0100 018±0 013—0 012±0 0070 013±0 003
3讨论
3.1复方磺胺甲噁唑在松浦镜鲤体内的药动学特征
本试验中,TMP在血浆、肌肉中的药物浓度与时间的关系符合一级吸收一室开放模型,这与艾晓辉等[6]报道TMP在草鱼血浆中的药动学模型为二室模型不同。SMZ在血浆、肌肉、肝胰脏、肾中的药物浓度与时间的关系均符合一级吸收二室开放模型,这与王群等[11]报道的SMZ在鲈血液中、曲志娜等[5]报道的SMZ在大菱鲆肌肉中、袁科平等[12]报道的SMZ在罗非鱼血浆和肌肉中的药动模型为一室模型不同,而与艾晓辉等[6]报道的SMZ在草鱼血浆和肌肉中、曲志娜等[5]报道的SMZ在大菱鲆血液中、范克俭[13]报道的SMZ在中国明对虾血液中的药动模型为二室模型相同。这些模型的差异,一方面与试验对象的种属差异有关,另一方面也可能与试验条件有关,包括给药剂量、水温、采样时间等。
由本试验结果可以看出,给药后0.25 h时,鲤肝胰脏中TMP和SMZ的含量均明显超过其他组织,说明两种药物进入松浦镜鲤体内后,具有明显的“首过效应”。而初始几个采样时间点SMZ在血浆中的含量也明显高于肌肉和肾脏组织中,且0.25 h时组织中的药物含量略高于0.5 h和0.75 h,据此推测,SMZ从肠道被吸收进入肝胰脏后,有一部分药物直接经肝胰脏进入血液循环,因此,血浆中的药物来源出现了肠道吸收和肝胰脏释放的叠加,从而造成血浆中SMZ含量明显偏高的情况。从药-时曲线可以看出,SMZ出现了明显的双峰现象。出现双峰乃至多峰现象的机制被认为可能是肠-肝循环和胃肠道的多部位吸收[14],而肠-肝循环又被认为是产生双峰或者多峰现象最有可能的一种机制,如果存在肠-肝循环,则第二峰的浓度要低于第一峰[15-16]。本试验中,松浦镜鲤4种组织中SMZ在给药后24 h出现的第二峰值均小于第一峰值,这一现象与肠-肝循环引起的药-时曲线双峰的情况完全相符。
Tmax、T1/2ka、ka是反映药物吸收速率的重要指标,β和T1/2β则是反映药物消除速率的重要指标。本试验中,松浦镜鲤口服复方磺胺甲噁唑后,对比TMP在4种组织中的ka、T1/2ka、Tmax值,发现TMP在肌肉中的吸收速率明显低于其他3种组织,并且达峰浓度Cmax也明显低于肝胰脏、肾组织;同时,TMP在肌肉中的β值大于肝胰脏、肾组织,T1/2β值明显小于肝胰脏和肾,由此发现,TMP在肌肉中的消除速率也较肝胰脏、肾迅速。同样,通过对比以上各参数,发现SMZ在松浦镜鲤肌肉中,相对于肝胰脏和肾表现为吸收慢、消除慢的特征。艾晓辉等[17]对SMZ在草鱼体内的研究以及曲志娜等[5]对SMZ在大菱鲆体内的研究都发现,SMZ在肌肉中的药动学行为有类似的特点。
3.2复方磺胺甲噁唑在松浦镜鲤体内的残留消除规律
对于动物源性食品中药物残留的检测,一般只选取可食性组织,中国农业行业标准NY 5070—2002《无公害食品水产品中渔药残留限量》中提到的鱼类中药物残留的检测对象为肌肉和皮。考虑到肌肉中有血管的分布,因此,本研究中选取血浆、皮、肌肉作为检测对象,进行复方磺胺甲噁唑在松浦镜鲤体内的残留消除规律研究。
在(20±0.5)℃水温条件下,以有效成分50 mg/kg(体质量)的剂量,每天一次,连续5 d对松浦镜鲤口灌复方磺胺甲噁唑粉混悬液后,TMP和SMZ在停药的前3 d均出现了明显的下降趋势。在停药后的第一天,SMZ在血浆、皮和肌肉中的残留量均远大于TMP,但在停药后第7天在肌肉中以及停药后第8天在血浆和皮中,SMZ残留量开始低于TMP。说明TMP在松浦镜鲤体内较SMZ消除缓慢,尤其是到停药第7天后,TMP在肌肉和皮中消除速度极其缓慢,由此发现,复方磺胺甲噁唑休药期制定的主要影响因素应该是TMP的消除速度。
3.3复方磺胺甲噁唑的效果评价与休药期
根据《新编渔药手册》记载,磺胺类药物对敏感菌的最小抑菌浓度(MIC)多为0.1~0.5 mg/L[18],而报道的SMZ对水产养殖常见致病菌的MIC为0.4~1.6 mg/L[19]。考虑到SMZ在与TMP联合使用的情况下抗菌作用更强[20],抗菌效果可增加数倍,因此,复方磺胺甲噁唑对致病菌的MIC值理应较SMZ低。但是,目前对于复方磺胺甲噁唑对水产常见致病菌的MIC研究极其缺乏,仅见宋学宏等[21]报道了复方新诺明对1996年苏州地区育苗场罗氏沼虾暴发性疾病病原菌的MIC为0.5 mg/L。如果以0.5 mg/L作为参考值,复方磺胺甲噁唑以50 mg/kg(体质量)的剂量一次给药后,其在松浦镜鲤体内血浆、肌肉、肝胰脏和肾中72 h内的浓度均能起到杀菌和抑菌效果。而以50 mg/kg(体质量)剂量每天一次连续5 d给药后,其在松浦镜鲤血浆、肌肉和皮中的浓度在停药后6 d内可以起到杀菌和抑菌效果。
在(20±0.5)℃水温条件下,松浦镜鲤按有效成分50 mg/kg(体质量)的剂量,每天一次,连续5 d口灌复方磺胺甲噁唑后,由检测结果可以发现,各组织中SMZ和TMP的含量分别于停药后第9天和第15天开始低于中国规定的磺胺类与增效剂最高残留限量(磺胺类为100 μg/kg,TMP为50 μg/kg)。因此,单独对松浦镜鲤使用复方磺胺甲噁唑时,按50 mg/kg(体质量)的剂量,每天1 次,连续5 d口灌复方磺胺甲噁唑后,其休药期(WDT) 可定为15 d。
参考文献:
[1] Samuelsen O B,Lunestad B T,Jelmert A.Pharmacokinetic and efficacy studies on bath-administering potentiated sulphonamides in Atlantic halibut,HippoglossushippoglossusL.[J].Journal of Fish Diseases,1997,20(4):287-296.
[2] Ueno R.Pharmacokinetics and bioavailability of sulfamonomethoxine in cultured eel[J].Fish Pathology,1998,33(4):297-301.
[3] Kleinow K M,Beilfuss W L,Jarboe H H,et al.Pharmacokinetics,bioavailability,distribution,and metabolism of sulfadimethoxine in the rainbow trout (Oncorhynchusmykiss)[J].Canadian Journal of Fisheries and Aquatic Sciences,1992,49(5):1070-1077.
[4] Kazuaki U,Takaiko A,Ryuji U.Pharmacokinetics and metabolism of sulfamonomethoxine in rainbow trout (Oncorhynchusmykiss) and yellowtail (Seriolaquinqueradiata) following bolus intravascular administration[J].Aquaculture,1997,153:1-8.
[5] 曲志娜,赵思俊,王玉东,等.磺胺甲噁唑在大菱鲆体内药代动力学及残留消除规律的研究[J].中国兽药杂志,2009,43(2):28-31.
[6] 艾晓辉,刘长征,刘义平.复方新诺明在草鱼体内的药代动力学及消除规律[J].水产学报,2004,28(增刊):53-57.
[7] Barnes H C,Hastings T S,Amyes S G B.Aquaculture antibacterials are antagonized by seawater cations[J].Journal of Fish Diseases,1995,18:463-465.
[8] Oppergaard H,Sørum H,Gravningen K.In vitro antimicrobial activity of sulfachlorpyridazine and sulfadiazine in combination with trimethoprim against bacterial fish pathogen[J].Journal of Fish Diseases,1995,18:371-376.
[9] Dixon-Holland D E,Katz S E.Competitive direct enzyme-linked immunosorbent assay for detection of sulfamethazine residues in swine urine and muscle tissue[J].Journal-Association of Official Analytical Chemists,1987,71(6):1137-1140.
[10] Ko E,Song H,Park J H.Direct competitive enzyme-linked immunosorbent assay for sulfamethazine[J].Journal of Veterinary Medical Science,2000,62(10):1121-1123.
[11] 王群,孙修涛,刘德月,等.复方新诺明在鲈鱼体内的药物代谢动力学研究[J].海洋科学,2001,25(2):35-38.
[12] 袁科平,艾晓辉.磺胺甲噁唑在罗非鱼体内的药代动力学及组织浓度研究[J].水利渔业,2008,28(3):25-27.
[13] 范克俭.土霉素和新诺明在中国明对虾体内的药代动力学研究[D].青岛:中国海洋大学,2005.
[14] 魏凤环,王永刚,罗佳波.药动学多峰现象研究概况[J].中国药学杂志,2005,40(23):1772-1774.
[15] 刘秀红,王群,李健.氯霉素在牙鲆体内的药代动力学及残留消除规律研究[J].集美大学学报:自然科学版,2003,8(4):305-310.
[16] 王慧.噁喹酸在养殖牙鲆(Paralichthysolivaceus)体内的残留消除规律研究[D].青岛:中国海洋大学,2006.
[17] 艾晓辉,刘长征,周运涛.不同水温和给药方式下磺胺甲噁唑在草鱼体内的药动学研究[J].水生生物学报,2005,29(2):210-214.
[18] 农业部《新编渔药手册》编撰委员会.新编渔药手册[M].北京:中国农业出版社,2005:192.
[19] 孙玉增,刘慧慧,秦华伟,等.磺胺甲基异噁唑在大菱鲆体内的代谢动力学研究[J].渔业科学进展,2009,30(6):42-47.
[20] 韩冰,杨洪波,王荻,等.复方磺胺甲恶唑在鲫组织中高效液相色谱检测法的建立与残留消除规律[J].食品安全质量检测学报,2014,5(2):401-407.
[21] 宋学宏,李蒙英,吴康,等.罗氏沼虾幼体暴发性疾病药物防治[J].淡水渔业,1997,27(5):34-36.
PharmacokineticsandresiduesofcompoundsulfamethoxazoleinSongpumirrorcarpCyprinuscarpioSongpu
HAN Bing1,2, YANG Hong-bo1,2, WANG Di1, LU Tong-yan1
(1.Heilongjiang River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Harbin 150070,China; 2.College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China)
Abstract:The pharmacokinetics and residues of compound sulfamethoxazole (trimethoprim∶sulfamethoxazole=1∶5) was studied in Songpu mirror carpCyprinuscarpioSongpu exposed to oral administration at 50 mg/kg body weight by means of HPLC. The results showed that the concentrations versus time of trimethoprim (TMP) in plasma and muscle were well described by one-department open model with first-order absorption. However, the concentrations versus time of trimethoprim in hepatopancreas and kidney were well described by two-department open model with first-order absorption after a single oral administration. The concentrations versus time of sulfamethoxazole(SMZ) in plasma, muscle, hepatopancreas and kidney were well described by a two-department open model with first-order absorption. The residues in Songpu mirror carp by oral administration for 5 d once a day was found to be less than the maximum residue limit (MRL) (0.05 mg/kg) at the day 15 for TMP and to be less than MRL(0.10 mg/kg) at the day 9 for SMZ. The findings indicate that the withdrawal time should be 15 d after administration in these conditions.
Key words:CyprinuscarpioSongpu; compound sulfamethoxazole; pharmacokinetics; residue
DOI:10.3969/J.ISSN.2095-1388.2014.06.014
文章编号:2095-1388(2014)06-0618-06
收稿日期:2014-03-25
基金项目:公益性行业(农业)科研专项(201203085);现代农业产业技术体系建设专项资金资助项目(CARS-46)
作者简介:韩冰(1989—), 男, 硕士研究生。E-mail:h_bing1022@163.com
通信作者:卢彤岩(1967—), 女, 博士, 研究员。E-mail:lutongyan@hotmail.com
中图分类号:S948
文献标志码::A




