海带和条斑紫菜凝集素提取液对刺参体壁主要免疫酶活性的影响
李丹彤,范友敏,常亚青,李晓丽,侯建华,曲诚,胡昕江
(大连海洋大学 农业部北方海水增养殖重点实验室,辽宁 大连116023)
摘要:为探讨凝集素提取液对刺参Apostichopusjaponicus免疫的影响,将刺参基础饲料中分别添加质量分数为0.64%、1.28%、2.56%的海带凝集素提取液,或质量分数为1.88%、3.76%、7.52%的条斑紫菜凝集素提取液,分别投喂6个试验组刺参(体质量为3.50 g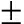 1.95 g),以基础饲料饲养组为对照,分别于投喂凝集素提取液后第4、8、12、17天时,检测各组刺参体壁中过氧化氢酶(CAT)、溶菌酶(LSZ)、碱性磷酸酶(AKP)和酸性磷酸酶(ACP)的活性。结果表明:投喂海带凝集素提取液后,各浓度组刺参CAT、LSZ活性在第8、12、17天时均有显著或极显著提高(P<0.05或P<0.01),0.64%组ACP活性在第8、17天时有显著提高(P<0.05);投喂条斑紫菜凝集素提取液后,各浓度组刺参CAT活性在第8、12、17天时有显著或极显著提高(P<0.05或P<0.01),7.52%组LSZ活性在第8天时有显著提高(P<0.05),AKP活性在第4、17天时有极显著提高(P<0.01),ACP活性在第12天时7.52%组有极显著提高(P<0.01),第17天时各浓度组均有显著或极显著提高(P<0.05或P<0.01)。研究表明,海带和条斑紫菜凝集素提取液均能提高剌参体壁中CAT、LSZ、AKP、ACP的活性,显著增强剌参非特异性免疫水平,将其作为刺参免疫增强剂具有广阔的应用前景。
1.95 g),以基础饲料饲养组为对照,分别于投喂凝集素提取液后第4、8、12、17天时,检测各组刺参体壁中过氧化氢酶(CAT)、溶菌酶(LSZ)、碱性磷酸酶(AKP)和酸性磷酸酶(ACP)的活性。结果表明:投喂海带凝集素提取液后,各浓度组刺参CAT、LSZ活性在第8、12、17天时均有显著或极显著提高(P<0.05或P<0.01),0.64%组ACP活性在第8、17天时有显著提高(P<0.05);投喂条斑紫菜凝集素提取液后,各浓度组刺参CAT活性在第8、12、17天时有显著或极显著提高(P<0.05或P<0.01),7.52%组LSZ活性在第8天时有显著提高(P<0.05),AKP活性在第4、17天时有极显著提高(P<0.01),ACP活性在第12天时7.52%组有极显著提高(P<0.01),第17天时各浓度组均有显著或极显著提高(P<0.05或P<0.01)。研究表明,海带和条斑紫菜凝集素提取液均能提高剌参体壁中CAT、LSZ、AKP、ACP的活性,显著增强剌参非特异性免疫水平,将其作为刺参免疫增强剂具有广阔的应用前景。
关键词:刺参;海带;条斑紫菜;凝集素;免疫酶
刺参Apostichopusjaponicus作为棘皮动物门海参纲的一种,壁厚味美,营养丰富,具有滋补强身和药用功能[1]。海参体壁因含有海参多糖、胶原蛋白和海参皂苷等多种生理活性物质而成为海参主要的食用和药用部位,其药理活性主要包括抗真菌[2]、抗肿瘤[3]、抗凝血[4]、调节血脂浓度[5]和抗疲劳等作用[6]。20世纪80年代以来,随着国内对刺参产品需求的增多,刺参已成为中国北方主要的海水养殖品种,但随着中国刺参大规模人工养殖的快速发展,病害问题日趋突出。目前,养殖业中防治病害普遍使用一些抗生素和化学药物,但这些药物易在刺参体内残留,影响刺参的食用品质。因此,提高刺参自身的抗病力是防治刺参暴发疾病、保证刺参优质高产的根本途径之一。Pedro等[7]采用脂多糖(LPS)可以增强海参体腔细胞的吞噬活性;江晓路等[8]采用褐藻寡糖,王东梅等[9]采用复方中草药等均可提高刺参免疫活性;熊川男等[10]认为,利用凝集素作为海参免疫增强剂是防治海参病的一条有效途径。
凝集素是一类具有糖专一性、可促使细胞凝集的蛋白质或糖蛋白,具有抗菌、激活淋巴细胞、抑制肿瘤细胞增殖等多种功能。Eliseikina等[11]已成功地利用甘露聚糖特异性凝集素来提高海参等棘皮动物抗假结核耶尔森氏菌(Yersinia Dseudotuberculosis)的能力。Eddie Ip等[12]研究表明,甘露糖结合凝集素(MBL)与TLR2/6异聚体的协同作用能够特异性地增强宿主金黄色葡萄球菌的应答。李丹彤等[13-17 ]研究了裙带菜、条斑紫菜、孔石莼和萱藻凝集素提取液对日本对虾、鲤、鲫和刺参非特异性免疫功能的影响,刘云等[18]研究了两种免疫多糖对刺参组织主要免疫酶活性的影响,均发现其具有明显的增强作用。海带和条斑紫菜的生物量较大,且其凝集素提取液活性较高,而有关凝集素提取液对刺参免疫活性物的诱导作用的报道较少。本研究中探究了海带和条斑紫菜凝集素提取液对刺参组织主要免疫酶活性的影响,以期为水产动物病害防治开辟一条新的有效途径。
1材料与方法
1.1材料
试验用刺参购自大连皮口养殖场,体质量为(3.50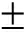 1.95)g,体长为(4.05
1.95)g,体长为(4.05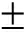 0.95)cm。购回后暂养于水槽(30 L)中,共饲养14箱(20头/箱)。暂养期间,水温为14 ℃,pH为8.0,海水盐度为33,每日9:00投喂1次幼参配合饲料(购于山东省蓬莱市蓬源饲料公司)并换水40%,7 d后用于试验。
0.95)cm。购回后暂养于水槽(30 L)中,共饲养14箱(20头/箱)。暂养期间,水温为14 ℃,pH为8.0,海水盐度为33,每日9:00投喂1次幼参配合饲料(购于山东省蓬莱市蓬源饲料公司)并换水40%,7 d后用于试验。
试验用新鲜海带长约1 m,新鲜条斑紫菜长约30 cm,均购买于大连市黑石礁市场。试验用兔购于大连医科大学。
1.2方法
1.2.1 凝集素提取液的制备 将海带和条斑紫菜用过滤海水洗净,用纱布和滤纸吸去水分,放入冰箱(-20 ℃)中冷冻,然后置于干燥机中烘干(45 ℃)。将烘干的海带、条斑紫菜用研钵研磨成粉末,放入自封袋内保存。以1∶16(g∶mL)的比例将干粉用含0.15 mol/L NaCl的0.015 mol/L Na2HPO4-NaH2PO4缓冲液(pH 7.2)于4 ℃下浸泡16 h,间歇性适当搅拌,混合液倒入离心管中,在4 ℃下以4000 r/min离心30 min,离心后得到的上清液即为凝集素提取液。
1.2.2 蛋白含量的测定 参照文献[19]中的方法,用紫外分光光度计测定(用A280 nm表示),蛋白含量的测定用牛血清白蛋白作对照。
1.2.3 凝集活性的测定 从兔子的耳缘静脉抽取兔血,用生理盐水将其配制成体积分数为2%的红细胞悬液。在96孔V形血凝板上用40 μL生理盐水和等量的凝集素提取液倍比稀释后,加入40 μL 2%的红细胞悬液,混匀并测定血凝活性。室温下放置2 h后,若观察到红细胞沉积在V型孔底部呈大红点状,则说明无凝集现象,若红细胞呈网状不下沉,表示有凝集现象。用能产生凝集现象的凝集素最大稀释倍数或最小凝集素的量来表示血凝活性。
1.2.4 试验设计 试验共设7组,每组设10个重复,每组放40头刺参,在基础饲料中分别添加质量分数为0.64%、1.28%、2.56%的海带凝集素提取液,或质量分数为1.88%、3.76%、7.52%的条斑紫菜凝集素提取液,分别投喂6个试验组刺参,以基础饲料饲养组为对照。每天9:00换水1次,每次换水量为1/3~1/2,每天换水后投喂饲料(投喂量按刺参体质量的3%~4%),并测量盐度、pH、温度等各项水质指标,分别在投喂凝集素提取液后的第4、8、12、17天时测定刺参组织的各项免疫指标。
1.2.5 样品的制备 每次从各组取刺参10头,测量其体长,用灭菌的剪刀从刺参肛门沿腹处剪开,用滤纸吸干体腔液,取体壁称重。按1∶3(g∶mL)的比例加入生理盐水,用匀浆器研磨,在4 ℃下以12 000 r/min离心30 min,取上清,置于冰箱(4 ℃)中保存备用,试验中每只刺参均单独测定免疫酶活性。
1.2.6 免疫酶活性的测定 CAT活性的测定依照桂远明等[20]的方法。CAT酶活力单位定义为:每分钟分解1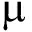 mol的过氧化氢(H2O2)的量为1个酶活力单位(U)。
mol的过氧化氢(H2O2)的量为1个酶活力单位(U)。
LSZ活性的测定依照王雷等[21]的方法,用0.1 mol/L磷酸钾盐缓冲液(pH 6.4)配成溶壁微球菌悬液(A570 nm=0.3)。取3 mL该悬液于试管中冰浴10 min后加入50 μL待测液,混匀,于570 nm波长处测定A0值,再将试液于37 ℃下水浴30 min,之后冰浴10 min中止反应,测定反应后的试液在570 nm波长处的光密度值A。溶菌酶活力的计算公式为
UL=(A0-A)/A0。
AKP活力的测定采用磷酸苯二钠法[20]。AKP酶活力单位定义为:样品在37 ℃下与底物作用15 min,产生1 mg酚为1 个酶活力单位(U)。
ACP活力的测定采用磷酸苯二钠法[20]。ACP酶活力单位定义为:样品在37 ℃下与底物作用60 min,产生1 mg酚为1个酶活力单位(U)。
1.3数据处理
试验数据均以平均值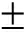 标准差表示。采用SPSS 13.0软件对试验数据进行方差分析,用t检验进行组间多重比较,显著性水平设为0.05。
标准差表示。采用SPSS 13.0软件对试验数据进行方差分析,用t检验进行组间多重比较,显著性水平设为0.05。
2结果与分析
2.1凝集素提取液的制备
在45 ℃下烘干海带和条斑紫菜,制备海带和条斑紫菜凝集素提取液,测得海带凝集素提取液比活力为条斑紫菜凝集素提取液的1517.31倍(表1)。
表1海带与条斑紫菜凝集素提取液的分离测定结果
Tab.1SeparationofkelpLaminariajaponicaAreschandlaverPorphyrayezoensisVedalectins
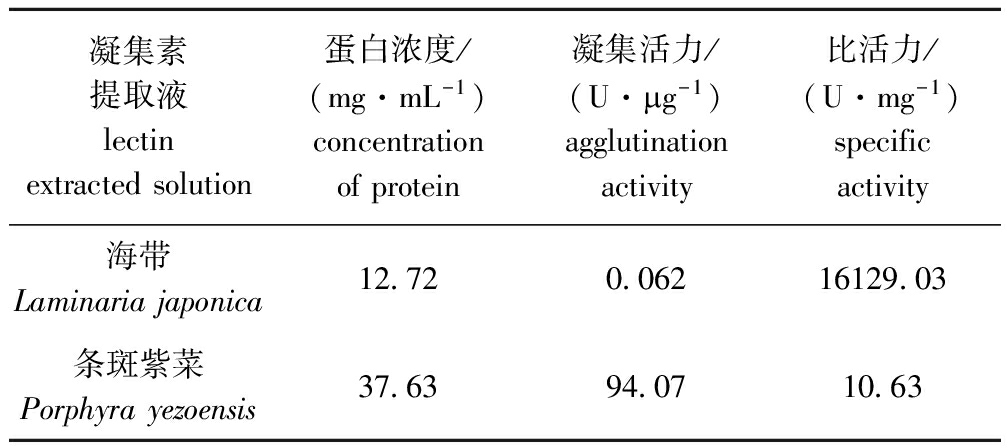
凝集素提取液lectinextractedsolution蛋白浓度/(mg·mL-1)concentrationofprotein凝集活力/(U·mg-1)agglutinationactivity比活力/(U·mg-1)specificactivity海带Laminariajaponica12 720 06216129 03条斑紫菜Porphyrayezoensis37 6394 0710 63
2.2海藻凝集素提取液对刺参体壁中CAT活性的影响
从表2可见:投喂含海带凝集素提取液的饲料后,除第4天时各试验组幼参的CAT活性小于对照组外,其余时间均比对照组高;第8天时,除2.56%试验组酶活性与对照组呈显著性差异(P<0.05)外,其他试验组均与对照组呈极显著性差异(P<0.01);第12天时,0.64%和1.28%试验组酶活性均与对照组呈极显著性差异(P<0.01)且1.28%试验组酶活性最高,为对照组酶活性的1.11倍;第17天时,1.28%和2.56%凝集素对刺参体壁CAT活性具有显著的诱导作用(P<0.05)。
投喂含条斑紫菜凝集素提取液的饲料后,第8天时各试验组刺参体壁CAT活性均有极显著提高(P<0.01);第12天时,1.88%组CAT活性有极显著提高(P<0.01)且酶活性最高,为对照组酶活性的1.10倍,而3.76%和7.52%组酶活性均呈显著提高(P<0.05);第17天时,试验组CAT酶活性均有显著提高(P<0.05)。
从统计分析结果来看,在投喂含海带和条斑紫菜凝集素提取液饲料的中后期,各组刺参体壁的CAT酶活性均显著或极显著提高。
2.3海藻凝集素提取液对刺参体壁中LSZ活性的影响
从表2可见:投喂海带凝集素提取液后,第8天时,0.64%和2.56%组刺参LSZ活性显著提高(P<0.05),而1.28%组则呈现极显著提高(P<0.01);第12天和第17天时,3个试验组均有极显著提高(P<0.01),2.56%组在第17天时活性达到最高,是对照组的2.25倍。投喂条斑紫菜凝集素提取液后,仅7.52%组刺参LSZ活性在第8天时显著提高(P<0.05),其他3个试验组酶活性在第4、8、12、17天时均与对照组无显著性差异(P>0.05)。
从统计分析结果来看,投喂不同含量的海带凝集素提取液,随着时间的增加LSZ活性均显著或极显著提高,且比条斑紫菜凝集素提取液对刺参体壁LSZ活性的诱导作用大。
表2海带和条斑紫菜凝集素提取液对刺参体壁CAT和LSZ活性的影响(n=10)
Tab.2EffectsofkelpLaminariajaponicaAreschandlaverPorphyrayezoensisVedalectinextractedsolutiononcatalase(CAT)andlysozyme(LSZ)activitiesinbodywallsofseacucumberApostichopusjaponicus(n=10)
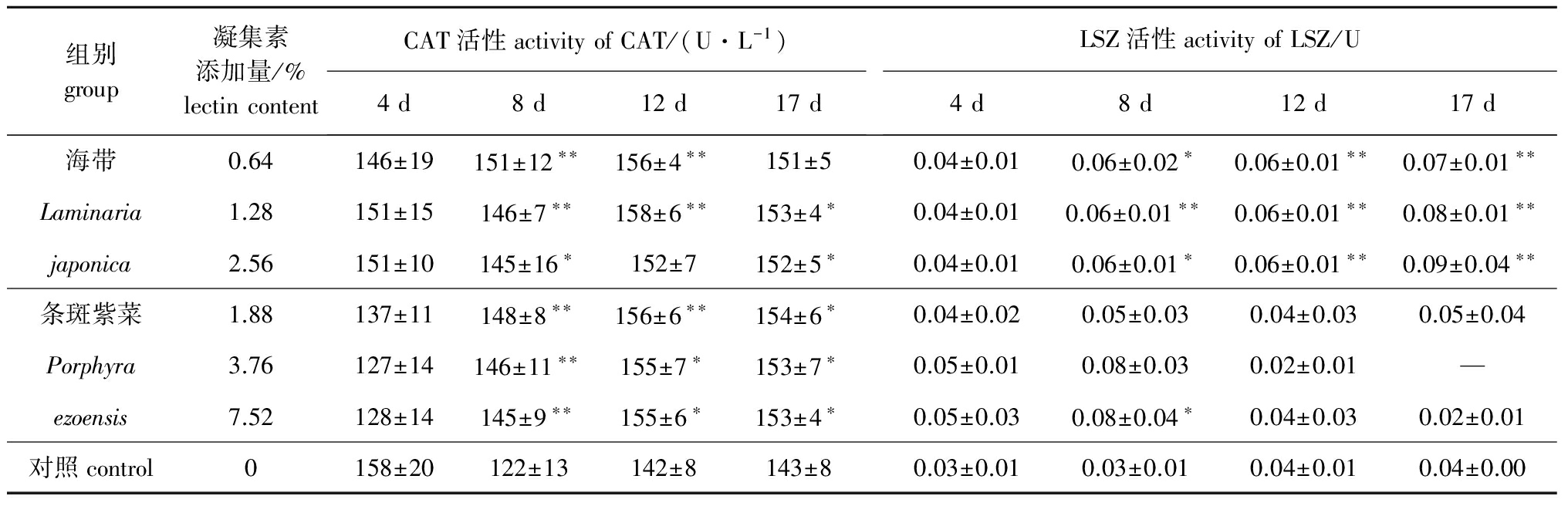
组别group凝集素添加量/%lectincontentCAT活性activityofCAT/(U·L-1)4d8d12d17dLSZ活性activityofLSZ/U4d8d12d17d海带0.64146±19151±12∗∗156±4∗∗151±50.04±0.010.06±0.02∗0.06±0.01∗∗0.07±0.01∗∗Laminaria1.28151±15146±7∗∗158±6∗∗153±4∗0.04±0.010.06±0.01∗∗0.06±0.01∗∗0.08±0.01∗∗japonica2.56151±10145±16∗152±7152±5∗0.04±0.010.06±0.01∗0.06±0.01∗∗0.09±0.04∗∗条斑紫菜1.88137±11148±8∗∗156±6∗∗154±6∗0.04±0.020.05±0.030.04±0.030.05±0.04Porphyra3.76127±14146±11∗∗155±7∗153±7∗0.05±0.010.08±0.030.02±0.01—ezoensis7.52128±14145±9∗∗155±6∗153±4∗0.05±0.030.08±0.04∗0.04±0.030.02±0.01对照control0158±20122±13142±8143±80.03±0.010.03±0.010.04±0.010.04±0.00
注:*表示与对照组有显著性差异(P<0.05);**表示与对照组有极显著性差异(P<0.01)
Note: *means significant difference compared with the control group(P<0.05);**means very significant difference compared with the control group(P<0.01)
2.4海藻凝集素提取液对刺参体壁中AKP活性的影响
从表3可见:投喂含海带凝集素提取液的饲料后,试验组幼参的AKP活性在第4、8、12、17天时均无显著提高(P>0.05);投喂含条斑紫菜凝集素提取液饲料后,第4、17天时,7.52%组AKP活性极显著提高(P<0.01)且在第4天时活性最高,其酶活性是对照组的1.42倍;第8、12天时3个试验组的酶活性在投喂期间无显著性变化(P>0.05)。
从统计分析结果来看,投喂7.52%条斑紫菜凝集素提取液,AKP活性均比对照组高,并在第4、17天时有极显著性差异,且比海带凝集素提取液对刺参体壁AKP的诱导作用大。
2.5海藻凝集素提取液对刺参体壁中ACP活性的影响
从表3可见:投喂含海带凝集素提取液的饲料后,第4天时试验组的ACP活性均低于对照组;第8、17天时仅0.64%组比对照组显著提高(P<0.05)且在第17天时ACP活性最高,其酶活性是对照组的1.26倍。投喂含有条斑紫菜凝集素提取液的饲料后,第4、8天时,3个试验组ACP活性均与对照组无显著性差异(P>0.05);第12天时,试验组与对照组相比ACP活性均有所提高,其中7.52%组有极显著性变化(P<0.01);第17天时,1.88%组和7.52%组酶活性较对照组极显著提高(P<0.01),3.76%组有显著提高(P<0.05),7.52%试验组在第12天时和第17天时分别为对照组的1.43倍和1.57倍。
从统计分析结果来看,投喂含条斑紫菜凝集素提取液饲料的后期,对刺参体壁ACP活性的影响明显,比投喂含海带凝集素提取液饲料的效果显著。
表3海带和条斑紫菜凝集素提取液对刺参体壁AKP和ACP活性的影响(n=10)
Tab.3EffectsofkelpLaminariajaponicaAreschandlaverPorphyrayezoensisVedalectinextractedsolutiononalkalinephosphatase(AKP)andacidphosphatase(ACP)activitiesinbodywallsofseacucumberApostichopusjaponicus(n=10)

组别group凝集素添加量/%lectincontentAKP活性activityofAKP/(U·L-1)4d8d12d17dACP活性activityofACP/(U·L-1)4d8d12d17d海带0.64280±90290±30200±40250±40140±20270±70∗280±120290±30∗Laminaria1.28250±90370±120220±40290±60150±30220±50250±80260±30japonica2.56260±70350±50320±100310±60160±20220±30220±40240±10条斑紫菜1.88330±100250±20320±60250±80160±40200±40240±70310±30∗∗Porphyra3.76290±110330±130250±50340±70130±10150±40280±70330±60∗ezoensis7.52440±160∗∗370±70400±110410±70∗∗150±20180±50300±50∗∗360±40∗∗对照control0310±50340±140330±40300±50200±60180±40210±30230±50
3讨论
海带属于褐藻门、海带科的一种常见食用海洋经济藻类,条斑紫菜属于红藻门、原红藻纲、红毛菜科、Pyropia属。两种海藻凝集素提取液对刺参体壁4种酶活性的研究结果表明,试验组中加入海带和条斑紫菜凝集素提取液能显著提高刺参体壁中CAT、LSZ、AKP和ACP的活性,且最高酶活的最佳凝集素提取液浓度和诱导时间不同。这表明,海藻凝集素提取液是对刺参机体具有显著免疫诱导功效的一种天然免疫增强剂。
CAT酶是存在于生物体内非常重要的抗氧化防御性功能酶,体内SOD清除过量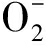 ·产生过量的H2O2,H2O2可由CAT与谷胱甘肽过氧化物酶等一起消除,从而维持机体正常的机能[22]。本研究中,在投喂含不同含量的海带和条斑紫菜凝集素提取液饲料的中后期,刺参体壁CAT酶活性均显著或极显著提高,说明机体抗氧化能力显著提高。
·产生过量的H2O2,H2O2可由CAT与谷胱甘肽过氧化物酶等一起消除,从而维持机体正常的机能[22]。本研究中,在投喂含不同含量的海带和条斑紫菜凝集素提取液饲料的中后期,刺参体壁CAT酶活性均显著或极显著提高,说明机体抗氧化能力显著提高。
LSZ酶是非特异性免疫系统的重要组成部分,主要参与机体中非特异性免疫的杀菌作用,水解细菌细胞壁肽聚糖的β-1,4糖苷键。当机体受到病原等外界刺激时,吞噬细胞活性增强并进行异物吞噬,因吞噬细胞含有LSZ,此时LSZ活性也随之变化[23-24]。本研究中,投喂不同含量的海带凝集素提取液,随着时间的增加LSZ活性均显著或极显著提高,这一结果与李丹彤等[17]研究的萱藻和裙带菜凝集素提取液作为免疫增强剂对刺参进行免疫诱导所得结论相近。海带凝集素提取液促进刺参LSZ活性上升的原因,可能是当用含海带凝集素提取液的饲料投喂刺参后,可激活吞噬细胞的吞噬功能和LSZ活性,刺激免疫细胞分泌细胞因子,启动免疫系统,增强刺参免疫能力[25]。金思等[26]在试验饲料中添加不同浓度的壳聚糖后测定香鱼LSZ活性和hsp70基因的表达量,结果发现香鱼肝脏、脾脏和肾脏中hsp70的表达量均较对照组升高,投喂壳聚糖后LSZ活性与hsp70的表达量呈正相关。hsp70基因家族是最重要且被最广泛研究的热激蛋白基因家族,参与生物体的多种免疫应答过程,推测海带凝集素提取液提高刺参LSZ活性与hsp70有一定的相关性。
AKP酶在体内细胞代谢过程中具有重要作用,可以催化几乎所有的磷酸单酯的水解反应,还可以催化磷酸基团的转移反应。其不仅参加钙磷代谢,维持体内适宜的钙磷比例,而且还与贝类角蛋白等蛋白质的分泌相关[27],同时其作为软体动物溶酶体酶的重要组成部分,在免疫反应中发挥作用[28-29]。本研究中,投喂7.52%条斑紫菜凝集素提取液后,AKP活性有显著提高,且比海带凝集素提取液对刺参体壁AKP的诱导作用大,推测条斑紫菜凝集素提取液可以通过提高AKP活性,提高刺参免疫活性。由于条斑紫菜凝集素提取液与海带凝集素提取液的结构组成不同,造成其对刺参体壁AKP活性的激活作用也不同。
ACP酶是溶酶体的重要组成部分,是巨噬细胞溶酶体的标志酶,可用ACP活性表示吞噬细胞清除异物的能力[9]。本研究中,投喂条斑紫菜和海带凝集素提取液的中后期,ACP活性均有显著或极显著提高,且在后期投喂条斑紫菜比投喂海带凝集素提取液提高得更显著。Rawal等[30]研究表明,阿米巴Gal/GalNAc专一凝集素对MAPK激酶途径有激活作用,MAPK进入细胞核,可使其转录因子活化。由此推测,这可能也是条斑紫菜和海带凝集素提取液显著提高刺参ACP活性的机理,有待于进一步研究。
参考文献:
[1] 李丹彤,常亚青,陈炜,等.獐子岛野生刺参体壁营养成分的分析[J].大连水产学院学报,2006,21(3):278-282.
[2] Kumar R,Chaturvedi A K,Shukla P K,et al.Antifungal activity in triterpene glycosides from the sea cucumberActinopygalecanora[J].Carbohydr Polym,2007,17(15):4387-4391.
[3] Moon J H,Ryu H S,Yang H S,et al.Antimutagenic and anticancer effect of glycoprotein and chondroitin sulfates from sea cucumber (Stichopusjaponicus)[J].The Korean Society of Food Science and Nutrition,1998,27(2):350-358.
[4] Chen S G,Xue C H,Yin L A,et al.Comparison of structures and anticoagulant activities of fucosylated chondroitin sulfates from different sea cucumbers[J].Carbohydr Polym,2011,83(2):688-696.
[5] 胡晓倩,王玉明,任兵兴,等.海参主要活性成分对大鼠脂质代谢影响的比较研究[J].食品科学,2009,30(23):393-396.
[6] 李冰,王静凤,傅佳,等.刺参对运动小鼠抗疲劳作用的研究[J].食品科学,2010,31(15):244-247.
[7] Pedro G S,Cósar A B,Francisco R.Lipopolysaccharides induce intestinal serum amyloid A expression in the sea cucumberHolothuriaglaberrima[J].Dev Comp Inmlunol,2003,27(2):105-110.
[8] 江晓路,杜以帅,王鹏,等.褐藻寡糖对刺参体腔液和体壁免疫相关酶活性变化的影响[J].中国海洋大学学报,2009,39(6):1188-1192.
[9] 王东梅,王维新.饲料中添加复方中草药对刺参免疫的影响[J].饲料研究,2012(10):16-18.
[10] 熊川男,李伟,白雪芳,等.凝集素作为海参免疫增强剂在人工养殖海参中的应用[J]. 饲料工业,2005,26(18):30-32.
[11] Eliseikina M,Timchenko N,Nedashkovskaya E,et al.Influence ofYersiniapseudotuberculosison the immunity of echinoderms[J].Epidemiology and Infectious Diseases(in Russian),2002(1):28-32.
[12] Eddie Ip W K,Takahashi K,Moore K J,et al.Mannose-binding lectin enhances Toll-like receptors 2 and 6 signaling from the phagosome[J].J Exp Med,2008,205(1):169-181.
[13] 李丹彤,张静,陈国栋,等.裙带菜凝集素对日本对虾非特异性免疫因子的影响[J].大连水产学院学报,2009,24(3):274-278.
[14] 李丹彤,陈国栋,张玲丽,等.裙带菜岩藻黄素的提取分离及对人肝癌细胞HepG2的抑制作用研究[J].辽宁师范大学学报:自然科学版,2012,35(3):383-389.
[15] 李丹彤,袁美云,林春江,等.不同海藻凝集素对鲤免疫活性物的诱导[J].辽宁师范大学学报:自然科学版,2006,29(3):348-351.
[16] 李丹彤,吕景才,邢殿楼,等.孔石莼和条斑紫菜凝集素对鲫鱼免疫活性物的诱导作用[J].信阳师范学院学报:自然科学版,2007,20(3):309-312.
[17] 李丹彤,谢广诚,李洪福,等.裙带菜和萱藻凝集素对刺参组织主要免疫酶活性的影响[J].水产学报,2011,35(4):524-529.
[18] 刘云,孔伟丽,姜国良,等. 2种免疫多糖对刺参组织主要免疫酶活性的影响[J].中国水产科学,2008,15(5):787-793.
[19] 北京大学生物系生物化学教研室.生物化学实验指导[M].北京:人民教育出版社,1980:94-96.
[20] 桂远明,吴垠,李丹彤,等.水产动物机能学实验[M].北京:中国农业出版社,2004:124-134.
[21] 王雷,李光友,毛远兴,等.口服免疫型药物对养殖中国对虾病害防治作用的研究[J].海洋与湖沼,1994,25(5):481-486.
[22] 陈玉春,顾雪飞,刘敏,等.5种中草药对鲤血清谷丙转氨酶、谷草转氨酶及红细胞过氧化氢酶活性的影响[J].淡水渔业,2007,37(5):11-13.
[23] Qi Y,Zhang B Q,Shen Z,et al.Antigens containing TAVSPTTLR tandem repeats could be used in assaying antibodies to classical swine fever virus[J].Acta Virol,2009,53(4):241-246.
[24] 张耀光,江莉.人工合成多表位抗原的研究进展[J].国际医学寄生虫病杂志,2010,37(6):360-365.
[25] Chang C Y,Huang C C,Lin Y J,et al.Antigenic domains analysis of classical swine fever virus E2 glycoprotein by mutagenesis and conformation-dependent monoclonal antibodies[J].Virus Res,2010,149(2):183-189.
[26] 金思,龚一富,章丽,等.壳聚糖对香鱼溶菌酶活性和hsp70基因表达的影响[J].生物学杂志,2012,29(5):10-14.
[27] 陈巧,廖金花,林丽蓉,等.乙醇对鲍鱼碱性磷酸酶活力与构象的影响[J].厦门大学学报:自然科学版,2005,44(4):125-127.
[28] 陈竞春,石安静.贝类免疫生物学研究概况[J].水生生物学报,1996,20(1):74-78.
[29] 周永灿,潘金培.贝类细胞和体液的防御机制研究进展[J].水产学报,1997,21(4):449-454.
[30] Rawal S,Majumdar S,Vohra H.Activation of MAPK Kinase pathway by Gal/GalNAc adherence lectin ofE.histolytica:gateway to host response[J].Molecular and Cellular Biochemistry,2005,268(1/2):93-101.
EffectsoftwolectinsextracedsolutionfromkelpLaminariajaponicaAreschandlaverPorphyrayezoensisVedaonactivitiesofimmunoenzymesinbodywallofseacucumberApostichopusjaponicus
LI Dan-tong, FAN You-min, CHANG Ya-qing, LI Xiao-li, HOU Jian-hua, QU Cheng, HU Xin-jiang
(Key Laboratory of Mariculture & Stock Enhancement in North China’s Sea, Ministry of Agriculture, Dalian Ocean University, Dalian 116023, China)
Abstract:The effects of two lectin solutions extracted from kelpLaminariajaponicaand laverPorphyrayezoensisVeda on activities of immunoenzymes were studied in body walls of juvenile sea cucumberApostichopusjaponicuswith body weight of (3.50±1.95)g. The juveniles were fed basic diet (as control group) supplemented with kelp lectin extracted solution at a rate 0.64%,1.28% and 2.56% (mass percent) and fed the basic diet supplemented with laver extracted solution at a rate 1.88%, 3.76% and 7.52%. The activities of catalase (CAT), lysozyme (LSZ), alkaline phosphatase (AKP) and acid phosphatase (ACP) were determined in the body walls on the 4th, 8th, 12th and 17th day after the sea cucumber juveniles were fed the diets supplemented with the kelp extracted solution, and on the 4th, 8th, 13th and 17th day after the juveniles were fed the diets supplemented with laver extracted solution. The results showed that the activities of CAT and LSZ were found to be significantly or very significantly increased in 8, 12, and 17 d after the juveniles were fed the diets containing kelp extracted lectin solution group(P<0.05 orP<0.01). The AKP activity was shown to be significantly increased in the juveniles in 12 d in 1.28% kelp extracted lectin solution group (P<0.01), and ACP activity in 8, and 17 d in 0.64% kelp extracted lectin solution group (P<0.05). The CAT activity was significantly or very significantly increased 8, 13, and 17 d after the juveniles were fed supplemented with laver extracted lectin solution group(P<0.05 orP<0.01), LSZ activity significantly enhanced 8 d after the juveniles were fed supplemented with laver extracted lectin solution (P<0.05), and AKP activity very significantly increased 4, and 17 d in 7.52% laver extracted lectin solution group(P<0.01). The activity of ACP was very significantly increased on the 12th d in 7.52% laver extracted lectin solution group(P<0.01), very significantly improved on the 17th d in 1.88% and 7.52% laver extracted lectin solution groups(P<0.01), and significantly increased on the 17th d in 3.76% laver extracted lectin solution group (P<0.05). The findings indicate that laver and kelp lectin extracted solution can lead to improve the activities of CAT, LSZ, AKP and ACP in body walls of sea cucumber, and thus increase in immunity, and will become a broad prospect on enhancing the immunity of sea cucumber
Key words:Apostichopusjaponicus;LaminariajaponicaAresch;PorphyrayezoensisVeda; lectin;immunoenzymes
DOI:10.3969/J.ISSN.2095-1388.2014.06.012
文章编号:2095-1388(2014)06-0607-06
收稿日期:2014-04-19
基金项目:辽宁省教育厅科研项目(2008T021);国家自然科学基金资助项目(31071612)
作者简介:李丹彤(1965—), 女, 教授。 E-mail:lidantong@dlou.edu.cn
中图分类号:S942.1
文献标志码::A
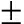 1.95 g),以基础饲料饲养组为对照,分别于投喂凝集素提取液后第4、8、12、17天时,检测各组刺参体壁中过氧化氢酶(CAT)、溶菌酶(LSZ)、碱性磷酸酶(AKP)和酸性磷酸酶(ACP)的活性。结果表明:投喂海带凝集素提取液后,各浓度组刺参CAT、LSZ活性在第8、12、17天时均有显著或极显著提高(P<0.05或P<0.01),0.64%组ACP活性在第8、17天时有显著提高(P<0.05);投喂条斑紫菜凝集素提取液后,各浓度组刺参CAT活性在第8、12、17天时有显著或极显著提高(P<0.05或P<0.01),7.52%组LSZ活性在第8天时有显著提高(P<0.05),AKP活性在第4、17天时有极显著提高(P<0.01),ACP活性在第12天时7.52%组有极显著提高(P<0.01),第17天时各浓度组均有显著或极显著提高(P<0.05或P<0.01)。研究表明,海带和条斑紫菜凝集素提取液均能提高剌参体壁中CAT、LSZ、AKP、ACP的活性,显著增强剌参非特异性免疫水平,将其作为刺参免疫增强剂具有广阔的应用前景。
1.95 g),以基础饲料饲养组为对照,分别于投喂凝集素提取液后第4、8、12、17天时,检测各组刺参体壁中过氧化氢酶(CAT)、溶菌酶(LSZ)、碱性磷酸酶(AKP)和酸性磷酸酶(ACP)的活性。结果表明:投喂海带凝集素提取液后,各浓度组刺参CAT、LSZ活性在第8、12、17天时均有显著或极显著提高(P<0.05或P<0.01),0.64%组ACP活性在第8、17天时有显著提高(P<0.05);投喂条斑紫菜凝集素提取液后,各浓度组刺参CAT活性在第8、12、17天时有显著或极显著提高(P<0.05或P<0.01),7.52%组LSZ活性在第8天时有显著提高(P<0.05),AKP活性在第4、17天时有极显著提高(P<0.01),ACP活性在第12天时7.52%组有极显著提高(P<0.01),第17天时各浓度组均有显著或极显著提高(P<0.05或P<0.01)。研究表明,海带和条斑紫菜凝集素提取液均能提高剌参体壁中CAT、LSZ、AKP、ACP的活性,显著增强剌参非特异性免疫水平,将其作为刺参免疫增强剂具有广阔的应用前景。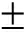 1.95)g,体长为(4.05
1.95)g,体长为(4.05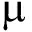 mol的过氧化氢(H
mol的过氧化氢(H

