鱼蛋白的浓缩分离及其凝胶性的研究进展
吴忠,刘俊荣,马永生,王伟,田元勇
(大连海洋大学 食品科学与工程学院,辽宁 大连 116023)
摘要:从食品蛋白配料角度出发,对传统冷冻鱼糜(Surimi)技术以及新兴分离鱼蛋白(FPI)技术在水产品加工中的研究及应用情况进行了系统回顾。从蛋白质的分离回收效果以及脱脂与脱色作用等方面对Surimi及FPI技术进行了对比分析,并围绕蛋白质的凝胶功能特性展开了讨论。结果表明:使用FPI法的蛋白回收率明显高于Surimi法,使用酸溶方法(AC-FPI)的蛋白回收率普遍高于碱溶方法(AL-FPI);FPI法的脱脂效果优于Surimi法;Surimi法的脱色效果优于FPI法,而AL-FPI法的脱色效果明显优于AC-FPI法,几乎接近Surimi法;Surimi凝胶与AL-FPI凝胶特性相似,且均优于AC-FPI凝胶;用3种方法分离的蛋白及其凝胶的贮藏稳定性,AL-FPI法最优,Surimi法次之,AC-FPI法最差。分析认为,今后FPI的研究和应用可从低值鱼蛋白资源出发,以蛋白质的结构变化为核心,蛋白质的食品功能特性为基础而开展。
关键词:分离鱼蛋白;冷冻鱼糜;凝胶特性
迄今为止,基于蛋白质凝胶原理的鱼糜技术仍是低值鱼蛋白资源高附加值利用的最有效方法。传统冷冻鱼糜(Surimi)技术通过漂洗再经精滤,得到以肌原纤维蛋白为主的浓缩产物,与抗冻剂混合后速冻以冷冻鱼糜的形式储存[1]。冷冻鱼糜作为典型的具有突出凝胶功能的鱼蛋白配料,被广泛用于加工系列鱼糜制品,在世界各国受到普遍欢迎。
鱼糜技术具有一定的局限性,在蛋白质的回收率、脱脂、脱色和脱臭等方面尚有很大的提升空间。新兴的分离鱼蛋白(Fish protein isolate,FPI)技术是基于等电点絮凝原理的鱼蛋白分离回收方法,包括酸溶(AC-FPI)及碱溶(AL-FPI)两种处理方法。1999年,Hultin等[2]采用pH调节法有效地解决了鱼糜技术的部分局限性:第一,原料来源广泛,能够把传统饲料级低值鱼蛋白原料分别制成食品级、饲料级产品;第二,可大大提高蛋白质回收率且脱脂效果显著;第三,较好地保留了蛋白质的凝胶形成能力;第四,大大降低了废水排放量,废水中含氮量、化学需氧量等指标显著低于鱼糜废水。国内针对罗非鱼的研究得到了相同结果[3-4]。研究表明,无论是传统鱼糜技术还是新兴蛋白分离技术,目标均是得到脱脂、脱色、浓缩的鱼蛋白基料,即FAO定义的浓缩鱼蛋白(Fish protein concentrate,FPC)[5-6]。本研究中,根据国内外现有的研究进展,从鱼蛋白的分离回收、脱脂与脱色效果,以及分离蛋白的凝胶特性等方面,比较了Surimi与FPI技术对鱼蛋白回收及性质的影响。
1鱼蛋白的浓缩分离
1.1蛋白质的回收率
Surimi法在漂洗和脱水过程中损失了大量水溶性蛋白质和小部分碎肉,大量研究证实,等电点絮凝法可以有效地解决此问题。表1归纳了用不同方法分离鱼蛋白的回收率。从表1可见:大部分研究结果中,AC-FPI法的回收率最高,AL-FPI法次之,Surimi法最低[7-11],FPI法的高回收率源于蛋白质等电点沉淀原理;而在少数研究结果中,AL-FPI法的回收率高于AC-FPI法[12-14]。
影响Surimi法得率和FPI回收率的因素不同。研究表明,漂洗次数是影响Surimi法得率的关键因素,一次漂洗的太平洋鳕回收率为56.7%,3次漂洗后降为44%[15]。对FPI法而言,蛋白质在不同pH下的溶解度决定了其回收率,之后的分离、等电点沉淀和回收等环节也有一定影响。Kristinsson等[11]研究表明,分离蛋白溶浆时,高速离心处理对蛋白质的回收率有很大影响,当无离心处理时,用AC-FPI和AL-FPI法分离的斑点叉尾鮰肌肉蛋白质的回收率分别可从71.5%和70.3%提高至85.8%和82.1%。此外,原料鲜度对回收率也有显著影响,Davenport等[17]发现,用FPI法对新鲜斑点叉尾鮰肌肉蛋白质的回收率显著高于贮藏原料;贮藏后的鲱肌肉蛋白质的分子发生交联,溶液中肌肉粒度增加,回收率降低[18]。对于FPI法而言,处理过程中得到的未溶出物以及软凝胶层和乳化层中都含有部分可溶性蛋白,对其进行处理也能够提高回收率,Cortes-Ruis等[16]采用AC-FPI法二次处理沙丁鱼肌肉未溶出物,将原有的回收率从65%提高至76%。对Surimi生产中的漂洗废水进行处理也能够回收其中部分蛋白质,Huang[19]采用膜过滤法有效地回收了废水中的肌原纤维蛋白质,Huang等[20]用加热絮凝法回收了冷冻无须鳕肌肉漂洗液中33%的蛋白质。
表1不同技术分离鱼蛋白的回收率
Tab.1Fishproteinyieldunderdifferentisolatingtreatments%
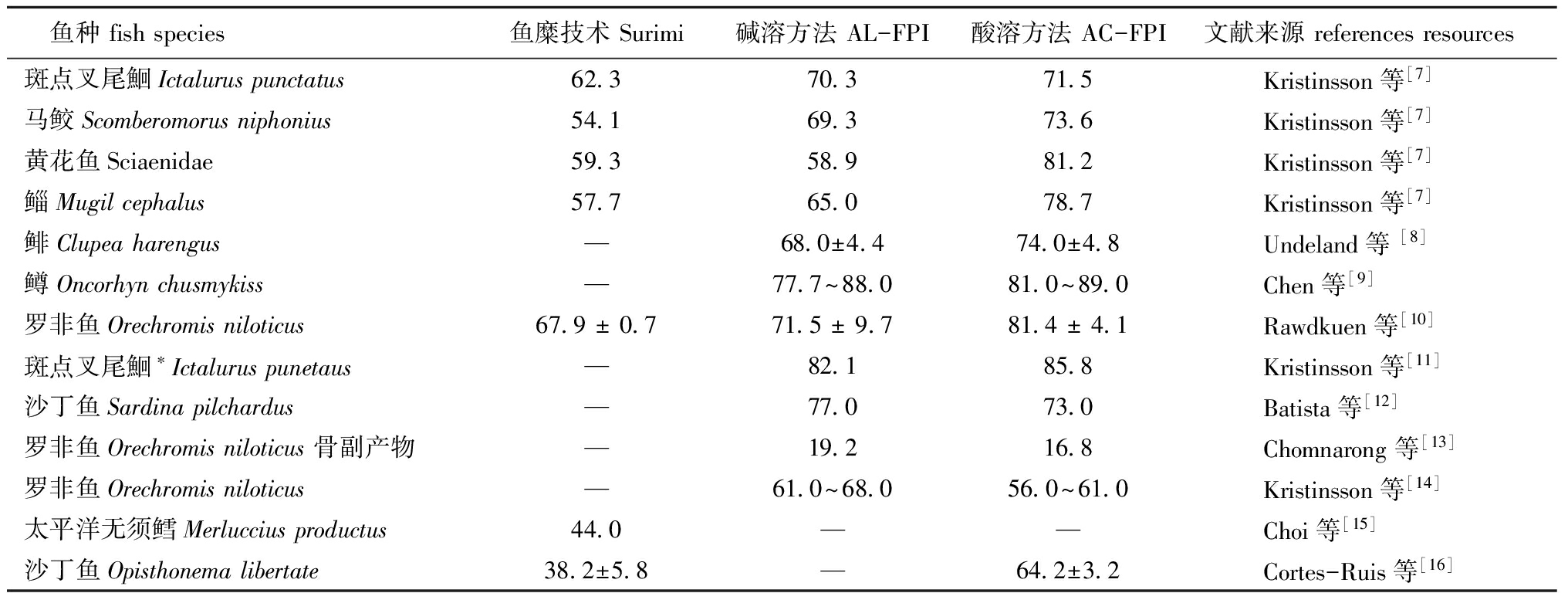
鱼种fishspecies鱼糜技术Surimi碱溶方法AL-FPI酸溶方法AC-FPI文献来源referencesresources斑点叉尾鮰Ictaluruspunctatus62 370 371 5Kristinsson等[7]马鲛Scomberomorusniphonius54 169 373 6Kristinsson等[7]黄花鱼Sciaenidae59 358 981 2Kristinsson等[7]鲻Mugilcephalus57 765 078 7Kristinsson等[7]鲱Clupeaharengus—68 0±4 474 0±4 8Undeland等[8]鳟Oncorhynchusmykiss—77 7~88 081 0~89 0Chen等[9]罗非鱼Orechromisniloticus67 9±0 771 5±9 781 4±4 1Rawdkuen等[10]斑点叉尾鮰∗Ictaluruspunetaus—82 185 8Kristinsson等[11]沙丁鱼Sardinapilchardus—77 073 0Batista等[12]罗非鱼Orechromisniloticus骨副产物—19 216 8Chomnarong等[13]罗非鱼Orechromisniloticus—61 0~68 056 0~61 0Kristinsson等[14]太平洋无须鳕Merlucciusproductus44 0——Choi等[15]沙丁鱼Opisthonemalibertate38 2±5 8—64 2±3 2Cortes-Ruis等[16]
注:*为不含离心处理,下同
Note:*,processing without centrifugation,et sequentia
值得注意的是,等电点絮凝法回收蛋白质的前提是蛋白质的溶出,蛋白质的两性特点使得其在极端pH下,由于其氨基酸残基侧链基团带净正电荷或净负电荷,蛋白质发生溶解。研究表明,影响鱼肉蛋白质溶出的因素很多,鲱肌肉蛋白质在pH 为2.7和10.8时,分别溶解了92%和88%[8]。然而,在pH为3~4和pH为10~11时,肌肉粒度较大,部分可溶性蛋白质被未溶出物包裹脱除,回收率降低。随着酸碱强度的增加,高净电荷引起分子内的静电斥力增强,蛋白质分子肿胀展开,肌肉粒度减小[3],回收率提高。
综上所述,用AC-FPI和AL-FPI法均比Surimi技术分离的蛋白质回收率高,对于Surimi处理时的废水和FPI处理时的未溶出物中的蛋白质也可进一步回收。蛋白质的回收率与原料、鱼种、鲜度、pH、离心处理等因素有关,这些因素如何共同作用还需进一步研究探讨。
1.2脱脂、脱色效果
1.2.1 脱脂效果 在Surimi技术中,原料中大部分三酰基甘油酯在去头、去皮、去内脏和水洗过程中已脱除[1]。在FPI技术中,脂质的脱除受到原料、肌肉粒度和离心处理等因素的影响。表2归纳了用FPI法和Surimi法对不同原料中脂质的脱除效果。从表2可知,FPI技术的脱脂效果优于Surimi技术,AL-FPI法优于AC-FPI法。Kristinsson等[11]采用AC-FPI、AL-FPI和Surimi法分别脱除斑点叉尾鮰肌肉中85.4%±2.0%、88.6%±2.8%和58.3%±7.8%的脂质。此外,高速离心处理显著影响肌肉中脂质的脱除效果,Kristinsson等[11]研究表明,若无高速离心处理时,AC-FPI、AL-FPI法对斑点叉尾鮰肌肉中脂质的脱除率从85.4%±2.0%和88.6%±2.8%分别降至45.4%±4.4%和61.2%±6.3%。
FPI技术难以脱除鱼体肌肉组织中的膜脂,例如鲱碎肉经过FPI技术处理后,膜脂脱除率为46%[8]。Liang等[21-22]在真鳕Gadusmorhua肉浆中加入CaCl2/MgCl2、柠檬酸,脱除了肌肉中90%的膜脂;此后,Liang等[23]在酸性和碱性真鳕肉浆中加入相对分子质量为310 000~375 000的壳聚糖,能够分别脱除约55%和80%的膜脂,对照组约为31%,这主要是因为壳聚糖含有大量正电荷,能够与带负电荷的膜脂聚合沉淀而脱除。
表2用不同方法对鱼肉中脂质的脱除效果
Tab.2Effectofdifferenttreatmentsonremovingthelipidsoffishes%
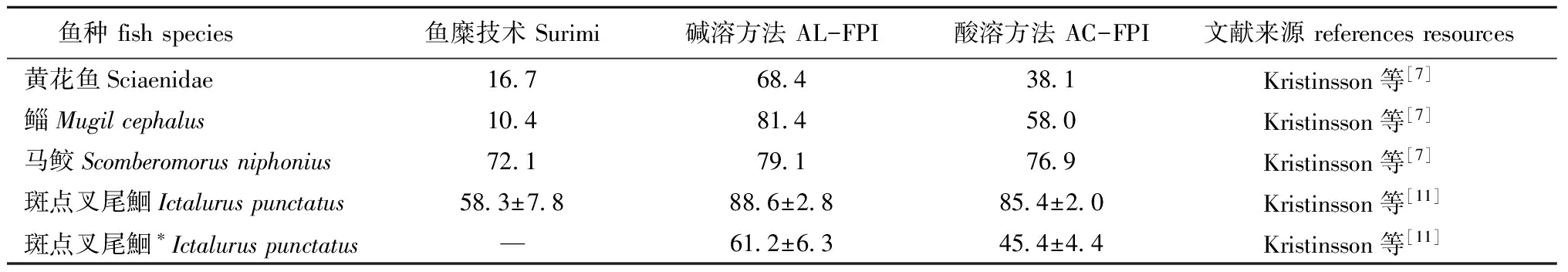
鱼种fishspecies鱼糜技术Surimi碱溶方法AL-FPI酸溶方法AC-FPI文献来源referencesresources黄花鱼Sciaenidae16 768 438 1Kristinsson等[7]鲻Mugilcephalus10 481 458 0Kristinsson等[7]马鲛Scomberomorusniphonius72 179 176 9Kristinsson等[7]斑点叉尾鮰Ictaluruspunctatus58 3±7 888 6±2 885 4±2 0Kristinsson等[11]斑点叉尾鮰∗Ictaluruspunctatus—61 2±6 345 4±4 4Kristinsson等[11]
注:*为无离心处理
Note:*,the processing without centrifugation
1.2.2 脱色效果 表3归纳了用不同鱼种制备Surimi及其凝胶和FPI及其凝胶的白度。从表3可见,大部分研究表明,Surimi及其凝胶的白度高于FPI及其凝胶[7,15-16,24-26],这是由于色素蛋白通过等电点絮凝一并被回收所致。
原料及其处理方式的差异决定了分离鱼蛋白及其凝胶的白度。其中,FPI处理中加入高比例水和进行高速离心影响FPI及其凝胶的白度[7,27],Surimi处理中的漂洗过程能够提高Surimi及其凝胶的白度。研究表明:沙丁鱼碎肉鲜肉糜的白度为37.2±1.6,Surimi及其凝胶的白度分别为51.8±1.1和60.3±1.2,AC-FPI及其凝胶的白度分别为45.2±1.5和48.3±2.2[18];太平洋鳕碎肉3次漂洗制备的Surimi凝胶的白度高于1次漂洗得到的Surimi凝胶[15];鲢FPI凝胶中加入TiO2能够显著提高其白度,并且高于狭鳕Surimi凝胶的白度[28]。
总之,血色素的含量影响FPI及其凝胶、Surimi及其凝胶的白度,Surimi处理中的漂洗过程以及AC-FPI、AL-FPI处理中加入高比例水和进行高速离心也影响浓缩鱼蛋白及其凝胶的白度。探索如何有效地脱除血色素以提高和控制分离产物的白度是当前研究的热点之一。
表3用不同方法得到的鱼蛋白及其凝胶的白度
Tab.3Whitenessofsurimi,surimi-basedgel,FPIandFPI-basedgelunderdifferenttreatments
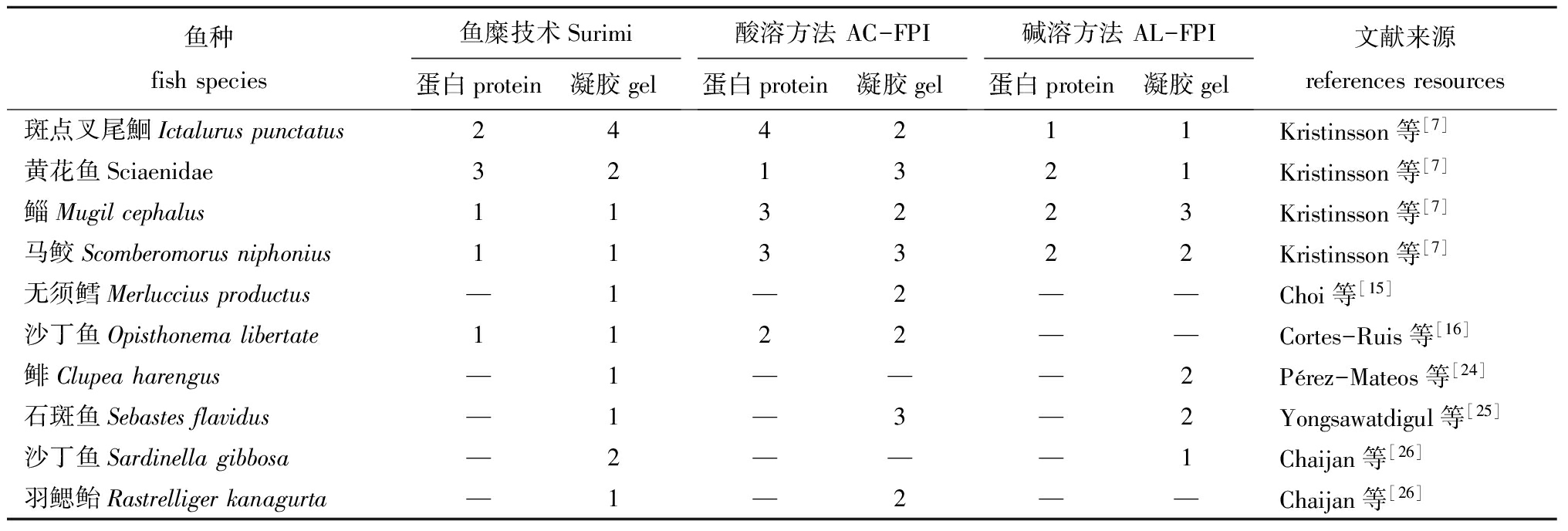
鱼种fishspecies鱼糜技术Surimi蛋白protein凝胶gel酸溶方法AC-FPI蛋白protein凝胶gel碱溶方法AL-FPI蛋白protein凝胶gel文献来源referencesresources斑点叉尾鮰Ictaluruspunctatus244211Kristinsson等[7]黄花鱼Sciaenidae321321Kristinsson等[7]鲻Mugilcephalus113223Kristinsson等[7]马鲛Scomberomorusniphonius113322Kristinsson等[7]无须鳕Merlucciusproductus—1—2——Choi等[15]沙丁鱼Opisthonemalibertate1122——Cortes-Ruis等[16]鲱Clupeaharengus—1———2Pérez-Mateos等[24]石斑鱼Sebastesflavidus—1—3—2Yongsawatdigul等[25]沙丁鱼Sardinellagibbosa—2———1Chaijan等[26]羽鳃鲐Rastrelligerkanagurta—1—2——Chaijan等[26]
注: 1为白度最高,2、3、4为白度不断降低
Note:1,the whitest gel;2-4,the whiteness of gel is weaker in the comparison
2分离处理对鱼蛋白凝胶的影响
2.1分离蛋白凝胶的功能
凝胶功能是蛋白质最重要的食品功能特性之一,往往作为评价食品蛋白质配料价值的重要指标,凝胶能力既与蛋白质种类有关,又与蛋白质稳定性密切相连。与陆产恒温动物相比,冷血鱼类的蛋白非常易于变性,一方面,在低温冻藏条件下发生冷冻变性,另一方面,在死后处置及加工过程也会因温度波动而导致热变性[29]。表4归纳了对不同原料采用AC-FPI、AL-FPI和Surimi法得到的凝胶特性。从表4可知,Surimi凝胶和AL-FPI凝胶的强度均优于AC-FPI凝胶[7-8,15-16,30-33]。凝胶强度受到不同因素的影响,其中凝胶中适量的盐分能够改善凝胶的特性[34-35]。
表4用不同方法得到的鱼蛋白凝胶的强度
Tab.4Strengthofsurimigel,andFPIgelfromdifferentfishspeciesunderdifferenttreatments
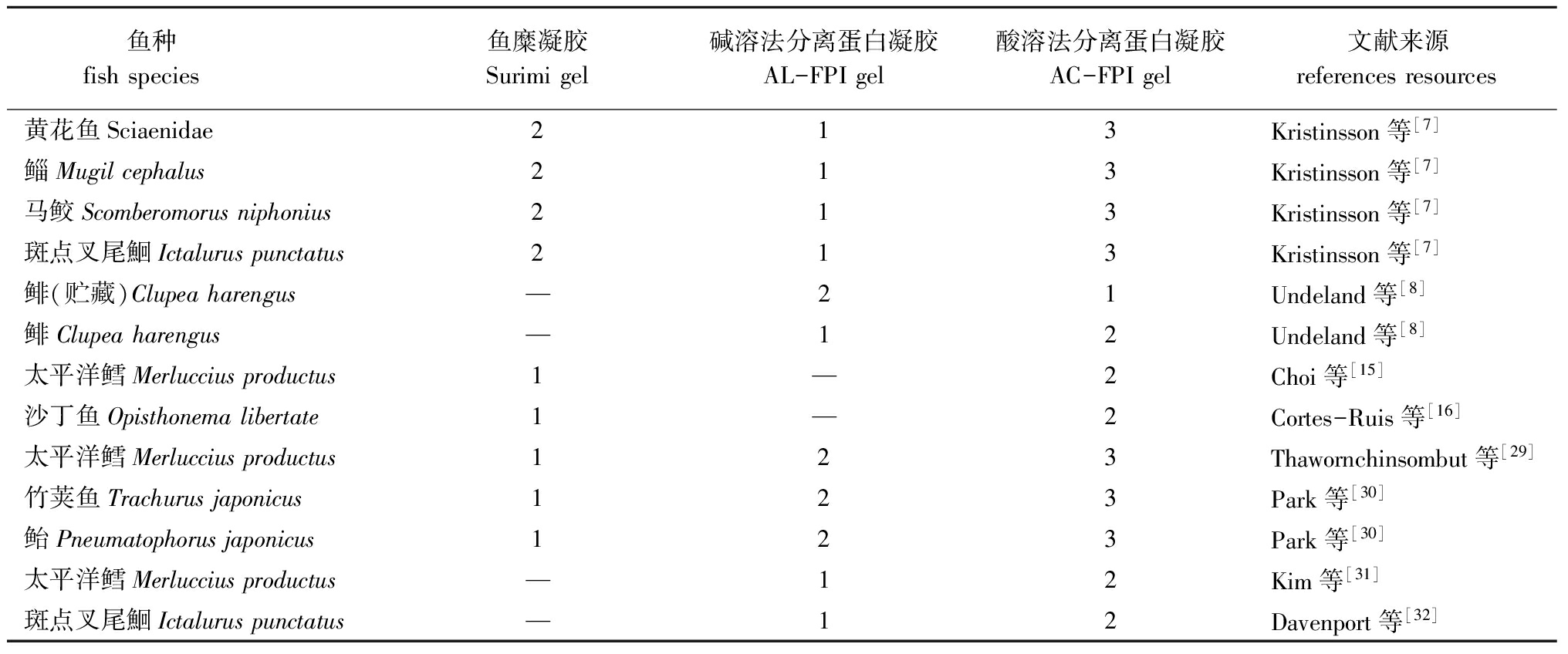
鱼种 fishspecies鱼糜凝胶Surimigel碱溶法分离蛋白凝胶AL-FPIgel酸溶法分离蛋白凝胶AC-FPIgel 文献来源 referencesresources黄花鱼Sciaenidae213Kristinsson等[7]鲻Mugilcephalus213Kristinsson等[7]马鲛Scomberomorusniphonius213Kristinsson等[7]斑点叉尾鮰Ictaluruspunctatus213Kristinsson等[7]鲱(贮藏)Clupeaharengus—21Undeland等[8]鲱Clupeaharengus—12Undeland等[8]太平洋鳕Merlucciusproductus1—2Choi等[15]沙丁鱼Opisthonemalibertate1—2Cortes-Ruis等[16]太平洋鳕Merlucciusproductus123Thawornchinsombut等[29]竹荚鱼Trachurusjaponicus123Park等[30]鲐Pneumatophorusjaponicus123Park等[30]太平洋鳕Merlucciusproductus—12Kim等[31]斑点叉尾鮰Ictaluruspunctatus—12Davenport等[32]
注: 1为凝胶强度最高;2为凝胶强度次高;3为凝胶强度最差
Note:1,the strongest gel in the comparison;2,next to 1 in strength gel;3,the weakest gel
对于Surimi技术而言,其凝胶强度受到漂洗次数的影响。研究表明,3次漂洗制备的太平洋鳕Surimi凝胶强度高于1次漂洗得到的Surimi凝胶[8]。对于FPI技术而言,其凝胶强度受到原料鲜度的影响,Davenport等[17]研究发现,用新鲜斑点叉尾鮰肌肉制备的FPI凝胶的强度高于用冻藏原料制备的凝胶。此外,FPI凝胶网络中蛋白质与蛋白质的作用决定了凝胶的硬度,蛋白质与水的作用使得凝胶软化[7]。FPI凝胶中残留的肌肉组织蛋白酶也影响凝胶的性能[8],Sriket等[36]研究发现,淡水对虾肠腺中胰蛋白酶和胰凝乳蛋白酶是造成肌肉软化的主要因素,同时肌肉中的丝氨酸蛋白酶也有一定作用。用贮藏原料制备的FPI凝胶的性能低于用高鲜度原料制备的凝胶,这主要受到贮藏过程中产生的脂质自由基的影响。Undeland等[8]研究表明,脂质自由基导致鲱肌肉蛋白质变性,用贮藏鲱制备的凝胶性能低于用高鲜度鲱制备的凝胶。
如何提高鱼蛋白凝胶特性一直为学者所关注。Kim等[32]在Surimi凝胶中加入0~5%肌浆蛋白粉后,监测Surimi凝胶和肌浆蛋白的作用,结果表明,肌浆蛋白粉能延缓肌球蛋白和肌动蛋白的热变性,提高凝胶破断力;Park等[37]对鲐、竹荚鱼FPI凝胶有相同的研究结果。此外,添加土豆淀粉、TG酶、磷酸盐和牛血浆蛋白后均能降低鳟FPI凝胶中蛋白酶的活性,提高其凝胶特性[18]。
总之,浓缩鱼蛋白凝胶的特性因原料、加工方式、内源蛋白酶等的不同而异,属多种因素的耦合作用,因此,对于FPI凝胶性能尚需系统地研究。
2.2分离鱼蛋白及其凝胶的贮藏稳定性
分离鱼蛋白及其凝胶的贮藏稳定性主要包括微生物、脂质氧化和冷冻贮藏特性。脂质氧化取决于产品中易氧化物质的含量[8]以及在氧气中暴露的程度和时间,因此,对加工方式和原料品质有严格要求。Kristinsson等[7]研究发现,Surimi拥有较低的脂质氧化水平,Surimi中脂质氧化产物水平低于AC-FPI和AL-FPI。黄花鱼副产物的AC-FPI的硫代巴比妥酸值(TBARS)值最高,原料次之,AL-FPI最低;贮藏后的AL-FPI和Surimi的TBARS值仍较低,但AC-FPI的TBARS值显著升高[38]。
对于Surimi技术而言,其难以脱除与血红素中Fe2+相连的高度不饱和膜脂,氧化的膜脂导致Surimi及其凝胶的贮藏特性降低[1]。此外,原料中部分天然抗氧化剂(如谷胱甘肽)被漂洗脱除,其贮藏氧化的风险提高[39]。
对于FPI技术而言,由于pH的变化导致血红蛋白氧化性的变化,最终影响FPI的脂质氧化稳定性[40]。学者们采用不同的方法控制FPI及其凝胶的脂质氧化。Petty等[41]研究发现,马鲛肉浆中的AL-FPI几乎不被氧化,而AC-FPI氧化剧烈,在AC-FPI中加入VC和VE能有效地抑制氧化。Raghavan等[42]用δ-VE、水杨酸和没食子酸丙脂抑制冰藏鳕鱼AC-FPI中血红蛋白的氧化,结果表明,其抗氧化效果依次为没食子酸丙脂>水杨酸>δ-VE。
微生物的种类和数量是影响Surimi和FPI的生产及贮藏的另一重要因素,由原料的捕捞和加工环境所决定。Surimi和FPI法均能不同程度地杀灭并抑制微生物生长,然而在贮藏过程中却有不同程度的变化。Kristinsson等[7]监测了斑点叉尾鮰碎肉、Surimi和FPI在冰藏10 d后细菌总数的变化,结果表明,鲜肉中细菌总数从6.32×103CFU/g增加到7.71×105CFU/g,Surimi从2.38×103CFU/g增加到1.55×106CFU/g,AC-FPI从1.45×103CFU/g增加到2.45×104CFU/g,AL-FPI从1.00×103CFU/g降至3×102CFU/g。
Surimi的冷冻贮藏特性受温度和抗冻剂的影响,而针对FPI冷冻贮藏特性的研究较少。Thawornchinsombut等[43]研究发现,Surimi凝胶和加入抗冻剂后的AL-FPI凝胶的质地相似且强度较高,抗冻剂及冻结-融化过程对凝胶质地影响显著。加入抗冻剂且不经冻结-融化的AL-FPI凝胶质地最好,加入抗冻剂且经冻结-融化的凝胶质地次之,未加抗冻剂并经冻结-融化的凝胶质地最差。
总之,Surimi及其凝胶和FPI及其凝胶的贮藏性能受到加工方式、原料等因素的影响,这些因素间有耦合作用,进而影响分离产物的贮藏性能。对于贮藏特性而言,仍需深入研究。
2.3分离过程中蛋白质的构象变化与凝胶功能
肌球蛋白是形成鱼蛋白凝胶的主体蛋白质,其构象变化决定了鱼蛋白的功能特性。Surimi和FPI的差异性源于处理过程中pH的变化。Kristinsson等[44-45]研究表明,极端pH下,真鳕肌肉蛋白分子构象改变,将pH调至7.0左右时蛋白质分子展开部分进行重折叠,但无法恢复天然构象,蛋白质功能性发生改变。Kristinsson[46]、Bhattacharyya等[47]研究发现,在酸性条件下,血红蛋白中的血红素与相邻的组氨酸的作用丧失,蛋白质球状部分局部打开并通过化学键作用形成熔球态。Mohan等[48]指出,酸显著影响鲻肌球蛋白分子构象,当pH恢复至原始pH时,肌球蛋白分子展开部分进行重折叠,然而蛋白质三级结构仍有部分断裂,碱却无此影响。对血红蛋白而言,碱对其结构的影响微小,而酸会导致其产生大量氧化前体,进而显著影响其结构。有研究表明,在不同pH条件下,肌球蛋白中二级结构的含量会发生变化,例如,在pH为7.0时,α-螺旋是鲢肌球蛋白凝胶中的主要结构,当pH偏离7.0时,α-螺旋组分下降,其他几种二级结构组分上升[49]。
作为新型食品蛋白质配料,FPI的食品功能特性由蛋白质构象变化所决定,而蛋白质构象的变化受到分离蛋白制备过程中不同因素的影响。探求并采用适当技术表现蛋白质构象变化,并将其构象变化与功能性相结合是现今的研究热点。
3展望
鱼蛋白营养价值高、易消化,具有较好的功能性,其中以凝胶性优良的Surimi为代表,然而Surimi技术无法应用于凝胶性差的低值鱼蛋白的分离中,且在蛋白质的回收率及脱脂、脱色等方面具有一定的局限性,而FPI技术在这些方面具有突出优势,有望在低值鱼蛋白精深加工领域发挥作用。蛋白质分离技术是开发食品蛋白质配料的重要途径,此技术已成熟应用于植物蛋白的分离,其中大豆分离蛋白SPI是其代表,SPI不仅营养价值高,而且拥有各种优良的食品功能性,包括保水性、起泡性、乳化性、吸油性、凝胶性、黏弹性等,依据不同功能性,SPI作为食品蛋白质配料已被广泛应用于食品工业领域。在动物性蛋白源中,经济水产动物资源是一个潜力巨大的优势蛋白源,特别是大量低值鱼原料,采用蛋白分离技术能够有效地提取FPI,有望与大豆分离蛋白SPI媲美,为市场提供新型蛋白质配料产品。
同样作为浓缩鱼蛋白,与已商品化的冷冻鱼糜Surimi相比,FPI尚处于研发尝试阶段,对FPI的研究仍需从基础与应用两方面开展:
(1)蛋白质的结构与功能。蛋白质结构的变化与功能性密切相关,FPI主要由肌浆蛋白、肌原纤维蛋白、肌红蛋白与血红蛋白构成,这些蛋白质在分离加工过程中不同因素的影响下,结构发生变化,各自的功能性以及FPI的功能性将发生改变。深入研究各种蛋白质在分离过程中的结构及功能性变化机理是现今研究的核心内容。
(2)分离产物的特性。FPI的食品功能特性决定了其应用潜力及应用方向。研究FPI的保水性、起泡性、乳化性、吸油性、凝胶性、黏弹性等食品功能特性,并以大豆分离蛋白SPI及冷冻鱼糜Surimi为鉴,从不同的功能性出发,应用于食品加工领域。
参考文献:
[1] Park J W.Surimi and Surimi Seafood[M].New York:Taylor & Francis Group,2005:33-47.
[2] Hultin H O,Kelleher S D.Process for isolating a protein composition from a muscle source and protein composition[P].US,6005073.1999-12-21.
[3] 刘俊荣,贺凌.不同pH条件下罗非鱼肌肉蛋白分离效果及其功能特性的研究[J].水产科学,2010,29(6):317-320.
[4] 刘诗长.罗非鱼肉FPI的制备及研究[D].湛江:广东海洋大学,2011.
[5] 刘俊荣.鱼肉蛋白质组织化方法的研究与应用[J].大连水产学院学报,1998,13(3):72-78.
[6] FAO.Fish Protein Concentrate,1969[EB/OL].[2014-03-22].http://www.fao.org/wairdocs/tan/x5917e/x5917e01.htm.
[7] Kristinsson H,Demir N.In functional fish protein ingredients from fish species of warm and temperate waters:comparison of acid-and alkali-aided processing vs conventional surimi processing[C]//Conference Proceedings Anchorage.Alaska Sea Grant College Program University of Alaska,2003:277-295.
[8] Undeland I,Kelleher S D,Hultin H O.Recovery of functional proteins from herring(Clupeaharengus) light muscle by an acid or alkaline solubilization process[J].Journal of Agricultural and Food Chemistry,2002,50(25):7371-7379.
[9] Chen Y C,Jaczynski J.Protein recovery from rainbow trout(Oncorhynchusmykiss) processing byproducts via isoelectric solubilization/precipitation and its gelation properties as affected by functional additives[J].Journal of Agricultural and Food Chemistry,2007,55(22):9079-9088.
[10] Rawdkuen S,Sai-Ut S,Khamsorn S,et al.Biochemical and gelling properties of tilapia surimi and protein recovered using an acid-alkaline process[J].Food Chemistry,2009,112:112-119.
[11] Kristinsson H G,Theodore A E,Demir N,et al.A Comparative study between acid-and alkali-aided processing and surimi processing for the recovery of proteins from channel catfish muscle[J].Journal of Food Science,2005,70(4):C298-C306.
[12] Batista I,Mendes R,Nelhas R,et al.Proteins from sardine and blue whiting recovered by new extraction techniques:solubility and gelation properties[C]//Icelandic Fisheries Laboratories.First Joint Trans Atlantic Fisheries Technology Conference.Iceland:Conference Proceeding,2003:276-278.
[13] Chomnawang C,Yongsawatdigul J.Protein recovery of tilapia frame by-products by pH-shift method[J].Journal of Aquatic Food Product Technology,2013,22:112-120.
[14] Kristinsson H G,Ingadottir B.Recovery and properties of muscle proteins extracted from tilapia(Oreochromisniloticus) light muscle by pH shift processing[J].Journal of Food Science,2006,71(3):E132-E141.
[15] Choi Y,Park J.Acid-aided protein recovery from enzyme-rich Pacific Whiting[J].Journal of Food Science,2002,67(8):2962-2967.
[16] Cortes-Ruiz J,Pacheco-Aguilar R,Garciasanchez G,et al.Functional characterization of a protein concentrate from bristly sardine made under acidic conditions[J].Journal of Aquatic Food Product Technology,2001,10(4):5-23.
[17] Davenport M,Kristinsson H,Nguyen H.In effect of cold storage and freezing of ground catfish muscle prior to acid or alkali-aided isolation of muscle proteins[M].Las Vegas:Annual IFT Meeting,2005.
[18] Undeland I,Kelleher S D,Hultin H O,et al.Consistency and solubility changes in herring(Clupeaharengus) light muscle homogenates as a function of pH[J].Journal of Agricultural and Food Chemistry,2003,51(14):3992-3998.
[19] Huang L.Application of membrane filtration to recover solids from protein solutions[D].Corvallis,OR,USA:Oregon State University,1997.
[20] Huang L,Chen Y,Morrissey M T.Coagulation of fish proteins from frozen fish mince wash water by ohmic heating[J].Journal of Food Process Engineering,1997,20(4):285-300.
[21] Liang Y,Hultin H O.Separation of muscle membrane from alkali-solubilized fish muscle proteins[J].Journal of Agricultural and Food Chemistry,2005,53(26):10012-10017.
[22] Liang Y,Hultin H O.Separation of membranes from acid-solubilized fish muscle proteins with the aid of calcium ions and organic acids[J].Journal of Agricultural and Food Chemistry,2005,53(8):3008-3016.
[23] Liang Y,Hultin H O,Kim S E.Effect of chitosan and chitin on the separation of membranes from proteins solubilized by pH shifts[J].Journal of Agricultural and Food Chemistry,2007,55:6778-6786.
[24] Pérez-Mateos M,Lanier T C.Comparison of Atlantic menhaden gels from surimi processed by acid or alkaline solubilization[J].Food Chemistry,2007,101(3):1223-1229.
[25] Yongsawatdigul J,Park J.Effects of alkali and acid solubilization on gelation characteristics of rockfish muscle proteins[J].Journal of Food Science,2004,69(7):499-505.
[26] Chaijan M,Benjakul S,Visessanguan W,et al.Physicochemical properties,gel-forming ability and myoglobin content of sardine(Sardinellagibbosa) and mackerel(Rastrelligerkanagurta) surimi produced by conventional method and alkaline solubilisation process[J].European Food Research and Technology,2006,222(1/2):58-63.
[27] Marmon S K,Undeland I.Protein Isolation from gutted herring(Clupeaharengus)using pH-shift processes[J].Journal of Agricultural and Food Chemistry,2010,58:10480-10486.
[28] Taskaya L,Chen Y C,Jaczynski J.Color improvement by titanium dioxide and its effect on gelation and texture of proteins recovered from whole fish using isoelectric solubilization/precipitation[J].LWT-Food Science and Technology,2010,43:401-408.
[29] 曾名勇,黄海,李八方.鲫鱼(Carassiusauratus)肌原纤维蛋白生化特性在冻藏过程中的变化[J].青岛海洋大学学报,2003,33(2):192-198.
[30] Thawornchinsombut S,Park J W.Effect of NaCl on gelation characteristics of acid- and alkali-treated Pacific Whiting fish protein isolates[J].Journal of Food Biochemistry,2007,31(4):427-455.
[31] Park J D,Jung C H,Kim J S,et al.Surimi processing using acid and alkali solubilization of fish muscle protein[J].Journal of the Korean Society of Food Science and Nutrition,2003,32(3),400-405.
[32] Kim Y S,Yongsawatdigul J,Park J W,et al.Characteristics of sarcoplasmic proteins and their interaction with myofibrillar proteins[J].Journal of Food Biochemistry,2005,29(5):517-532.
[33] Davenport M P,Kristinsson H.Channel catfish(Ictaluruspunctatus) muscle protein isolate performance processed under different acid and alkali pH values[J].Journal of Food Science,2011,76:E240-E247.
[34] Tahergorabi R,Beamer S K,Matak K E,et al.Salt substitution in surimi seafood and its effects on instrumental quality attributes[J].LWT-Food Science and Technology,2012,48:175-181.
[35] Ingadottir B,Kristinsson H.Gelation of protein isolates extracted from tilapia light muscle by pH shift processing[J].Food Chemistry,2010,118:789-798.
[36] Sriket C,Benjakul S,Visessanguan W.Characterisation of proteolytic enzymes from muscle and hepatopancreas of fresh water prawn[J].Food Agriculture,2011,91:52-59.
[37] Park J D,Yoon S S,Jung C H,et al.Effect of sarcoplasmic protein and NaCl on heating gel from fish muscle surimi prepared by acid and alkaline processing[J].Journal of the Korean Society of Food Science and Nutrition,2003,32(4):567-573.
[38] Kristinsson H,Liang Y.Effect of pH-shift processing and surimi processing on Atlantic croaker(Micropogoniasundulates) muscle proteins[J].Journal of Food Science,2006,71(5):C304-C312.
[39] Undeland I,Ekstrand B,Lingnert H.Lipid oxidation in minced herring(Clupeaharengus) during frozen storage.Effect of washing and precooking[J].Journal of Agricultural and Food Chemistry,1998,46(6):2319-2328.
[40] Kristinsson H G,Hultin H O.Effect of low and high pH treatment on the functional properties of cod muscle proteins[J].Journal of agricultural and Food Chemistry,2003,51(17):5103-5110.
[41] Petty H,Kristinsson H O.In impact of Antioxidants on lipid oxidation during acid and alkali processing of Spanish mackerel[M].Las Vegas:2004 IFT Annual Meeting,2004.
[42] Raghavan S,Hultin H O.Effect of various antioxidants on the oxidative stability of acid and alkali solubilized muscle protein isolates[J].Journal of Food Biochemistry,2009,33(2):163-175.
[43] Thawornchinsombut S,Park J W.Frozen stability of fish protein isolate under various storage conditions[J].Journal of Food Science,2006,71(3):C227-C232.
[44] Kristinsson H G,Hultin H O.Changes in conformation and subunit assembly of cod myosin at low and high pH and after subsequent refolding[J].Journal of Agricultural and Food Chemistry,2003,51(24):7187-7196.
[45] Kristinsson H G,Hultin H O.Effect of low and high pH treatment on the functional properties of cod muscle proteins[J].Journal of Agricultural and Food Chemistry,2003,51(17):5103-5110.
[46] Kristinsson H G.Conformational and functional changes of hemoglobin and myosin induced by pH:functional role in fish quality[D].Amherst:University of Massachusetts,2002.
[47] Bhattacharyya S,Varadarajan R.Packing in molten globules and native states[J].Current Opinion in Structural Biology,2013,23:11-21.
[48] Mohan M,Ramachandran D,Sankar T,et al.Influence of pH on the solubility and conformational characteristics of muscle proteins from mullet(Mugilcephalus)[J].Process Biochemistry,2007,42(7):1056-1062.
[49] Liu R,Zhao S M,Liu Y M,et al.Effect of pH on the gel properties and secondary structure of fish myosin[J].Food Chemistry,2010,121(1):196-202.
Areview:concentrating,separationandgelformingpropertyinfishprotein
WU Zhong, LIU Jun-rong, MA Yong-sheng, WANG Wei,TIAN Yuan-yong
(College of Food Science and Engineering, Dalian Ocean University, Dalian 116023, China)
Abstract:Research and development of conventional surimi technique and novel fish protein isolate (FPI) process in fish processing industry are reviewed in detail from the view of food protein ingredients. Several key points are compared between Surimi and FPI including yield of fish protein concentrate (FPC) products, lipid reduction, decolourization, especially gel forming properties of various FPC. FPI process is usually shown to hold higher protein yield than surimi process, more recovered protein in acid-FPI(AC-FPI) process than in alkaline-FPI (AL-FPI) process. More lipid is effectively removed by FPI process compared with by surimi process which had similar decolourization effects to AL-FPI process in whiteness. But AL-FPI process has whiter products than AC-FPI process. In general, little difference in gel forming properties is found between surimi gel and AL-FPI gel, higher gel forming capacities than AC-FPI gel. Furthermore, the best lipid oxidation stability is observed in AL-FPI and its gel during storage, followed by surimi and surimi gel, the least in AC-FPI and its gel. It is suggested that the research and application of FPI technology be initial from low value fish protein resources, focusing on the structural changes in proteins based on food functional properties of protein.
Key words:fish protein isolate (FPI); frozen surimi; gel forming property
DOI:10.3969/J.ISSN.2095-1388.2014.05.021
文章编号:2095-1388(2014)05-0536-07
收稿日期:2014-01-09
基金项目:国家自然科学基金资助项目(31271980)
作者简介:吴忠(1988—), 男,硕士研究生。E-mail:wuzhong6837@163.com
通信作者:刘俊荣(1963—), 女,博士,教授。E-mail:ljunrong@dlou.edu.cn
中图分类号:S985.1
文献标志码::A



