菲律宾蛤仔凝集素抑菌机制的研究
佟长青,李琦,曲敏,金桥,李伟
(大连海洋大学 食品科学与工程学院 辽宁省水产品加工及综合利用重点实验室,辽宁 大连 116023)
摘要:通过分析菲律宾蛤仔Ruditapesphilippinarum凝集素(MCL-T)对细菌的呼吸代谢及细菌中总DNA、总RNA和可溶性蛋白合成的影响,以及MCL-T与金黄色葡萄球菌膜蛋白(OMP)的相互作用及其核酸酶(RNase)活性,研究了MCL-T的抑菌机制。结果表明:MCL-T具有抑制金黄色葡萄球菌Staphylococcusaureus和枯草芽孢杆菌Bacillussubtilis代谢过程中的磷酸戊糖途径(HMP);MCL-T与金黄色葡萄球菌或枯草芽孢杆菌共同培养时,随着MCL-T质量浓度的增加,金黄色葡萄球菌或枯草芽孢杆菌中的总DNA、总RNA和可溶性蛋白含量均呈下降趋势;固相吸附测试表明,MCL-T可与金黄色葡萄球菌膜蛋白结合,两者的结合具有浓度依赖关系,该结合位点受N-乙酰-D-半乳糖酰胺(N-acetyl-D-galactosamine,GalNAc)及猪胃黏蛋白(Mucin from porcine stomach,PSM)的抑制,MCL-T具有RNase活性。研究表明,MCL-T通过抑制细菌的呼吸代谢及细菌中总DNA、总RNA和可溶性蛋白来发挥抑菌作用,同时其抑菌活性还与凝集素的OMP结合结构域和RNase活性结构域相关。
关键词:菲律宾蛤仔凝集素;抑菌机制;结构域;膜蛋白;核酸酶
目前,已有大量文献报道了海洋贝类凝集素所具有的抑菌现象,但对于其抑菌机理的研究尚不完全清楚。抑菌剂发挥抑菌作用,首先需要与细菌细胞膜结合,如具有抗菌活性的核酸酶和抗菌肽通过结合在细菌细胞膜上的脂蛋白受体来发挥抗菌活性[1-2]。凝集素可以与细菌细胞膜上的寡糖链结合,但凝集素结合细菌作用与抑制细菌活性不具有相关性,如贻贝凝集素(CGL)具有凝集和抑制枯草芽孢杆菌Bacillussubtilis、大肠杆菌E.coli的作用,但CGL对金黄色葡萄球菌Staphylococcusaureus却不具有凝集作用,只具有抑制作用[3-4]。凝集素通过糖结合结构域来实现结合细菌的作用,但凝集素的糖结合结构域在其抑菌功能过程中不起决定性作用,因此,可以通过研究凝集素参与发挥抑菌作用的结构域来获得其抑菌机理。本研究中,考察了菲律宾蛤仔Ruditapesphilippinarum凝集素(MCL-T)对细菌呼吸代谢的影响,MCL-T与金黄色葡萄球菌外膜蛋白(OMP)的相互作用,以及MCL-T具有的核酸酶(RNase)活性,旨在为全面了解凝集素的抑菌机制提供参考。
1材料与方法
1.1材料
MCL-T由辽宁省水产品加工及综合利用重点实验室制备;革兰氏阳性菌金黄色葡萄球菌ATCC25923和枯草芽孢杆菌ATCC6633取自辽宁出入境检验检疫局;酵母RNA、辣根过氧化物酶(Horse radish peroxidase,HRP)、透析袋(8000-14000)购于北京索莱宝科技有限公司;细菌总RNA快速抽提试剂盒、细菌基因组DNA快速抽提试剂盒、细菌蛋白抽提试剂盒购于生工生物工程(上海)股份有限公司;96孔U型酶标板购于丹麦NUNC公司;其他试剂均为市售国产分析纯。
1.2方法
1.2.1 MCL-T对细菌呼吸代谢的影响试验 参照李伟等[5]的方法,用牛肉膏蛋白胨液体培养基活化枯草芽孢杆菌及金黄色葡萄球菌后,用含0.15 mol/L NaCl的0.1 mol/L PBS溶液(pH 7.4)清洗3次,然后用PBS制成OD600 nm值为1.0的菌悬液。
取15 mL PBS、1 mL 1%的葡萄糖溶液、1 mL菌悬液置于测量瓶中剧烈搅拌5 min。将溶氧测定仪传感器置于菌悬液中,密封后开动磁力搅拌器,每隔1 min记录1次,记录10 min内平均溶氧含量(mg/L),计算空白对照的耗氧速率。
在空白溶液中分别加入100 μL 50 mg/mL Na3PO4,100 μL 50 mg/mL丙二酸,100 μL 50 mg/mL碘乙酸,100 μL 12.5 mg/mL MCL-T,100 μL 50 mg/mL Na3PO4+100 μL 12.5 mg/mL MCL-T,100 μL 50 mg/mL碘乙酸+100 μL 12.5 mg/mL MCL-T,100 μL 50 mg/mL丙二酸+100 μL 12.5 mg/mL MCL-T,测定存在抑菌剂时菌体耗氧速率。
按照文献[6-7]中的方法,计算抑制剂对细菌的呼吸抑制率IR和典型抑制剂对MCL-T的呼吸叠加抑制率RR。
1.2.2 MCL-T对细菌DNA、RNA和可溶性蛋白合成的影响试验 将枯草芽孢杆菌及金黄色葡萄球菌在牛肉膏蛋白胨液体培养基中活化30 min后,分装于无菌试管中(3 mL/管),再加入不同质量浓度的MCL-T溶液,36 ℃下以120 r/min在空气浴恒温振荡器中孵育6 h。
按照试剂盒说明书提取DNA、RNA和可溶性蛋白,并根据二苯胺法、光度法、Lowry等[8]的方法分别测量DNA、RNA和可溶性蛋白含量。
1.2.3 细菌NOS活性的测定 按照“1.2.2”节方法,将菌悬液于4 ℃下以9000 r/min离心20 min,取上清液,按文献[9]中方法计算NO含量。
1.2.4 金黄色葡萄球菌OMP的分离 取用LB培养基培养的金黄色葡萄球菌,用生理盐水洗涤3次后,在冰水浴中用超声波破碎(400 W,间隔时间3 s,工作时间3 s,总时间30 min)后,按文献[10]中的方法提取金黄色葡萄球菌的OMP后,透析、冻干。
1.2.5 MCL-T-HRP固相吸附的测试 取5 mg HRP溶解于1 mL ddH2O中,加入0.2 mL新配制的0.1 mol/L NaIO4溶液,室温下避光搅拌20 min,4 ℃下在1 mmol/L醋酸钠缓冲溶液(pH 4.4)中透析过夜;将透析液中加入20 μL 0.2 mol/L碳酸盐缓冲溶液(pH 9.5)后,立即加入10 mg溶解于1 mL 0.01 mol/L碳酸盐缓冲液的MCL-T,室温下避光轻轻搅拌2 h;再加入0.1 mL新配的4.0 mg/mL NaBH4溶液,混匀,4 ℃下静置2 h,4 ℃下在0.15 mol/L PBS溶液(pH 7.4)中透析过夜,制得MCL-T-HRP[11]。
将金黄色葡萄球菌的OMP溶于0.1 mol/L碳酸盐缓冲溶液(pH 9.5)中,分别取100 μL溶液加入96孔板中,4 ℃下过夜;用含0.15 mol/L NaCl、0.05% Tween 20的0.02 mol/L PBS洗液(pH 7.2)洗涤3次,每次间隔3 min;洗涤后,每孔加入200 μL含有0.1% BSA、0.15 mol/L NaCl的BSA-PBS,4 ℃下封闭过夜。以上述相同方式用PBS洗液洗涤3次。
将MCL-T-HRP溶液稀释100倍后,再进行倍比稀释(1∶100、1∶200、1∶400、1∶800、1∶1600)。取各稀释液100 μL加入到金黄色葡萄球菌OMP包被的96孔板中,4 ℃下过夜;用PBS洗液洗涤3次,加入100 μL新配制的4 mg邻苯二胺与10 mL磷酸-柠檬酸(pH 5.0)的混合液,以及15 μL H2O2溶液,37 ℃下孵育10 min,以2 mol/L H2SO4终止反应,于492 nm波长下测定吸光度。空白对照以BSA代替金黄色葡萄球菌的OMP。每个试验设3个重复。
1.2.6 pH对MCL-T-HRP结合OMP的影响试验 将OMP包被96孔板,各孔内分别加入90 μL 0.05 mol/L pH为5.0的HAc-NaAc、pH为6.0的NaH2PO4-Na2HPO4、pH为7.0的NaH2PO4-Na2HPO4、pH为8.0的Tris-HCl、pH为9.0的Gly-NaOH溶液,然后再加入90 μL MCL-T-HRP,4 ℃下过夜。其余的洗涤、显色反应、吸光度测定过程同MCL-T-HRP的制备。
1.2.7 GalNAc、PSM对MCL-T-HRP结合OMP的影响试验 将OMP包被96孔板,各孔内分别加入质量浓度为3.25、1.63、0.81、0.41、0.20 mg/mL的GalNAc 20 μL,再加入稀释10倍的MCL-T-HRP 20 μL,4 ℃下过夜。其余的洗涤、显色反应、吸光度测定过程同MCL-T-HRP的制备。
将OMP包被96孔板,各孔内分别加入质量浓度为5.00、2.50、1.25、0.63、0.32 mg/mL的PSM溶液50 μL,然后再加入稀释100倍的MCL-T-HRP 50 μL,4 ℃下过夜。其余的洗涤、显色反应、吸光度测定过程同MCL-T-HRP的制备。
1.2.8 MCL-T RNase活性的测定 依次在离心管中加入25 μL 30 mmol/L DTT,40 μL 10 mg/mL酵母RNA,0、10、20、40、80、160 μL凝集素溶液,175 μL 0.05 mol/L NaAC-HAC缓冲液(pH 5.0),并用ddH2O补至700 μL,混匀后置于37 ℃水浴锅中孵育30 min,冰水浴中孵育5 min;加入700 μL 0.02 mol/L La(NO3)3与0.2 mol/L HCl的混合溶液,混匀后于4 ℃下静置10 min,4 ℃下以1100×g离心20 min;取上清液300 μL,加入2.7 mL ddH2O混匀,于260 nm下测定吸光度。以双蒸水代替凝集素做空白对照[12],每个试验设3个重复,观察MCL-T裂解酵母RNA的情况。
凝集素降解酵母RNA的活力单位定义为:在37 ℃下,每毫升孵育液中,30 min催化降解酵母RNA生成1 mg产物时所用凝集素的毫克数为1 个活力单位(U)。
依次在离心管中加入25 μL 30 mmol/L DTT,25 μL 1 mg/mL酵母RNA,0、5、10、20、40、80 μL凝集素溶液,并用0.05 mol/L NaAC-HAC(pH 5.0)补足至700 μL,其余孵育、吸光度测定过程同MCL-T裂解酵母RNA,并计算MCL-T催化降解酵母RNA的米氏常数。
1.3数据处理
所有试验数据均以平均值±标准差表示,用SPSS 13.0软件进行单因素方差分析,用Duncan法进行多重比较,显著性水平设为0.05。
2结果与讨论
2.1MCL-T对细菌呼吸代谢的影响
丙二酸、碘乙酸和磷酸钠分别抑制细菌呼吸代谢过程中三羧酸循环途径(TCA)、糖酵解途径(EMP)和磷酸戊糖途径(HMP)。当两种抑制剂共存时,若两种抑制剂具有不同的呼吸代谢抑制途径时,这种共存可协同增加抑制效应,而当两种抑制剂具有相同的呼吸代谢抑制途径时,这种协同效应降低。因此,通过观察每种抑制剂对细菌的呼吸抑制率以及组合抑制剂的呼吸抑制率,可以得出未知抑制剂对细菌的呼吸代谢抑制途径[7]。
MCL-T对金黄色葡萄球菌及枯草芽孢杆菌表现出较高的抑菌活性[5]。从表1可见:MCL-T对两种细菌均具有呼吸抑制作用,其中MCL-T对金黄色葡萄球菌的呼吸代谢抑制率为40.63%,对枯草芽孢杆菌呼吸代谢抑制率为19.23%;当MCL-T分别与丙二酸、碘乙酸和磷酸钠3种典型抑制剂组合形成组合抑制剂后,磷酸钠对MCL-T的叠加抑制率最小,分别为24.21%和26.67%,这表明MCL-T抑制这两种菌糖氧化代谢途径中的HMP。
2.2MCL-T对细菌总DNA、总RNA和可溶性蛋白合成的影响
从图1-A可见,随着MCL-T质量浓度的增加,枯草芽孢杆菌的总DNA含量呈现下降趋势,金黄色葡萄球菌的总DNA含量呈极缓慢下降趋势。多重比较结果表明:MCL-T质量浓度为160 μg/mL时,金黄色葡萄球菌的总DNA含量与空白组有显著性差异(P<0.05),其余质量浓度组与空白组均无显著性差异(P>0.05);MCL-T质量浓度为10 μg/mL以上时,枯草芽孢杆菌的总DNA含量与空白组均有显著性差异(P<0.05)。
表1MCL-T对金黄色葡萄球菌及枯草芽孢杆菌呼吸代谢的影响
Tab.1EffectofMCL-TonrespiratorymetabolismofbacteriaStaphylococcusaureusandBacillussubtilis
抑制剂inhibitor金黄色葡萄球菌S aureus抑制率IR/%叠加抑制率RR/%枯草芽孢杆菌B subtilis抑制率IR/%叠加抑制率RR/%蛤仔凝集素MCL-T 40 6319 23丙二酸Malonicacid 62 5073 6862 3137 50碘乙酸Iodoaceticacid64 2934 5059 6238 10磷酸钠Sodiumphosphate60 7124 2122 6026 67
从图1-B可见:MCL-T质量浓度为0~20 μg/mL时,随着MCL-T质量浓度的增加,金黄色葡萄球菌总RNA含量呈快速下降趋势,随着MCL-T质量浓度的继续增加,其总RNA含量下降速度较慢;MCL-T质量浓度为0~20 μg/mL时,随着MCL-T质量浓度的增加,枯草芽孢杆菌总RNA含量呈快速下降趋势,随着MCL-T质量浓度的继续增加,其总RNA含量变化不明显。多重比较结果表明,MCL-T质量浓度为10 μg/mL以上时,金黄色葡萄球菌、枯草芽孢杆菌的总RNA含量与空白组均有显著性差异(P<0.05)。
从图1-C可见:MCL-T质量浓度为0~40 μg/mL时,随着MCL-T质量浓度的增加,金黄色葡萄球菌中的可溶性蛋白含量呈快速下降趋势,随着MCL-T质量浓度的继续增加,其可溶性蛋白含量下降趋势变缓;而MCL-T质量浓度为0~40 μg/mL时,随着MCL-T质量浓度的增加,枯草芽孢杆菌中的可溶性蛋白含量下降较快,当MCL-T质量浓度为40μg/mL以上时,其可溶性蛋白含量下降减缓。多重比较结果表明,MCL-T质量浓度为20 μg/mL以上时,金黄色葡萄球菌、枯草芽孢杆菌的可溶性蛋白含量与空白组均有显著性差异(P<0.05)。本研究表明,MCL-T抑制了金黄色葡萄球菌及枯草芽孢杆菌中总DNA、总RNA和可溶性蛋白的合成。
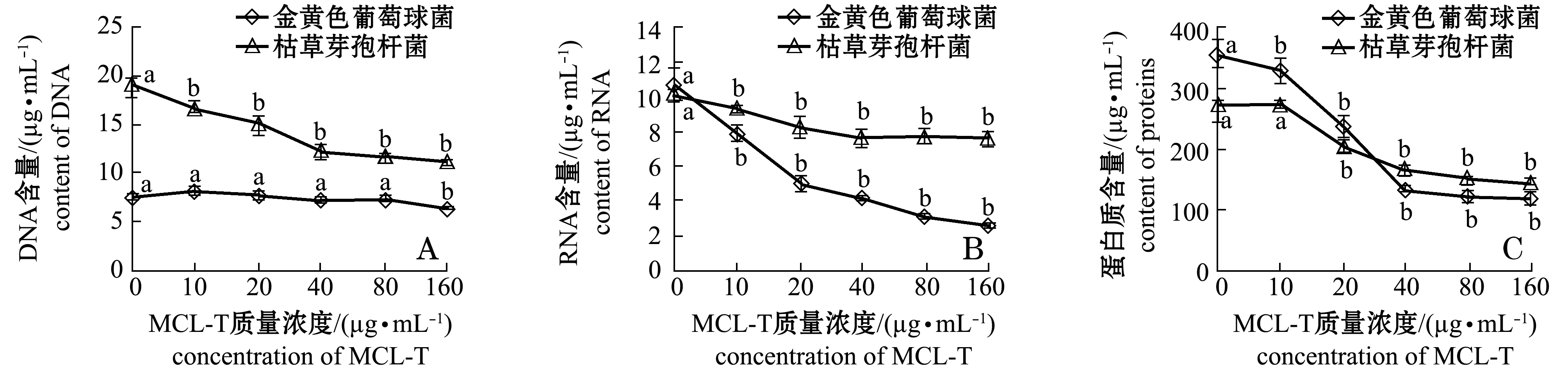
2.3MCL-T对细菌NOS的影响
细菌生长代谢过程中,外界环境中的各种因素对其产生刺激,使得细菌产生相应的各类应激信号。其中一氧化氮(NO)是生物体一氧化氮合酶催化产生的具有抵抗氧应激反应的物质。NO产生量的多少,在一定程度上反映氧应激的强度。采用Griess试剂测定液体培养基中亚硝酸盐的含量,可以计算出NO产生的量[13]。
从图2可见:MCL-T质量浓度为0~20 μg/mL时,金黄色葡萄球菌菌悬液上清液中NO含量呈上升趋势,随着MCL-T质量浓度的继续增加,NO含量开始快速下降;当MCL-T存在时,枯草芽孢杆菌菌悬液上清液中NO含量均增加,当MCL-T质量浓度为0~160 μg/mL时,NO含量呈现急剧上升后缓慢下降的趋势。多重比较结果表明:MCL-T在质量浓度为20、40 μg/mL时,金黄色葡萄球菌的NO产生量与空白组均有显著性差异(P<0.05);MCL-T质量浓度为10 μg/mL以上时,枯草芽孢杆菌NO产生量与空白组有显著性差异(P<0.05)。
2.4MCL-T与金黄色葡萄球菌OMP的相互作用
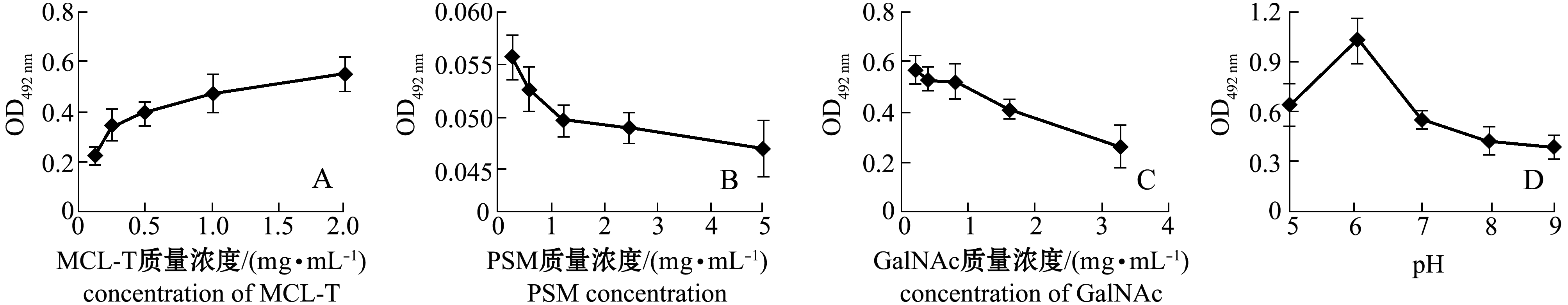
将提取分离获得的金黄色葡萄球菌的OMP与新制备的不同浓度的MCL-T-HRP在96孔酶联免疫吸附板上进行结合测试,结果见图3-A。从图3-A可见,MCL-T与OMP可以结合,而且随着MCL-T质量浓度的增加,与OMP结合的量也增加,且在MCL-T质量浓度为0.25~2.00 mg/mL时,OMP与MCL-T的结合具有含量依赖关系。
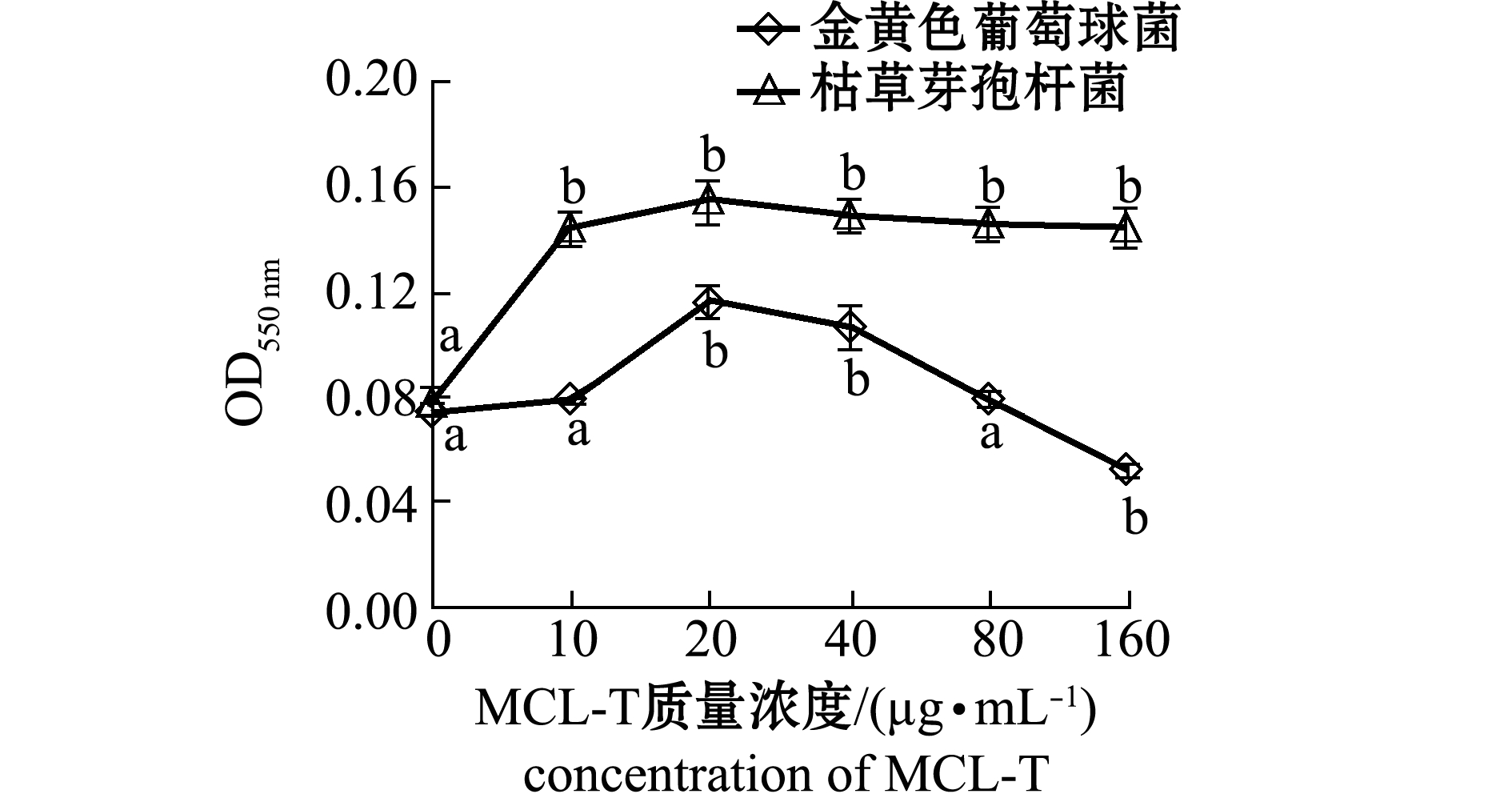
从图3-B可见,随着PSM含量的增加,MCL-T结合金黄色葡萄球菌OMP的量显著下降。这表明,MCL-T与OMP的结合受到PSM的抑制。PSM上的糖链与其核心蛋白之间是通过蛋白上Ser或Thr侧链上的羟基与GalNAc上的羟基通过O-糖苷键连接[14]。PSM含有12个由1~5个糖残基组成的糖链,其核心为Gal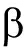 1-3 GalNAc
1-3 GalNAc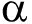 -O-Ser/Thr,该核心结构是PSM执行其功能的重要部分[15]。
-O-Ser/Thr,该核心结构是PSM执行其功能的重要部分[15]。
从图3-C可见,随着GalNAc质量浓度的增加,MCL-T结合金黄色葡萄球菌OMP的量逐渐下降。这表明,MCL-T与OMP的结合受到GalNAc的抑制。
从图3-D可见,当pH值从5增加到6时,MCL-T结合金黄色葡萄球菌OMP的量增加,而随着pH值的进一步增加,MCL-T结合金黄色葡萄球菌OMP的能力逐渐下降。这表明,MCL-T与OMP的结合受到pH值的影响,且在pH为6时两者结合最多。
Odintsova等[16]研究凝集素DTL时发现,该凝集素不仅具有糖结合位点,还具有胶原蛋白结合位点,胶原蛋白结合位点对于DTL黏附HeLa细胞活性非常重要。对于MCL-T与OMP的结合来说,MCL-T上的OMP结合位点受到PSM及GalNAc的抑制。一般来说,凝集素上的糖结合位点具有专一性,因此,OMP结合位点与糖结合位点分别存在于凝集素上两个不同的结构域中。本研究中,OMP结合位点受到糖配体结合凝集素的干扰,表明凝集素分子不是刚性分子;而凝集素与糖配体的结合导致了其构象变化,其与OMP的结合结构域亦发生了改变,以致其与OMP结合减少。这表明,MCL-T分子不是刚性分子,凝集素与糖配体的结合导致了其构象的变化,其功能结构域也发生了改变。
2.5MCL-T的RNase活性
在生物体内,mRNA、tRNA、rRNA等协同作用实现蛋白质的合成。RNA经降解形成寡核苷酸后,就丧失了其生物功能,生物体内蛋白质代谢就会发生混乱,从而导致生物体死亡。因此,自然界中存在大量起着抑菌作用的RNase。Lin等[17]研究指出,人核酸酶7(hRNase 7)具有对铜绿假单胞菌Pseudomonasaeruginosa的抑菌活性。
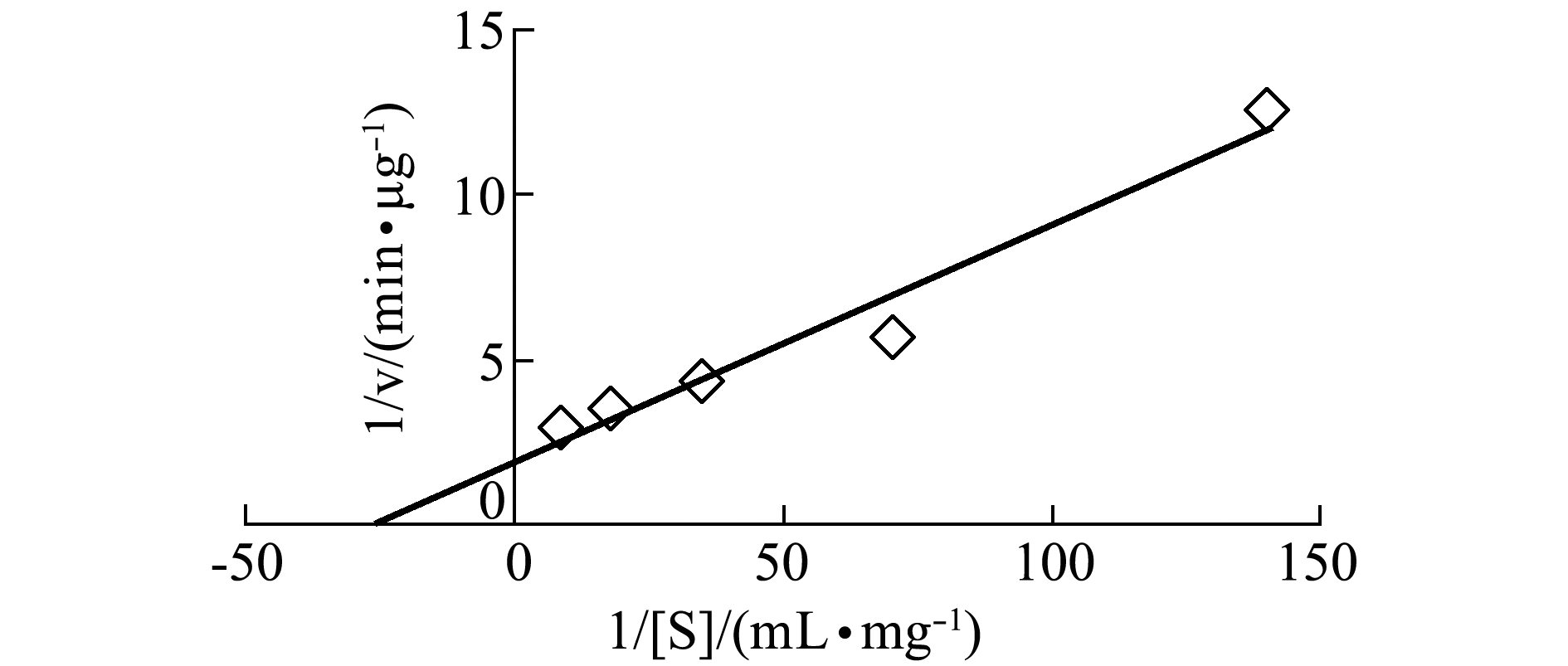
本研究中,在37 ℃下用MCL-T进行降解酵母RNA试验,结果表明,MCL-T降解酵母RNA 30 min,生成1 mg寡核苷酸需凝集素127.15 mg(图4)。通过作Lineweaver-Burk图获得了MCL-T酶解酵母RNA的米氏常数Km(37.23)及降解酵母RNA的速率vmax(0.52 μg/min)。这表明,MCL-T具有RNase活性,而MCL-T所具有的RNase活性是否与其抑菌活性相关,需进一步研究。
从传统的定义来讲,凝集素通常不具有酶活性,但近年来研究发现有许多凝集素具有酶活性。从荷兰鸢尾Irishollandicavar. Professor Blaauw及接骨木Sambucusnigra中提取的凝集素具有酶活性[18-19];从牛蛙Ranacatesbeiana卵中分离出的唾液酸特异性凝集素(cSBL)具有RNase活性[20-22]。cSBL的氨基酸序列有65%与从该牛蛙肝中的RNase同源,从结构及功能上来看,cSBL属于人胰RNase酶超家族。现在把这些具有酶活性的凝集素称为“凝集酶”(leczymes)。本研究中发现,MCL-T具有RNase活性结构域,这可能是MCL-T具有抑菌活性的原因之一。
参考文献:
[1] Huang Y C,Lin Y M,Chang T W,et al.The flexible and clustered lysine residues of human ribonuclease 7 are critical for membrane permeability and antimicrobial activity[J].The Journal of Biological Chemistry,2007,282(7):4626-4633.
[2] Shin S W,Park D S,Kim S C,et al.Two carbohydrate recognition domains ofHyphantriacunealectin bind to bacterial lipopolysaccharides through O-specific Chain[J].FEBS Letters,2000,467(1):70-74.
[3] Kovalchuk S N,Chikalovets I V,Chernikov O V,et al.cDNA cloning and structural characterization of a lectin from the musselCrenomytilusgrayanuswth a unique amino acid sequence and antibacterial activity[J].Fish & Shellfish Immunology,2013,35:1320-1324.
[4] Moura R M,Queiroz A F,Fook J M,et al.CvL,a lectin from the marine spongeClionavarians:isolation,characterization and its effects on pathogenic bacteria andLeishmaniapromastigotes[J].Comparative Biochemistry and Physiology A:Molecular & Integrative Physiology,2006,145(4):517-523.
[5] 李伟,陈文,佟长青,等.菲律宾蛤仔凝集素的分离纯化及抑菌活性研究[J].大连海洋大学学报,2012,27(4):333-337.
[6] 陈亚非,黄凯玲,高健华,等.α-溴代肉桂醛及烷烯基酸酯类对微生物的呼吸代谢的抑制作用研究[J].食品与发酵工业,1994(3):26-29.
[7] 汪海洪,包杰中,宁正祥,等.富马酸二甲酯对微生物生长和呼吸的抑制作用[J].食品与发酵工业,1993(2):1-6.
[8] Lowry O H,Rosenbrough N J,Farr A L,et al.Protein measurement with the folin phenol reagent[J].The Journal of Biological Chemistry,1951,193:265-275.
[9] Aguirre E,Rodríguez-Juárez F,Bellelli A,et al.Kinetic model of the inhibition of respiration by endogenous nitric oxide in intact cells[J].Biochimica et Biophysica Acta,2010,1797(5):557-565.
[10] Xu C,Wang S,Zhang Z,et al.Immunogenic cross-reaction among outer membrane proteins of gram-negative bacteria[J].International Immunopharmacology,2005,5(7/8):1151-1163.
[11] Molchanova V,Chikalovets I,Li W,et al.New GlcNAc/GalNAc-specific lectin from the ascidianDidemnumternatanum[J].Biochimica et Biophysica Acta,2005,1723(1/3):82-90.
[12] Hanson D M,Fairley J L.Enzymes of nucleic acid metabolism from wheat seedlings:I.purification and general properties of associated deoxyribonuclease,ribonuclease,and 3’-nucleotidase activities[J].The Journal of Biological Chemistry,1969,244:2440-2449.
[13] Kim Y H,Woo K J,Lim J H,et al.8-Hydroxyquinoline inhibits iNOS expression and nitric oxide production by down-regulating LPS-induced activity of NF-κB and C/EBPβ in raw 264.7 cells[J].Biochemical and Biophysical Research Communications,2005,329(2):591-597.
[14] Xiong C,Li W,Liu H,et al.A normal mucin-binding lectin from the spongeCraniellaaustraliensis[J].Comparative Biochemistry and Physiology C:Toxicology & Pharmacology,2006,143(1):9-16.
[15] Gerken T A,Owens C L,Pasumarthy M.Site-specific core 1 O-glycosylation pattern of the porcine submaxillary gland mucin tandem repeat.Evidence for the modulation of glycan length by peptide sequence[J].The Journal of Biological Chemistry,1998,273(41):26580-26588.
[16] Odintsova N A,Belogortseva N I,Khomenko A V,et al.Effect of lectin from the ascidian on the growth and the adhesion of HeLa cells[J]. Molecular and Cellular Biochemistry,2001,221:133-138.
[17] Lin Y M,Wu S J,Chang T W,et al.Outer membrane protein I ofPseudomonasaeruginosais a target of cationic antimicrobial peptide/protein[J].The Journal of Biological Chemistry,2010,285(12):8985-8994.
[18] Van Damme E J,Barre A,Barbieri L,et al.Type 1 ribosome-inactivating proteins are the most abundant proteins in iris (Irishollandicavar.Professor Blaauw) bulbs:characterization and molecular cloning[J].Biochemical Journal,1997,324:963-970.
[19] Shahidi-Noghabi S,Van Damme E J,Smagghe G.Carbohydrate-binding activity of the type-2 ribosome-inactivating protein SNA-I from elderberry (Sambucusnigra) is a determining factor for its insecticidal activity[J].Phytochemistry,2008,69(17):2972-2978.
[20] Nitta K,Ozaki K,Tsukamoto Y,et al.Catalytic lectin (leczyme) from bullfrog (Ranacatesbeiana) eggs[J].International Journal of Oncology,1996,9(1):19-23.
[21] Iwama M,Ogawa Y,Sasaki N,et al.Effect of modification of the carboxyl groups of the sialic acid binding lectin from bullfrog (Ranacatesbeiana) oocyte on anti-tumor activity[J].Biological & Pharmaceutical Bulletin,2001,24(9):978-981.
[22] Iwama M,Ogawa Y,Ohgi K,et al.Enzymatic properties of sialic acid binding lectin fromRanacatesbeianamodified with a water-soluble carbodiimide in the presence of various nucleophiles[J].Biological & Pharmaceutical Bulletin,2001,24(12):1366-1369.
Antibacterialmechanismofshort-neckclamRuditapesphilippinarumlectin(MCL-T)
TONG Chang-qing,LI Qi,QU Min,JIN Qiao,LI Wei
(College of Food Science and Engineering,Key Laboratory of Fishery Product Processing and Utilization of Liaoning Province,Dalian Ocean University,Dalian 116023,China)
Abstract:The effects of short-neck clamRuditapesphilippinarumlectin(MCL-T)on respiration, and synthesis of total DNA, total RNA and soluble proteins in bacteriaStaphylococcusaureusandBacillussubtilis, and reaction of MCL-T with out membrane proteins (OMP) ofS.aureusand RNase activity ofS.aureuswere studied by solid phase assay to elucidate antibacterial mechanism of MCL-T. The MCL-T was shown to inhibit pentose phosphate pathway (HMP) in respiratory metabolism of the bacteria. The contents of total DNA, total RNA and soluble proteins were decreased in both bacteria incubated with MCL-T with increase in concentrations of MCL-T. The solid phase assay revealed that MCL-T binding to out membrane proteins (OMP) was concentration-dependent and inhibited by PSM or GalNAc with RNase activity. The findings indicated that MCL-T inhibited the growth of the two bacteria by respiration inhibition, and the antibacterial activities of MCL-T were related to its domains of binding to OMP and to RNase activity.
Key words:Ruditapesphilippinarumlectin; antibacterial mechanism; domain; outer membrane protein(OMP); RNase
DOI:10.3969/J.ISSN.2095-1388.2014.05.016
文章编号:2095-1388(2014)05-0508-06
收稿日期:2014-01-12
基金项目:国家自然科学基金资助项目(31071612);海洋公益性行业科研专项(201205022-7)
作者简介:佟长青(1976—), 男, 博士, 副教授。E-mail:changqingtong@dlou.edu.cn
通信作者:李伟(1964—), 男, 博士, 教授,博士生导师。E-mail:aisingioro@dlou.edu.cn
中图分类号:Q532
文献标志码::A

 1-3 GalNAc
1-3 GalNAc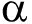 -O-Ser/Thr,该核心结构是PSM执行其功能的重要部分
-O-Ser/Thr,该核心结构是PSM执行其功能的重要部分