化学发光免疫分析与酶联免疫分析法检测水产品药物残留的比较研究
萨仁托雅,张峰,郑有虎,卢亚楠
(大连海洋大学 水产与生命学院 辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁 大连116023)
摘要:对检测水产品中呋喃唑酮代谢物(AOZ)和氯霉素(CAP)药物残留的两种方法——化学发光免疫分析(CLEIA)和酶联免疫分析(ELISA)法进行了比较研究。结果表明:两种药物残留检测中, CLEIA分析方法的线性范围和检出限均优于ELISA法,且两种免疫分析法的添加回收率均具有很好的相关性;用CLEIA法检测AOZ的检出限为0.01 μg/kg,线性范围为0.01~2.56 μg/kg,检测CAP的检出限为0.016 μg/kg,线性范围为0.025~6.400 μg/kg;用ELISA法检测AOZ的检出限为0.1 μg/kg,线性范围为0.10~1.62 μg/kg,检测CAP的检出限为0.05 μg/kg,线性范围为0.05~4.05 μg/kg;用CLEIA法检测CAP的批内变异系数(RSD)为5.5%~11.3%,批间RSD为12.3%~20.9%,检测AOZ的批内RSD为6.6%~11.1%,批间RSD为15.6%~18.3%。研究表明,用CLEIA法检测水产品药物残留较ELISA法检出限低、线性范围宽,虽然检出CAP和AOZ的变异系数均高于ELISA法,但仍符合《兽药残留酶联免疫试剂(盒)备案参考评判标准》的规定。
关键词:化学发光免疫分析;酶联免疫分析;氯霉素;呋喃唑酮代谢物
近年来,食品安全方面的问题越来越多,食品中某些药物的残留问题受到了人们的高度重视。氯霉素可引起骨髓造血机能紊乱、视神经炎、多发性神经炎等症状,并可造成血小板减少、细胞减少性贫血[1]。呋喃唑酮会对人类造成潜在危害,可引起溶血性贫血、眼部损害和急性肝坏死等疾病。2002年,氯霉素和硝基呋喃类药物被列入中国《食品动物禁用兽药及其他化合物清单》,规定不得在水产品中检出氯霉素、硝基呋喃类及其代谢物[2]。
目前,药物残留检测技术主要有气相色谱-质谱联用法[3](GC-MS)、液相色谱-质谱联用法[4](LC-MS)、酶联免疫法[5](ELISA)、放射性免疫测定法[6-7](RIA)等。GC-MS、LC-MS法可准确定量农药残留量且灵敏度高,但操作复杂、设备昂贵;RIA法中标记物易衰变且具有放射性污染;ELISA法虽操作方便快捷,但检出限较高。化学发光免疫分析(CLEIA)技术是近年来发展较快的新型检测技术,该技术集化学发光的高灵敏度和免疫分析的高特异性于一体,具有无污染、特异性强、检出限低、灵敏度高等特点,可快速大规模筛选样品[8-9]。本研究中,对检测水产品药物残留的化学发光免疫分析和酶联免疫分析两种方法进行了比较研究,旨在为化学发光免疫分析技术的实际应用提供参考依据。
1材料与方法
1.1材料
试验用魁蚶Scapharcabroughtonii、仿刺参Apostichopusjaponicus、虾夷扇贝Patinopectenyessoensis、大连紫海胆Strongylocentrotuspurpuratus、菲律宾蛤仔Ruditapesphilippinarum均购于大连市长兴水产品批发市场。
30%过氧化氢、鲁米诺(luminuol)、三羟甲基氨基甲烷(Tris)、盐酸(HCl)等药品购于上海生工生物有限公司;呋喃唑酮代谢物(AOZ)、氯霉素(CAP)ELISA检测试剂盒,以及试验所用抗原包被的96孔酶标板、AOZ与CAP多克隆抗体、HRP-AOZ与HRP-CAP标记复合物、标准品稀释液、洗液、标准品等均由深圳绿诗源公司提供。
Centro LB960 微孔板式发光仪购自德国 Berthold 公司, ELx808 Ultra Microplate Readers酶标仪购自美国伯腾(Bio-tek)公司,WZ-A微量振荡器由常州澳华仪器有限公司生产,恒温水浴锅购于上海亚荣生化仪器厂,高速分散机ULTRA-TURRAX购于IKA公司。
1.2方法
1.2.1 药品的配制 发光底物A:用0.1 mol/L NaHCO3将5 mmol/L鲁米诺原液稀释成浓度为0.5 mmol/L的溶液。发光底物B:用0.1 mol/L Tris-HCl(pH 8.5)将30% H2O2稀释成浓度为5 mmol/L的溶液,使用前按1∶1混合[10-11]。
1.2.2 样品的前处理 取待测样品可食用部分,用捣碎机捣碎后再用高速分散机匀浆。
(1)呋喃唑酮代谢物的提取。分别称取(1.00±0.05)g魁蚶、仿刺参、虾夷扇贝、菲律宾蛤仔组织样品,加入4 mL蒸馏水、0.5 mL 1 mol/L HCl和100 μL衍生化试剂,充分振荡,56 ℃水浴中孵育2 h;再加入5 mL 0.1 mol/L K2HPO4、0.4 mL 1 mol/L NaOH和5 mL乙酸乙酯,充分振荡5 min,室温下以4000 r/min离心10 min;取2.5 mL上层液体加入到另一个容器中,50 ℃下用氮气吹干,加入1 mL正己烷溶解干燥物,再加入1 mL样本复溶液充分混合30 s,室温下以4000 r/min离心10 min,取50 μL下层液体进行分析。
由于海胆中酯含量较高,不宜用乙酸乙酯提取残留药物,所以应先称取(1.00±0.05)g海胆样品,加入4.5 mL甲醇和0.5 mL去离子水,振荡2 min,以4000 r/min离心5 min,倾倒出全部液体,再加5 mL乙腈和5 mL正己烷,振荡2 min,以4000 r/min离心5 min,倾倒出全部液体,留固体沉淀部分,再按照上述方法提取呋喃唑酮代谢物。
(2)氯霉素的提取。分别称取(3.00±0.05)g魁蚶、仿刺参、虾夷扇贝、菲律宾蛤仔组织样品,加入3 mL去离子水混匀,再加入6 mL乙酸乙酯,振荡2 min,室温下以4000 r/min离心10 min;取4 mL上层液体加入到另一容器中,50 ℃下用氮气吹干,加入1 mL正己烷溶解干燥物,再加入1 mL样本复溶液混合30 s,室温下以4000 r/min离心10 min,取50 μL下层液体进行分析。
海胆中氯霉素的提取方法:称取(3.00±0.05)g海胆样品,加入9 mL乙腈-水(84 mL∶16 mL)溶液振荡2 min,室温下以4000 r/min离心10 min;取3 mL上层相与3 mL去离子水混合,加入4.5 mL乙酸乙酯,混合1 min,室温下以4000 r/min离心10 min;取上层有机相,50 ℃下用氮气吹干,再按照上述氯霉素提取方法进行提取。
1.2.3 CLEIA和ELISA方法 CLEIA法检测步骤详见文献[12],ELISA法检测步骤详见ELISA试剂盒说明书。
2结果与分析
2.1CLEIA和ELISA检测方法的批内、批间精密度
在一次测定中,取不同浓度的标准品,每个浓度下均进行5次重复测定,计算批内变异系数(RSD);分别以5个批次测定不同浓度标准品,计算批间RSD。从表1、表2可见:用CLEIA法检测CAP的批内、批间RSD分别为5.5%~11.3%和12.3%~20.9%,用ELISA法检测CAP的批内、批间RSD分别为1.6%~5.9%和8.9%~13.4%;用CLEIA法检测AOZ的批内、批间RSD分别为6.6%~11.1%和15.6%~18.3%,用ELISA法检测AOZ的批内、批间RSD分别为4.9%~6.3%和14.2%~15.0%。虽然用CLEIA法检测的批内和批间变异系数均高于ELISA法,但仍符合《兽药残留酶联免疫试剂(盒)备案参考评判标准》(农医发[2005]17号文件)的规定。该标准中规定:每批平行样之间的变异系数(批内变异系数)不得大于25%,对于禁用药物不得大于30%,而样品之间的变异系数值(批间变异系数)不得大于30%,对于禁用药物不得大于40%。
2.2CLEIA和ELISA检测方法的添加回收率
将不同浓度的AOZ、CAP添加到空白仿刺参匀浆组织中,每个浓度下进行5次重复测定,分别测定两种方法的添加回收率。从表3可见:用CLEIA法检测AOZ、CAP的回收率分别为90.7%~111.9%和83.7%~115.8%;用ELISA法检测AOZ、CAP的回收率分别为84.4%~106.7%和85.3%~111.3%,两种方法的回收效果相当。
表1CLEIA法检测CAP和AOZ的批内和批间精密度(n=5)
Tab.1Intra-andinter-assayprecisionsofCAPdetectionbychemiluminescenceimmunoassay(n=5)
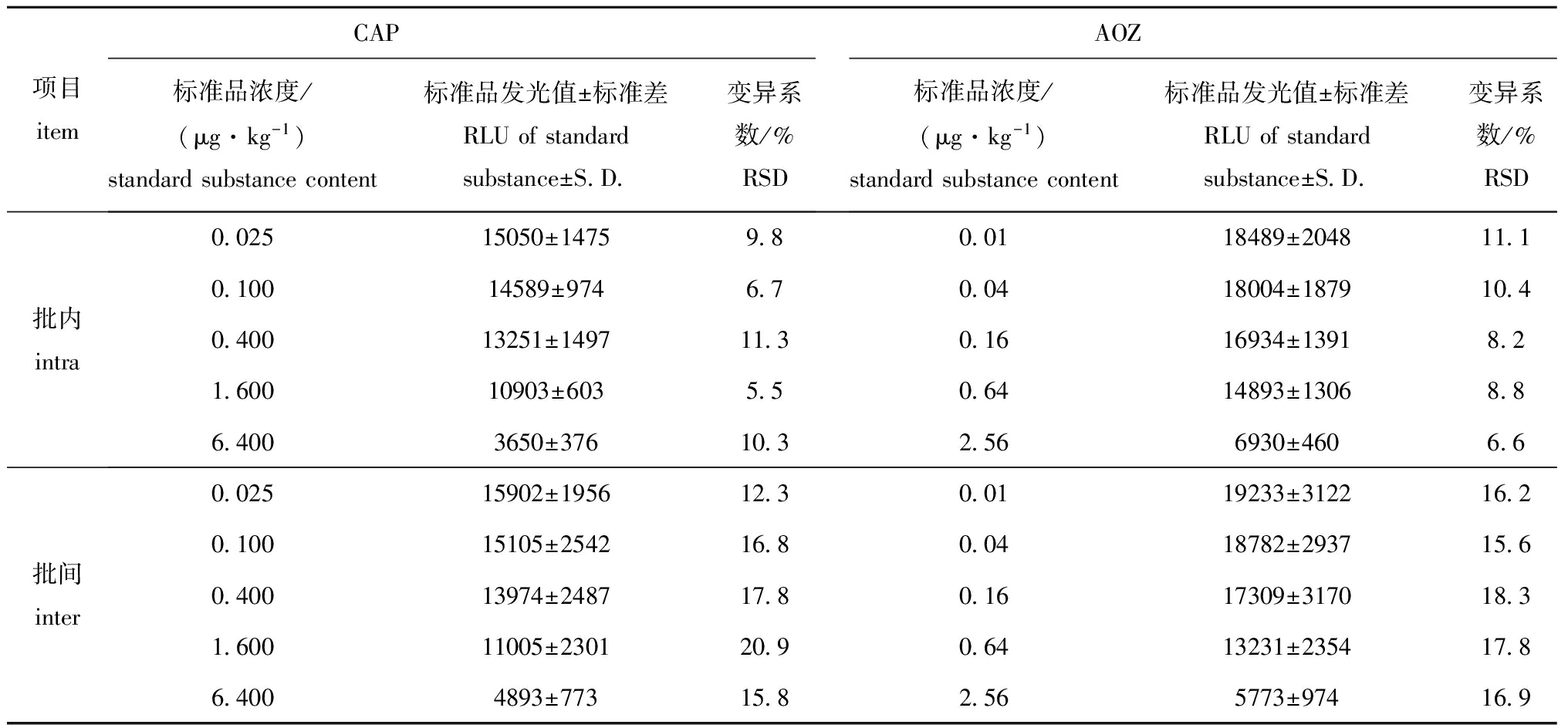
项目itemCAP标准品浓度/(μg·kg-1)standardsubstancecontent标准品发光值±标准差RLUofstandardsubstance±S D 变异系数/%RSDAOZ标准品浓度/(μg·kg-1)standardsubstancecontent标准品发光值±标准差RLUofstandardsubstance±S D 变异系数/%RSD批内intra0 02515050±14759 80 0118489±204811 10 10014589±9746 70 0418004±187910 40 40013251±149711 30 1616934±13918 21 60010903±6035 50 6414893±13068 86 4003650±37610 32 566930±4606 6批间inter0 02515902±195612 30 0119233±312216 20 10015105±254216 80 0418782±293715 60 40013974±248717 80 1617309±317018 31 60011005±230120 90 6413231±235417 86 4004893±77315 82 565773±97416 9
表2ELISA法检测CAP和AOZ的批内和批间精密度(n=5)
Tab.2Intra-andinter-assayprecisionsofAOZdetectionbyenzyme-linkedimmunosorbentassay(n=5)
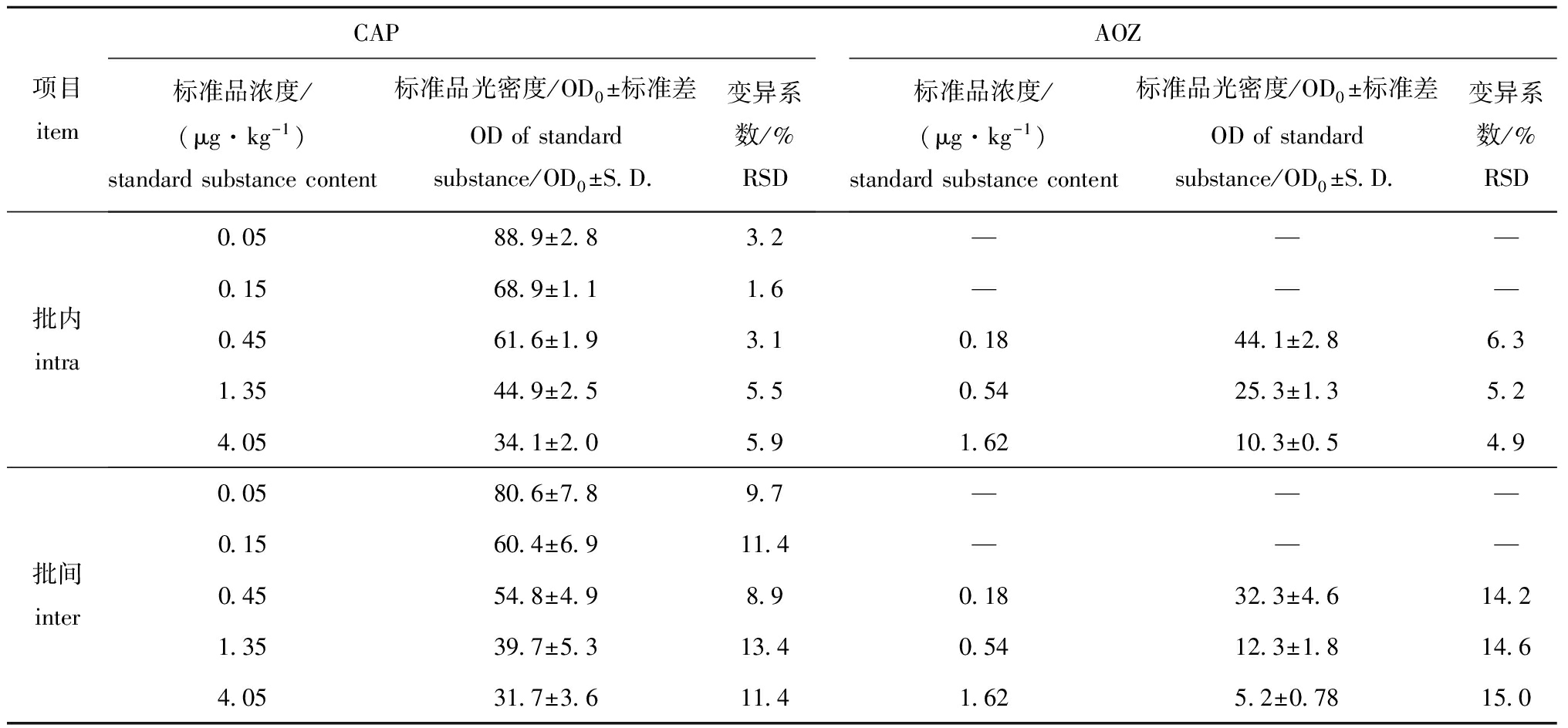
项目itemCAP标准品浓度/(μg·kg-1)standardsubstancecontent标准品光密度/OD0±标准差ODofstandardsubstance/OD0±S D 变异系数/%RSDAOZ标准品浓度/(μg·kg-1)standardsubstancecontent标准品光密度/OD0±标准差ODofstandardsubstance/OD0±S D 变异系数/%RSD批内intra0 0588 9±2 83 2———0 1568 9±1 11 6———0 4561 6±1 93 10 1844 1±2 86 31 3544 9±2 55 50 5425 3±1 35 24 0534 1±2 05 91 6210 3±0 54 9批间inter0 0580 6±7 89 7———0 1560 4±6 911 4———0 4554 8±4 98 90 1832 3±4 614 21 3539 7±5 313 40 5412 3±1 814 64 0531 7±3 611 41 625 2±0 7815 0
表3CLEIA和ELISA法检测AOZ和CAP的添加回收率
Tab.3AddedrecoveryofCAPandAOZdetectionbyCLEIAandELISAmethodsμg/kg
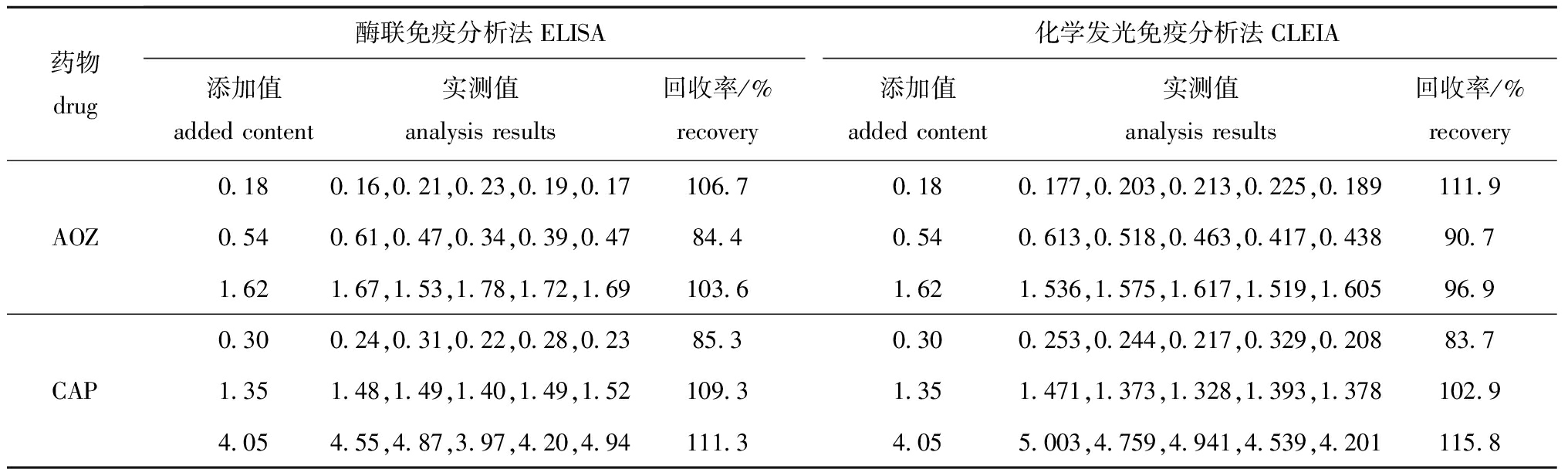
药物drug酶联免疫分析法ELISA化学发光免疫分析法CLEIA添加值addedcontent实测值analysisresults回收率/%recovery添加值addedcontent实测值analysisresults回收率/%recovery0 180 16,0 21,0 23,0 19,0 17106 70 180 177,0 203,0 213,0 225,0 189111 9AOZ0 540 61,0 47,0 34,0 39,0 4784 40 540 613,0 518,0 463,0 417,0 43890 71 621 67,1 53,1 78,1 72,1 69103 61 621 536,1 575,1 617,1 519,1 60596 90 300 24,0 31,0 22,0 28,0 2385 30 300 253,0 244,0 217,0 329,0 20883 7CAP1 351 48,1 49,1 40,1 49,1 52109 31 351 471,1 373,1 328,1 393,1 378102 94 054 55,4 87,3 97,4 20,4 94111 34 055 003,4 759,4 941,4 539,4 201115 8
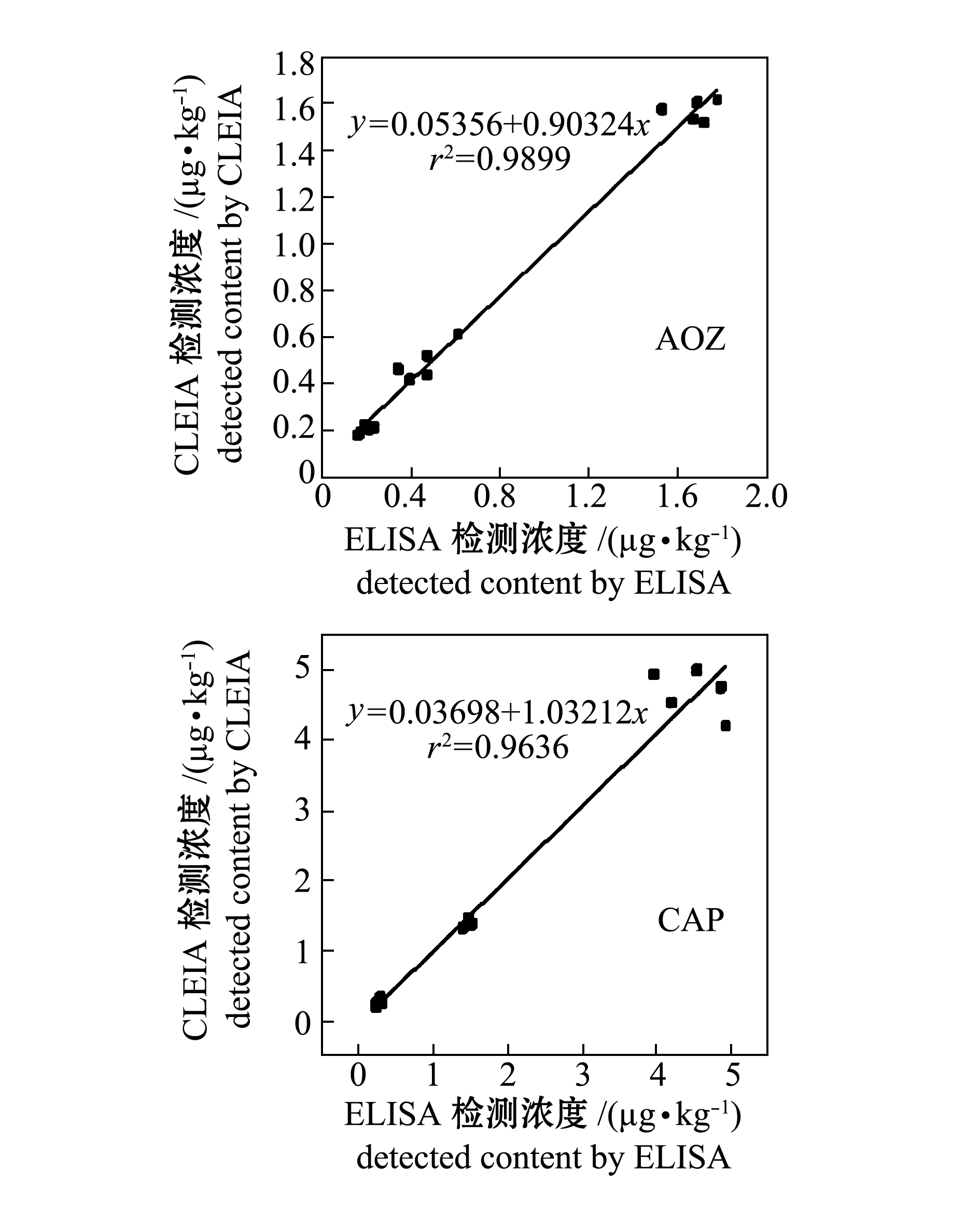
2.3CLEIA和ELISA检测方法的相关性分析
对两种分析方法的添加回收率测定结果进行线性回归分析(图1),结果表明,测定AOZ的回归方程为
y=0.05356+0.90324x(r2=0.9899),
测定CAP的回归方程为
y=0.03698+1.03212x(r2=0.9636)。
说明CLEIA与ELISA两种方法具有很好的相关性,可以准确筛选样品组织中AOZ和CAP残留。
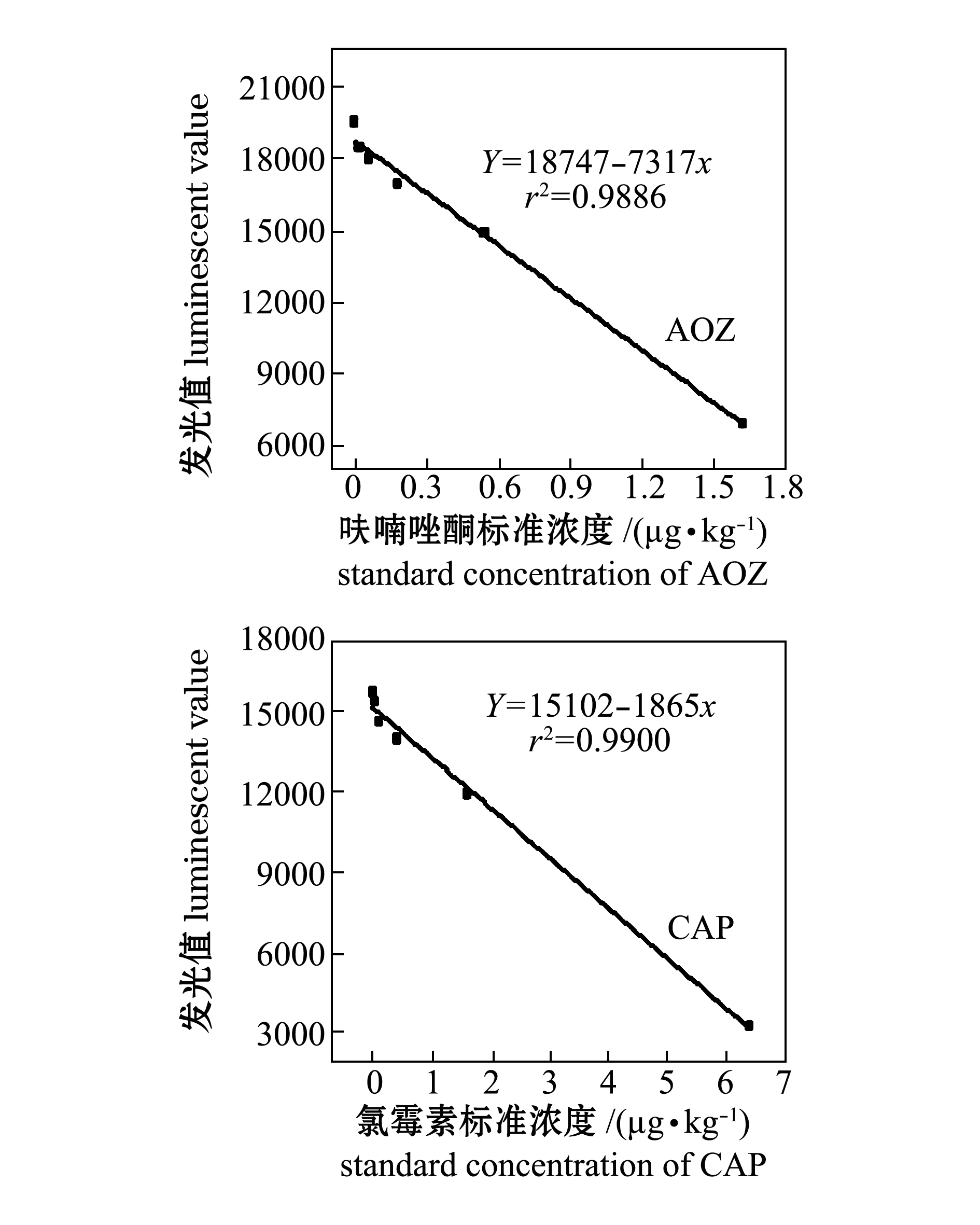
2.4用CLEIA法检测水产品中CAP和AOZ的标准曲线和检出限
测定 20 份空白仿刺参样品中CAP和AOZ的含量,计算出每种样品中 CAP和AOZ 的平均值和标准差,最低检出限等于空白样品检测平均值加上3倍空白样品检测值的标准差。如图2所示,用CLEIA法检测水产品中AOZ和CAP,其线性方程分别为y=18747-7317x和y=15102-1865x,其线性范围分别为0.01~2.56、0.025~6.400 μg/kg,检出限分别为0.01、0.016 μg/kg。用ELISA法检测水产品中AOZ和CAP,检出限分别为0.10、0.05 μg/kg,线性范围分别为0.10~1.62、0.05~4.05 μg/kg。
2.5用CLEIA法检测5种水产品中CAP和AOZ的残留量
用CLEIA法检测5种水产品中CAP、AOZ的残留情况如表4所示。其中,仿刺参和海胆中未检测出CAP残留,而菲律宾蛤仔、魁蚶、虾夷扇贝3种贝类中都不同程度地检测出CAP残留。5种水产品食用组织中几乎没有AOZ的存在。
3讨论
本研究中通过对两种药物残留进行检测,结果表明,用CLEIA法检测的线性范围和检出限均优于ELISA法。马玲等[13]建立了一步式检测CAP残留的CLEIA法,最低检出限为0.01 μg/L;姚焱等[14]建立了检测猪肉中CAP含量的CLEIA法,检出限为 0.018 ng/mL,而使用ELISA法的检出限为 0.177 ng/mL。本研究中,用CLEIA法检测CAP的检出限为0.016 μg/kg,这与以上研究结果基本一致。沈美芳等[15]运用ELISA法检测水产品中AOZ代谢物,最低检出限为0.3 μg/kg,而本研究中,用CLEIA法检测水产品中AOZ的检出限为0.01μg/kg,明显优于ELISA法。
表4用CLEIA法检测出的水产品中CAP和AOZ的残留量
Tab.4TheresiduelevelsofAOZandCAPinfishandfisheryproductsbyCLEIAμg/kg
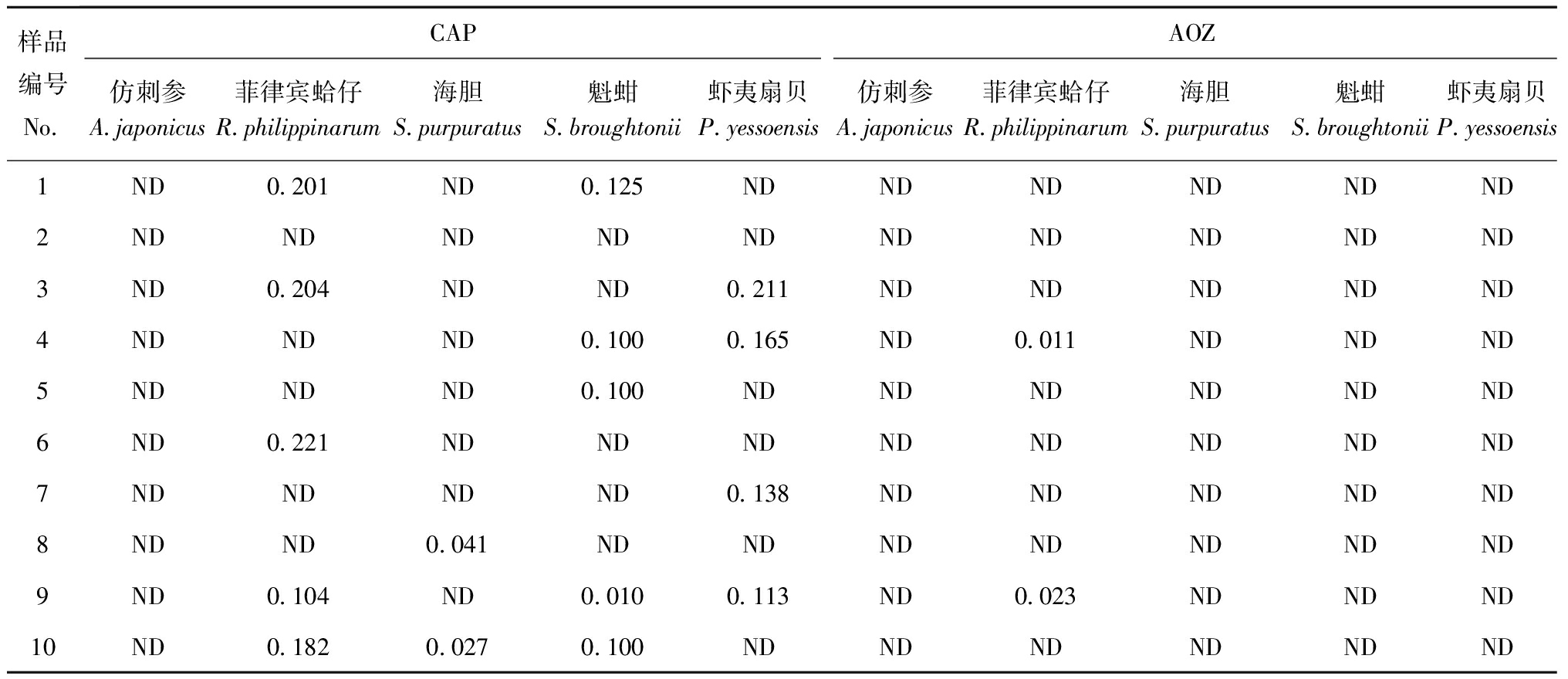
样品编号No CAPAOZ仿刺参A japonicus菲律宾蛤仔R philippinarum海胆S purpuratus魁蚶S broughtonii虾夷扇贝P yessoensis仿刺参A japonicus菲律宾蛤仔R philippinarum海胆S purpuratus魁蚶S broughtonii虾夷扇贝P yessoensis1ND0 201ND0 125NDNDNDNDNDND2NDNDNDNDNDNDNDNDNDND3ND0 204NDND0 211NDNDNDNDND4NDNDND0 1000 165ND0 011NDNDND5NDNDND0 100NDNDNDNDNDND6ND0 221NDNDNDNDNDNDNDND7NDNDNDND0 138NDNDNDNDND8NDND0 041NDNDNDNDNDNDND9ND0 104ND0 0100 113ND0 023NDNDND10ND0 1820 0270 100NDNDNDNDNDND
注:ND表示未检测出
Note:ND shows not detected
通过比较批内和批间变异系数可知,CLEIA法检测两种药物的变异系数相对于ELISA法均偏高,这可能是由于发光液性能不够稳定所致,因此,需要进一步筛选优化发光系统。另外,本研究中所用发光液不含发光增敏物质,如果能在更优化的发光系统中添加发光增敏物质,可得到更高的检测灵敏度。此外,在免疫试验操作中,也应避免环境和人为操作的影响,尽量缩短前后孔的加样时间,避免漂移现象的产生,减少前后孔免疫反应的差异。虽然CLEIA法检出的变异系数较大,但其具有前处理简单、高通量、检出灵敏度高、线性范围宽等优点,使其在样品初筛检测技术中具有绝对的优势[16]。
目前,对于禁用药物CAP和硝基呋喃类代谢物,欧盟在水产品中制定的最低执法限量(Minimum required performance limit,MRPL)分别为0.3、1.0 μg/kg,中国规定为不得检出,但中国检测分析的灵敏度和检测方法与欧盟存在一定的差距,水产品质量不符合欧盟的要求,出口水产品屡遭受阻,经济损失严重。中国农业部规定:用ELISA法检测动物源性CAP的检出限为0.05 μg/kg,定量限为0.25 μg/kg[17],高效液相色谱-串联质谱法测定动物源食品中AOZ的检出限为0.25 μg/kg,定量限为0.5 μg/kg[18]。本研究中,3种贝类中CAP被不同程度地检出,但由于CLEIA法属于快速检测初筛法,其检出结果是否低于欧盟最低执法限量,需要用GC-MS、LC-MS等方法确证。本研究结果显示,个别地区可能还存在违规使用CAP的现象,需要相关部门加以监督;而5种水产品食用组织中几乎没有AOZ代谢物的存在,符合欧盟及中国国家标准的规定。
参考文献:
[1] 吴永宁,邵兵,沈建忠.兽药残留检测与监控技术[M].北京:化学工业出版社,2007:378-379.
[2] 柳爱春,刘超,赵芸,等.免疫胶体金法快速检测水产品中硝基呋喃类代谢物的研究[J].浙江农业学报,2013,25(1):95-102.
[3] Liu T,Xie J,Zhao J,et al.Magnetic chitosan nanocomposite used as cleanup material to detect chloramphenicol in milk by GC-MS[J].Food Analytical Methods,2014,7(4):814-819.
[4] Cronly M,Behan P,Foley B,et al.Rapid multi-class multi-residue method for the confirmation of chloramphenicol and eleven nitroimidazoles in milk and honey by liquid chromatography-tandem mass spectrometry (LC-MS)[J].Food Additives and Contaminants,2010,27(9):1233-1246.
[5] Wesongah J O,Murilla G A,Guantai A N,et al.A competitive enzyme-linked immunosorbent assay for determination of chloramphenicol[J].Journal of Veterinary Pharmacology and Therapeutics,2007,30(1):68-73.
[6] Arnold D,Somogyi A.Trace analysis of chloramphenicol residues in eggs,milk,and meat:comparison of gas chromatography and radioimmunoassay[J].Journal-Association of Official Analytical Chemists,1985,68(5):984-990.
[7] 陈小雪,张林田,相大鹏,等.水产品中氯霉素残留的放射免疫分析[J].检验检疫科学,2006,16(3):19-21.
[8] 高彬文,张素霞,沈建忠,等.化学发光酶联免疫法检测鱼虾中氯霉素残留[J].2007,43(5):68-69.
[9] 王硕,李细芬,生威,等.增强化学发光酶免疫法对猪肉中盐酸克伦特罗的检测[J].分析测试学报,2010,29(3):215-219.
[10] 吕小虎,路明刚.过氧化氢-次氯酸钠氧化鲁米诺发光的研究[J].光谱学与光谱分析,1994,14(1):123-127.
[11] Gion M,Mione R,Leon A E,et al.Comparison of the diagnostic accuracy of CA27.29 and CA15.3 in primary breast cancer[J].Clinical Chemistry,1999,45(5):630-637.
[12] 吕丽,郑峻峰,张峰,等.大连地区几种食用贝类药物残留的检测[J].水产学杂志,2011,24(4):29-32.
[13] 马玲,关忠谊,吴敏健.氯霉素残留一步式化学发光酶免疫法的建立[J].南方农业学报,2011,42(2):205-208.
[14] 姚焱,吴海珍,陈键.化学发光酶免疫分析(CLEIA) 法测定猪肌肉组织中的氯霉素含量[J].农业灾害研究,2012,2(2):42-44.
[15] 沈美芳,宋红波,耿雪冰,等.酶联免疫法测定水产品中呋喃唑酮代谢物AOZ的残留[J].水产学报,2006,30(4):520-524.
[16] 林斯,许文革,刘一兵.氯霉素酶促化学发光免疫分析方法的建立[J].中国核科技报告,2007(1):186-195.
[17] 中华人民共和国农业部.农业部1025号公告-26—2008 动物源性食品中氯霉素残留检测 酶联免疫吸附法[S].北京:中国标准出版社,2008.
[18] 中华人民共和国农业部.农业部781号公告-4—2006 动物源食品中硝基呋喃类代谢物残留量的测定 高效液相色谱-串联质谱法[S].北京:中国标准出版社,2006.
Detectionofdrugresiduesinfishandfisheryproducts:comparisonbetweenchemiluminescenceenzyme-linkedimmunoassayandenzymelinkedimmunosorbentassay
SAREN Tuoya,ZHANG Feng,ZHENG You-hu,LU Ya-nan
(College of Fisheries and Life Science,Key Laboratory of Marine Bio-resource Restoration and Habitat Reparation in Liaoning Province,Dalian Ocean University,Dalian 116023,China)
Abstract:Detection of furazolidone metabolite (AOZ) and chloramphenicol(CAP) residues in fish and fishery products was comparatively studied by chemiluminescence enzyme-linked immunoassay(CLEIA) and traditional colorimetric enzyme-linked immunosorbent assay (ELISA). The results showed that CLEIA had better linear range and detection limit than ELISA, and a close correlation of recovery rate was shown in the two methods. In CLISA, the detection limit was about 0.01 μg/kg for AOZ, and about 0.016 μg/kg for CAP and the linear range was from 0.01 to 2.56 μg/kg for AOZ, and from 0.025 μg/kg to 6.400 μg/kg for CAP. In ELISA, however, the detection limit was 0.1 μg/kg for AOZ and about 0.05 μg/kg for CAP and the linear range was from 0.1 to 1.62 μg/kg for AOZ and from 0.05 to 4.05 μg/kg for CAP. The satisfactory precisions of the assay were found in CLEIA, with variation coefficient of 5.5%-11.3% in the intra-assay and 12.3%-20.9% in the inter-assay for CAP, and with variation coefficient of 6.6-11.1% in the intra-assay and 15.6%-18.3% in the inter-assay for AOZ, within the record reference evaluation standard of ELISA residues of veterinary drugs (kit).
Key words:chemiluminescence immunoassay; enzyme-linked immunosorbent assay; chloramphenicol; furazolidone metabolite
DOI:10.3969/J.ISSN.2095-1388.2014.05.012
文章编号:2095-1388(2014)05-0486-06
收稿日期:2014-01-02
基金项目:辽宁省农业攻关计划项目(2011215004);国家自然科学基金资助项目(30471323)
作者简介:萨仁托雅(1989—), 女, 硕士研究生。E-mail:magituoya@163.com
通信作者:张峰(1957—), 男, 博士, 教授。E-mail:Fengz57@gmail.com
中图分类号:Q954.4
文献标志码::A