小体鲟雌性亲鱼性腺不同发育时期消化酶分布及其活性的研究
徐翱1、2,刘晓勇3,张颖2,潘鹏3,孙大江2
(1.上海海洋大学 水产与生命学院,上海 201306;2.中国水产科学研究院 黑龙江水产研究所,黑龙江 哈尔滨 150070;3.中国 水产科学研究院,北京 100039)
摘要:采用酶学方法测定了不同性腺发育时期(Ⅱ~Ⅴ期)小体鲟AcipenserruthenusLinnaeus雌性亲鱼胃、肠道和幽门盲囊中蛋白酶、淀粉酶、脂肪酶的活性,并分析了3种酶活性随性腺发育时期的变化规律。结果表明:小体鲟雌性亲鱼5种消化器官中的蛋白酶活性以性腺发育Ⅱ期、Ⅲ期较高,淀粉酶活性以性腺发育Ⅴ期较高,脂肪酶活性以性腺发育Ⅴ期、Ⅱ期较高,3种酶活性均以性腺发育Ⅳ期较低;各性腺发育期,雌性亲鱼的蛋白酶活性均以幽门盲囊、后肠中较高,其次为胃、中肠,淀粉酶活性以中肠中最高,其次为胃、幽门盲囊、前肠、后肠,脂肪酶活性均以幽门盲囊中最高,其次为中肠、前肠、胃、后肠。研究表明,小体鲟雌性亲鱼在性腺发育Ⅱ期、Ⅲ期对食物中蛋白质和碳水化合物需求较高,而性腺发育周期中对脂类物质的需求Ⅴ期最高,其次是Ⅱ期,总体来说,小体鲟亲鱼在整个性腺发育时期对脂肪的需求量较高。
关键词:小体鲟;雌性亲鱼;蛋白酶;淀粉酶;脂肪酶
鲟鱼是鲟形目鱼类的统称,全球现存约27种,属大型经济鱼类,广泛分布于北回归线以北的水域中[1]。中国是鲟鱼资源较为丰富的国家之一,据记载分布有8种鲟鱼,也是全世界最大的鲟鱼养殖国家,2012年中国鲟鱼养殖产量占世界鲟鱼总产量的85%以上[2]。鲟鱼的全人工繁殖已取得成功,为规模化养殖提供了基本保证,但人工培育亲鱼的再繁殖效率(催产率、受精率、孵化率等)普遍不高[3]。亲鱼阶段作为鱼类的一个特殊生理阶段,其营养需求与成鱼和幼鱼的营养需求不同[4]。亲鱼的营养对提高产卵量、卵与仔鱼质量,促进仔稚鱼生长与存活等均具有重要作用,而亲鱼培育质量和繁殖效果主要取决于培育环境和配合饲料的质量,所以优化亲鱼饲料有助于提高其繁殖性能[5-6]。消化系统分泌的消化酶活力的高低直接影响亲鱼对营养物质的消化能力,从而影响性腺的发育[7-8]。有关水产动物繁殖期消化酶的研究,仅见对中国明对虾、中华绒螯蟹和九孔鲍等的研究[9-10]。有关鲟鱼养殖和人工繁殖技术方面的研究报道较多,而对消化能力和营养需求等方面的研究较少,仅见Fabio 等[11]对高首鲟Acipensertransmontanu、张颖等[12]对施氏鲟Acipenserschrenckii等的研究。对鲟鱼消化酶的研究多集中于消化酶的种类、性质,幼体发育不同阶段酶活力的变化,以及水环境因子、饵料对消化酶的影响等方面[13-15],对鲟亲鱼不同性腺发育时期相关营养需求的研究目前尚未见报道。本研究中,以小体鲟AcipenserruthenusLinnaeus亲鱼为对象,研究其性腺不同发育阶段的消化酶活性,为了解和掌握鲟亲鱼不同发育阶段的营养生理需求,科学配制亲鱼饲料和制定合理饲育策略,提高人工繁殖效率提供基础依据。
1材料与方法
1.1材料
试验用鱼均为中国水产科学研究院鲟鱼繁育技术工程中心的小体鲟亲鱼,试验鱼为7龄性成熟亲鱼,从2012年6月25日至2013年3月25日共进行4次采样,每次间隔3个月,共采集12尾雌鱼,体长为(65±5)cm,体质量为(2.75±0.5)kg。
1.2方法
1.2.1 样品的制备 将试验鱼置于冰盘上活体解剖,取出全部消化器官,剔除其上的结缔组织和脂肪,分离出胃、幽门盲囊和肠道,并将肠道的前肠、中肠和后肠分装,用预冷生理盐水快速冲洗,清除内容物并用脱脂棉小心揩干,放入冰箱(-80 ℃)中保存备用。
1.2.2 卵巢发育分期和肠道前中后肠的界定 卵巢发育分期依据苏联学者桀特拉弗等[16]提出的分期标准,以观察外部形态和显微镜下观察组织压片相结合的方法来确定,将卵巢发育分为Ⅱ~Ⅵ期。卵巢发育各期的界定,是以在卵巢切面中所占面积超过50%的生殖细胞的时相为准。
鲟鱼肠道通常分为前肠、中肠、后肠,胃向后和幽门盲囊与十二指肠连接处为前肠,呈“乙”状弯曲;前肠先从右往左拐,后又形成一个弯曲,此弯曲部分即为中肠,中肠部分比较短并较前肠细;肠管的最后一个弯曲处为中肠与后肠的分界点,后肠是十二指肠后面较粗的瓣肠部分,其内约有7 个螺旋瓣,后肠向肛门处逐渐缩小[17-18]。
1.2.3 酶液的制备 将已经处理好的胃、幽门盲囊、前肠、中肠、后肠取出,放在滤纸上去冰,分别称重,按质量与体积比为1∶9(g∶mL)在样品中加入0.85%预冷的生理盐水,用高速组织匀浆机在冰浴中匀浆,所得匀浆液在4 ℃下以3500 r/min离心15 min,提取组织匀浆上清液即为消化酶样品,置于冰箱(-80 ℃)中保存,6 d内测定完毕。
1.2.4 酶活性的测定 样品的蛋白浓度、蛋白酶、淀粉酶和脂肪酶活性均采用南京建成生物工程研究所的相应试剂盒进行测定。
蛋白酶活性单位定义:每毫克组织蛋白37 ℃下每分钟分解蛋白生成1 μg氨基酸相当于1个酶活力单位。
脂肪酶活性单位定义:在37 ℃条件下,每克组织蛋白在反应体系中与底物反应1 min,每消耗1 μmol底物为1个酶活力单位。
淀粉酶活性单位定义:组织中每毫克蛋白在37 ℃下与底物作用30 min,水解10 mg淀粉为1个酶活力单位。
1.3数据处理
试验数据用Microsoft Excel和SPSS Statistics 17.0软件进行统计分析,描述性统计值使用平均值±标准差(mean±S.D.)表示,采用Duncan’s 法进行多重比较,显著性水平设为0.05。
2结果与分析
2.1小体鲟雌性亲鱼蛋白酶活性的变化
从表1可见:小体鲟雌性亲鱼性腺发育过程中,5种消化器官中的蛋白酶活性均无显著性差异(P>0.05),蛋白酶活性均以幽门盲囊、后肠中较高,其次为胃、中肠,前肠最低;不同性腺发育时期,各消化器官中的蛋白酶活性均以性腺发育Ⅱ期、Ⅲ期较高,Ⅳ期较低,其中胃和幽门盲囊中的蛋白酶活性性腺发育Ⅱ期显著高于其他发育时期(P<0.05),其余组织各性腺发育期间均无显著性差异(P>0.05)。
表1小体鲟雌性亲鱼不同消化器官中的蛋白酶活性
Tab.1ProteaseactivitiesindifferentorgansoffemalesterletbroodstocksU/mg
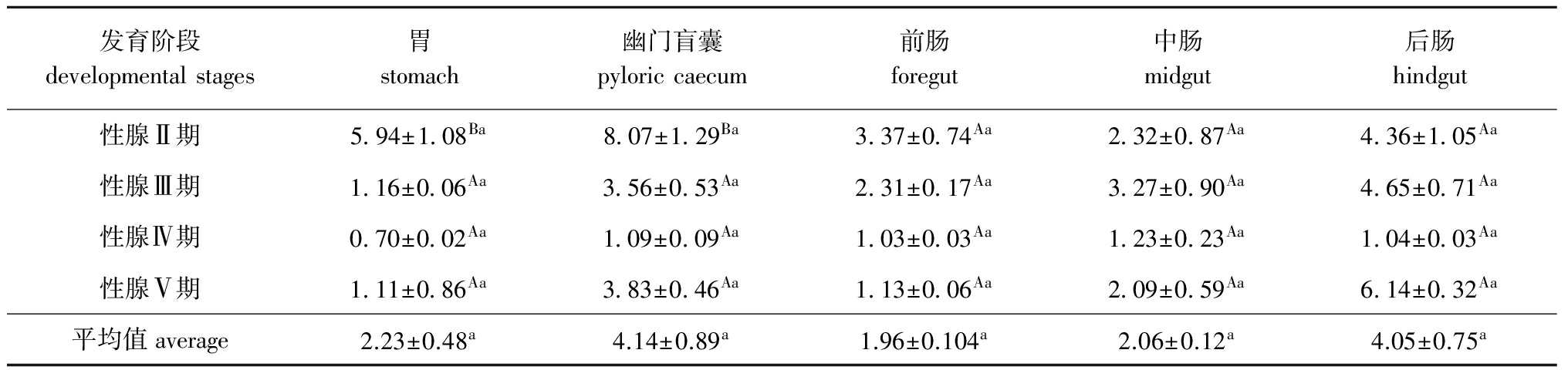
发育阶段developmentalstages胃stomach幽门盲囊pyloriccaecum前肠foregut中肠midgut后肠hindgut性腺Ⅱ期5 94±1 08Ba8 07±1 29Ba3 37±0 74Aa2 32±0 87Aa4 36±1 05Aa性腺Ⅲ期1 16±0 06Aa3 56±0 53Aa2 31±0 17Aa3 27±0 90Aa4 65±0 71Aa性腺Ⅳ期0 70±0 02Aa1 09±0 09Aa1 03±0 03Aa1 23±0 23Aa1 04±0 03Aa性腺Ⅴ期1 11±0 86Aa3 83±0 46Aa1 13±0 06Aa2 09±0 59Aa6 14±0 32Aa平均值average2.23±0.48a4.14±0.89a1.96±0.104a2.06±0.12a4.05±0.75a
注:不同小写字母表示同一性腺发育时期不同消化器官间有显著性差异(P<0.05),不同大写字母表示同一消化器官不同性腺发育时期间有显著性差异(P<0.05),标有相同字母组间表示无显著性差异(P>0.05),下同
Notes: Different letters indicate significant differences in different organs (P<0.05), different capital letters represent significant differece in different developmental stages of the gonad (P<0.05), and the same letters denote no significant difference(P>0.05),et sequentia
2.2小体鲟雌性亲鱼淀粉酶活性的变化
从表2可见:小体鲟雌性亲鱼性腺发育过程中,5种消化器官中的淀粉酶活性以中肠最高,依次为中肠、胃、幽门盲囊、前肠、后肠,其中性腺发育Ⅱ期中,中肠的淀粉酶活性显著高于前肠(P<0.05),性腺发育Ⅳ期中,中肠的酶活性显著高于其他器官(P<0.05),其余性腺发育时期,各器官中的酶活性均无显著性差异(P>0.05);不同性腺发育时期,各消化器官中的淀粉酶活性均以性腺发育Ⅴ期较高,Ⅳ期较低(中肠除外),其中胃和前肠中的淀粉酶活性Ⅴ期显著高于Ⅳ期(P<0.05),其余组织各发育期间均无显著性差异(P>0.05)。
表2小体鲟雌性亲鱼不同消化器官中的淀粉酶活性
Tab.2AmylaseactivitiesindifferentorgansoffemalesterletbroodstocksU/mg

发育阶段developmentalstages胃stomach幽门盲囊pyloriccaecum前肠foregut中肠midgut后肠hindgut性腺Ⅱ期0 66±0 08ABab0 58±0 06Aab0 39±0 14ABa0 78±0 27Bb0 68±0 07Bb性腺Ⅲ期0 59±0 13ABa0 71±0 11Aa0 71±0 41ABa0 89±0 19Ba0 53±0 24ABa性腺Ⅳ期0 35±0 09Ab0 36±0 05Ab0 17±0 01Aa0 96±0 11Bc0 41±0 09ABb性腺Ⅴ期1 68±1 47Ba0 90±0 59Aa0 91±0 45Ba1 08±0 11Ba0 42±0 04ABa平均值average0.82±0.08a0.64±0.03a0.54±0.03a0.93±0.12a0.51±0.02a
2.3小体鲟雌性亲鱼脂肪酶活性的变化
从表3可见:小体鲟雌性亲鱼性腺发育过程中,5种消化器官中的脂肪酶活性以幽门盲囊最高,其次是中肠、前肠和胃,后肠最低,其中各性腺发育时期中,后肠中的酶活性均显著低于其他各器官(P<0.05);不同性腺发育时期,各消化器官中的脂肪酶活性以Ⅴ期、Ⅱ期较高,Ⅳ期较低(后肠除外),其中胃中的酶活性Ⅴ期显著高于其他发育期(P<0.05);幽门盲囊中的酶活性Ⅴ期显著高于Ⅲ期和Ⅳ期(P<0.05),而后肠中的酶活性随性腺的发育呈递减趋势,且Ⅴ期显著低于Ⅱ期(P<0.05)。
表3小体鲟雌性亲鱼不同消化器官中的脂肪酶活性
Tab.3LipaseactivitiesindifferentorgansoffemalesterletbroodstockU/g
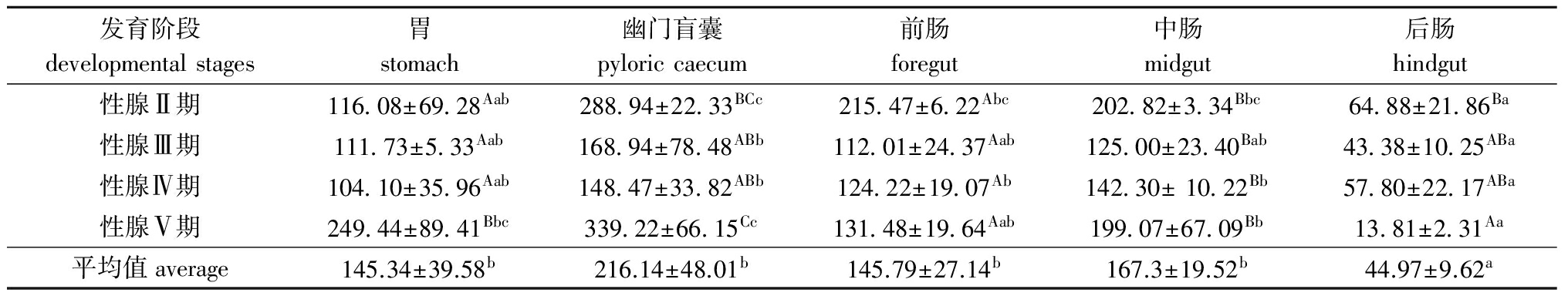
发育阶段developmentalstages胃stomach幽门盲囊pyloriccaecum前肠foregut中肠midgut后肠hindgut性腺Ⅱ期116 08±69 28Aab288 94±22 33BCc215 47±6 22Abc202 82±3 34Bbc64 88±21 86Ba性腺Ⅲ期111 73±5 33Aab168 94±78 48ABb112 01±24 37Aab125 00±23 40Bab43 38±10 25ABa性腺Ⅳ期104 10±35 96Aab148 47±33 82ABb124 22±19 07Ab142 30±10 22Bb57 80±22 17ABa性腺Ⅴ期249 44±89 41Bbc339 22±66 15Cc131 48±19 64Aab199 07±67 09Bb13 81±2 31Aa平均值average145.34±39.58b216.14±48.01b145.79±27.14b167.3±19.52b44.97±9.62a
3讨论
3.1小体鲟亲鱼消化酶分布的特点
研究资料表明,鲟科鱼类的胃、肠道结构与其他鱼类不同,导致其胃、肠道的消化酶活性也与其他鱼类具有一定的差异性。鲟鱼的胃具有较厚的肌层,肠道较短,具有特殊的螺旋瓣状结构[19-23],这种结构相当于增加了肠道的长度,延长了食物在肠道中停留的时间,有利于营养物质的消化吸收,因此,其肠道消化酶活性要高于其他消化器官,但也具有一定的种属特异性。
鲟科鱼类的蛋白酶组织活性具有种属特异性。叶继丹等[24]研究表明,鲟鱼的蛋白酶和脂肪酶活性均以幽门盲囊中含量最高,淀粉酶活性以中肠中含量最高;伍莉等[25]对施氏幼鲟蛋白酶的研究表明,施氏鲟幽门盲囊和肠道中蛋白酶活性很高。本试验结果与上述研究结果一致,可以认为,鲟鱼对蛋白质的消化主要集中在幽门盲囊和肠道内,而胃对蛋白质的消化作用却不明显。尾崎久雄[26]研究表明,匙吻鲟胃中的蛋白酶活性显著高于其他消化器官,鱼类的幽门盲囊和肠道内在中性和弱碱性条件下存在一定量的蛋白酶活性,而胃内的蛋白酶只有在强酸条件下才能分解蛋白质,表明匙吻鲟胃内酸碱度与其他鲟科鱼类不同。
鱼类对脂肪的消化主要在其肠道的后部进行, 特别是肠道较短的肉食性鱼类, 这表明鱼类消化器官的组织结构和消化机能是与其食性相适应的[27]。本试验中,小体鲟亲鱼的脂肪酶活性以幽门盲囊最高,其次是肠道,与中华鲟和匙吻鲟幼鱼幽门盲囊的脂肪酶含量低、肠道活性高的变化规律不同,其原因可能是亲鱼的消化酶特点与幼鱼不同,表明鲟亲鱼的幽门盲囊也参与脂肪的消化。与其他鲟科鱼类的淀粉酶活性变化规律相同,小体鲟亲鱼的淀粉酶活性在各消化器官中差异不显著。
3.2小体鲟亲鱼性腺发育阶段对消化酶的影响
鱼体在不同的生长阶段,所需营养成分的含量不同,随着消化器官的相对增大,内分泌机能的增强,营养物质摄取量的增加,以及鱼类各种习性的变化,消化酶活性也产生相应的变化[28]。国内外对仔、稚鱼期消化酶的研究较多[29-30],而对亲鱼消化酶的分布特点和变化规律的研究则较少。幼鱼内源营养期消化酶活性变化总的趋势是随着消化道的逐步发育而逐渐增强,但出现顺序不同,随着不同消化组织器官的分化,各种酶活性变化规律也不同。消化酶作为消化系统分泌的影响消化作用的酶类,其种类、特性和活力在一定程度上可以反映鱼类的消化及营养生理状况,消化酶活力的高低直接影响亲鱼对营养物质的消化能力,影响性腺发育,进而影响成熟精卵的质量及幼体的存活率。因此,在鲟亲鱼性腺发育期间一定要加强亲鱼的营养。
有关鲟鱼消化酶的研究证明,随着鱼体的生长和发育,蛋白酶、淀粉酶和脂肪酶活性均成倍数增长,而脂肪酶活性的增长极为显著[31-32]。鲟鱼幼鱼幽门盲囊对脂肪的消化能力很低,在本试验中,小体鲟亲鱼幽门盲囊中脂肪酶活性很高,由此可见,此发育时期鲟亲鱼的幽门盲囊为脂肪消化的主要场所。有研究表明,在鲟鱼幼鱼消化酶活性中以蛋白酶活性最高,其次是淀粉酶和脂肪酶,而在本研究中,小体鲟亲鱼中消化酶活性与幼鱼消化酶活性相似,可以认为,在性腺发育时期的鲟亲鱼需要更多的蛋白和脂肪等物质来补充营养物质。在鲟幼鱼消化酶活性中淀粉酶的活性需求较低,虽然鱼体对碳水化合物的需求量少,但是碳水化合物是必不可少的营养物质。随着鱼体的不断生长,淀粉酶活性在不断升高,在鲟亲鱼饲料中添加适量的碳水化合物有助于鱼体的发育。
本试验结果表明,在小体鲟雌性亲鱼Ⅱ期的蛋白酶和脂肪酶活性均高于其他性腺发育时期,这可能与鲟科鱼类的Ⅱ期发育在整个繁殖周期所占时间最长有关,此时期是鲟鱼性腺发育的主要营养物质积累时期。随性腺原生质的增长,对蛋白质的需要量最大,蛋白酶和脂肪酶活性也最高。小体鲟亲鱼体内淀粉酶活性是Ⅴ期最高,此阶段为鲟亲鱼产后修复阶段,需要消耗碳水化合物等物质来促进卵巢对营养物质的消化吸收。因此,在鲟亲鱼配合饲料中,性腺发育早期要加强对蛋白质及含脂类营养物质的补充。随着鲟鱼性腺的发育,从Ⅲ期到Ⅳ期为大卵黄积累期,主要是卵黄磷蛋白和磷脂类的增长,对鲟亲鱼需要持续补充蛋白质和脂类等营养物质。在性腺发育Ⅴ期的脂肪酶活性也很高,所以在Ⅴ期鲟亲鱼饲料中也要适当添加含脂类营养物质,补充性腺发育所需的营养。有关研究证明,亲鱼饲料中的脂肪酸含量对亲鱼的产卵量、卵质量和胚胎发育都有密切的关系[33]。淀粉酶的活性伴随着性腺发育的成熟含量在不断升高,因此,在亲鱼配合饲料中添加一定的碳水化合物对亲鱼性腺发育有很大的促进作用。
由此可见,随着性腺发育的逐渐成熟,小体鲟体内需要的营养物质含量不断增加。在鲟鱼不同的生长阶段应根据其消化能力的改变,适当调整蛋白质和碳水化合物在饲料中的比例,以提高饲料的利用率[18]。在鲟亲鱼性腺发育成熟时期,更要加强鲟亲鱼的营养,使亲鱼获得足够的营养物质,提高亲鱼的繁殖性能,确保人工繁殖的效率。
参考文献:
[1] 谢忠明,孙大江,王京树.鲟鱼养殖技术[M].北京:中国农业出版社,2002:2-30.
[2] 孙大江,曲秋芝,张颖,等.中国的鲟鱼养殖[J].水产学杂志,2011,24(4):67-70.
[3] 郭澎涛,申慧卿,董小果.鲟鱼全人工繁殖技术研究的意义[J].中国水产,2009(7):31-32.
[4] 罗琳,付海利,穆祥兆,等.营养强化培育对硬头鳟亲鱼繁殖性能的影响[J].饲料工业,2010,31(24):36-38.
[5] 肖登元,梁萌青.维生素在亲鱼营养中的研究进展[J].动物营养学报,2012,12:2319-2325.
[6] 朱嘉洁.河川沙塘鳢(Odontobutispotamophila)雌鱼亲鱼营养代谢研究[D].重庆:重庆师范大学,2013:31-47.
[7] Wouters R,Lavens P,Nieto J,et al.Penaeid shrimp broodstock nutrition:an updated review on research and development[J].Aquaculture,2001,202(1):1-21.
[8] Marsden G E,McGuren J J,Hansford S W,et al.A moist artificial diet for prawn broodstock:its effect on the variable reproductive performance of wild caughtPenaeusmonodon[J].Aquaculture,1997,149(1):145-156.
[9] 吴垠,孙建明,周遵春,等.中国对虾亲虾生殖周期中消化酶活性及组织生化成分的变化[J].水产学报,2003,27(6):550-557.
[10] 姜永华,颜素芬,严正凛,等.九孔鲍性腺发育过程中消化酶活力的变化[J].水产科学,2012,31(3):125-131.
[11] Fabio C,Vittorio M M,Federica B,et al.Fatty acid composition and volatile compounds of caviar from farmed white sturgeon (Acipensertransmontanus)[J].Analytica Chimica Acta,2008,217:139-147.
[12] 张颖,孙慧武,徐伟,等.饲料卵磷脂对施氏鲟血清卵黄蛋白原、卵径及性类固醇激素水平的影响[J].中国水产科学,2010,17(4):783-790.
[13] 高露姣,陈立侨,赵晓勤,等.施氏鲟幼鱼的饥饿和补偿生长研究对消化器官结构和酶活性的影响[J].中国水产科学,2004,11(5):413-419.
[14] 白海文,张颖,李雪,等.温度对施氏鲟幼鱼摄食、生长和肠道消化酶活性的影响[J].中国水产科学,2012,19(5):799-805.
[15] 庄平,章龙珍,田宏杰,等.盐度对施氏鲟幼鱼消化酶活力的影响[J].中国水产科学,2008,15(2):198-203.
[16] 桀特拉弗 T A,金兹堡 A C.鲟鱼类的胚胎发育与其养殖问题[M].北京:科学出版社,1958:20-51.
[17] 曲秋芝,华育平,曾朝辉,等.史氏鲟消化系统形态学与组织学观察[J].水产学报,2003,27(1):1-6.
[18] 徐雪峰.中华鲟消化系统的发育及消化酶活性变化的研究[D].武汉:华中农业大学,2006.
[19] 黄瑾,熊邦喜,陈洁,等.鱼类消化酶活性与其体长、体重和水质的相关性研究[J].水生态学杂志,2012,19(2):121-126.
[20] Tan B P.Studies on protease activity of some predatory fishes in coastal area of Taihu Lake[J].Journal of Hubei Agricultural College,1995,15(2):96-98.
[21] 黄瑾,熊邦喜,陈洁,等.匙吻鲟的消化酶分布及其活性[J].华中农业大学学报,2013,32(1):110-115.
[22] 张云龙,樊启学,彭聪,等.泥鳅仔稚鱼发育期间消化酶及碱性磷酸酶比活力的变化[J].淡水渔业,2013,43(1):19-23.
[23] 王吉桥,姜志强,胡红霞.主要养殖鲟鱼的生物学特性[J].水产科学,1998,17(6):34-38.
[24] 叶继丹,卢彤岩,刘红柏,等.六种鲟鱼消化酶活性的比较研究[J].水生生物学报,2003,27(6):590-595.
[25] 伍莉,陈鹏飞,陈建.史氏鲟消化酶活性的初步研究[J].西南农业大学学报,2002,24(2):179,181-189.
[26] 尾崎久雄.鱼类消化生理.上册[M].上海:上海科学技术出版社,1983:90-93.
[27] 白晓慧,王贵英,熊传喜.不同年龄黑尾近红鲌消化酶活性比较[J].淡水渔业,2007(3):30-33.
[28] 阮国良,杨代勤,严安生.不同发育时期月鳢消化酶活性的研究[J].水生态学杂志,2010,17(1):93-97.
[29] 陈慕雁,张秀梅,连建华.大菱鲆仔稚鱼期消化酶及碱性磷酸酶活性的变化[J].中国海洋大学学报:自然科学版,2005,35(3):483-486.
[30] Chakrabartia R,Rathorea R M,Kumar S.Study of digestive enzyme activities and partial characterization of digestive proteases in a freshwater teleost,Labeorohita,during early ontogeny[J].Aquaculture Nutrition,2006,12(1):35-43.
[31] 龙勇,李林春.鲟鱼消化生理和营养需求研究进展[J].信阳农业高等专科学校学报,2007,17(3):108-111.
[32] 黄瑾,熊邦喜,陈洁,等.鱼类消化酶活性及其影响因素的研究进展[J].湖南农业科学,2011(5):129,131-141.
[33] 陈伟洲,李远友,孙泽伟,等.饲料中n-3高度不饱和脂肪酸含量对花尾胡椒鲷亲鱼组织的脂质含量和脂肪酸构成的影响[J].华南农业大学学报,2006,27(1):96-100.
ActivitiesofdigestiveenzymesatdifferentdevelopmentalstagesinsterletAcipenserruthenusLinnaeus
XU Ao1,2,LIU Xiao-yong3,ZHANG Ying2,PAN Peng3,SUN Da-jiang2
(1.College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306,China;2.Heilongjiang River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China;3.Chinese Academy of Fishery Sciences,Beijing 100039,China)
Abstract:Activities of protease, amylase and lipase were analyzed and compared in stomach, intestine and pyloric caecum in female sterletAcipenserruthenusbroodstock with different developmental phases (Ⅱ-Ⅴ). The results showed that the maximal protease activity was observed in the broodstock with Ⅱ phase ovary, and that higher protease activity in the broodstock with Ⅲ phase ovary. The amylase activity was found to be higher in the broodstock with Ⅴ phase ovary, and the lipase activity to be higher in broodstock with Ⅴ and Ⅱ phase ovaries. The minimal activities of protease, amylase and lipase were observed in the broodstock with Ⅳ phase ovary, and in the broodstock with different gonadal developmental phases higher protease activity was observed in pyloric caecum and hindgut, followed by in the stomach and midgut. The maximal amylase activity, however, was found in hindgut, followed by in the stomach, pyloric caecum, foregut and hindgut. The maximal lipase activity was observed in the pyloric caecum, and higher lipase activity was found in the intestine and stomach. The findings indicated that the sterlet broodstock with Ⅱ and Ⅲ phase ovary required more dietary protein and carbohydrate, while the sterlet broodstock with Ⅴ or Ⅱphase ovary needed more lipid. During the whole gonadal development, the sterlet broodstock required more dietary lipid.
Key words:AcipenserruthenusLinnaeus; broodstock; protease; amylase; lipase
DOI:10.3969/J.ISSN.2095-1388.2014.05.010
文章编号:2095-1388(2014)05-0476-05
收稿日期:2013-12-23
基金项目:国家公益性行业(农业)科研专项(201003055);国家重大科技成果转化项目(ZD-2012-345);国家科技支撑计划项目(2012BAD25B10);中国水产科学研究院基本业务费资助项目(2010C013)
作者简介:徐翱(1990—), 女, 硕士研究生。E-mail:aoao2531@126.com
通信作者:孙大江(1955—), 男, 研究员。E-mail:sundajiang0451@sonu.com
中图分类号:S917.4
文献标志码::A


