2007—2012年中国罗非鱼无乳链球菌流行菌株血清型分析
李莉萍1,王瑞1,黄婷1,梁万文1,雷爱莹1,李健2,黄维义2,唐佳有1,施金谷2,甘西1,陈明1、2
(1.广西水产科学研究院 广西水产遗传育种与健康养殖重点实验室,广西 南宁 530021;2.广西大学 动物科学技术学院,广西 南宁 530005)
摘要:采用PCR血清型鉴定方法,对2007—2012年从广西、广东、海南、福建和云南等地养殖的罗非鱼Oreochromisniloticus中分离获得的168株无乳链球菌Streptococcusagalactiae流行菌株的血清型进行分析。结果表明:有159株为Ⅰa血清型,6株为Ⅰb血清型,3株为Ⅲ血清型。各区域流行菌株血清型也存在差异:从广西自治区7个地区50个养殖场的罗非鱼中分离的61株无乳链球菌中,有54株为Ⅰa型,4株为Ⅰb型,3株为Ⅲ型;从广东省10个地区59个养殖场的罗非鱼中分离的64株无乳链球菌中,有63株为Ⅰa型,1株为Ⅰb型;从海南省5个地区26个养殖场的罗非鱼中分离的33株无乳链球菌中,有32株为Ⅰa型,1株为Ⅰb型;从福建省漳州6个养殖场的罗非鱼中分离的6株和从云南省文山4个养殖场的罗非鱼中分离的4株均为Ⅰa型。研究表明,2007—2012年中国罗非鱼链球菌病流行菌株血清型存在Ⅰa、Ⅰb和Ⅲ 3种血清型,Ⅰa型为主要血清型,研究结果可为准确分析中国罗非鱼链球菌病流行规律和特点提供数据,为该病防治及疫苗候选菌株筛选提供理论基础。
关键词:罗非鱼;无乳链球菌;血清型
2009—2012年中国养殖罗非鱼Oreochromisniloticus大面积暴发流行链球菌病,累计死亡率为30%~90%,每年给罗非鱼养殖业造成经济损失10~15亿元,严重影响了该产业的健康发展。该病发病区域逐年扩大,发病率和死亡率逐年递增,染病罗非鱼的规格逐年增大,以前不易感染链球菌的鱼苗也出现大批死亡[1-5]。每年都有新的流行病状出现,从之前感染链球菌的罗非鱼出现突眼、游姿异常等症状到出现无任何明显症状即发生死亡,不同区域的菌株致病力、药物敏感性和耐药性均存在差异[6]。2009年前部分养殖区域还可以用抗生素控制部分病情,但2010年之后抗生素几乎不产生实际效果,多数养殖户只能选择停料处理。疫苗是防治该病的有效途径,但据报道疫苗在不同养殖场使用时,其免疫保护率差异较大,有些养殖场的疫苗保护率仅达到50%,还有些养殖场完全无法显示免疫保护作用[7-10]。
对罗非鱼链球菌病流行菌株进行血清型鉴定有助于掌握病原的起源、分布和传播等流行病学信息,科学地选择有效的疫苗和防治措施。目前,国内关于罗非鱼链球菌病流行菌株血清型分析的研究较少,郭玉娟等[4]对2007年、2008年分别从福建省和海南省分离获得的各2株无乳链球菌和2009—2010年从广东省肇庆市8个养殖场的罗非鱼中分离获得的21株无乳链球菌进行分子血清型鉴定,结果全部鉴定为Ⅰa型;Ye等[11]2009—2010年对从广东省5个地区的10个养殖场和海南省3个地区的6个养殖场的罗非鱼中分离获得的14株无乳链球菌进行分子血清型鉴定,结果同样全部是Ⅰa型。上述两项研究的流行菌株主要集中于部分省市的部分区域,而罗非鱼链球菌病流行情况近些年发生的巨大变化和区域差异,提示流行菌株可能存在差异性和多样性。因此,有必要对中国罗非鱼链球菌病进行更全面的流行菌株分离鉴定及血清型分析。本研究中,采用PCR方法对广西水产遗传育种与健康养殖重点实验室2007—2012年从广西、广东、海南、福建和云南5省罗非鱼主养区145个养殖场的罗非鱼中分离到的168株无乳链球菌进行血清型分析,旨在掌握罗非鱼无乳链球菌流行菌株血清型及流行病学情况,为该病的防治及疫苗研发提供科学依据。
1材料与方法
1.1材料
血平板购自郑州安图绿科生物工程有限公司;TSB培养基购自杭州微生物试剂有限公司;细菌DNA抽提试剂盒为天根生化科技有限公司产品;引物由宝生物工程(大连)有限公司合成;Taq DNA聚合酶、10×buffers、dNTPs、DL2000 Maker均为宝生物工程(大连)有限公司产品;Gel-red核酸染料购自Biotium公司。
罗非鱼链球菌病流行菌株为广西水产遗传育种与健康养殖重点实验室于2007—2012年从广西、广东、海南、福建和云南罗非鱼养殖场的罗非鱼中分离的链球菌病流行菌株,经生化鉴定及特异性PCR验证,其中168株为无乳链球菌,详细记录菌株相关信息后,于冰箱(-80 ℃)中保存备用。
1.2方法
细菌DNA的抽提:从冰箱中取出无乳链球菌,环划线接种于血平板上。待平板上长出单个菌落时,染色镜检,确认无污染之后,挑取单个菌落置于TSB液体培养基中,于28 ℃下培养24 h,取1.5 mL菌液,以9000 r/min离心10 min,弃上清,按细菌DNA抽提试剂盒说明书提取菌体DNA,-20 ℃下保存备用。
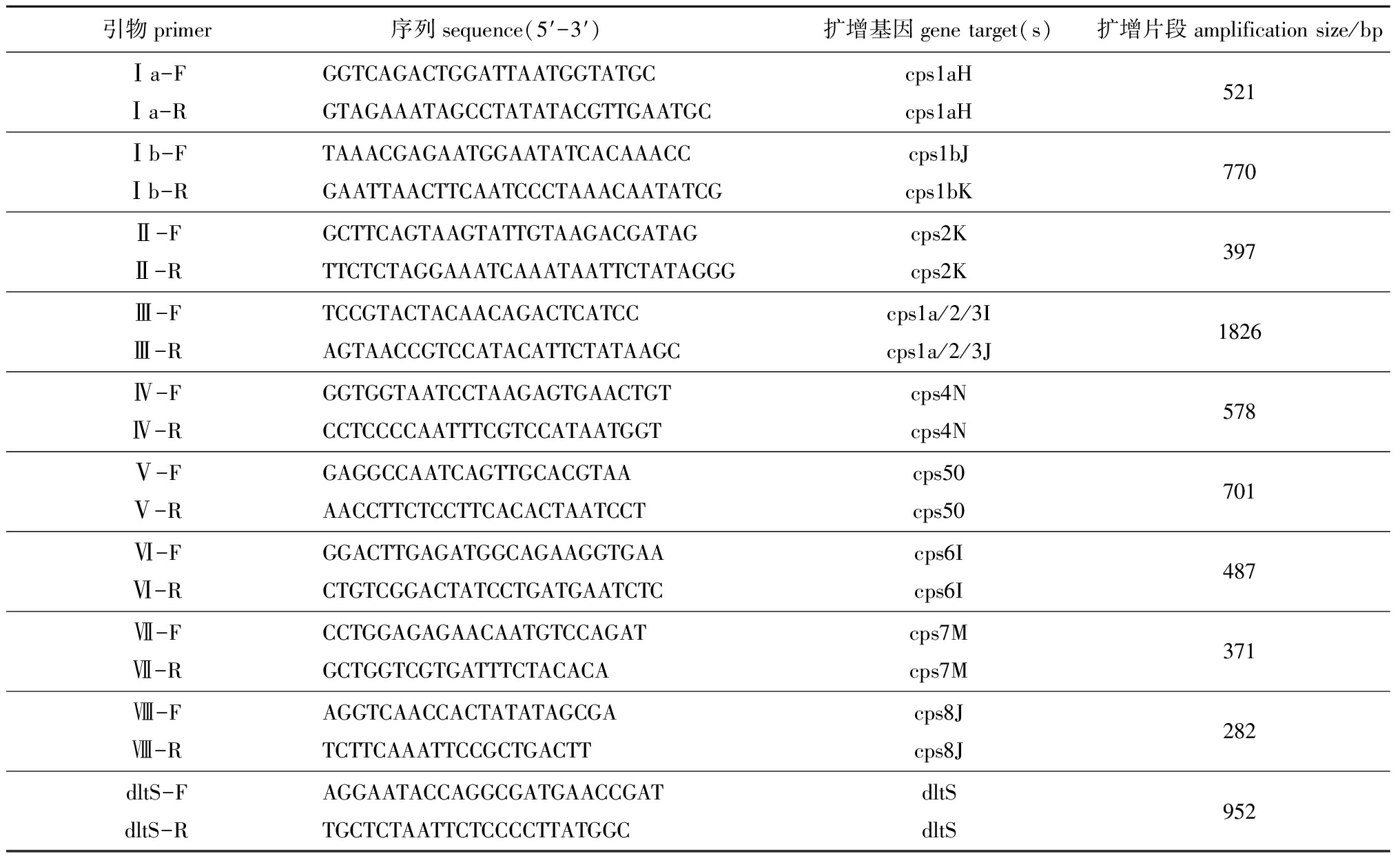
PCR扩增: 按文献[12]中报道的10种血清型特异性引物序列合成引物(表1)。
表1无乳链球菌血清型特异性引物序列和PCR扩增产物片段
Tab.1Sequenceofserotype-specificprimersandPCRproductsofamplificationinStreptococcusagalactiae
引物primer 序列sequence(5′-3′)扩增基因genetarget(s)扩增片段amplificationsize/bpⅠa-FⅠa-RGGTCAGACTGGATTAATGGTATGCGTAGAAATAGCCTATATACGTTGAATGCcps1aHcps1aH521Ⅰb-FⅠb-RTAAACGAGAATGGAATATCACAAACCGAATTAACTTCAATCCCTAAACAATATCGcps1bJcps1bK770Ⅱ-FⅡ-RGCTTCAGTAAGTATTGTAAGACGATAGTTCTCTAGGAAATCAAATAATTCTATAGGGcps2Kcps2K397Ⅲ-FⅢ-RTCCGTACTACAACAGACTCATCCAGTAACCGTCCATACATTCTATAAGCcps1a/2/3Icps1a/2/3J1826Ⅳ-FⅣ-RGGTGGTAATCCTAAGAGTGAACTGTCCTCCCCAATTTCGTCCATAATGGTcps4Ncps4N578Ⅴ-FⅤ-RGAGGCCAATCAGTTGCACGTAAAACCTTCTCCTTCACACTAATCCTcps50cps50701Ⅵ-FⅥ-RGGACTTGAGATGGCAGAAGGTGAACTGTCGGACTATCCTGATGAATCTCcps6Icps6I487Ⅶ-FⅦ-RCCTGGAGAGAACAATGTCCAGATGCTGGTCGTGATTTCTACACAcps7Mcps7M371Ⅷ-FⅧ-RAGGTCAACCACTATATAGCGATCTTCAAATTCCGCTGACTTcps8Jcps8J282dltS-FdltS-RAGGAATACCAGGCGATGAACCGATTGCTCTAATTCTCCCCTTATGGCdltSdltS952
目前报道的罗非鱼无乳链球菌大部分为Ⅰa型,因此,本试验中将所有菌株DNA先用Ⅰa血清型引物进行扩增,Ⅰa血清型引物扩增不出的菌株再用Ⅰb血清型引物进行扩增,Ⅰb血清型引物还未扩增出的菌株再用Ⅲ血清型引物进行扩增,另外再用其余7种血清型引物分别对所有代表菌株DNA混合物进行扩增辅助验证。通过对PCR扩增的退火温度、引物浓度、dNTP浓度和Taq DNA聚合酶浓度进行优化,最终确定PCR反应体系为50 μL,包括:10×Ex Taq Buffer(Mg2+Plus)5.0 μL,2.5 mmol/L dNTP 2.0 μL,引物各2.0 μL,DNA模板2.0 μL(约50 ng),5 U/μL Ex Taq(TaKaRa公司)1.0 μL,ddH2O 36.0 μL。PCR反应条件:94 ℃下预变性5 min;94 ℃下变性45 s,58 ℃下退火1 min,72 ℃下延伸60 s,共进行35个循环;最后在72 ℃下再延伸10 min。PCR阳性扩增产物送宝生物工程(大连)有限公司进行测序。
2结果与分析
2.1PCR血清型分析
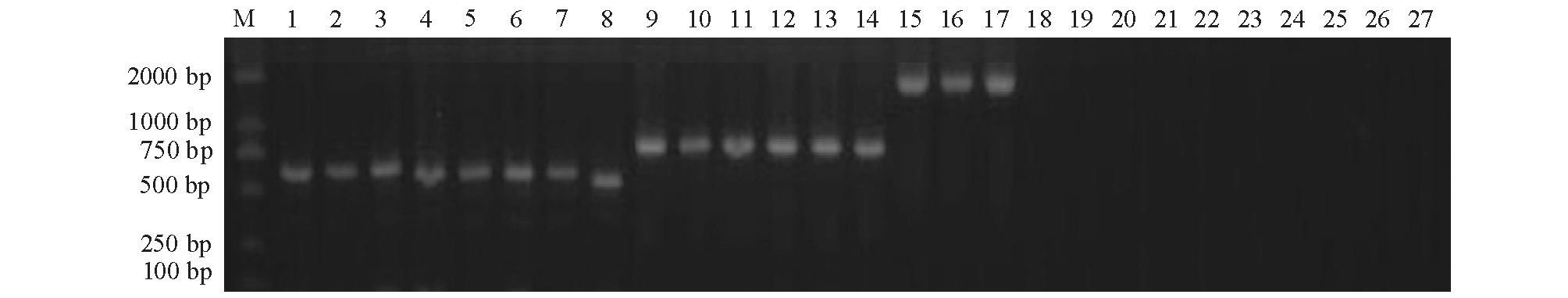
8株Ⅰa血清型代表菌株、6株Ⅰb血清型菌株和3株Ⅲ血清型菌株的特异PCR扩增结果见图1。8株Ⅰa血清型代表菌株扩增出521 bp的特异性片段(孔1~8),6株Ⅰb血清型菌株扩增出770 bp特异性片段(孔9~14),3株Ⅲ血清型菌株扩增出1826 bp特异性片段(孔15~17),空白对照未扩增出条带(孔18~20),其余7种血清型引物对所有代表菌株DNA混合物未扩增出条带(孔21~27)。扩增目的片段测序结果在GenBank中进行Blast比对,结果显示,测序结果与GenBank中无乳链球菌相应基因序列的同源性为99%~100%。
2.2各省区罗非鱼链球菌病流行菌株血清型鉴定
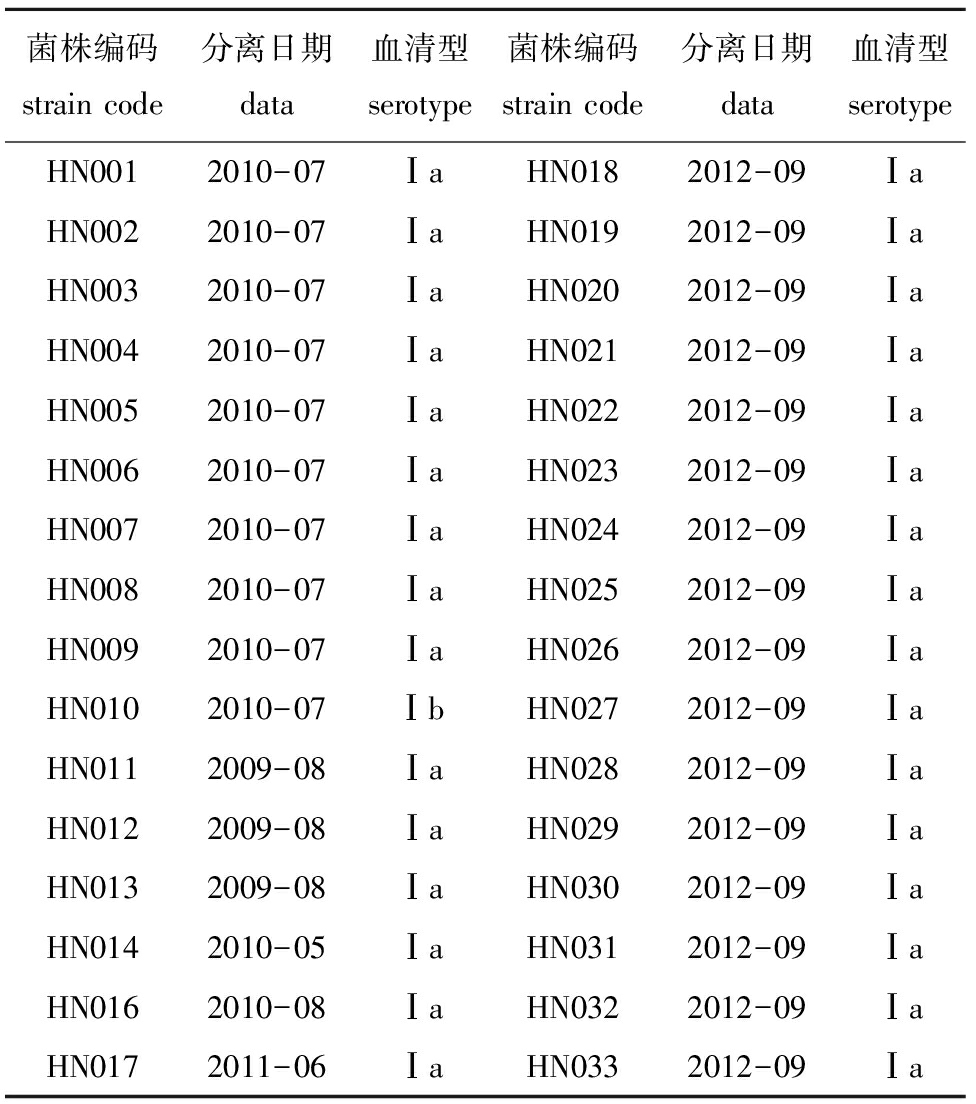
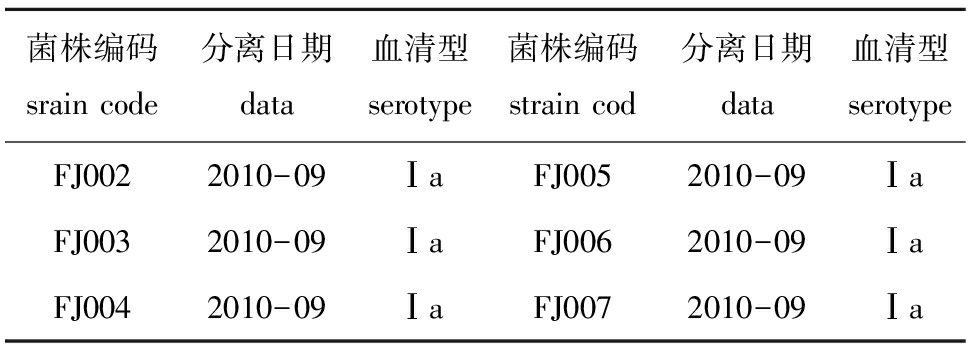
经过血清型特异性PCR分析,168株罗非鱼链球菌病流行菌株中,有159株为Ⅰa型,6株为Ⅰb型,3株为Ⅲ型。其中2007—2012年从广西南宁、北海、玉林、柳州、百色、钦州和崇左7个地区50个养殖场的罗非鱼中分离的61株无乳链球菌中,有54株为Ⅰa型,4株为Ⅰb型,3株为Ⅲ型(表2);2010—2012年从广东省茂名、湛江、珠海、阳江、惠州、汕头、揭阳、高州、化州和肇庆10个地区59个养殖场的罗非鱼中分离的64株无乳链球菌中,有63株为Ⅰa型,1株为Ⅰb型(表3);2009—2012年从海南省临高、海口、文昌、澄迈和琼海5个地区26个养殖场的罗非鱼中分离的33株无乳链球菌中,有32株为Ⅰa型,1株为Ⅰb型(表4);2010年从福建省漳州6个养殖场的罗非鱼中分离的6株和2012年从云南省文山4个养殖场的罗非鱼中分离的4株无乳链球菌,均为Ⅰa型(表5和表6)。
3讨论
根据无乳链球菌荚膜多糖的不同,可以将无乳链球菌分为Ⅰa、Ⅰb、Ⅱ~Ⅷ、dltS共10种血清型[12]。无乳链球菌传统血清型鉴定常用兰氏分类法,根据抗原与已知血清型抗体反应结果进行鉴定,如免疫沉淀、酶免疫测定、协同凝集试验、对流免疫电泳、毛细管沉淀试验等,这些方法必须有特异性血清抗体且工作量较大[13]。另外,由于荚膜多糖某些基因在不同情况下可能不表达或表达量较低,达不到与抗血清反应要求,利用传统方法鉴定可造成部分无乳链球菌菌株血清型无法分型;同时由于缺少鱼类特异性血清而使用人源标准抗血清,并且市场上也仅有6种人用血清型鉴定试剂盒,导致部分鱼源菌株不能与其反应,无法分型[14-15]。随着分子生物学的发展和无乳链球菌全基因组测序的完成,建立了多种荚膜区域血清型特异基因的检测方法并得到完善和发展,如PCR[16]、PFGE[17]、mPCR/RLB[18]方法。该类方法可在普通分子实验室条件下完成,具有分辨率高、特异性强、操作简单快速、重复性好等特点,分型结果与传统鉴定方法结果相符,并且还能鉴定出传统方法鉴定不出的血清型。其中,PCR分型方法具有高敏感性,可检测出微量的DNA,并且对DNA的纯度要求没有像酶切分析、杂交分析等那样高,可以直接对临床样品进行检验;同时PCR引物是化学合成的,具有稳定、可预测的特点,易于标准化[19]。Kong等[20]对206株无乳链球菌临床菌株进行传统方法鉴定和PCR分型比较,传统方法能够鉴定出188株(91.3%),而PCR分型可以鉴定出所有菌株,同时用PCR分型与传统方法鉴定的188株菌株血清型完全一致。采用PCR方法对罗非鱼无乳链球菌进行血清型分析,不但操作简单快速,而且分析结果准确可靠。目前PCR分型方法主要包含3种技术,如PCR加杂交、PCR加酶切、PCR加序列分析。本研究中,主要参考Poyart等[12]无乳链球菌血清型多重PCR分型方法,该方法可检测出10种已知血清型。但该文献并未报道此多重PCR的反应体系和反应条件,向该文作者咨询也未予回复。为保证试验结果的准确可靠,根据目前报道的罗非鱼无乳链球菌分为3个血清型(Ⅰa、Ⅰb和 Ⅲ)[21-22],本试验中对PCR反应进行了合理设计和优化。所有菌株的DNA先用Ⅰa型引物扩增,Ⅰa型引物扩增不出的菌株再用Ⅰb型引物扩增,Ⅰb型引物还未扩增出的菌株再用Ⅲ型引物扩增,最后用其余7种血清型引物分别对所有代表菌株的DNA混合物扩增辅助验证。通过研究发现,退火温度为58 ℃,退火时间为1 min时,3个血清型均能扩增出特异目的片段,PCR产物测序结果证明,扩增条带为目的序列,证明建立的方法准确可靠。
表2 2007—2012年从广西自治区分离获得的罗非鱼无乳链球菌流行菌株信息表
Tab.2InformationonepidemicstrainsofS.agalactiaeisolatedfromNiletilapiainGuangxiduring2007—2012
菌株编码straincode分离日期data血清型serotype菌株编码straincode分离日期data血清型serotypeGX0152007-06ⅠbGX0562012-08ⅠaGX0262009-09ⅠbGX0572012-08ⅠaGX0272010-07ⅠaGX0582012-08ⅠaGX0282010-08ⅠaGX0592012-08ⅠaGX0292010-08ⅠaGX0602012-08ⅠaGX0302010-08ⅠaGX0612012-08ⅠaGX0312010-09ⅠaGX0622012-08ⅠaGX0322010-10ⅠbGX0632012-08ⅠaGX0332011-07ⅢGX0642012-08ⅢGX0342011-07ⅠaGX0652012-08ⅠaGX0352011-08ⅠaGX0662012-08ⅠaGX0362011-08ⅠaGX0682012-08ⅠaGX0372011-08ⅠaGX0692012-08ⅠaGX0382011-08ⅠaGX0702012-08ⅠaGX0392011-08ⅠaGX0732012-08ⅠaGX0402011-08ⅠaGX0742012-08ⅠaGX0412011-08ⅠaGX0752012-08ⅠaGX0422011-08ⅠaGX0762012-08ⅠaGX0432011-08ⅠaGX0772012-08ⅠaGX0442011-08ⅠaGX0782012-08ⅠaGX0452011-08ⅠaGX0792012-08ⅠaGX0462011-08ⅠaGX0802012-08ⅠbGX0472011-08ⅠaGX0812012-09ⅠaGX0482011-08ⅠaGX0822012-09ⅠaGX0492012-07ⅠaGX0832012-09ⅠaGX0502012-07ⅠaGX0842012-09ⅠaGX0512012-08ⅠaGX0852012-09ⅠaGX0522012-08ⅠaGX0862012-09ⅠaGX0532012-08ⅠaGX0872012-09ⅢGX0542012-08ⅠaGX0882012-09ⅠaGX0552012-08Ⅰa
表3 2010—2012年从广东省分离获得的罗非鱼无乳链球菌流行菌株信息表
Tab.3InformationonepidemicstrainsofS.agalactiaeisolatedfromNiletilapiainGuangdongProvinceduring2010—2012
菌株编码straincode分离日期data血清型serotype菌株编码straincode分离日期data血清型serotypeGD0012010-08ⅠaGD0352011-08ⅠaGD0022010-08ⅠaGD0362011-08ⅠaGD0032010-08ⅠaGD0372011-08ⅠaGD0042010-08ⅠbGD0382011-08ⅠaGD0052010-08ⅠaGD0392011-08ⅠaGD0062010-08ⅠaGD0402011-08ⅠaGD0072010-08ⅠaGD0412011-08ⅠaGD0082010-08ⅠaGD0422011-08ⅠaGD0092010-08ⅠaGD0432011-08ⅠaGD0102010-08ⅠaGD0442011-08ⅠaGD0112010-08ⅠaGD0452011-08ⅠaGD0122010-08ⅠaGD0462011-08ⅠaGD0132010-08ⅠaGD0472011-08ⅠaGD0142010-08ⅠaGD0482011-08ⅠaGD0152010-08ⅠaGD0492011-08ⅠaGD0162010-08ⅠaGD0502011-08ⅠaGD0172010-08ⅠaGD0512011-08ⅠaGD0182010-08ⅠaGD0522012-08ⅠaGD0192010-08ⅠaGD0532012-08ⅠaGD0202010-08ⅠaGD0542012-08ⅠaGD0212010-08ⅠaGD0552012-08ⅠaGD0222010-08ⅠaGD0562012-08ⅠaGD0232010-08ⅠaGD0572012-08ⅠaGD0242010-08ⅠaGD0582012-08ⅠaGD0252010-08ⅠaGD0592012-08ⅠaGD0262010-08ⅠaGD0602012-08ⅠaGD0272010-08ⅠaGD0612012-08ⅠaGD0282010-08ⅠaGD0622012-08ⅠaGD0292010-08ⅠaGD0632012-08ⅠaGD0302010-08ⅠaGD0642012-08ⅠaGD0312010-08ⅠaGD0652012-08ⅠaGD0322010-08ⅠaGD0662012-08Ⅰa
表4 2009—2012年从海南省分离获得的罗非鱼无乳链球菌流行菌株信息表
Tab.4InformationonepidemicstrainsofS.agalactiaeisolatedfromNiletilapiainHainanProvinceduring2009—2012
菌株编码straincode分离日期data血清型serotype菌株编码straincode分离日期data血清型serotypeHN0012010-07ⅠaHN0182012-09ⅠaHN0022010-07ⅠaHN0192012-09ⅠaHN0032010-07ⅠaHN0202012-09ⅠaHN0042010-07ⅠaHN0212012-09ⅠaHN0052010-07ⅠaHN0222012-09ⅠaHN0062010-07ⅠaHN0232012-09ⅠaHN0072010-07ⅠaHN0242012-09ⅠaHN0082010-07ⅠaHN0252012-09ⅠaHN0092010-07ⅠaHN0262012-09ⅠaHN0102010-07ⅠbHN0272012-09ⅠaHN0112009-08ⅠaHN0282012-09ⅠaHN0122009-08ⅠaHN0292012-09ⅠaHN0132009-08ⅠaHN0302012-09ⅠaHN0142010-05ⅠaHN0312012-09ⅠaHN0162010-08ⅠaHN0322012-09ⅠaHN0172011-06ⅠaHN0332012-09Ⅰa
表5 2010年从福建省分离获得的罗非鱼无乳链球菌流行菌株信息表
Tab.5InformationonepidemicstrainsofS.agalactiaeisolatedfromNiletilapiainFujianProvincein2010
菌株编码sraincode分离日期data血清型serotype菌株编码straincod分离日期data血清型serotypeFJ0022010-09ⅠaFJ0052010-09ⅠaFJ0032010-09ⅠaFJ0062010-09ⅠaFJ0042010-09ⅠaFJ0072010-09Ⅰa
表6 2012年从云南省分离获得的罗非鱼无乳链球菌流行菌株信息表
Tab.6InformationonepidemicstrainsofS.agalactiaeisolatedfromNiletilapiainYunnanProvincein2012

菌株编码straincode分离日期data血清型serotype菌株编码straincode分离日期data血清型serotypeYN012012-07ⅠaYN032012-08ⅠaYN022012-07ⅠaYN042012-08Ⅰa
目前国外报道,罗非鱼无乳链球菌血清型包括Ⅰa、Ⅰb和Ⅲ共3种血清型且以Ⅰa型为主,而国内仅报道1种血清型(Ⅰa),推测可能是由于菌株来源区域范围小,菌株分离时间跨度较窄所致。本试验中收集了从中国主要罗非鱼养殖区广东省10个地区的59个养殖场,广西自治区7个地区的50个养殖场,海南省5个地区的26个养殖场,福建省1个地区的6个养殖场,云南省1个地区的4个养殖场的罗非鱼中分离的共168株罗非鱼无乳链球菌进行血清型分析,在时间和地域上均有很好的代表性。鉴定结果显示,168株罗非鱼无乳链球菌中,Ⅰa血清型159株(占94.64%),Ⅰb血清型6株(占3.57%),Ⅲ血清型3株(占1.79%),与国外报道的罗非鱼有Ⅰa、Ⅰb和 Ⅲ 3种血清型一致。研究结果表明,中国罗非鱼无乳链球菌主要以Ⅰa血清型为主。广东、海南省有Ⅰa、Ⅰb 两种血清型,广西自治区有Ⅰa、Ⅰb和 Ⅲ 3种血清型,其他省份是否也存在多种血清型还需进一步研究。广东、海南省流行菌株比较稳定,除了2010年发现2株Ⅰb型菌株,再没有其他新血清型出现。血清型分析主要是针对细菌表面某个成分进行的,可以总体了解当地流行菌株特点及发生变异的速度和频率,但是中国罗非鱼链球菌病流行情况复杂,新病情不断出现,相同血清型菌株的抗原性及耐药性可能存在较大差异。因此,在对菌株进行血清型鉴定之后,还可利用分辨率更高的分型技术,如PFGE技术,对这些流行菌株进行分型,获得菌株之间更细微的差异信息,同时与血清型分型结果进行比较分析,进一步明确感染来源和暴发因素,分析流行规律和特点,为预防控制该病及筛选疫苗候选菌株提供参考[23-27]。
广西自治区的中国罗非鱼产量位居全国第三,近年来也一直深受链球菌危害。从2007—2009年,广西只有Ⅰb血清型,2010年出现Ⅰa血清型,2011年出现Ⅲ血清型,新血清型出现间隔时间较短。广西北海市从2007—2012年短短6年时间,出现3种血清型。特别值得注意是,在同一个养殖场、同样的时间内,可分离到2种不同血清型菌株(GX033和GX034)。北海市作为广西自治区罗非鱼养殖的主要地区,与广东、海南两省相邻,养殖苗种多从这两省购进,同时又自繁部分苗种,伴随养殖环境恶化、养殖密度增加、抗生素滥用,大大增加了流行菌株发生变异的可能性,导致血清型呈现多样性。研究证实,无乳链球菌可在人、奶牛、小鼠、蜥蜴和罗非鱼间进行交叉感染,人和奶牛的无乳链球菌都可以感染鱼[28-30]。罗非鱼链球菌也严重威胁到人类健康与安全。截至目前,在北美和亚洲已有9例罗非鱼海豚链菌感染人的病例报道,感染途径均是患者直接接触发病罗非鱼引起[31]。从2012年广西柳州市,分离到一株Ⅲ型菌株,与北海市不同,柳州市苗种引进比较单一,离其他罗非鱼主养区较远,理论上其血清型应该比较单一,但实际上并非如此。据调查,距离该菌株来源的罗非鱼养殖场100米处有一个奶牛场,而牛无乳链球菌主要血清型正是Ⅲ型[18],因此,可能是通过人员流动或水流把人、牛源的Ⅲ型无乳链球菌传染给了罗非鱼。究竟是无乳链球菌在鱼体内进行重组产生变异还是来源于人、牛源无乳链球菌,还需要进一步试验验证。但由此可能引发的公共卫生事件,却值得我们提高警惕,如国内暴发的禽流感[32-34]、猪链球菌感染人[35-37]事例,都是菌株在长期进化过程中适应环境发生变异进而引发人畜共患。因此,对罗非鱼链球菌病流行病学进行深入研究,密切注意链球菌流行菌株的变化情况,及时掌握菌株来源和传播途径,不但对罗非鱼链球菌病防治具有重要意义,也为公共卫生建设和未来应对可能由链球菌引起的突发事件提供参考依据。
参考文献:
[1] 柴家前,丁巧玲,王振龙,等.罗非鱼链球菌的分离鉴定[J].中国预防兽医学报,2002,24(1):18-20.
[2] 甘西,陈明,余晓丽,等.罗非鱼海豚链球菌16S rRNA基因的序列测定和系统进化分析[J].水产学报,2007,31(5):618-623.
[3] 祝璟琳,杨弘,邹芝英,等.海南养殖罗非鱼(Oreochromisniloticus)致病链球菌的分离、鉴定及其药敏试验[J].海洋与湖沼,2010,41(4):590-596.
[4] 郭玉娟,张德锋,樊海平,等.中国南方地区罗非鱼无乳链球菌的分子流行病学研究[J].水产学报,2012,36(3):399-406.
[5] Chen M,Li L P,Wang R,et al.PCR detection and PFGE genotype analyses of streptococcal clinical isolates from tilapia in China[J].Veterinary Microbiology,2012,159(3/4):526-530.
[6] 柯剑,赵飞,罗理,等.广东省罗非鱼主养区无乳链球菌的分离、鉴定与致病性[J].广东海洋大学学报,2010,30(3):22-27.
[7] Pretto-Giordano L G,Müller E E,Klesius P,et al.Efficacy of an experimentally inactivatedStreptococcusagalactiaevaccine in Nile tilapia (Oreochromisniloticus) reared in Brazil[J].Aquaculture Research,2010,14(10):1539-1544.
[8] Chen M,Wang R,Li L P,et al.Screening vaccine candidate strains againstStreptococcusagalactiaeof tilapia based on PFGE genotype[J].Vaccine,2012,30(42):6088-6092.
[9] Evans J J,Klesius P H,Shoemaker C A,et al.Streptococcusagalactiaevaccination and infection stress in Nile tilapia,Oreochromisniloticus[J].J Appl Aquacult,2004,16(3/4):105-115.
[10] Evans J J,Shoemaker C A,Klesius P H.Efficacy ofStreptococcusagalactiae(Group B) vaccine in tilapia(Oreochromisniloticus) by intraperitoneal and bath immersion administration[J].Vaccine,2004,22(27/28):3769-3777.
[11] Ye X,Li J,Lu M X,et al.Identification and molecular typing ofStreptococcusagalactiaeisolated from pond-cultured tilapia in China[J].Fisheries Science,2011,77(4):623-632.
[12] Poyart C,Tazi A,Reglier-Poupet H,et al.Multiplex PCR assay for rapid and accurate capsular typing of group B streptococci[J].Journal of Clinical Microbiology,2007,45(6):1985-1988.
[13] Chaffin D O,Beres S B,Yim H H,et al.The serotype of type Ⅰa and Ⅲ group B streptococci is determined by the polymerase gene within the polycistronic capsule operon[J].J Bacteriol,2000,182(16):4466-4477.
[14] Persson E,Berg S,Trollfors B,et al.Serotypes and clinical manifestations of invasive group B streptococcal infections in western Sweden 1998-2001[J].Clin Microbiol Infect,2004,10(9):791-796.
[15] Slotved H C,Kong F,Lambertsen L,et al.Serotype IX,a proposed newStreptococcusagalactiaeserotype[J].J Clin Microbiol,2007,45(9):2929-2936.
[16] Mawn J A,Simpson A J,Heard S R.Detection of the C protein gene among group B streptococci using PCR[J].J Clin Pathol,1993,46(7):633-636.
[17] Gordillo M E,Singh K V,Baker C J.Typing of group B streptococci:comparison of pulsed-field gel electrophoresis and conventional electrophoresis[J].Journal of Clinical Microbiology,1993,31(6):1430-1434.
[18] Zhao Z,Kong F,Martinez G,et al.Molecular serotype identification ofStreptococcusagalactiaeof bovine origin by multiplex PCR-based reverse line blot (mPCR/RLB) hybridization assay[J].FEMS Microbiol Lett,2006,263(2):236-239.
[19] 宋程,陈小玲.PCR技术用于病原微生物的血清型鉴定研究进展[J].中国兽药杂志,2001,35(1):56-59.
[20] Kong F,Gowan S,Martin D,et al.Serotype identification of group B streptococci by PCR and sequencing[J].J Clin Microbiol,2002,40(1):216-226.
[21] Vandamme P,Devriese L A,Pot B,et al.Streptococcusdifficileis a nonhemolytic group B,type ⅠbStreptococcus[J].Int J Syst Bacteriol,1997,47(1):81-85.
[22] Naraid S,Fanrong K,Gwendolyn L G,et al.Occurrence of rare genotypes ofStreptococcusagalactiaein cultured red tilapiaOreochromissp.and Nile tilapiaO.niloticusin Thailand-relationship to human isolates?[J] Aquaculture,2008,284(1/4):35-40.
[23] Bannerman T,Hancock G.Pulsed-Field gel electrophoresis as a replacement for bacteriophage typing ofStaphylococcusaureus[J].J Clin Microbiol,1995,33(3):551-555.
[24] 黄彦,孙贵娟,唐振柱,等.出血性大肠杆菌O157:H7的脉冲场凝胶电泳分型方法研究[J].应用预防医学,2007,13(1):19-22.
[25] Schlichting C,Branger C.Typing ofStaphylococcusaureusby pulsed-field gel electrophoresis,zymotyping,capsular typing,and phage typing:resolution of clonal relationships[J].J Clin Microbiol,1993,31(2):227-232.
[26] Harrell L,Andersen G.Genetic variability ofBacillusanthracisand related species[J].J Clin Microbiol,1995,33(7):1847-1850.
[27] Murayama O,Matsuda M,Moore J E.Studies on the genomic heterogeneity ofMicrococcusluteusstrains by macro-restriction analysis using pulsed-field gel electrophoresis[J].J Basic Microbiol,2003,43(4):337-340.
[28] Evans J J,Klesius P H,Pasnik D J,et al.HumanStreptococcusagalactiaeisolate in Nile tilapia (Oreochromisniloticus)[J].Emerg Infect Dis,2009,15(5):774-776.
[29] Pereira U P,Mian G F,Oliveira I C,et al.Genotyping ofStreptococcusagalactiaestrains isolated from fish,human and cattle and their virulence potential in Nile tilapia[J].Vet Microbiol,2010,140(1/2):186-192.
[30] Hetzel U,Konig A,Yildirim A O,et al.Septicaemia in emerald monitors (VaranusprasinusSchlegel 1839) caused byStreptococcusagalactiaeacquired from mice[J].Vet Microbiol,2003,95(4):283-293.
[31] Lau S K,Woo P C,Luk W K,et al.Clinical isolates ofStreptococcusiniaefrom Asia are more mucoid and beta-hemolytic than those from North America[J].Diagn Microbiol Infect Dis,2006,54(3):177-181.
[32] Kwon Y K,Sung H W,Joh S J,et al.An outbreak of highly pathogenic avian influenza subtype H5N1 in broiler breeders,Korea[J].J Vet Med Sci,2005,67(11):1193-1195.
[33] 郭元吉,李建国,程小斐,等.禽H9N2亚型流感病毒能感染人的发现[J].中华实验和临床病毒学杂志,1999,13:105-108.
[34] Subbarao K,Klimov A,Katz J,et al.Characterization of an avian influenza A(H5N1)virus isolated from a child with a fatal respiratory illness[J].Science,1998,279:393-396.
[35] 杨维中,余宏杰,景怀琦,等.四川省一起伴中毒性休克综合征的人感染猪链球菌2型暴发[J].中华流行病学杂志,2006,27(3):185-191.
[36] 祝小平,祖荣强,陈志海,等.四川省人感染猪链球菌病死亡病例特征分析[J].中华流行病学杂志,2005,26(9):633-635.
[37] 姚火春,陈国强,陆承平.猪链球菌1998分离株病原特性鉴定[J].南京农业大学学报,1999,22(2):67-70.
SerotypeofStreptococcusagalactiaeisolatedfromNiletilapiaOreochromisniloticusinChinafrom2007to2012
LI Li-ping1,WANG Rui1,HUANG Ting1,LIANG Wan-wen1,LEI Ai-ying1,LI Jian2,HUANG Wei-yi2,TANG Jia-you1,SHI Jin-gu2,GAN Xi1,CHEN Ming1,2
(1.Guangxi Key Laboratory of Aquatic Genetic Breeding and Healthy Aquaculture,Guangxi Academy of Fishery Sciences,Nanning 530021, China;2.Institute of Animal Science and Technology,Guangxi University,Nanning 530005,China)
Abstract:PCR typing assay was used to evaluate serotype of 168Streptococcusagalactiaeprevalent strains isolated from Nile tilapiaOreochromisniloticusin Guangxi,Guangdong,Hainan,Fujian and Yunnan provinces in China from 2007 to 2012. There were 159 strains ofⅠa,6 strains ofⅠb, and 3 strains of Ⅲ, with differences in serotypes of isolates from different regions. In the 61 strains isolated from 50 farms in 7 regions in Guangxi,54 strains were Ⅰa,4 strains Ⅰb, and 3 strains Ⅲ.There were 64 strains isolated from 59 farms in 10 regions in Guangdong, with 63 strains of Ⅰa,1 strain of Ⅰb. Thirty-three strains were isolated from 26 farms in 5 regions in Hannan, including 32 strains of Ⅰa, and 1 strains of Ⅰb. Four strains of Ⅰa were isolated from 6 farms in Zhangzhou in Fujian and Wenshan in Yunnan. The 168S.agalactiaeprevalent strains isolated from tilapia in China during 2007-2012 were identified as 3 serotypes (Ⅰa,Ⅰb and Ⅲ),with the predominant serotypeⅠa. The findings provide data for analysis of the rules and characteristics of tilapiaS.agalactiaeepidemic, and therefore provide a theoretical basis for prevention and control of the tilapia streptococcicosis and for screening vaccine candidate strains ofS.agalactiaein tilapia.
Key words:Oreochromisniloticus;Streptococcusagalactiae; serotype
DOI:10.3969/J.ISSN.2095-1388.2014.05.009
文章编号:2095-1388(2014)05-0469-07
收稿日期:2013-12-10
基金项目:广西科技发展“十二五”规划重大专项课题(桂科重14121004-2-4);广西水产遗传育种与健康养殖重点实验室开放基金资助项目(14-A-03-02);广西壮族自治区“八桂学者”专项(BGXZ-LFY-04);广西自治区水产畜牧兽医局科技计划项目(桂渔牧科1304527);广西自治区水产畜牧科技推广应用项目(桂渔牧科201452011)
作者简介:李莉萍(1979—), 女, 助理研究员。E-mail:pinglili2000@163.com
通信作者:陈明(1979—), 男, 副研究员。E-mail:cm990919@163.com;甘西(1956—), 男, 研究员。E-mail:ganxicn@163.com
中图分类号:S943
文献标志码::A