
注: M为DNA ladder;1为G基因片段;2为重组质粒经Bam H I、Xho I双酶切
Note:M,DNA ladder; 1,G gene fragment; 2, digestion production of pET-28a-G by Bam H I and Xho I enzymes
图1 鲤春病毒G基因片段扩增
Fig.1 Amplification of spring viremia of carp virus(SVCV) G gene fragment
摘要:利用原核表达系统表达纯化鲤春病毒血症病毒(SVCV)G蛋白,制备特异性单克隆抗体,扩增出鲤春病毒0504分离株G基因片段,并将其克隆至原核表达载体pET-28a(+)中,经诱导表达、裂解离心包涵体,包涵体经His Bind亲和层析柱纯化及尿素浓度梯度复性后,作为抗原免疫Balb/c小鼠,制备单克隆抗体。结果表明:成功筛选出2株稳定分泌G蛋白单克隆抗体的杂交瘤细胞株,命名为1C5、2D5,经Western-Blot检测表明,制备的单克隆抗体具有良好的特异性。本研究中成功制备的抗G蛋白单克隆抗体,可为建立新型鲤春病毒检测方法提供工具。
关键词:鲤春病毒血症病毒(SVCV);G蛋白;原核表达;单克隆抗体
鲤春病毒血症(Spring viremia of carp,SVC)是由鲤春病毒血症病毒(Spring viremia of carp virus,SVCV)引发的危害鲤科鱼类的一种急性、高致死性的传染病,目前在欧洲、美洲、亚洲广泛传播,现已造成了巨大的经济损失,世界动物卫生组织(World Organisation for Animal Health,OIE)已将其列为必须申报的疾病[1],中国在2008年颁布的动物疫病名录中将其列为一类动物疫病[2]。近年来,国内外很多学者致力于研究更加快速、准确地检测SVCV的方法。中国应用较多的检测方法有套式RT-PCR、荧光定量PCR、LAMP等,相关免疫学检测方法尚未成熟[3]。而OIE推荐的SVCV检测方法是建立在单克隆抗体基础上的间接免疫荧光(IFA)和酶联免疫吸附试验(ELISA),其中单克隆抗体具有特异性强、灵敏度高、能够大量制备的特点,可应用于开发各种诊断试剂,具有广阔的应用前景[4],而传统的制备方法是用纯化病毒作为抗原制备单克隆抗体,但病毒纯化程序较为复杂且很难筛选出特定抗原表位的单克隆抗体。随着生物技术的不断发展,用重组蛋白制备特异性单克隆抗体已成为研究趋势。糖蛋白(G)位于SVCV囊膜表面,是最主要的表面抗原,能够诱导引起鱼体产生中和抗体,参与病毒的感染[5]、免疫识别[6]和介导病毒内吞[7]等,可作为SVCV 免疫诊断的抗原,同时也是抗病毒药物作用的理想靶点。本研究中,选取并扩增鲤春病毒血症病毒(简称为鲤春病毒,下同)G基因片段,原核重组表达了G蛋白,继而制备了抗G蛋白的单克隆抗体,并对单抗进行了初步鉴定,旨在为建立新型SVCV免疫学诊断方法提供工具。
1.1材料
1.1.1 病毒、质粒和菌株 SVCV 0504毒株为辽宁省海洋生物资源恢复与生境修复重点实验室保存菌株。克隆载体pMD18-T购于TaKaRa(大连)公司,表达载体pET-28a(+)、大肠杆菌DH5α 和BL21(DE3)感受态细胞由辽宁省海洋生物资源恢复与生境修复重点实验室保存。
1.1.2 工具酶、试剂和试验动物 rTaq酶、DNA Marker购自TaKaRa(大连)公司;抗His单抗、质粒小提试剂盒、胶回收试剂盒购自天根生化科技有限公司;Bam H I酶、Xho I酶、T4DNA连接酶、蛋白Marker均购自Thermo Scientific公司;His Bind Kits购自Novagen公司;胎牛血清、RPMI 1640培养基、M199培养基购于Hyclone公司;HT、HAT、PEG1500、AP标记羊抗鼠Ig和FITC标记羊抗鼠Ig购自Sigma公司;PCR引物合成及DNA测序由华大基因公司完成。6~8周龄Balb/c小鼠购自大连医科大学SPF实验动物中心,鲤春病毒阳性血清由北京检验检疫技术中心赠送。
1.2方法
1.2.1 鲤春病毒G蛋白片段的扩增 采用Trizol法提取病毒总RNA,按照TaKaRa(大连)公司RNA反转录试剂盒说明书进行反转录,以反转录得到的cDNA产物作为模板。根据SVCV 0504株G蛋白基因序列(GenBank:EU370915.1)设计扩增引物:F,5′ TGGATCCTTTGTTCCATCTGGGC 3′;R,5′GCTCGAGAGTTCCCCACCCACTG 3′。分别引入酶切位点Bam H I、Xho I,PCR扩增G基因片段(第21aa~第463aa)。PCR反应条件:94 ℃下预变性5 min;94 ℃下变性30 s,51.5 ℃下退火30 s,72 ℃下延伸1 min 30 s,共进行35个循环;最后在72 ℃下再延伸10 min,终止反应。PCR产物经10 g/L琼脂糖凝胶电泳切胶回收后,克隆至pMD18-T载体中,将重组质粒pMD18-T-G转化至大肠杆菌DH5α 感受态细胞中,挑选阳性克隆送华大基因公司测序,验证插入的外源基因正确无误。
1.2.2 重组G蛋白表达质粒的构建 根据质粒小提试剂盒说明书提取pMD18-T-G及pET-28a(+)质粒,分别采用限制性内切酶Bam H I、Xho I进行双酶切,酶切产物经胶回收后,用T4DNA连接酶于16 ℃下连接过夜,连接产物转化至大肠杆菌DH5α感受态细胞中,挑选单菌落进行菌液PCR、双酶切和测序鉴定,将测序正确的重组质粒命名为pET-28a(+)-G。将重组表达质粒转化至大肠杆菌BL21(DE3)感受态细胞中。
1.2.3 重组G蛋白的表达及SDS-PAGE分析 挑取单菌落接种于含Kan+(40 μg/mL)的LB培养基中,37 ℃下震荡培养过夜。以1∶100比例转接至5 mL新鲜培养基中,在37 ℃恒温培养箱中培养至细菌对数生长期,加入IPTG至终浓度为1 mmol/L后继续培养5 h,制样进行SDS-PAGE电泳,分析蛋白的表达形式,并设置空载体诱导全菌和未诱导全菌为对照。同时采用湿法转印,用1% BSA 于4 ℃下封闭过夜,用PBST洗涤3次,每次5 min,加入用0.01 mol/L PBS稀释的抗His单抗(1∶1000),37 ℃下孵育1 h;用PBST洗涤3次,每次5 min,加入用0.01 mol/L PBS稀释的羊抗鼠Ig(1∶3000),37 ℃下孵育45 min;再用PBST洗涤3次,每次5 min,最后加入NBT-BCIP显色液,以双蒸水终止反应。
1.2.4 包涵体的纯化及复性 在筛选出的最佳诱导条件(0.4 mmoL/L IPTG,37 ℃下孵育5 h)下大量表达重组表达菌,将其超声破碎后进行漂洗、洗涤、变性,变性蛋白按照Invitrogen His-Bind Kits说明书进行亲和层析纯化。调整蛋白浓度至1 mg/mL,分别在含4、3、2、1、0.5 moL/L尿素的复性缓冲液(50 mmol/L Tris,0.5 mmol/L EDTA,50 mmol/L NaCl,10%甘油,1%精氨酸,pH 8.0)中进行梯度透析复性,每6 h更换1次透析液,最后在Tris-HCl缓冲液中透析过夜。采用SDS-PAGE电泳检测复性蛋白的纯度,用BCA蛋白定量试剂盒测定蛋白浓度。
1.2.5 杂交瘤细胞的建立 以复性蛋白免疫Balb/c小鼠,参考李强等[8]的方法进行细胞融合,杂交瘤培养上清液用间接ELISA结合间接IFA的方法进行检测。同时采用有限稀释法对阳性细胞株多次克隆,直至筛选结果为100%阳性止。
间接ELISA检测方法的建立:以5 μg/mL的复性蛋白作为检测原,按照李强等[8]的方法对融合细胞上清液进行间接ELISA检测,设置阳性对照(免疫鼠血清)、阴性对照(空载体菌液)和空白对照(PBS),用酶标仪检测OD405 nm值,将P/N≥2.1时的杂交瘤上清液判定为阳性。
间接IFA检测方法的建立:在6孔细胞培养板中进行EPC细胞爬片,待接种病毒出现CPE后倾去培养液,用体积分数为4%的多聚甲醛固定10 min,室温风干,用PBS洗涤3次。以上述阳性杂交瘤细胞上清液为一抗,37 ℃下孵育1 h,再用PBS洗涤3次,每次5 min,然后以FITC标记羊抗鼠Ig(1∶100)为二抗,37 ℃下孵育45 min,再用PBS洗涤后甘油封片,在荧光显微镜下观察。出现特异的亮绿色荧光者为阳性,反之判为阴性。同时设置未感染病毒EPC细胞作为阴性对照,鲤春病毒阳性血清为阳性对照。
1.2.6 单克隆抗体的特性鉴定 收集细胞培养上清液,从1∶10开始做二倍系列稀释,采用Dot-ELISA法测定抗体效价;表达鲤春病毒G蛋白pET-28a-G,经诱导后进行SDS-PAGE,湿法转印后,用杂交瘤细胞上清液进行Western-Blot抗体检测;将阳性率达100%的细胞株每隔3 d连续培养30 d,取培养的上清液进行间接ELISA检测。
2.1G基因片段的扩增及重组表达质粒的构建
RT-PCR扩增后得到1326 bp的特异性条带,与预期大小相符,将pET-28a(+)质粒与pMD18-T-G质粒经双酶切后连接,构建重组表达质粒,命名为pET-28a-G。经双酶切鉴定表明,已在pET-28a(+)质粒中插入了一段约1326 bp的序列(图1),结合测序结果证明,重组表达载体构建正确无误。

注: M为DNA ladder;1为G基因片段;2为重组质粒经Bam H I、Xho I双酶切
Note:M,DNA ladder; 1,G gene fragment; 2, digestion production of pET-28a-G by Bam H I and Xho I enzymes
图1 鲤春病毒G基因片段扩增
Fig.1 Amplification of spring viremia of carp virus(SVCV) G gene fragment
2.2重组蛋白的表达及纯化
重组表达菌株经IPTG诱导后,可表达相对分子质量为51 600左右的融合蛋白(图2泳道3),而空载体诱导全菌、未诱导全菌无相应蛋白条带。裂解试验说明,重组表达的G蛋白主要以包涵体形式存在(图2泳道4、5)。经优化条件(0.4 mmol/L IPTG,37 ℃下孵育5 h)后大量表达,制备包涵体并采用亲和层析柱纯化(图2泳道6),通过尿素梯度透析复性和Western-Blot检测表明,融合蛋白与抗His单抗特异性结合,条带大小与预测结果相一致(图2泳道7),证实了目的蛋白成功表达。用Image J软件检测SDS-PAGE图谱,结果表明,复性蛋白纯度达到90%。用BCA蛋白定量试剂盒检测,蛋白浓度约为1.0 mg/mL。
2.3杂交瘤细胞株的建立
采用间接ELISA法筛选出11株阳性杂交瘤细胞株,经有限稀释法克隆后收集培养上清液,同时制备病毒感染的EPC细胞爬片,采用间接IFA法进一步筛选出两株能与病毒反应的杂交瘤细胞株,分别命名为1C5、2D5(图3)。
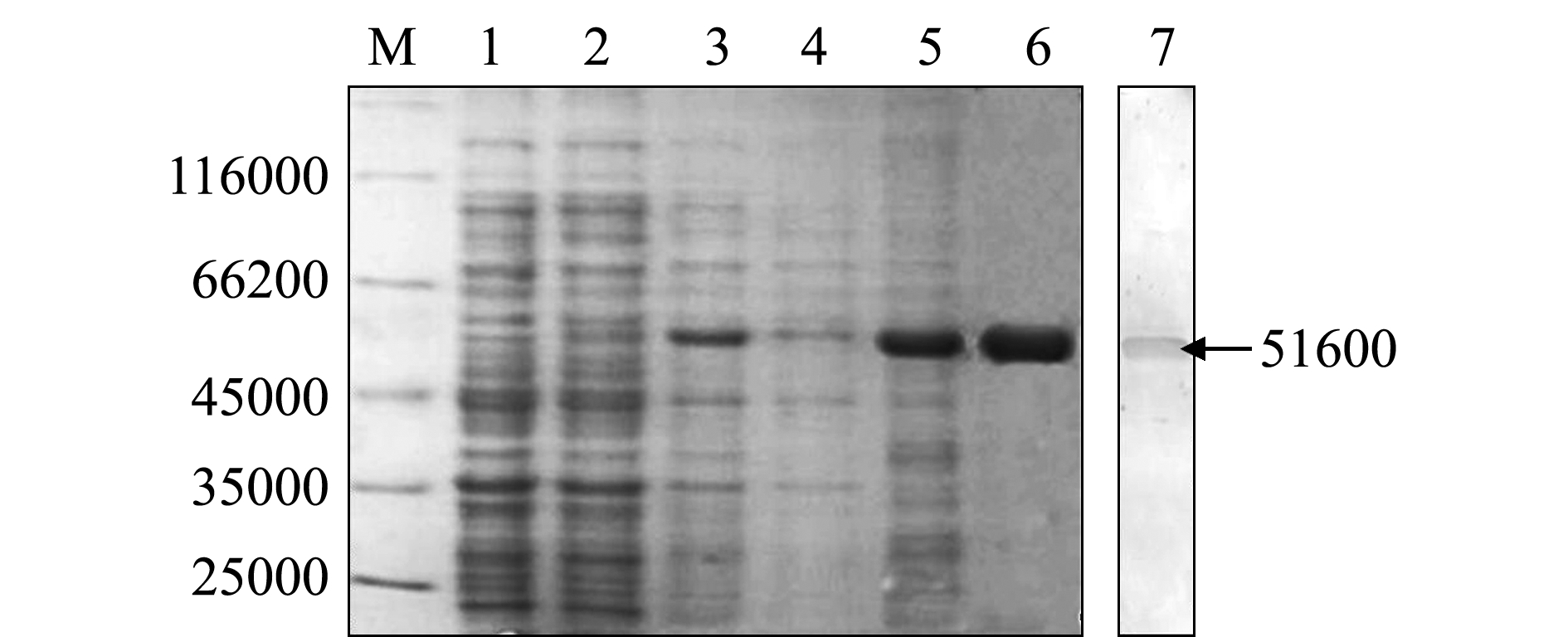
注:M为Marker;1为pET-28a全菌;2为未诱导全菌;3为诱导全菌;4为裂解上清液;5为裂解沉淀;6为纯化产物;7为经Western-Blot鉴定的蛋白
Note:M,Marker; 1,induced BL21/pET-28a; 2,uninduced BL21/pET-28a-G; 3,induced BL21/ pET-28a-G; 4,supernatant of lysis; 5,sediment of lysis; 6,purified production; 7,the protein identified by Western-Blot
图2 重组G蛋白的表达
Fig.2 Expression of recombinant G protein
2.4单克隆抗体的特性分析
经Dot-ELISA检测,MAb 1C5、MAb 2D5的细胞培养上清液效价分别为1∶2560、1∶5120(图4); 经Western-Blot检测表明,两株单抗与G蛋白在相对分子质量为51 600处结合(图5);分泌稳定性试验结果表明,两株杂交瘤细胞株体外连续培养30 d后,可稳定分泌抗体(图6)。
由SVCV引起的鲤春病毒血症严重威胁中国鲤科鱼类的养殖,而现阶段缺乏对SVCV有效的治疗药物,及早检测、疫苗免疫等策略成为防控鲤春病毒血症最有效的途径。SVCV主要结构蛋白包括核蛋白(N)、磷蛋白(P)、基质蛋白(M)、糖蛋白(G)、RNA聚合酶(L),其中全长G蛋白由509个氨基酸组成,具有信号肽序列及跨膜结构域,是典型的跨膜糖蛋白[9-10],在病毒检测、DNA疫苗构建上具有广阔的应用前景。随着分子生物学的发展,重组表达外源病毒蛋白已成为研究病毒蛋白的主要手段,鲤春病毒G蛋白已在大肠杆菌、毕赤酵母和昆虫细胞中获得表达[11-13]。预试验中,构建的全长G蛋白重组表达质粒在大肠杆菌中表达量过低,原因可能是全长G蛋白含有较多疏水性氨基酸及大肠杆菌稀有密码子,影响了G蛋白的表达。因此,本研究中在设计引物时去掉N端信号肽及尾部疏水区,截取G蛋白片段,成功地实现了G蛋白的高效表达,这与张琳等[11]的研究结论一致。

注: A为MAb 1C5; B为MAb 2D5; C为阳性对照; D为阴性对照
Note: A, MAb 1C5; B, MAb 2D5; C, positive control; D, negative control
图3 间接IFA检测结果
Fig.3 Dection results of indirect immunofluorescence analysis(IFA)
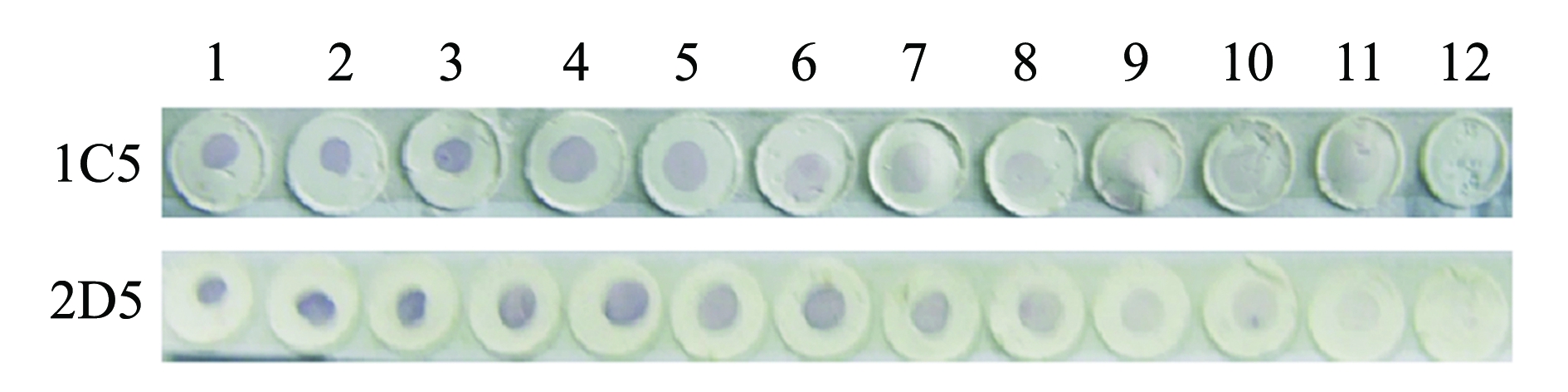
注:1~12代表抗体的稀释度为1∶1、 1∶10、 1∶20、 1∶40、 1∶80、1∶160、 1∶320、 1∶640、 1∶1280、 1∶2560、 1∶5120、 1∶10240
Note:No.1-12 indicate the dilution of: 1∶1,1∶10,1∶20,1∶40,1∶80,1∶160,1∶320,1∶640,1∶1280,1∶2560,1∶5120,and 1∶10240
图4 单克隆抗体效价的测定
Fig.4 Determination of 2 MAbs titer by Dot-enzyme-linked immunosorbent assay(Dot-ELISA)

注:M为Marker;1为单抗1C5与重组G蛋白反应结果;2为单抗2D5与重组G蛋白反应结果
Note:M,Marker;1, immuno-stained results of reaction between MAb 1C5 and recombinant G protein;2,reaction between MAb 2D5 and recombinant G protein
图5 单克隆抗体的特异性分析
Fig.5 Specificity analysis of MAbs
pET-28a原核表达载体功能强大,表达产物携带His标签,可采用亲和层析法进行纯化。本研究中构建重组表达质粒pET-28a-G时,同时转化大肠杆菌BL21,经诱导,表达产物浓度在1 mg/mL左右,但主要以包涵体形式存在。通常载体、宿主、外源基因和诱导条件等是影响外源蛋白可溶性表达的主要因素,本研究中曾更换携带GST标签的pGS-21a(+)表达载体,更换E.coliRosseta表达菌株,筛选表达条件(即固定其他因子,对单个因子进行不同温度、不同IPTG浓度和不同诱导时间表达),均未明显提高上清液表达量,较多的疏水性氨基酸与稀有密码子成为G蛋白的可溶表达瓶颈。
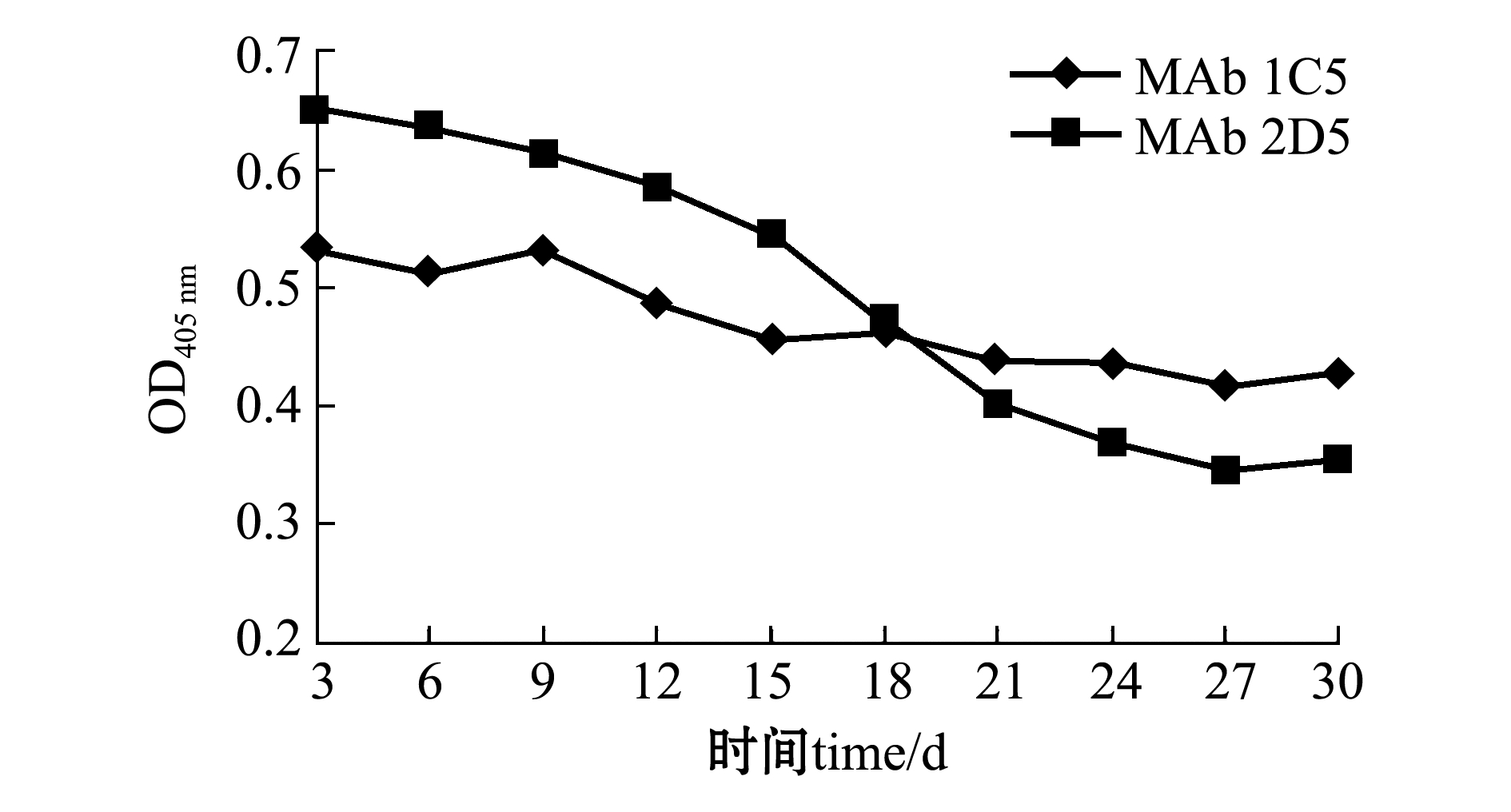
图6 分泌稳定性测定
Fig.6 Secreting stability analysis of MAb 1C5 and MAb 2D5
包涵体经复性后可恢复部分抗原性,杨振慧[14]制备了包涵体形式的SVCV-G蛋白,割胶回收后免疫新西兰大白兔,经Western-Blot检测表明,制备的兔抗血清与细胞培养的SVCV发生特异性反应,这是本研究中利用包涵体形式蛋白制备单克隆抗体的理论依据。
张朋等[15]利用纯化病毒制备抗鲤春病毒单克隆抗体,经Western-Blot检测表明,制备的单抗主要识别SVCV N蛋白,这可能与N蛋白是病毒粒子中含量最丰富的蛋白有关。若用全病毒抗原制备单克隆抗体,难以筛选出与鲤春病毒G蛋白反应的单抗,而本研究中以重组蛋白制备抗SVCV G蛋白的单抗,则无需进行复杂的病毒纯化。为保证筛选结果的准确性,本研究中建立了间接ELISA结合间接IFA的筛选方法,前者可一次性处理大批样品以缩小筛选范围,后者可确保具有特异性的单抗与病毒反应。结果表明,本研究中成功筛选出两株阳性的杂交瘤细胞株,经Western-Blot检测表明,两株单抗能与SVCV G蛋白反应,具有良好的特异性。
本研究中,采用大肠杆菌原核表达系统地实现了鲤春病毒G蛋白的高效表达,经包涵体洗涤、亲和层析纯化后,采用尿素浓度梯度复性,首次以重组蛋白制备出抗鲤春病毒G蛋白的单克隆抗体,为进一步建立新型SVCV快速检测方法提供了技术支持。
参考文献:
[1] 付峰,刘荭.鲤春病毒血症病毒(SVCV)的研究进展[J].中国水产科学,2006,13(2):328-334.
[2] 王姝,张利峰,徐立蒲.鲤春病毒核酸检测方法研究进展[J].检验检疫学刊,2012,22(3):49-51.
[3] 吕文雪,孟庆峰.淡水鱼病毒性疾病的研究进展[J].中国农学通报,2012,28(8):77-81.
[4] 刘萍,陈苗苗,刘学荣.单克隆抗体研究进展[J].中国畜牧兽医,2012,39(1):67-70.
[5] Jorgensen P E V,Olesen N J,Ahne W,et al.SVCV and PFR viruses: serological examination of 22 isolates indicates close relationship between the two fish rhabdoviruses[C]//Viruses of Lower Vertebrates.Berlin:Springer,1989:349-366.
[6] 刘荭,付峰,黄倢.鲤春病毒血症病毒中国分离株糖蛋白基因和氨基酸序列的初步解析[J].中国病毒学,2005,20(6):647-651.
[7] Padhi A,Verghese B.Detecting positively selected codons in the glycoprotein of spring viremia of carp virus(SVCV)isolates from the USA and China[J].J Fish Dis,2008,31:785-791.
[8] 李强,迟刚,李莹,等.仿刺参体腔细胞单克隆抗体的制备及特性分析[J].大连海洋大学学报,2010,25(6):542-546.
[9] 孟思妤,孟长明.鲤春病毒血症(spring viremia of carp,SVC)的研究现状[J].渔业致富指南,2010(3):66-67.
[10] Ahne W,Bjorklund H,Essbauer S,et al.Spring viremia of carp(SVC)[J].Dis Aquat Organ,2002,52: 261-272.
[11] 张琳,丁雅苓,陈建民,等.中国鲤鱼春病毒血症毒株糖蛋白基因的亚克隆表达与纯化[J].中国兽医杂志,2011,47(7):10-12.
[12] 付峰,刘荭.鲤春病毒血症病毒的克隆及其在毕赤酵母中的初步表达[J].海洋水产研究,2007,28(4):72-76.
[13] Huang F T,Li Q,Cui X X,et al.Characterization of spring viremia of carp virus glycoprotein expressed by recombinant baculovirus[J].Pak Vet J,2012,32(3):334-338.
[14] 杨振慧.鲤春病毒血症病毒外膜蛋白G和基质蛋白M的原核表达及多克隆抗体的制备[D].福州:福建师范大学,2011.
[15] 张朋,刘荭,陈孝煊.鲤春病毒血症病毒单克隆抗体的制备及其特性鉴定[J].中国预防兽医学报,2011,33(4):305-308.
Abstract:The fragment of G gene isolated from spring viremia of carp virus (SVCV, 0504) was cloned into the pET-28a(+) vector. The aimed protein was expressed after induction and lysed by concentration,then the G inclusion bodies were purified with Ni-NTA affinity column and renaturalized by the urea dialyzation way. The Balb/c was immuned by the recombinant glycoprotein and prepared for monoclonal antibody. Two hybridoma cell lines that secreted anti-G MAb were obtained successfully, named as 1C5, and 2D5. Western-Blot showed that the MAbs reacted specifically with recombinant glycoprotein, which laid foundation for the establishment of the new SVCV detection methods.
Key words:spring viraemia of carp virus (SVCV); glycoprotein; prokaryotic expression; monoclonal antibody
DOI:10.3969/J.ISSN.2095-1388.2014.05.006
文章编号:2095-1388(2014)05-0454-05
收稿日期:2014-01-26
基金项目:辽宁省高等学校优秀人才支持计划项目(LJQ2011075)
中图分类号:Q786
文献标志码::A