摘要:采集异株风信子鹿角珊瑚Acroporahyacinthus自然排放的精卵,进行人工授精,并在显微镜下连续观察其胚胎和幼虫的发育过程。结果表明:风信子鹿角珊瑚是雌雄同体,体外受精,在月圆后2~3 d同期排卵;其胚胎发育分为6个阶段,即受精卵期、卵裂期、囊胚期、原肠期、浮浪幼虫期、珊瑚幼体;受精卵经过48 h发育为浮浪幼虫,再经7 d着床变形发育为珊瑚幼体;其浮浪幼虫附着在附着基上后逐渐膨大,由圆形变成蝶形完全附着在基底上,口盘朝上,随后幼虫发生附着变形,长出触手,形成珊瑚幼体。本研究为国内对文昌云龙湾风信子鹿角珊瑚的胚胎和幼虫发育过程的首次报道,研究结果可为珊瑚礁的生态修复提供参考依据。
关键词:风信子鹿角珊瑚;胚胎发育;幼虫发育
风信子鹿角珊瑚Acroporahyacinthus(Dana,1846)隶属于珊瑚虫纲Anthozoa Ehrenberg、六放珊瑚亚纲Hexacorallia haeckel、石珊瑚目Scleractinia boune、鹿角珊瑚科Acroporidae verrill、鹿角珊瑚属Acroporaoken,其骨骼为伞房序式的群体,圆盘状生长,分枝拥挤,短而粗状,外形美观,生活时为棕黄色、黄褐色、咖啡色等[1]。
2010年,本研究室人员在对海南各地区的珊瑚礁进行调查时发现,风信子鹿角珊瑚Acroporahyacinthus分布极为广泛,在三亚、文昌、万宁等地皆为优势种,该品系适应能力强、外形美观、相对生长速率快,可作为海南地区珊瑚生态修复的优势品种[2]。1981年,Bothwell[3]首次观察发现,风信子鹿角珊瑚为雌雄同体,于每年春末夏初期间从口腔向外排放大量配子,其配子在体外发生受精作用而形成受精卵。1985年,Wallace[4]记录了大堡礁上9种鹿角珊瑚的有性繁殖过程,发现风信子鹿角珊瑚同期排卵行为发生在月圆后的一周内。但这些研究都没有详细报道风信子鹿角珊瑚胚胎和幼虫的发育过程。国内对珊瑚胚胎和幼虫发育过程的研究甚少,仅有2011年黄洁英等[5]记录了鹿回头膨胀蔷薇珊瑚和壮实鹿角珊瑚胚胎和幼虫的发育过程,但对风信子鹿角珊瑚胚胎和幼虫的发育过程目前尚未见报道。
随着海南省社会经济的快速发展,热带沿海地区人口不断增加,近岸海域海洋环境越来越恶化,尽管珊瑚礁生态修复技术和方法在过去的几十年内得到广泛运用,但珊瑚礁等热带浅海生态系统仍在退化[6-7]。本研究室人员自2010年以来,对云龙湾珊瑚进行了多样性和有性繁殖的调查,成功地记录了风信子鹿角珊瑚胚胎和幼虫的发育过程,并试探性地对珊瑚幼虫进行了饲养。本研究中,对风信子鹿角珊瑚的胚胎和幼虫发育过程进行了研究,旨在为更好地掌握造礁珊瑚的有性繁殖以及为珊瑚礁的生态修复提供参考依据。
1.1材料
风信子鹿角珊瑚采自海南省文昌市云龙湾(东经110°28′~111°03′、北纬19°20′~20°10′),云龙湾东南和北面分别是南海和琼州海峡,该海域珊瑚礁面积大,种类繁多,其中风信子鹿角珊瑚占地面积广,长势极好,便于开展研究[8]。
1.2方法
1.2.1 人工授精 2013年5月25日,月圆之夜潜水观察到风信子鹿角珊瑚断枝顶端呈现粉红色,靠近口盘处有簇状的橙红色卵包。将带有塑料瓶的锥形网(孔径为 100 μm 的滤网)倒置在产卵珊瑚上,利用珊瑚卵包的浮力让卵包自动进入塑料瓶中。2013年5月27日21时潜水观察到珊瑚大量产卵,90 min后取回收集珊瑚精卵的塑料瓶。将收集到的精卵混合物用滤网进行分离,并分装到盛有过滤海水的10 L塑料桶中。立即将1株珊瑚的卵子与另1株珊瑚的精子相混合,人工授精1 h 后用气石连续充气。
1.2.2 发育观察 卵裂阶段,每隔5 min取样一次,每个样品含受精卵30个以上,将其置于平皿内,于体式解剖镜下观察,并用佳能G12相机连续拍照。囊胚期至原肠期阶段,每隔20 min取样一次,取样方法和处理方法与卵裂阶段相同。
1.2.3 浮浪幼虫的着床和生长发育观察 受精24 h后,将珊瑚卵平均分装到3个25 L白色塑料箱中,每个箱内装入20 L过滤海水,用气石连续充气。每隔2 h抽取受精卵30个以上置于平板内,于显微镜下观察。当塑料箱内大部分珊瑚卵变成浮浪幼虫后,在箱内放入经海水浸泡一段时间的瓦片、花岗石、大理石、鹿角珊瑚骨骼等附着基,控制水温为25~26 ℃,盐度为32~34。每隔12 h,取附着基于显微镜下观察浮浪幼虫是否着床。将已着床的浮浪幼虫移入循环水养殖缸中,每隔5 h观察一次幼体的发育情况,并着重观察其活动与病变情况,以及水生动物等对珊瑚幼虫的影响。
1.2.4 供试养殖环境水质的测定 采用《GB 17378.4—2007 海洋检测规范:第四部分海水分析》的方法对珊瑚幼虫养殖缸中的水质进行测定[9]。每天用温度计、pH计、盐度计分别测定水温、pH和盐度;每周采用碘量法测定DO,每月采用碱性高锰酸钾法、次溴酸钠氧化法、磷钼蓝法分别测定![]() -P含量,采用重氮-偶氮法测定
-P含量,采用重氮-偶氮法测定![]() -N和
-N和![]() -N含量。
-N含量。
2.1精卵形成和受精过程
2013年5月27日潜水观察到大部分风信子鹿角珊瑚的水螅体前端发生明显膨胀,卵包已靠近口盘处;30 min后有少数几个珊瑚虫将橙红色的卵包从口盘处慢慢挤出;1 h后几乎所有珊瑚虫都开始排出卵包,约90 min后排卵结束。取一定数量橙红色卵包于显微镜下观察,发现卵包破裂后释放出红色的卵子和白色的精子,这证实风信子鹿角珊瑚是雌雄同体。将用滤网(孔径为50 μm)分离的精卵分别装到不同的塑料杯中(图1-A),取不同株珊瑚的精卵相混合进行体外受精,受精1 h后于体式解剖镜下观察到橙红色的受精卵(图1-B)。
2.2胚胎发育过程
在水温为25~26 ℃、盐度为32~34的条件下,受精卵经过48 h发育为浮浪幼虫(表1)。根据胚胎发育的形态变化,可将风信子鹿角珊瑚的胚胎发育分为6个阶段:受精卵期、卵裂期、囊胚期、原肠期、浮浪幼虫期、珊瑚幼体,其发育类型为体外受精、体外发育。
表1风信子鹿角珊瑚的胚胎发育
Tab.1TheembryonicdevelopmentofcoralAcroporahyacinthus

发育期developmentstages发育时间developmenttime主要形状特征mainmorphologicalchanges受精卵fertilizedeggs1h10min扁圆形单细胞2细胞期2cellphase2h30min均等分成两半,呈“8”字形4细胞期4cellphase3h40min均等分成四半,呈“田”字形多细胞期multicellularcellphase6h53min细胞的排列不规则,呈桑葚状囊胚期blastulaphase7h35min中间出现圆状环沟,由扁圆状向盘状和碗状发育原肠期gastrulaphase10h20min呈圆形浮浪幼虫期planulaphase48h0min随水流能游动,呈圆柱形或纺锤形
受精2 h 30 min后,受精卵首次在一边进行水平分裂,形成一个心形的受精卵,随后裂痕扩大,将受精卵沿水平方向均等地分裂成2部分(图2-A)。受精3 h 40 min后,受精卵进行第二次分裂,此次分裂与第一次分裂均在同一水平面内,方向与第一次分裂方向垂直,受精卵被近似地分成4部分(图2-B)。受精6 h 53 min后,胚盘进行多次的水平与垂直分裂,形成圆形的桑葚胚,此时各细胞的排列不规则,细胞界限不清。在此之前,各细胞之间的卵裂大致同步,直至卵裂进行至64~128细胞时变得不同步,开始向囊胚期过渡(图2-C)。受精7 h 35 min后,扁圆形的桑葚胚逐渐变形为盘状。受精9 h 32 min后,盘状的胚开始由四周向内弯曲,在中间逐渐出现一个圆状环沟,形成碗状囊胚(图2-D)。受精10 h 20 min后,碗状囊胚的胚盘中间变得平整,囊胚层细胞由四周继续向内弯曲, 形成圆形的原肠胚,原肠胚的形成标志着原肠胚发育阶段的开始(图2-E)。 受精34 h 15 min后,原肠胚逐渐关闭,呈圆形的单细胞状,这标志着原肠胚发育阶段结束(图2-F)。受精48 h后,圆形胚体发育成圆柱形或纺锤形的浮浪幼虫(图2-G),多数为圆形,该时期浮浪幼虫具有活动能力, 但不具备明显的目的性,只是转圈或随机游动。
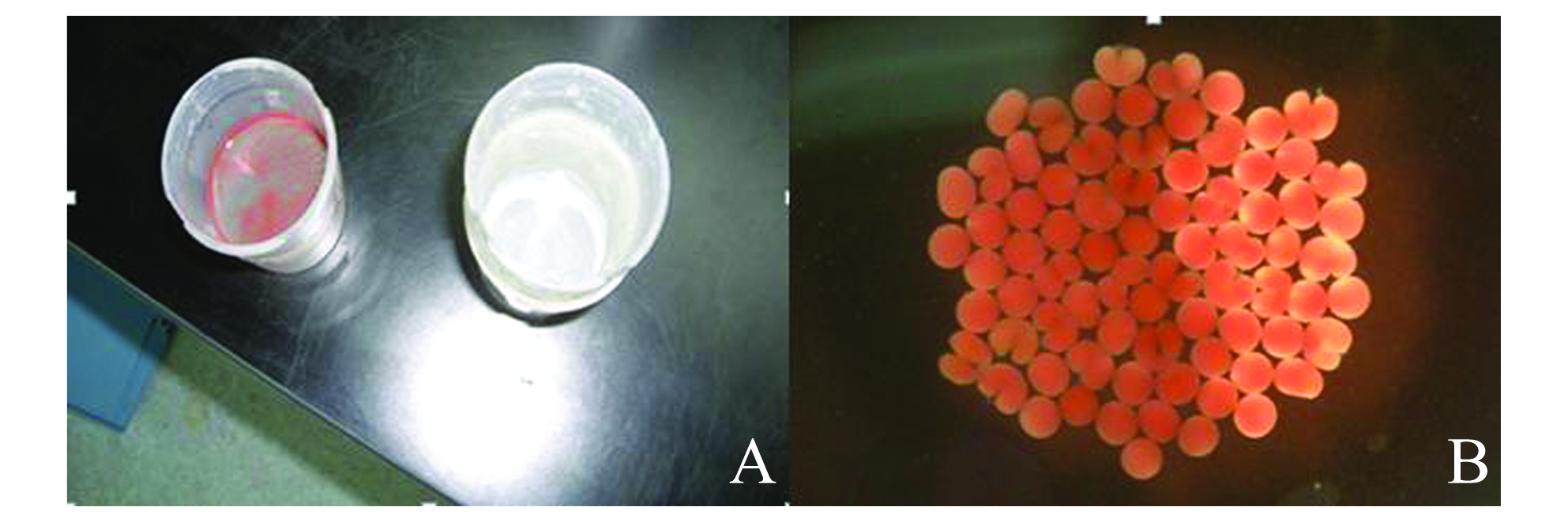
注:A中红色为卵子,白色为精子;B为受精卵开始分裂
Note:A,the red oocytes and white sperm;B,fertilized eggs commencing first cleavage
图1 风信子鹿角珊瑚的配子和受精卵
Fig.1 The embryonic development of coral Acropora hyacinthus
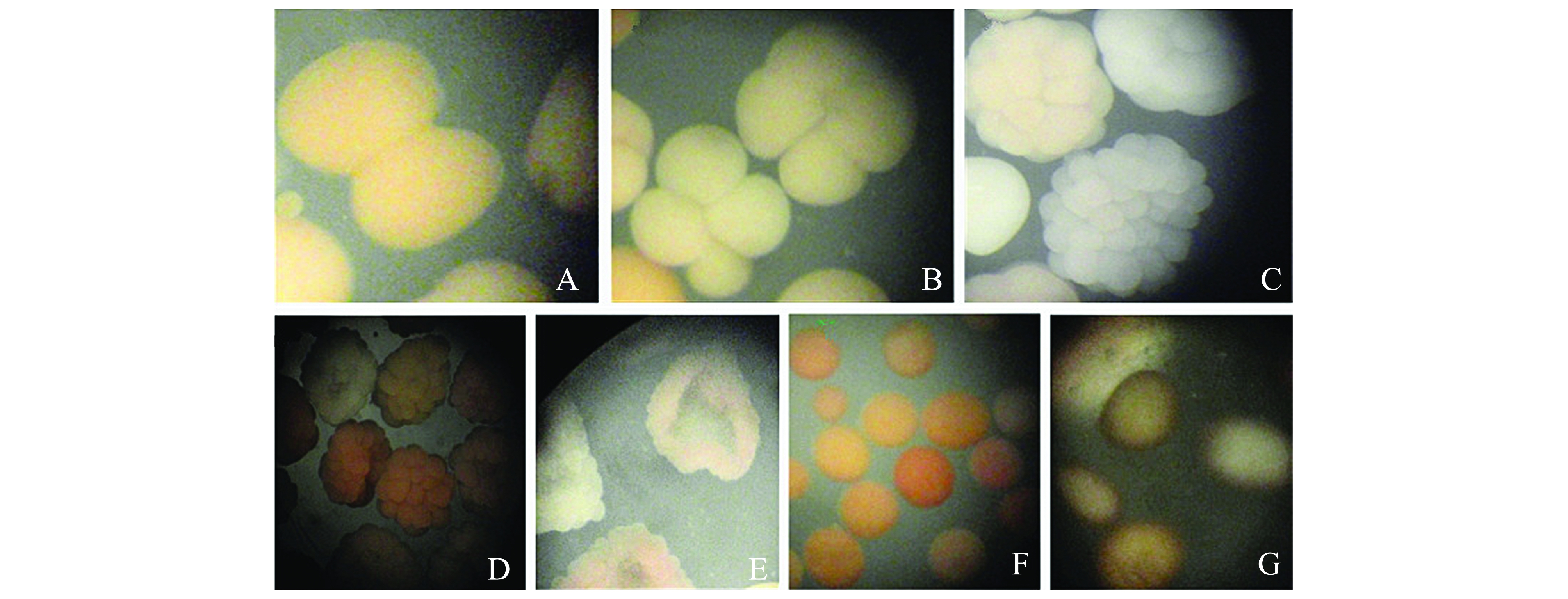
注:A为2细胞期;B为4细胞期;C为多细胞期;D为囊胚期;E为原肠胚期;F为原肠胚期完成;G为浮浪幼虫期
Note:A, 2-cell stage; B, 4-cell phase; C, multicellular phase; D, blastula; E,gastrula; F, the end of gastrula; G, planula phase
图2 风信子鹿角珊瑚的胚胎发育过程
Fig.2 The embryonic development of Acropora hyacinthus
2.3浮浪幼虫的附着和珊瑚幼虫的生长发育特点
在白色塑料箱内暂养3 d后,观察塑料箱内浮浪幼虫的活动情况,发现其喜欢在底层水中活动,并具有一定的目的性,当发现有附着基时,其反口极细胞会分泌黏液黏附在基底的上部,但此时黏附的不够牢靠,稍微有水流冲过就会从基底上脱落,并不是真正附着,可能是在试探基底是否合适附着(图3-A)。当感觉到是合适的附着基时,浮浪幼虫会逐渐膨大,最终由圆形变成蝶形完全附着在基底上,口盘朝上(图3-B)。塑料箱内许多找不到合适附着基的浮浪幼虫游动2个多星期后便死亡。能附着并继续生长发育的个体,大部分附着在瓦片和鹿角珊瑚的骨骼上。
将成功着床的浮浪幼虫从白色塑料箱内取出,在表2所示的环境下进行循环水饲养,3 d后发现,部分幼虫完全变形,逐渐长出触手,整个形状呈现为花朵状,随后触手逐渐发育并伸展出来(图3-C),形成珊瑚幼虫。
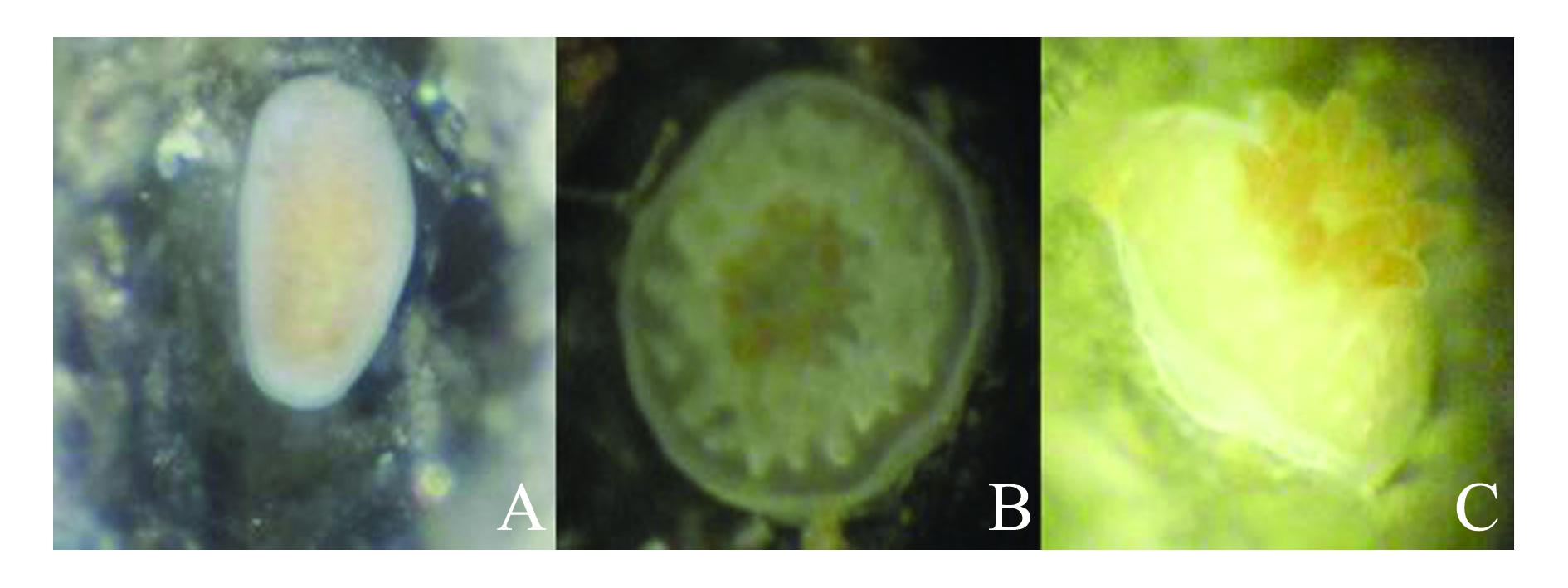
注:A为浮浪幼虫正在着床;B为浮浪幼虫着床成功;C为珊瑚幼虫伸出触手
Note:A, The planula larvae are settling; B, the planula larvae settled down well; C, coral larvae stretch out their tentacles
图3 珊瑚幼虫的着床和生长发育
Fig.3 Coral larvae settlement, growth and development
表2饲养珊瑚幼虫的水环境条件
Tab.2Theenvironmentalconditionsofcorallarvarearing

项目itemDO/(mg·L-1)COD/(mg·L-1)NO+2-N/(mg·L-1)NO-3-N/(mg·L-1)NH+4-N/(mg·L-1)PO3-4-P/(mg·L-1)温度/℃temperature盐度salinitypH光照时间/(h·d-1)illuminationtime光照强度/lx(实测值)lightintensity养殖水7 040 110 0050 0020 0110 03125~27328 2125980正常范围[10]7 6~8 6<0 41<0 2<1.0<0 1<0 523~2833~357 8~8 58~125000~10000
3.1风信子鹿角珊瑚的排卵行为和胚胎发育特点
通过对云龙湾海域风信子鹿角珊瑚连续3年的调查监测,发现风信子鹿角珊瑚产卵时间一年比一年推迟,即2011年和2012年产卵集中在4月下旬到5月初,而2013年产卵集中在5月底,数量也相应的大幅减少。出现这种现象,一方面是云龙湾周围海水被日渐污染,珊瑚大面积死亡,导致珊瑚卵的数量大幅减少;另一方面根据Harrison等[11]、Jokiel等[12]、Van Woesik等[13]报道,珊瑚的排卵时间因受水温、月相、盐度、潮汐等多种因素的影响而有差异。近3年来,云龙湾的风信子鹿角珊瑚皆在月圆之后的2~3 d同期排卵,风信子鹿角珊瑚这种同期排卵行为在Indo-Pacific、Singapore和Great Barrier Reef等地方也有发生,不同的是,在Indo-Pacific同期排卵发生在3月月圆之后的2~3 d,而在Singapore和Great Barrier Reef同期排卵发生在4月月圆后的5~6 d[14-16]。造礁石珊瑚的种类繁多,其产卵时排放的配子一般有5种形式:(1)包含有精子和卵子的卵包,如黄藓蜂巢珊瑚Faviafavus、Acroporanobilis等;(2)只有卵子的卵包,如腐蚀刺柄珊瑚Hydnophoraexesa等;(3)排放单独的精子,如丛生盔形珊瑚Galaxeafaseieularis、石芝珊瑚Fungiafungites等;(4)直接排放珊瑚幼虫, 如箭排孔珊瑚Seriatoporahystrix、鹿角 杯 形 珊 瑚Pocilloporadamicornis。本研究中发现,风信子鹿角珊瑚排放配子的形式为第1种,这与Shlesinger等[17]、Babcock等[14]报道的珊瑚排卵方式相同。在对风信子鹿角珊瑚人工授精过程中,本研究中使用异株珊瑚的精卵受精,这与同株珊瑚的精卵受精相比,大大提高了受精率。
本研究中,风信子鹿角珊瑚的受精卵经过8 h分裂形成扁圆形的桑葚胚进入囊胚期,囊胚期持续时间较短,囊胚层细胞由四周继续向内弯曲形成圆形的原肠胚,原肠胚逐渐闭合、变形为纺锤形的浮浪幼虫,此阶段共经历了48 h,这与黄洁英等[5]记录的壮实鹿角珊瑚受精卵形成浮浪幼虫的46 h时间比较接近,与蔷薇珊瑚的34 h相差较远,这表明不同属的石珊瑚在胚胎发育时间上有明显差异,但同属相差较小。
3.2浮浪幼虫的附着特点
据Nozawa等[18]报道,在试验条件下,大部分鹿角珊瑚的浮浪幼虫在受精9~10 d后开始附着在基底上,本研究中,风信子鹿角珊瑚的浮浪幼虫也是在受精9 d后完成附着。与海蛰浮浪幼虫附着方向不同,风信子鹿角珊瑚的浮浪幼虫附着在附着基的上方,口盘朝上;而海蜇的浮浪幼虫绝大部分附着在附着基的下侧形成螅状体,螅状体的柄部向上,口端向下,呈倒垂状[19]。这一区别与它们以后的发育生长规律及生态习性有关,海蜇的螅状体进一步横裂释放碟状幼体掉入水体中,碟状幼体发育为海蜇营浮游生活,海蜇浮游生活期中绝大部分时间口盘朝下;而风信子鹿角珊瑚的浮浪幼虫附着后进一步变形发育成碟形,碟形直接发育生长为珊瑚幼体,主要营固着生活,珊瑚栖居时生长期口盘朝上。
3.3珊瑚幼虫生长中的危害生物
在饲养珊瑚幼虫的循环水体中出现一种哲水蚤,该蚤经常活跃于附着的珊瑚周围。据赵文[20]的研究记载,哲水蚤有3种摄食方式:滤食性、捕食性和杂食性。本研究中发现,活跃于珊瑚虫周围的哲水蚤在珊瑚幼虫触手未展开时,以附着基上的硅藻为食,全身呈现棕色;当珊瑚触手伸展出来后,哲水蚤以珊瑚幼虫为食,全身呈现红色。这种哲水蚤行杂食性的摄食方式,为减少其对珊瑚幼虫的伤害,本次饲养试验中采用王建钢等[21]对桡足类防治的方法成功地去除了这种哲水蚤。国内的珊瑚人工养殖还在起步阶段,一般认为,水质对珊瑚幼虫的生长起决定性因素,而对珊瑚的危害生物关注度较低。由表2可知,饲养试验的水环境符合自然界珊瑚生存所适范围,因此,哲水蚤的出现极大地影响了珊瑚幼虫的生长。关于为何会出现哲水蚤,以及如何有效地防治危害生物等问题将在今后进一步进行研究。
参考文献:
[1] 邹仁林.中国动物志 石珊瑚目 造礁石珊瑚[M].北京:科学出版社,2001:1-242.
[2] 杨晨,杨亚辉,李洪武,等.海南省文昌市龙楼镇云龙湾石珊瑚的物种多样性调查[J].海南师范大学学报:自然科学版,2011,24(2):201-203.
[3] Bothwell A M.Fragmentation,a means of asexual reproduction and dispersal in the genusAcropora(Scleraetinia:Astrocoeniida:Acroporidae)—A preliminary report[J].Fourth International Coral Reef Symposium,1981,2:137-144.
[4] Wallace C C.Reproduction,recruitment and fragmentation in nine sympatric species of the coral genusAcropora[J].Marine Biology,1985,88(3):217-233.
[5] 黄洁英,黄晖,张浴阳,等.膨胀蔷薇珊瑚与壮实鹿角珊瑚的胚胎和幼虫发育[J].热带海洋学报,2011,30(2):67-73.
[6] Hatcher B G,Johannes R E,Robertson A I.Review of research relevant to the conservation of shallow tropical marine ecosystems[J].Oceanogr Mar Bio1 Annu Rev,1989,27:337-414.
[7] 刘瑞玉.人类活动对底栖生物多样性的影响[C]//中山大学近岸海洋科学与技术研究中心.1997海岸海洋资源与环境研讨会论文集.香港:香港科技大学理学院及海岸与大气研究中心,1998:39-46.
[8] 周祖光.海南珊瑚礁的现状与保护对策[J].海洋开发与管理,2004(6):48-51.
[9] 第二次全国海洋污染基线调查领导小组办公室.第二次全国海洋污染基线调查技术规程[M].北京:海洋出版社,1997.
[10] 王尔栋,陈韵竹,陈国华,等.人工养殖珊瑚栉水虱病害防治[J].海南师范大学学报:自然科学版,2013,26(2):208-213.
[11] Harrison P L,Wallace C C.Reproduction,dispersal and recruitment of scleractinian corals[C]//Dubinsky Z.Ecosystems of the World.Amsterdam:Elsevier,1990,25:133-179.
[12] Jokiel P L,Ito R Y,Liu P M.Night irradiance and synchronization of lunar release of planula larvae in the reef coralPocilloporadamicornis[J].Mar Biol,1985,88:167-174.
[13] Van Woesik R,Lacharmoise F,Koksal S.Annual cycles of solar insolation predict spawning times of Caribbean corals[J].Ecology Letters,2006,9(4):390-398.
[14] Babcock R C,Bull G D,Harrison P L,et al.Synchronous spawnings of 105 scleractinian coral species on the Great Barrier Reef[J].Marine Biology,1986,90(3):379-394.
[15] Guest J R,Baird A H,Goh B P L,et al.Seasonal reproduction in equatorial reef corals[J].Invertebrate Reproduction and Development,2005,48:207-218.
[16] Toh T C,Guest J,Chou L M.Coral larval rearing in Singapore:observations on spawning timing,larval deveopmen and settlement of two common scleractinian coral species[J].Marine Science,2012:81-87.
[17] Shlesinger Y,Loya Y.Larval development and survivorship in the coralsFaviafavusandPlatygyralamellina[J].Hydrobiologia,1991,216/217:101-108.
[18] Nozawa Y,Harrison P L.Temporal patterns of larval settlement and survivorship of two broadcast-spawning acroporid corals[J].Mar Biol,2008,155:347-351.
[19] 张洪芬.海蛰人工育苗及养殖技术[J].水产养殖,2006,27(2):21-23.
[20] 赵文.水生生物学[M].北京:中国农业出版社,2005:224-225.
[21] 王建钢,乔振国,于忠利.在轮虫培养中用敌百虫杀灭桡足类的试验[J].海洋渔业,2006,28(1):83-86.
Abstract:The embryonic and larval development of dioecious coralAcroporahyacinthuswas continuously observed in artificially fertilized eggs by sperm collected from natural spawn corals under a microscope. It was that the corals were hermaphrodites, in vitro fertilization, and spawn on the second to third day after full moon. The embryonic development was divided into six stages: zygote stage, cleavage, blastula, gastrula, planula and coral larvae. The fertilized eggs developed into planula attached to the tiles in 48 h and then became gradually expanded from round to butterfly, completely attached to the substrate, oral disc up, and the larvae settled and metamorphosized in 7 d. The planulae grew and had tentacles to form coral larvae. The findings provided a theoretical basis for ecological restoration of coral reefs. The hyacinthAcroporaembryonic and larval development in Wenchang Cloud Longwan was reported for the first time in China.
Key words:Acroporahyacinthus; embryonic; larval development
DOI:10.3969/J.ISSN.2095-1388.2014.05.004
文章编号:2095-1388(2014)05-0444-05
收稿日期:2014-01-14
基金项目:万宁大洲岛整治修复及保护任务——珊瑚海草养护与修复(HZ2012-174)
中图分类号:Q954.4
文献标志码::A