Eiseniabicyclis的克隆苗繁育及养殖技术研究
曹淑青,张泽宇,李晓丽,由学策
(大连海洋大学 农业部北方海水增养殖重点实验室,辽宁 大连 116023)
摘要:以从日本引进的Eiseniabicyclis雌、雄配子体为材料,研究了不同温度(10、15、20 ℃)和光照强度[20、40、60 μmol/(m2·s)]对雌、雄配子体生长发育和幼孢子体生长的影响。结果表明:雌、雄配子体在温度为20 ℃时生长最快,15 ℃时次之,10 ℃时最慢,在温度为10 ℃时随光照强度的升高其生长速度加快,但随温度的升高不同光照组间的生长差异逐渐缩小;15 ℃和20 ℃是雌、雄配子体发育成熟的适宜温度,培养12 d后配子体的成熟率可达到95%~100%,而且高光照条件下的成熟率明显优于低光照下;幼孢子体生长的适宜温度为20 ℃,在各光照条件下的生长速度明显快于温度为15、10 ℃组;温度为10 ℃时,光照强度越高幼孢子体生长越快,温度为15、20 ℃时,幼孢子体在光照强度为20 μmol/(m2·s)时的生长速度明显慢于40、60 μmol/(m2·s)组,而40 μmol/(m2·s)组与60 μmol/(m2·s)组间生长差异不明显;将雌、雄配子体打碎进行克隆苗繁育,在室内培养至体长为800 μm以上的幼孢子体,将其移至海区暂养,1个月后可生长成2 cm左右的幼体。
关键词:Eiseniabicyclis;室内培养;克隆苗繁育;海区暂养
Eiseniabicyclis(Kjellman)Setechell原产于日本北部沿海,俗称“荒布”,在分类上属于海带目Laminariales、海带科Laminariaceae、Eisenia属,在亚洲主要分布于日本和朝鲜半岛沿海,是具有较高经济价值的褐藻[1-2]。该褐藻藻体长度一般为1~2 m,主茎较长,呈圆柱状,顶端生有叉状分枝,分枝末端生有带状裂叶,裂叶表面具有明显的皱褶。假根呈叉状分枝,末端生有吸盘,牢固地附着在海底的岩礁上,在水深5~10 m的近海海底形成大规模藻场,可以用于构建海中森林或海藻场[3-4]。
E.bicyclis的生活史与海带目其他种类基本相同,主要由孢子体世代和配子体世代组成。该褐藻一般为多年生,第一年藻体具短茎,叶片呈椭圆形,第二年茎逐渐延长变粗呈圆柱状,其顶端形成叉状分枝并在末端生出带状裂叶,随着生长时间的延长,茎继续延长变粗,其顶端形成多个叉状分枝和次生叉状分枝及其裂叶,成为成体[5]。E.bicyclis富含铁、钙、镁等矿物质和B、E、K族等多种维生素,100 g干品中β-胡萝卜素含量高达2.7 mg,自古以来是日本当地人们喜欢食用的经济海藻[6]。此外,E.bicyclis也是鲍鱼、海胆等经济种类的优质活鲜饲料,因此,在日本中北部采用投藻礁等方式构建海藻场,对底播鲍鱼、海胆等具有良好的饵料补充作用,由此成为海底森林和海洋牧场建设的主要海藻种类[7]。
日本有关E.bicyclis的研究,多为人工增殖和藻场建设的报道[3-4,7-8],但室内培养和人工育苗技术等未见报道。为了满足中国沿海鲍鱼、海胆增殖业不断发展的需要,特别是近年来中国浅海也有“海底荒漠化”的现象,需要不断考虑引进合适的海藻,进行人工繁育及浅海增养殖。为此,本研究中以E.bicyclis雌、雄配子体为材料,分析其生长发育与温度、光照条件的关系,结合克隆苗技术,进行室内繁育及种苗培养,结合浅海养殖,建立E.bicyclis繁育及养殖新体系,旨在为海藻场的恢复和构建发挥作用。
1材料与方法
1.1材料
E.bicyclis雌、雄配子体于2006年从日本引进,经室内培养繁殖后用于试验。配子体培养温度为20 ℃,光照强度为40 μmol/(m2·s),光源为日光灯,光照时间为12 L∶12D。培养液为经沉淀过滤的天然海水,经加热(80 ℃)、冷却后,再加入营养盐待用。营养盐的主要成分含量:NaNO3100 g/m3、NaH2PO4·12H2O 20 g/m3、微量元素PI[9]溶液1 L/m3。培养液每15 d全量更换1次。
1.2方法
1.2.1 温度、光照强度对配子体生长和成熟的影响试验 取配子体(雌、雄各半) 10 mg (湿质量)移入250 mL培养液中,然后用组织搅碎机(SANYO SM - G321)切碎(切碎时间为120 s),各取1 mL 配子体液移入培养皿(直径9 cm,下同)中,添加培养液后,置于不同温度、光照强度下进行培养,每个培养皿中添加10 mL维尼纶绳浸出液以抑制配子体发育成熟。配子体生长期间,每4 d测定1次雌、雄配子体各50个个体的长度,取其平均值。从切断第7天后开始,测定雌、雄配子体各50个个体的成熟度, 按成熟个体的百分比计算成熟率。
1.2.2 温度、光照强度对幼孢子体生长的影响试验 取边长为2.0 cm的玻璃片铺于培养皿内,将切碎的配子体洒在玻璃片上,于15 ℃下静置培养,当大部分雌、雄配子体成熟且50%以上雌配子体排出的卵受精形成幼孢子体后,将玻璃片分别置于不同温度、光照强度下进行培养。每5 d测量1次藻体长度,取50 个被测个体长度的平均值。
1.2.3 幼苗培育 附着基为缠绕在30 cm×40 cm聚乙烯框架上的维尼纶绳(直径3.0 mm),采苗时间为2009年8月10日,采苗前将附着基铺在聚乙烯水槽(50 cm×60 cm×20 cm)内,添加培养液浸过附着基后,将切碎的雌、雄配子体洒在附着基的苗绳上,于20 ℃、40 μmol/(m2·s)条件下静置培养,当幼苗长度达到 800 μm以上时移至海区暂养。
在生物培养箱内不同温度(10、15、20 ℃)以及不同光照[20、40、60 μmol/(m2·s)]条件下,进行双因子组合试验,培养液的制作与配方与“1.1”节相同,培养液每3 d全量更换1次。
1.2.4 幼苗暂养 待海上水温达到21 ℃时,将带有幼苗的维尼纶绳缠绕在60 cm×80 cm的聚乙烯框架上,将上端用细绳固定,下端切断,拆掉下端和两侧的框架后,将上端连同苗绳垂挂在大连市黑石礁海区的浮筏上暂养。暂养期间,每5 d 测定1次幼苗长度,取50个被测个体长度的平均值。
1.3数据处理
所有数据均用平均值±标准差(mean±S.D.)表示,用SPSS 15.0软件进行单因素方差分析和多重比较,显著性水平设为0.05。
2结果与分析
2.1温度、光照强度对配子体生长和成熟的影响
E.bicyclis雌、雄配子体为分枝丝状体,多个雌、雄配子体相互缠绕在一起形成大的藻团。显微镜观察发现:雌配子体细胞粗大,平均长度为18 μm(14~21 μm),平均宽度为13 μm(10~16 μm),内含2~3个盘状色素体呈黄褐色(图1-A);雄配子体细胞细长,平均细胞长度为14 μm(11~16 μm),平均宽度为8 μm(6~10 μm),内含1个盘状色素体,呈浅黄色(图1-B)。
雌、雄配子体经切碎后成为平均长度为170 μm(90~320 μm)的藻段,依靠破碎细胞溢出的原生质附着在基质上。3 d后,观察被切碎的藻段时发现,其两端因破损严重,色素体消失,细胞已经死亡,藻段上部分受伤的细胞伤口已经愈合,没有受到伤害的细胞已经开始生长。配子体生长时首先是细胞拉长,细胞内的色素体也随之变长,细胞呈浅黄色,随后在细胞中间产生隔阂,将色素体及原生质分隔并分裂成为两个细胞[10]。
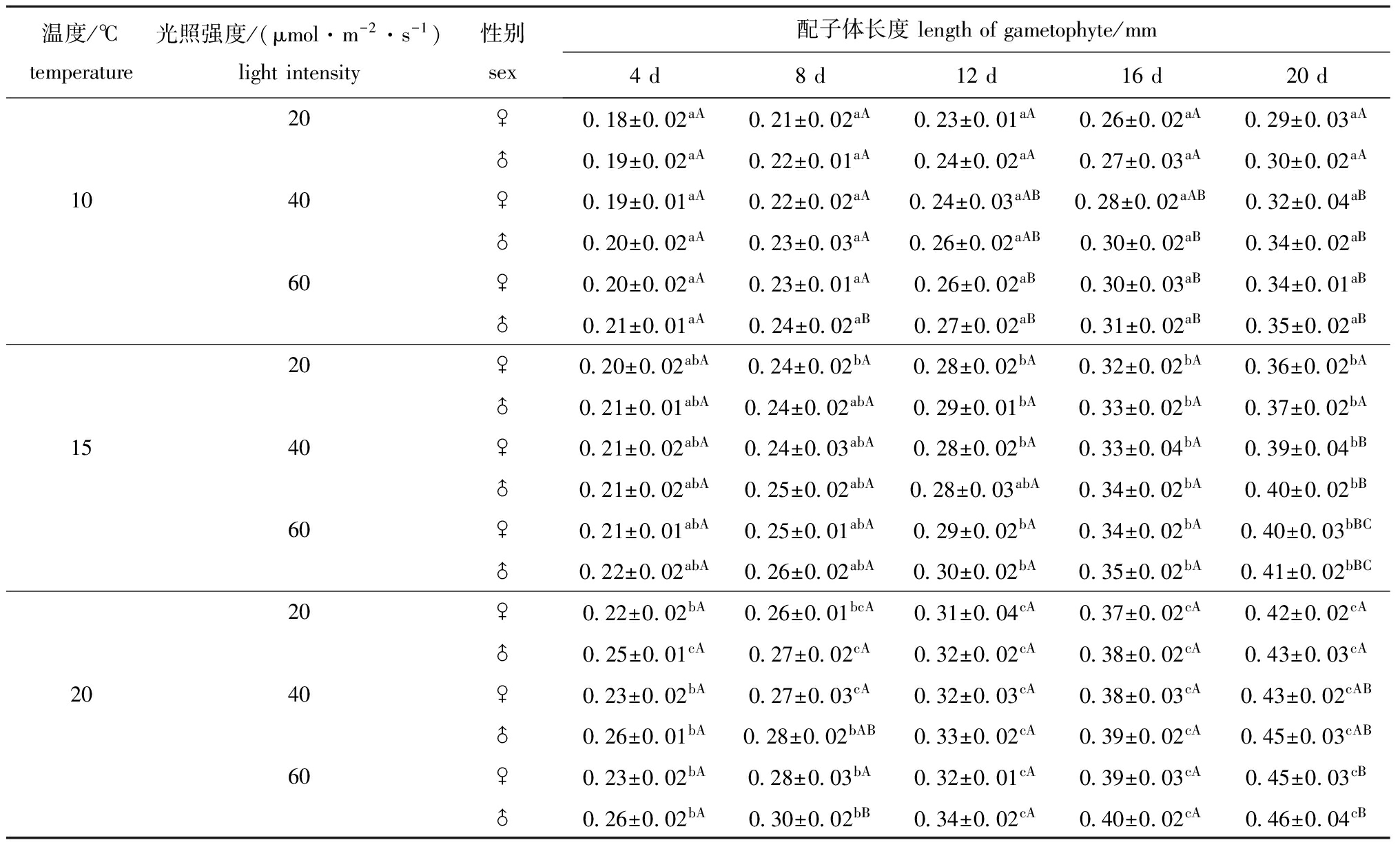
不同温度和光照强度对雌、雄配子体生长的影响如表1所示。可以看出,温度是影响雌、雄配子体生长的主要因子,光照强度是辅助因子。在设定的温度、光照强度条件下,20 ℃组各光照强度下雌、雄配子体的生长速度最快,15 ℃组次之,10 ℃组最慢。在同一温度下,高光照强度下雌、雄配子体的生长速度较快,温度为10 ℃时,高、低光照强度下的配子体生长差异较明显,但随着温度的升高,各光照强度组间的差异逐渐缩小,20 ℃时这种差异已经不明显。在适宜的培养条件下,雌、雄配子体藻段细胞在生长的同时,部分细胞开始发育并逐渐成熟。配子体发育时一般从枝端开始,细胞首先拉长且顶端逐渐膨大呈椭圆形,细胞内的原生质向膨大处移动使细胞顶端呈褐色,当细胞内的原生质全部移动到细胞顶端膨大处后,细胞中下部呈透明状,细胞顶端膨大呈圆形、浓褐色,形成圆形的卵囊,卵囊成熟后排出卵。刚排出的卵呈圆形,平均直径为25 μm(22~30 μm),内含1个盘状色素体和丰富的褐色原生质,挂在透明的卵囊袋上等待受精(图1-C)。
表1不同温度、光照强度下配子体的长度
Tab.1Lengthofgametophytesatdifferenttemperatureandlightintensity
温度/℃temperature光照强度/(μmol·m-2·s-1)lightintensity性别sex配子体长度lengthofgametophyte/mm4d8d12d16d20d20♀0 18±0 02aA0 21±0 02aA0 23±0 01aA0 26±0 02aA0 29±0 03aA♂0 19±0 02aA0 22±0 01aA0 24±0 02aA0 27±0 03aA0 30±0 02aA1040♀0 19±0 01aA0 22±0 02aA0 24±0 03aAB0 28±0 02aAB0 32±0 04aB♂0 20±0 02aA0 23±0 03aA0 26±0 02aAB0 30±0 02aB0 34±0 02aB60♀0 20±0 02aA0 23±0 01aA0 26±0 02aB0 30±0 03aB0 34±0 01aB♂0 21±0 01aA0 24±0 02aB0 27±0 02aB0 31±0 02aB0 35±0 02aB20♀0 20±0 02abA0 24±0 02bA0 28±0 02bA0 32±0 02bA0 36±0 02bA♂0 21±0 01abA0 24±0 02abA0 29±0 01bA0 33±0 02bA0 37±0 02bA1540♀0 21±0 02abA0 24±0 03abA0 28±0 02bA0 33±0 04bA0 39±0 04bB♂0 21±0 02abA0 25±0 02abA0 28±0 03abA0 34±0 02bA0 40±0 02bB60♀0 21±0 01abA0 25±0 01abA0 29±0 02bA0 34±0 02bA0 40±0 03bBC♂0 22±0 02abA0 26±0 02abA0 30±0 02bA0 35±0 02bA0 41±0 02bBC20♀0 22±0 02bA0 26±0 01bcA0 31±0 04cA0 37±0 02cA0 42±0 02cA♂0 25±0 01cA0 27±0 02cA0 32±0 02cA0 38±0 02cA0 43±0 03cA2040♀0 23±0 02bA0 27±0 03cA0 32±0 03cA0 38±0 03cA0 43±0 02cAB♂0 26±0 01bA0 28±0 02bAB0 33±0 02cA0 39±0 02cA0 45±0 03cAB60♀0 23±0 02bA0 28±0 03bA0 32±0 01cA0 39±0 03cA0 45±0 03cB♂0 26±0 02bA0 30±0 02bB0 34±0 02cA0 40±0 02cA0 46±0 04cB
注:同列中相同照度、相同性别、不同温度下,标有不同小写字母者表示组间有显著性差异(P<0.05),同列中相同温度、相同性别、不同照度下,标有不同大写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者或相同大写字母者表示组间无显著性差异(P>0.05),下同
Note:At same light intensity,same sex, and different temperature, the means with different letters within the same column are significant differences at the 0.05 probability level. However, at same temperature,same sexes, and different light intensity, the means with different capital letters within the same column are significant differences at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
雄配子体发育时首先细胞表面产生大量乳状突起,随后突起逐渐扩大并向上延伸形成精子囊(图1-D),精子囊成熟后从顶端的开口处放出精子。精子呈梨形,长度为4~8 μm,无色素体呈透明状,依靠侧生2条鞭毛摆动游向卵,卵受精形成幼孢子体(图1-E)。
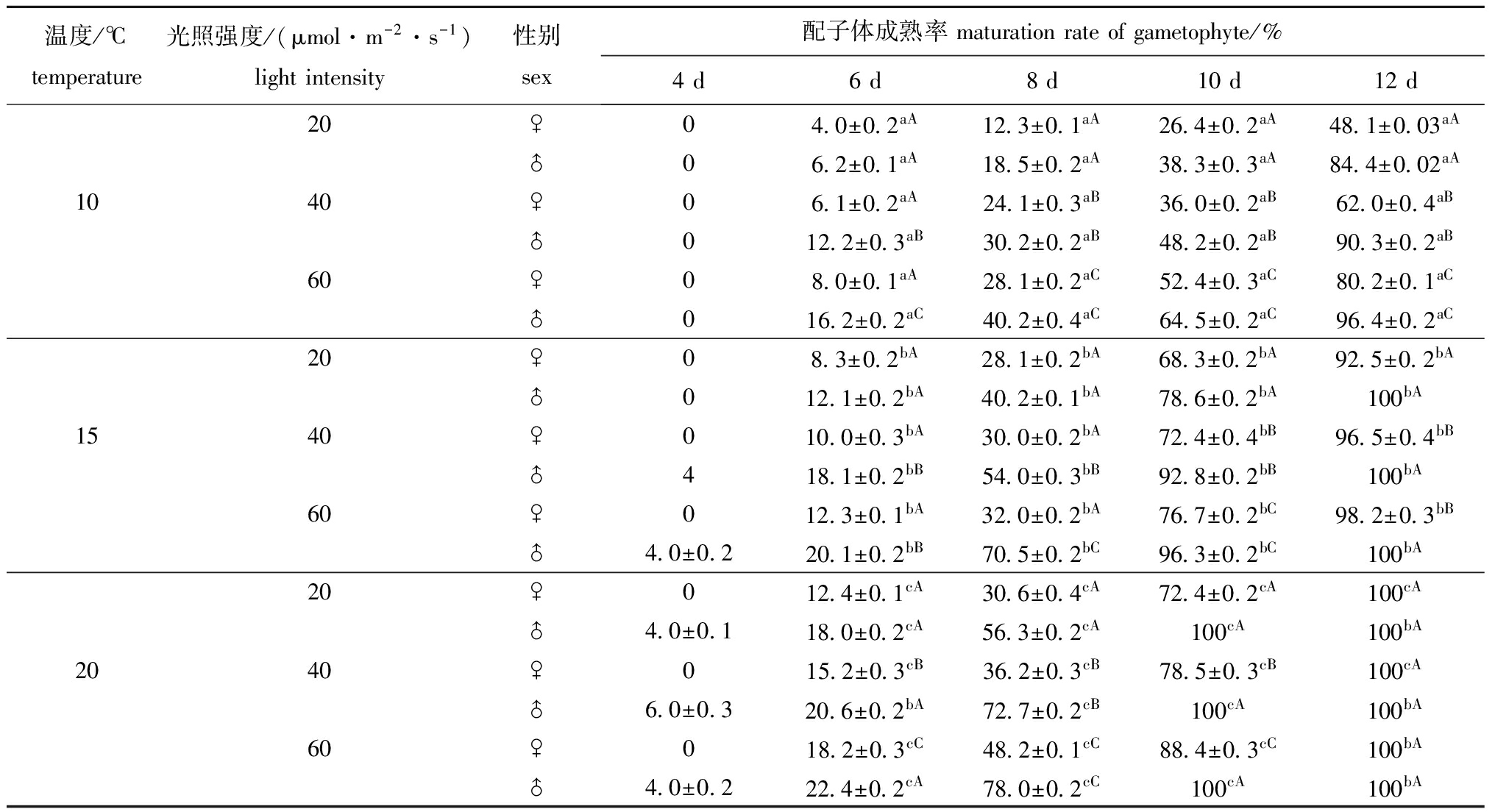
不同温度和光照强度对雌、雄配子体成熟的影响如表2所示。从表2可以看出,在设定的温度、光照强度条件下雌、雄配子体都能成熟,其中20 ℃和15 ℃组雌、雄配子体成熟时间早,成熟率也较高,培养10 d 后,各光照强度下雌、雄配子体的成熟率分别达到60%和70%以上,培养12 d后,雄配子体的成熟率达到100%,雌配子体达到92%以上,不同光照强度组间成熟率的差异不明显(P>0.05);10 ℃组雌、雄配子体的成熟率显著低于15 ℃和20 ℃组(P<0.05),且高光照强度组明显优于低光照强度组(P<0.05)。
另外,E.bicyclis配子体表现出明显的雄性先成熟的现象,在相同的培养条件下,雄配子体要比雌配子体早成熟2~3 d。
2.2温度、光照强度对幼孢子体生长的影响
卵受精后细胞拉长,由圆形变为椭圆形,先经1次横分裂形成上、下2个细胞,再经3~4次横分裂后形成6~7个细胞的单列细胞幼孢子体,随后,再经过多次细胞纵横分裂成为叶片状多细胞幼孢子体。刚形成的多细胞幼孢子体长为50~60 μm,一般由20~30个细胞组成,基部为1~2列细胞,中、上部为3~5列细胞,呈扁圆形,依靠与基部细胞连接的卵囊袋寄生在雌配子体上。当幼孢子体长度达到200 μm以上时,可见基部细胞生出数条透明的假根丝延伸到基质表面,替代卵囊袋附着在基质上。当幼孢子体长度达到800 μm以上时,由基部细胞向下延伸形成柄与假根相连,成为根、柄、叶明显的幼孢子体(图1-F)。
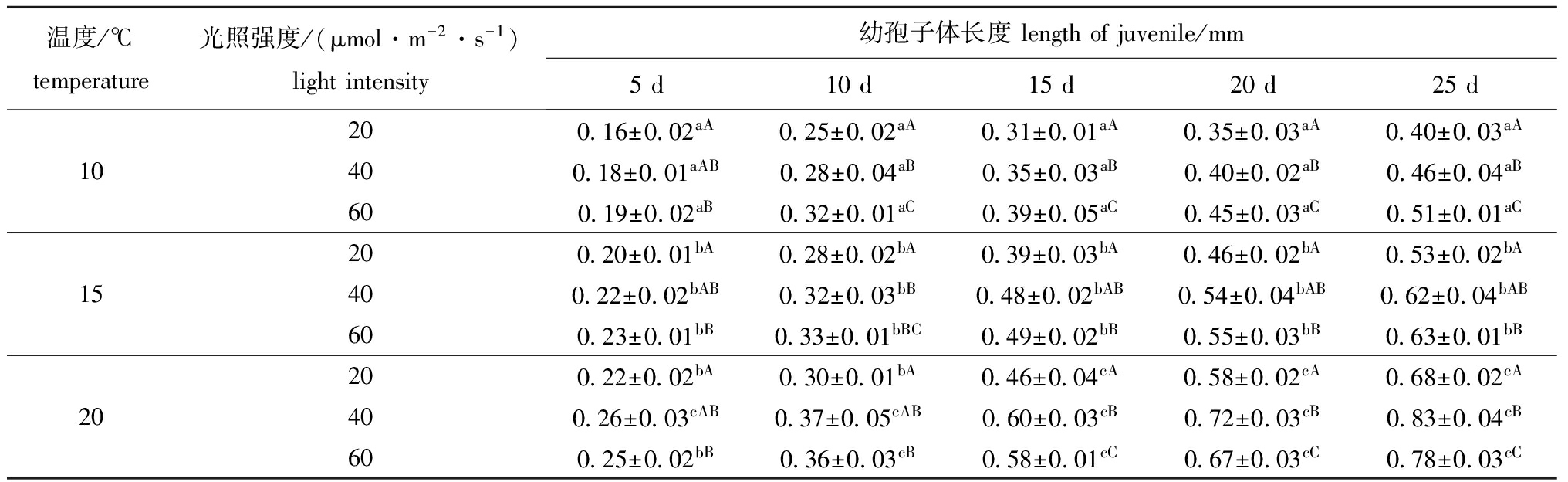
不同温度、光照强度对幼孢子体的生长有影响(表3),其中温度的影响尤为显著。在设定的3个温度下,20 ℃组幼孢子体的生长速度最快,培养25 d后各光照强度组幼孢子体的长度明显大于 15、10 ℃组(P<0.05),15 ℃组次之,10 ℃组最慢。在同一温度下,不同光照强度对培养初期的幼孢子体生长影响不明显,当藻体长度达到0.2 mm以上时,不同光照强度组间的生长差异逐渐拉大,其中10 ℃时,随着光照强度的升高幼孢子体生长速度明显加快,15 ℃和20 ℃时,20 μmol/(m2·s)组幼孢子体的生长明显慢于60 μmol/(m2·s)组(P<0.05),而40 μmol/(m2·s)与60 μmol/(m2·s) 组间幼孢子体的生长差异不明显(P>0.05)。
2.3幼苗的培育与暂养
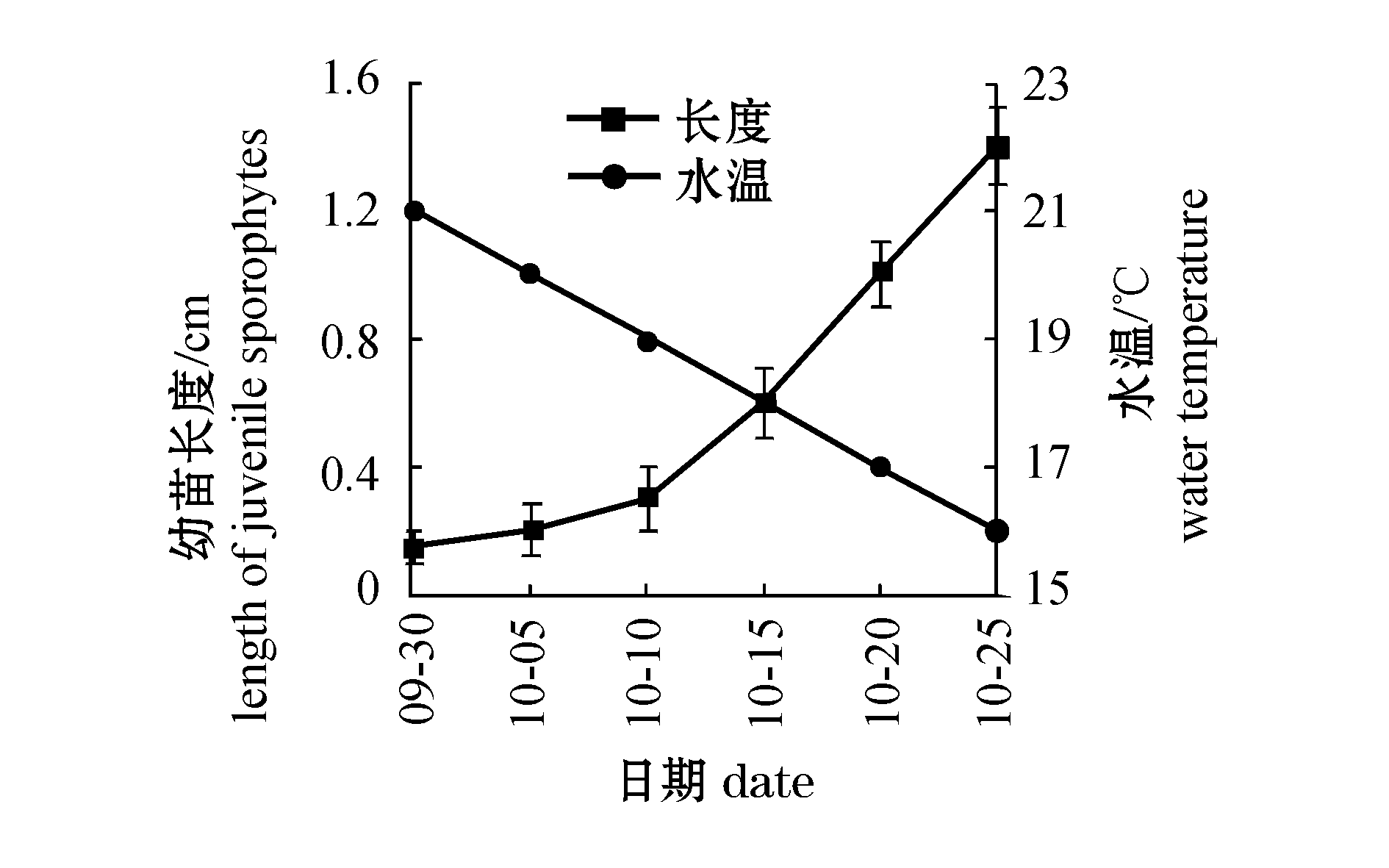
将切碎后的雌、雄配子体藻段培育3 d后在维尼纶绳上附着牢固,5 d后雄配子体陆续成熟,可见其表面产生乳状精子囊;7 d后雌配子体开始成熟,形成卵囊并排出卵,卵受精形成幼孢子体;10 d后大部分的雌、雄配子体成熟,显微镜下可见有大量幼孢子体形成;20 d后可见多数的藻体长度达到200 μm以上,已经过多次纵横分裂成为多细胞幼孢子体,叶片基部细胞已生长出透明的假根丝附着在维尼纶绳上;30 d后幼孢子体长度达到500 μm,肉眼可见维尼纶绳上浅褐色的藻落;40 d后,藻体平均长度为800 μm,少数藻体长度达到1 mm以上(图1-G),肉眼可见,显微镜下可见叶片基部已生长出的多条假根丝牢固地附着在维尼纶绳上,可下海暂养。
暂养期间幼苗的生长与水温情况如图2所示。从图2可以看出,暂养初期因对温度等海区环境的不适应和杂藻附着的影响幼苗生长缓慢,随着水温的降低和藻体的增大幼苗生长逐渐加快。暂养10 d后,幼苗平均长度为0.2 cm,藻体呈浅黄色,叶片基部可见短柄生出,下端膨大形成假根;20 d后,藻体长度达到0.6 cm,叶片、柄、假根分化明显,叶片呈椭圆形,表面平滑,柄扁呈圆形,较短,假根呈圆球状;30 d后,幼苗长度达到1.4 cm(图1-H),叶片由椭圆形变为扁圆形,随着细胞层数的增多藻体变厚、平直,柄拉长,由扁圆形变为圆柱状,球状假根上生长出叉状假根附着在维尼纶绳上,成为幼苗,可分苗栽培。
表2不同温度、光照强度下配子体的成熟率
Tab.2Maturationrateofgametophytesatdifferenttemperatureandlightintensity
温度/℃temperature光照强度/(μmol·m-2·s-1)lightintensity性别sex配子体成熟率maturationrateofgametophyte/%4d6d8d10d12d20♀04 0±0 2aA12 3±0 1aA26 4±0 2aA48 1±0 03aA♂06 2±0 1aA18 5±0 2aA38 3±0 3aA84 4±0 02aA1040♀06 1±0 2aA24 1±0 3aB36 0±0 2aB62 0±0 4aB♂012 2±0 3aB30 2±0 2aB48 2±0 2aB90 3±0 2aB60♀08 0±0 1aA28 1±0 2aC52 4±0 3aC80 2±0 1aC♂016 2±0 2aC40 2±0 4aC64 5±0 2aC96 4±0 2aC20♀08 3±0 2bA28 1±0 2bA68 3±0 2bA92 5±0 2bA♂012 1±0 2bA40 2±0 1bA78 6±0 2bA100bA1540♀010 0±0 3bA30 0±0 2bA72 4±0 4bB96 5±0 4bB♂418 1±0 2bB54 0±0 3bB92 8±0 2bB100bA60♀012 3±0 1bA32 0±0 2bA76 7±0 2bC98 2±0 3bB♂4 0±0 220 1±0 2bB70 5±0 2bC96 3±0 2bC100bA20♀012 4±0 1cA30 6±0 4cA72 4±0 2cA100cA♂4 0±0 118 0±0 2cA56 3±0 2cA100cA100bA2040♀015 2±0 3cB36 2±0 3cB78 5±0 3cB100cA♂6 0±0 320 6±0 2bA72 7±0 2cB100cA100bA60♀018 2±0 3cC48 2±0 1cC88 4±0 3cC100bA♂4 0±0 222 4±0 2cA78 0±0 2cC100cA100bA
表3不同温度、光照强度下幼孢子体的长度
Tab.3Lengthofjuvenilesporophytesatdifferenttemperatureandlightintensity
温度/℃temperature光照强度/(μmol·m-2·s-1)lightintensity幼孢子体长度lengthofjuvenile/mm5d10d15d20d25d200 16±0 02aA0 25±0 02aA0 31±0 01aA0 35±0 03aA0 40±0 03aA10400 18±0 01aAB0 28±0 04aB0 35±0 03aB0 40±0 02aB0 46±0 04aB600 19±0 02aB0 32±0 01aC0 39±0 05aC0 45±0 03aC0 51±0 01aC200 20±0 01bA0 28±0 02bA0 39±0 03bA0 46±0 02bA0 53±0 02bA15400 22±0 02bAB0 32±0 03bB0 48±0 02bAB0 54±0 04bAB0 62±0 04bAB600 23±0 01bB0 33±0 01bBC0 49±0 02bB0 55±0 03bB0 63±0 01bB200 22±0 02bA0 30±0 01bA0 46±0 04cA0 58±0 02cA0 68±0 02cA20400 26±0 03cAB0 37±0 05cAB0 60±0 03cB0 72±0 03cB0 83±0 04cB600 25±0 02bB0 36±0 03cB0 58±0 01cC0 67±0 03cC0 78±0 03cC
3讨论
对温度、光照等条件的适应能力是评价藻类生产力水平和产业化应用价值的重要指标,对于海带目种类来说,雌、雄配子体在生长发育和幼孢子体生长过程中对温度、光照等条件的适应能力,特别是雌、雄配子体发育至成熟的过程中对温度的适应能力,不仅关系到苗种生产中培养条件的控制,也是判断其自然分布属性和评价其生产力水平的重要依据[11]。E.bicyclis属于多年生海藻,具有适温范围广、环境适应能力强和藻场易形成的特点,这也是日本太平洋一侧广阔地区内其作为海底森林和海洋牧场主要种类的原因之一[3-4,7-8]。
本研究中发现,E.bicyclis雌、雄配子体发育至成熟阶段对温度具有广泛的适应性,在设定的3个温度条件下,雌、雄配子体均能够发育成熟,在较高温度下,雌、雄配子体成熟的快且成熟率也较高,不同温度仅影响雌、雄配子体的发育程度,在10 ℃时,培育20 d后雌、雄配子体的成熟度也均达到90%以上,这表明其具有广温性海藻特点。
E.bicyclis雌、雄配子体的生长和发育,以及幼孢子体生长对温度的广适性可为人工繁育提供有利条件。本研究结果表明,雌、雄配子体发育程度和幼孢子体生长对因更换培养液引起的温差变动不敏感,表现出成熟率高、卵受精率高和幼孢子体生长速度快、易培养的特点,在室内均能培育出一定数量的幼孢子体,经过海上暂养后,也能培育出大规格E.bicyclis种苗,这为在中国北方开展其苗种繁育提供了参考依据。关于E.bicyclis能否用于中国北方海底森林和海洋牧场建设,成为大规模增殖的重要海藻,还有待继续深入研究。
参考文献:
[1] 殖田三郎,岩本康三,三浦昭雄.水産植物学[M].東京:恒星社厚生阁,1978:408-412.
[2] 新崎盛敏.アラメ.カジメの分类[M].東京:海洋科学,1985:760-765.
[3] 德田広,大野正夫,小河久郎.海藻資源養殖学[M].東京:绿書房,1987:201-203.
[4] 中久喜昭.アラメ.カジメ場,藻場.海中林[M].東京:恒星社厚生阁,1981:116-129.
[5] 崛辉三.藻类の生活史集成第2卷:褐藻、红藻类[M].東京:内田老鹤圃,1993:125-137.
[6] 吉田忠生.アラメの物貭生産に関する2,3の知见[J].東北区水研研報,1970,30:107-112.
[7] 谷口和也.アラメ海中林の造成[J].水産の研究,1984,2(3):81-85.
[8] 喜田和四郎,前川行幸.アラメ.カジメ群落に関する研究Ⅱ[J].三重大水産实験所研報,1983,10:57-69.
[9] 西澤一俊,千原光雄.海藻研究法[M].東京:共立出版,1979:281-293.
[10] 张泽宇,曹淑清,邵魁双,等.裙带菜配子体采苗及育苗的研究[J].大连水产学院学报,1999,14(3):19-25.
[11] 曾呈奎,王素娟,刘思俭,等.海藻栽培学[M].上海:上海科学技术出版社,1985:11-15.
BreedingandcultureinclonedseedlingsofseaweedEiseniabicyclis
CAO Shu-qing,ZHANG Ze-yu,LI Xiao-li,YOU Xue-ce
(Key Laboratory of Mariculture & Stock Enhancement in North China’s Sea, Ministry of Agriculture, Dalian Ocean University, Dalian 116023,China)
Abstract:The effects of temperature(10, 15,and 20 ℃)and light intensity [20, 40, and 60 μmol/(m2·s)] on growth and maturation of gametophytes and juvenile sporophytes of sea weedEiseniabicyclisintroduced from Japan. The results showed that the best growth of female and male gametophytes was observed at 20 ℃, followed by at 15 ℃ and then at 10 ℃. The higher light intensity was, the better growth was found at 10 ℃, and there was less difference in growth among different light intensity groups as water temperature was rising. It was found that the suitable temperatures for the development and maturation of male and female gametophytes were 15 ℃ with maturation rate of above 95% and 20 ℃ with maturation rate of 100%,significantly higher at high light intensity than at low light intensity in 12 day culture. The juvenile sporophytes had best growth at 20 ℃ and poor growth at 15 ℃ and 10 ℃ in each light intensity. The higher light intensity was, the better growth of juvenile sporophytes were at 10 ℃. There was better growth in juvenile sporophytes at 20 μmol/(m2·s) than at 40 μmol /(m2·s) and 60 μmol/(m2·s),without significantly difference at 15 ℃ and 20 ℃. The cloned seedlings bred by the treated gametophytes were reared indoor to juvenile sporophytes with body length of 800 μm, which then were cultured to juveniles with body length of 2 cm in the sea in one month holding culture.
Key words:Eiseniabicyclis; indoor culture; cloned seedling breeding; holding culture in the sea
DOI:10.3969/J.ISSN.2095-1388.2014.05.001
文章编号:2095-1388(2014)05-0425-06
收稿日期:2013-12-19
基金项目:国家海洋公益项目(201405040)
作者简介:曹淑青(1971—), 男, 工程师。E-mail:csq@dlou.edu.cn
中图分类号:S968.42
文献标志码::A