摘要:在水温为18 ℃下,按10 mg/kg(体质量)对体质量为(200±30)g的福瑞鲤Cyprinuscarpio单次肌肉注射和混饲口灌培氟沙星,于不同时间点采集鲤血浆、肌肉、肝胰脏、肾脏组织,经超高液相色谱法测定各组织中培氟沙星的浓度,并采用DAS 3.0药物代谢动力学软件的非房室模型统计矩方法分析药时数据。结果表明:混饲口灌给药和肌注给药后,培氟沙星的药时曲线下面积(AUC)分别为88.35、139.9 mg·h/L,达峰浓度(Cmax)分别为2.092、3.687 mg/L,达峰时间(Tmax)分别为4.0、0.5 h,消除半衰期(t1/2)分别为22.301、74.357 h,表观分布容积(Vd)分别为5.464、15.342 L/kg,总体清除率(CL)分别为0.170、0.143 L·kg/h。研究表明,肌肉注射给药较混饲口灌达峰时间短,达峰浓度高,半衰期长,生物利用度高。
关键词:鲤;培氟沙星;药代动力学;给药方案
鲤是中国的主要经济鱼类之一,细菌性鱼病是鲤养殖的主要限制因素,尤其是细菌出血性败血病最为严重,其主要致病菌为温和气单胞菌和嗜水气单胞菌。诺氟沙星[1-2]、恩诺沙星[3-4]、环丙沙星[5]等喹诺酮类药物已长期应用于鱼类细菌性疾病的防治,由于滥用、乱用药物现象严重,已导致鱼类细菌产生耐药性。培氟沙星(Pefloxacin)是第三代喹诺酮类药物,由于其分子基本结构中引入了疏水性的氟原子及亲水性的吡嗪环,在体内具有良好的组织渗透性,除脑组织和脑液外,在各组织和体液中均有良好的分布,不仅抗菌性能更强、更广谱(包括革兰氏阳性菌),而且使用方便、成本低、治疗效果显著、不良反应少[6],比早期喹诺酮类药物的细菌耐药性有所降低[7]。目前,培氟沙星已广泛应用于水产养殖中,但尚未见关于该类药物在鱼类体内药动学方面的报道,使用该类药物治疗水生动物的细菌性病时,大多是借鉴兽医对哺乳动物的研究成果,造成该类药物在水产业疾病防治用药的盲目性[8]。本研究中,进行了培氟沙星在福瑞鲤Cyprinuscarpio体内药代动力学研究,旨在指导临床合理用药,有效控制鱼类细菌性疾病。
1.1材料
试验用鲤由九台水产良种场提供,体质量为(200±30)g,共300尾,试验前一周暂养在水族箱内。
试验试剂:乙腈(色谱纯)、KH2PO4、NaOH、HCOOH均为分析纯;甲磺酸培氟沙星标准品由中国兽药监察所提供;培氟沙星原料药(含甲磺酸培氟沙星不少于98.0%),由南京农牧高科生物技术有限公司提供。
试验仪器:超高液相色谱仪(Waters ACQUITY UPLC)、离心机(XiangYi L-550)、振荡器(IKA MS3 digital)、氮吹仪(HGC-24A)、Waters OasisR HLB固相萃取柱等。
1.2方法
1.2.1 肌肉注射给药及样品的采集 用生理盐水将甲磺酸培氟沙星配制成所需浓度,按照培氟沙星10 mg/kg(体质量)的剂量给每尾鲤肌肉注射,共注射150尾,于给药后0.08、0.25、0.50、1、2、4、6、8、12、24、48、72、96、120 h时间点分别取6尾鱼,自尾静脉采集血样,同时将鱼处死,取其肌肉、肝胰脏、肾脏等组织,继续于168、216、264、312、360、408 h采集肌肉、肝胰脏、肾脏等组织。将采集的血样置于含1%肝素离心管中混匀、离心,分离上清液血浆,每个样品设6个重复。血浆及各组织样品于-20 ℃下保存备用。
1.2.2 混饲口灌给药[9]及样品的采集 将培氟沙星溶解后混入饲料中,加水搅拌成糊状,配制成一定浓度。按照10 mg/kg(体质量)的剂量灌入每尾试验鱼的前肠,共口灌150尾,无回吐者保留作为试验鱼。于给药后0.25 h开始采集血液、肌肉、肝胰脏、肾脏样品,后期处理同上。
1.2.3 样品的前处理[10-13]
血浆样品:量取0.5 mL血浆,加入5 mL乙腈,振荡2 min,以4000 r/min离心10 min,转移上清液,再加5 mL乙腈重复上述操作一次,合并上清液,在50 ℃下用氮气保护浓缩至近干,用流动相溶液定容至1.0 mL,待上机检测。
肌肉、肝胰脏、肾脏样品:称取2.0 g剪碎的样品组织于50 mL塑料离心管中,加入pH为7.0(肝胰脏、肾脏用pH为4.5)的PB液10 mL,振荡2 min,以4000 r/min离心10 min,转移上清液,重复上述操作一次,合并上清液,取合并上清液5.0 mL过柱,将HLB固相萃取柱预先依次用1 mL甲醇、1 mL水活化,用1 mL水淋洗、吹干,最后用1 mL流动相洗脱,洗脱液过0.22 μm滤膜后待超高液相色谱分析。
1.2.4 超高液相色谱(UPLC)的测定条件 色谱柱为ACQUITY UPLCTMBEH C18(2.1 mm×50 mm,1.7 μm),柱温为35 ℃,流速为0.4 mL/min,流动相为0.1%甲酸水溶液与乙腈的混合液(体积比为90∶10),检测波长为280 nm,进样体积为3 μL。
1.2.5 线性范围和最低检出限 准确称取含10.0 mg培氟沙星的甲磺酸培氟沙星标准品,用水定容至100 mL,配制成浓度为100 μg/mL的母液,用流动相稀释为0.01、0.05、0.10、0.70、2.00、5.00、10.00 μg/mL的标准使用液,用UPLC进行测定,以峰面积为纵坐标、浓度为横坐标做标准曲线,分别求出回归方程、相关系数。以引起3倍信噪比(S/N≥3)的药物浓度为最低检出限。
1.2.6 回收率与精密度 对空白血浆、肌肉、肝胰脏、肾脏样品分别进行高、中、低3组加标试验,然后按照“1.2.3”节中的方法进行处理后测定,回收率按下式计算:
回收率![]() 。
。
上述样品于1 d内重复测定5次,连续测定5 d,计算各浓度水平响应值峰面积的变异系数,以此衡量检测方法的精密度。
1.3数据处理
药代动力学模型拟合及参数采用DAS 3.0和SPSS软件进行计算。
2.1色谱方法验证[13]
采用本试验中的方法,血浆、肌肉、肝胰脏和肾脏中的杂质和标样峰分离良好,标样谱图中物质色谱峰尖锐且对称(图1)。
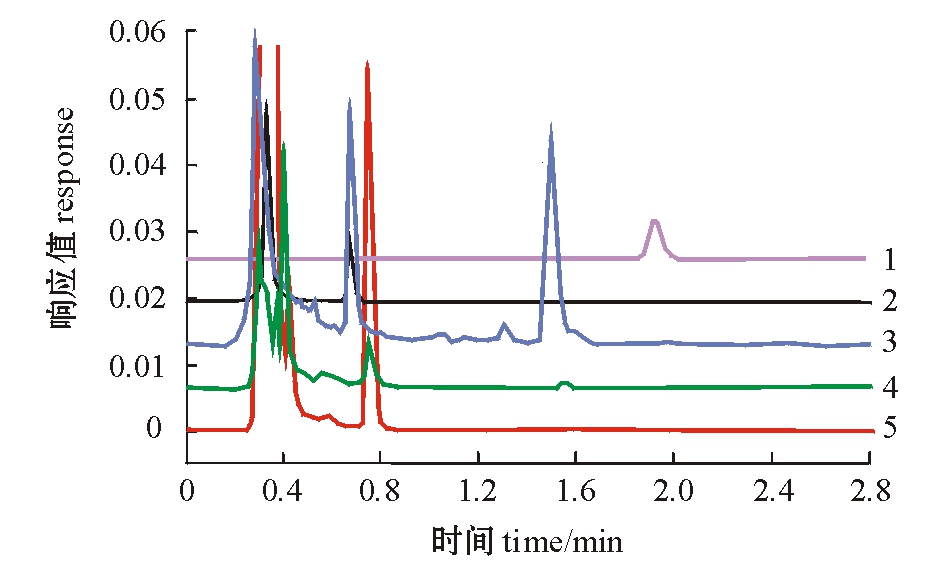
注:1标样;2~5分别为肌肉空白、肾脏空白、肝胰脏空白、血浆空白
Note:1,standard solutio;2-5 is blank muscle,blank kidney,blank hepatopancreas,and blank plasma,respectively
图1 标样谱图及鲤各组织空白谱图
Fig.1 Chromatogram of pefloxacin standard solution and blank chromatogram in the issues of common carp
培氟沙星标准液在0.01~10.00 μg/mL浓度范围内有良好的相关性,相关系数R2=0.999。血浆的检出限为0.01 μg/mL,肌肉、肝胰脏、肾脏的检出限均为20 μg/kg。各组织中培氟沙星回收率均在70%以上。日内变异系数为0.13%~1.95%,日间变异系数为2.11%~4.50%。表明该试验的准确度和精密度均良好。
2.2培氟沙星在鲤体内的药代动力学参数
按10 mg/kg(体质量)混饲口灌给药和肌注给药后,鲤血浆中培氟沙星的药动学参数见表1。
表1不同给药方式下培氟沙星在鲤血浆中的药物代谢动力学参数
Tab.1Pharmacokineticsparametersofpefloxacininplasmaofthecommoncarpchallengedbydifferentadministration
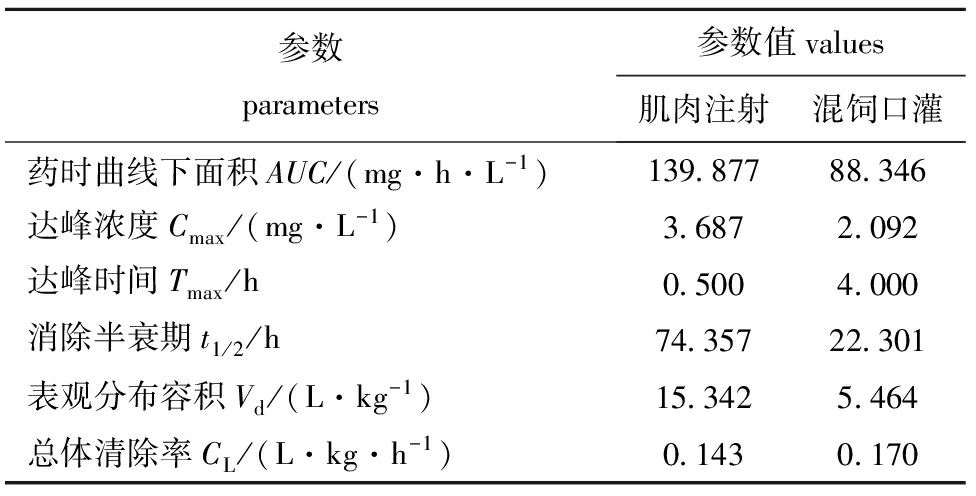
参数parameters参数值values肌肉注射混饲口灌药时曲线下面积AUC/(mg·h·L-1)139 87788 346达峰浓度Cmax/(mg·L-1)3 6872 092达峰时间Tmax/h0 5004 000消除半衰期t1/2/h74 35722 301表观分布容积Vd/(L·kg-1)15 3425 464总体清除率CL/(L·kg·h-1)0 1430 170
2.3不同给药方式下培氟沙星在各组织中的含量
从表2和表3可见:混饲口灌培氟沙星后鲤肌肉中的药物浓度于24 h时达到峰值4536.25 μg/kg,之后处于消除阶段,直至408 h时药物浓度为42.35 μg/kg;鲤肌注给药后肌肉中的药物浓度于6 h时达到峰值5035.28 μg/kg。混饲口灌培氟沙星后肝胰脏中药物浓度于2 h时达到峰值11 518.73 μg/kg;肌注给药比口灌给药提前达到峰值,其药物达峰时间为0.50 h,峰值为5456.30 μg/kg。混饲口灌后肾脏中药物浓度于2 h时达到峰值13 192.74 μg/kg;肌注给药后肾脏中药物浓度于0.50 h时达到峰值11 137.97 μg/kg。
表2混饲口灌给药后培氟沙星在鲤各组织中的含量
Tab.2Massconcentrationofpefloxacinintissuesofcommoncarpwithoraladministration
μg/kg
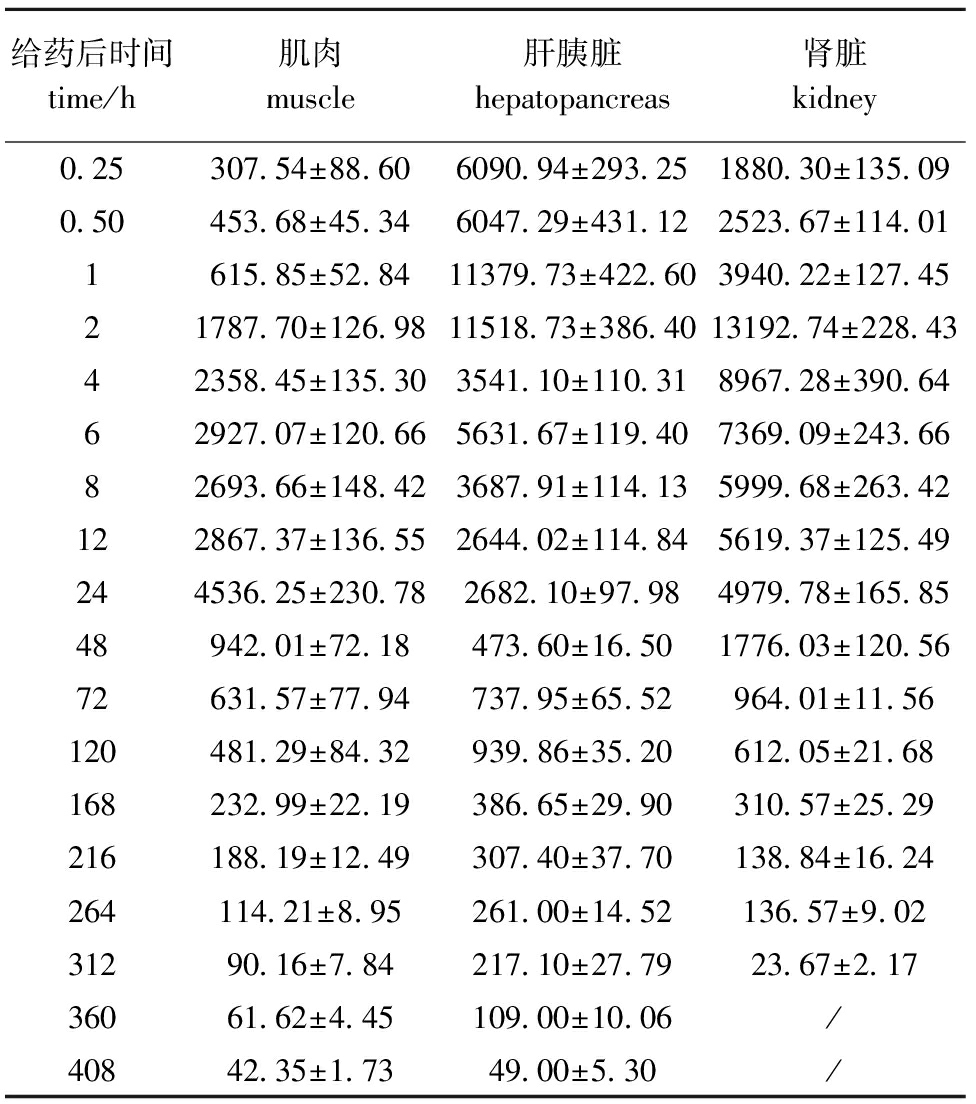
给药后时间time/h肌肉muscle肝胰脏hepatopancreas肾脏kidney0 25307 54±88 606090 94±293 251880 30±135 090 50453 68±45 346047 29±431 122523 67±114 011615 85±52 8411379 73±422 603940 22±127 4521787 70±126 9811518 73±386 4013192 74±228 4342358 45±135 303541 10±110 318967 28±390 6462927 07±120 665631 67±119 407369 09±243 6682693 66±148 423687 91±114 135999 68±263 42122867 37±136 552644 02±114 845619 37±125 49244536 25±230 782682 10±97 984979 78±165 8548942 01±72 18473 60±16 501776 03±120 5672631 57±77 94737 95±65 52964 01±11 56120481 29±84 32939 86±35 20612 05±21 68168232 99±22 19386 65±29 90310 57±25 29216188 19±12 49307 40±37 70138 84±16 24264114 21±8 95261 00±14 52136 57±9 0231290 16±7 84217 10±27 7923 67±2 1736061 62±4 45109 00±10 06/40842 35±1 7349 00±5 30/
表3肌肉注射给药后培氟沙星在鲤各组织中的含量
Tab.3Massconcentrationofpefloxacinintissuesofthecommoncarpchallengedbyintramuscularinjection
μg/kg
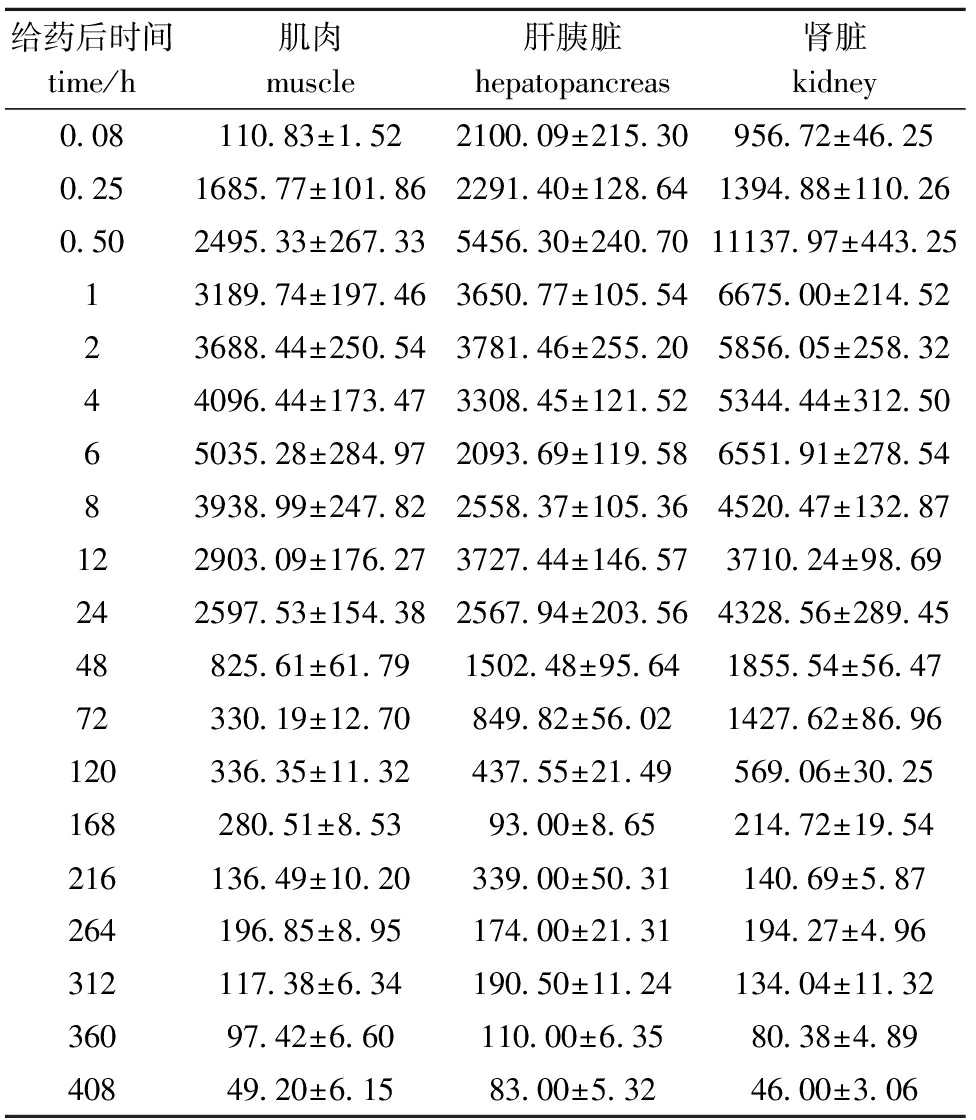
给药后时间time/h肌肉muscle肝胰脏hepatopancreas肾脏kidney0 08110 83±1 522100 09±215 30956 72±46 250 251685 77±101 862291 40±128 641394 88±110 260 502495 33±267 335456 30±240 7011137 97±443 2513189 74±197 463650 77±105 546675 00±214 5223688 44±250 543781 46±255 205856 05±258 3244096 44±173 473308 45±121 525344 44±312 5065035 28±284 972093 69±119 586551 91±278 5483938 99±247 822558 37±105 364520 47±132 87122903 09±176 273727 44±146 573710 24±98 69242597 53±154 382567 94±203 564328 56±289 4548825 61±61 791502 48±95 641855 54±56 4772330 19±12 70849 82±56 021427 62±86 96120336 35±11 32437 55±21 49569 06±30 25168280 51±8 5393 00±8 65214 72±19 54216136 49±10 20339 00±50 31140 69±5 87264196 85±8 95174 00±21 31194 27±4 96312117 38±6 34190 50±11 24134 04±11 3236097 42±6 60110 00±6 3580 38±4 8940849 20±6 1583 00±5 3246 00±3 06
3.1检测方法
建立可靠的分析方法是进行临床药代动力学研究的关键之一。目前,有关水产品中培氟沙星的测定标准有农业部1077号公告-1—2008[14]和GB/T 21312—2007[15],均采用液相色谱-串联质谱法,检出限较低,均为1.0 μg/kg。本试验中采用超高液相色谱法,检出限为20 μg/kg,但根据行业标准NY 5070—2002[16]水产品中渔药残留限量的规定,环丙沙星、诺氟沙星和恩诺沙星的残留限量为50 μg/kg,但没有明确规定培氟沙星最高残留限量,若参照NY 5070—2002中同类药物残留限量的规定,本试验中检出限即可满足要求。而且线性范围、回收率、精密度均能达到药代动力学试验要求。本试验中选用UPLC,3 min即可检测一个样品,而使用HPLC需要15~25 min,大大缩短了检测时间,减少了流动相的浪费,降低了有机溶剂对环境的污染,保护了操作人员的身体健康。
UPLC超高的分析速度极大地提高了大批量样品的分析效率,而消耗时间较长的前处理环节成为了整个分析周期的瓶颈, 如何尽量缩短样品前处理时间成为了亟需解决的问题之一[17]。本试验中,前处理过程操作简便快捷,利用磷酸二氢钾水溶液提取,取代了传统方法中使用的有机溶剂,安全无毒,解决了前处理时间长、杂质干扰的问题。本检测方法的建立,对于此类药物在鱼体中的药代动力学及其残留的研究均有一定的实际意义。
3.2培氟沙星在鲤体内的药代动力学参数
从培氟沙星在鲤体内的药动学参数可以看出,不同给药方式对其药动学参数的影响比较大。培氟沙星混饲口灌给药后,经消化道消化进入血液,达峰时间比肌注给药晚,达峰浓度较肌注小;而肌注给药方式下消除半衰期较混饲口灌给药长,与血浆AUC较大有关,这与张雅斌等[1]对诺氟沙星在鲤体内的药动学研究时得出的肌注给药时的t1/2(3.40 h)较混饲口服给药半衰期(2.02 h)长的结果相一致。 李春雨等[4]研究表明,腹腔注射和口灌恩诺沙星后药物在鲤体内的药动学均符合一级消除二室模型,其血浆AUC分别为59.185、600.296 μg·h/mL,Cmax分别为3.297、3.266 1 μg/mL,t1/2分别为96.545 6、168.287 1 h,表明口灌组血浆吸收要好于腹腔注射组,t1/2要比腹腔注射组时间长。杨雨辉等[5]研究表明,按10 mg/kg混饲口服乳酸环丙沙星在鲤体内的药动学参数:AUC为5.29 mg·h/L,t1/2为14.47 h,Cmax为0.70 μg/mL,Tmax为1.10 h。其AUC明显小于本研究中混饲口灌给药时的AUC值,AUC是衡量药物在体内吸收和分布的主要药动学参数,这说明培氟沙星在鲤体内的吸收较环丙沙星好,生物利用度高。本研究中,混饲口灌给药方式的Vd为5.464 L/kg,小于肌注方式的Vd(15.342 L/kg),Vd可以反映药物分布的广泛程度或与组织中大分子的结合程度。Vd越小,说明药物排泄越快,在体内存留的时间短,而Vd越大,药物排泄越慢,在体内存留的时间越长,正好与半衰期的长短一致。
3.3肌肉注射和混饲口灌培氟沙星后药物在鲤体内的分布和消除特征
从两种给药方式下培氟沙星在鱼体不同组织的药时含量可以看出,培氟沙星在各组织中的浓度均为开始逐渐上升达峰后逐渐下降的变化过程。同时也可以看出,肌肉注射给药后培氟沙星在鲤体内的达峰时间均小于混饲口灌给药,说明肌肉注射培氟沙星在鲤体内的分布速率快于口灌给药。同种给药方式下,肝胰脏和肾脏同时达峰,随后是肌肉,并且达峰时肝胰脏和肾脏组织中的峰浓度大于肌肉中的峰浓度。这可能是由于肝胰脏和肾脏渗透性好且血管丰富,所以药物首先分布在这些组织中,比在渗透性差、血管贫乏的肌肉中分布得多[18]。培氟沙星在鲤体内的分布规律与梁俊平等[19]报道的恩诺沙星在大菱鲆体内的分布特征一致。鲤肌注培氟沙星后的t1/2与梁俊平等[19]报道的大菱鲆肌注恩诺沙星t1/2(68.003 h)相差不多,与张雅斌等[1]报道的鲤肌注诺氟沙星后的t1/2(3.40 h)相差很大。鲤混饲口灌培氟沙星后的t1/2与梁俊平等[19]、张雅斌等[1]和李春雨等[4]报道的鲤口灌恩诺沙星后的t1/2相差均很大。这些差异可能是由于种属[20]、性别[21]、给药方式[22]等原因造成的,因此,造成水产动物药代动力学差异的原因非常复杂,须慎重分析其差异才能制定出合理的给药方案。
3.4建议给药方案
培氟沙星作为第三代喹诺酮类药物,在水产养殖上主要作为内服药物混饲投喂。对于特殊的水产动物或特殊病例,可以采用注射或药浴方法,出于对环境保护的考虑,不允许在水体中泼洒给药。内服给药方案的制定,主要依据药物的药效学和在鱼体内药代动力学研究结果,以及生产应用效果。
刘艳辉等[23]对淡水鱼类细菌出血性败血病致病菌嗜水气单胞菌和温和气单胞菌进行了体外药效试验,培氟沙星均具有很好的抗菌活性,培氟沙星对两种菌的最小抑菌浓度(MIC)均为0.01 μg/mL。本试验结果表明,以10 mg/kg(体质量)的剂量给鱼肌肉注射和混饲口服培氟沙星,培氟沙星在鱼体中血药浓度迅速上升,肌注给药0.5 h时药物即达到峰值,口灌给药4 h 达到峰值。而且药物在鱼体血液中维持有效浓度的时间长,从给药后0.17 h到120 h 均在温和气单胞菌和嗜水气单胞菌的最小抑菌范围内。根据此试验结果和养殖生产的具体情况,确定给药次数为每日1次,即可防治鱼类细菌性出血病、打印病、烂鳃病、肠炎病、赤皮病和白头白嘴病等。考虑到药饵入水的散失和水产动物摄食的不确定性,制定给药方案时应该加大药量。培氟沙星用于防治细菌性疾病时,按每日每千克鱼体质量10~20 mg的剂量,每日给药2次,连续混饲投喂5~7 d。药浴或注射,可用于特殊水产动物或特殊需要。药浴时,浓度为4 mg/L,时间为1~2 h;肌注时,剂量为5 mg/kg(体质量),每日注射1次,3~5 d为一疗程。
参考文献:
[1] 张雅斌,张祚新,郑伟,等.不同给药方式下鲤对诺氟沙星的药代动力学研究[J].水产学报,2000,24(6):559-563.
[2] 张祚新,张雅斌,杨永胜,等.诺氟沙星在鲤鱼体内的药代动力学[J].中国兽医学报,2000,20(1):66-69.
[3] 黄文祥,邓文武.恩诺沙星在水产动物体内药物代谢的研究概况[J].中国实用医药,2009,4(12):233-234.
[4] 李春雨,李继昌,卢彤岩,等.不同给药方式下恩诺沙星在鲤体内的药动学研究[J].集美大学学报,2009,14(3):8-13.
[5] 杨雨辉,卢彤岩,赵吉伟,等.环丙沙星在鲤鱼各组织中的残留消除规律[J].中国兽医杂志,2010,46(11):61-63.
[6] 刘明亮.喹诺酮类抗菌药的概况与展望[J].国外医药:抗生素分册,2001,22(1):1-4.
[7] 肖永红.喹诺酮类药物的抗菌和细菌耐药机制[J].国外医药:抗生素分册,1994,15(4):291-295.
[8] 王瑞旋, 陈毕生.喹诺酮类药物在水产养殖中的应用研究概况[J].南方水产,2007,3(3):73-79.
[9] 刘艳辉,李改娟,祖岫杰,等.水温和药物剂量对德国镜鲤体内氟苯尼考和氟苯尼考胺残留的影响[J].大连海洋大学学报,2013,28(2):127-132.
[10] 董艳峰,于静泉,张巍.超高效液相色谱法同时测定鸡肝中五种氟喹诺酮类药物残留[J].中国兽药杂志,2010,44(6):5-8.
[11] 董琳琳,刘艳华,汪霞,等.反相高效液相色谱法同时测定4种氟喹诺酮类药物在鸡可食性组织中的残留[J].色谱,2005,23(3):285-288.
[12] 赵思俊,李存,江海洋,等.高效液相色谱检测动物肌肉组织中7种喹诺酮类药物的残留[J].分析化学,2007,35(6):786-790.
[13] 李改娟,刘艳辉,郭军,等.超高效液相色谱法测定鱼体组织中培氟沙星的含量[J].水产学杂志,2013,26(2):26-28.
[14] 中华人民共和国农业部.中华人民共和国农业部1077号公告-1—2008 水产品中17种磺胺类及15种喹诺酮类药物残留量的测定 液相色谱-串联质谱法[S].北京:中华人民共和国农业部,2008.
[15] 中国国家标准化管理委员会.GB/T 21312—2007 动物源性食品中14种喹诺酮药物残留检测方法液相色谱-质谱/质谱法[S].北京:国家质量监督检验检疫总局,2007.
[16] 中华人民共和国农业部.NY5070—2002无公害食品 水产品中渔药残留限量[S].北京:中华人民共和国农业部,2002.
[17] 朱凌,张双庆,李佐刚,等.超高效液相色谱(UPLC)在药物代谢动力学中的应用[J].中国药事,2011,25(8):829-831.
[18] 邓树海,张秀珍,邹立家.药物动力学与生物药剂学[M].天津:天津科技翻译出版公司,1992:239-450.
[19] 梁俊平,李健,张喆,等.肌注和口服恩诺沙星在大菱鲆体内的药代动力学比较[J].水生生物学报,2010,34(6):1122-1128.
[20] 房文红,邵锦华,施兆鸿,等.斑节对虾血淋巴中诺氟沙星含量测定及药代动力学研究[J].水生生物学报,2003,27(1):13-17.
[21] 杨先乐,刘至治,恒山雅仁.盐酸环丙沙星在中华绒螯蟹体内药物代谢动力学研究[J].水生生物学报,2003,27(1):18-22.
[22] Ho S P,Cheng C F,Wang W S.Pharmacokinetic and deletion studies of sarafloxacin after oral administration to eel(Anguillaanguilla)[J].Journal of Veterinary Medical Science,1999,61(5):459-463.
[23] 刘艳辉,李改娟,祖岫杰,等.培氟沙星对淡水鱼类细菌出血性败血病药效学研究[J].水产科技情报,2014,41(1):17-20.
Abstract:The concentration of pefloxacin was determined in plasma, muscle, hepatopancreas and kidney of FFRC common carpCyprinuscarpiostrain with body weight of (200±30)g challenged by a single intramuscular injection and oral administration at a dose of 10 mg/kg body weight by the ultrahigh performance liquid chromatography at water temperature of 18 ℃, and the data were analyzed by the non-compartmental analysis method of DAS 3.0 pharmacokinetic program software to establish a reasonable withdrawal period for pefloxacin in common carp. The Auc was found to be 88.35 mg·h/L for oral administration and 139.9 mg·h/L for the injection. The elimination half-life(t1/2) was found to be 22.301 h after oral administration and 74.357 h after injection,and the volume of distribution(Vd) 5.464 L/kg for oral administration and 15.342 L/kg for the injection. The peak concentration of the pefloxacin (Cmax) was 2.092 mg/L for oral administration and 3.687 mg/L for the injection, and the peak time(Tmax) 4.0 h for oral administration and 0.5 h for the injection. The total body clearance(CL) of pefloxacin was 0.170 L·kg/h for oral administration and 0.143 L·kg/h for the injection. It is concluded that more quickly absorption, higher peak plasma concentration, higher bioavailability and faster elimination is observed in intramuscular injection compared with the oral administration.
Key words:common carp; pefloxacin; pharmacokinetics; dosage regime
DOI:10.3969/J.ISSN.2095-1388.2014.04.012
文章编号:2095-1388(2014)04-0386-05
收稿日期:2013-11-22
基金项目:国家现代农业产业技术体系(CARS-46-29);吉林省公益性科研院所行业科研项目;吉林省世行贷款农产品质量安全项目(2011-YS9); 吉林省科技发展计划项目(20140417021CB)
中图分类号:S965.116
文献标志码::A