饲料中亚油酸和亚麻酸含量对团头鲂幼鱼生长、体成分和消化酶活性的影响
王煜恒1、2,刘文斌2,王会聪1,陈军1,骆桂兰1,邢军1
(1. 江苏农林职业技术学院 畜牧兽医系,江苏 镇江 212400;2. 南京农业大学 动物科技学院 江苏省水产动物营养重点实验室, 江苏 南京 210095)
摘要:采用3×3双因子设计方法,设3个亚油酸(LA)水平(0.5%、1.0%、1.5%,占饲料质量比)和3个亚麻酸(ALA)水平(0.5%、0.9%、1.3%),配制成9种饲料,分别投喂9组鱼,每组设4个重复,每个重复放20尾鱼(体质量为0.80 g±0.02 g),共饲养8周,探讨饲料中LA和ALA含量对团头鲂Megalobramaamblycephala幼鱼生长、体成分和消化酶活性的影响。结果表明:幼鱼的增重率、特定生长率和蛋白质效率均随饲料中LA和ALA含量的增加先升高后降低,当LA为1.0%和ALA为0.9%时均达到最高;通过二次回归方程分析得出,LA、ALA的最适添加量分别为1.09%、0.84%;ALA为1.3%组的饲料系数显著高于其他两个ALA组(P<0.05),而添加LA对饲料系数无显著影响(P>0.05);LA为1.0%组的鱼体肥满度显著高于其他两个LA组(P<0.05),全鱼粗脂肪含量随LA含量的增加显著升高(P<0.05),而水分及肝胰脏脂肪含量的变化趋势与此相反;ALA对鱼体肥满度及全鱼水分和粗脂肪含量无显著影响(P>0.05);LA为0.5%组的肠道脂肪酶和蛋白酶活性显著低于其他两个LA组(P<0.05),而ALA为1.3%时对酶活又有所抑制;LA和ALA含量对肝体指数、脏体指数、全鱼粗蛋白质、粗灰分和肠道淀粉酶活性均无显著影响(P>0.05)。研究表明,团头鲂幼鱼对LA、ALA的需要量分别为1.0%~1.5%和0.5%~0.9%,当饲料中添加1.09%的LA和0.84%的ALA时,团头鲂幼鱼生长较好,各项生理机能指标正常。
关键词:团头鲂;亚麻酸;亚油酸;生长性能;消化酶
鱼类的必需脂肪酸(essential fatty acid, EFA)是一些不能由鱼体自身合成而只能由食物提供的满足其正常生长发育及维持细胞组织功能所必需的多不饱和脂肪酸。必需脂肪酸缺乏或者相互之间组成不平衡,均会导致鱼类生长速度及饲料转化率下降,肌肉中水分和肝脏中脂肪含量显著增加,并引发多种病理缺乏症[1-3]。淡水鱼和海水鱼在EFA需求上存在较大差异,淡水鱼能利用18碳脂肪酸合成20碳或22碳脂肪酸,因此,它的EFA主要是C18:2n-6(linoleic acid,LA)和C18:3n-3(α- linolenic acid,ALA),而海水鱼主要对高不饱和脂肪酸如C20:5n-3(EPA)和C22:6n-3(DHA)需求比较大[4]。
以往研究EFA需要量的试验都采用单因素设计,即在饱和或单不饱和脂肪酸的基础上添加单一的EFA,最近有学者开始通过在脂肪中添加两种或更多的EFA来研究各种EFA之间的交互作用。Smith等[5]通过4×4双因子试验发现,砂鲈Bidyanusbidyanus对LA的最适需要量为1.7 g/kg;斑节对虾Penaeusmonodon饲料中n-3和n-6系列EFA的比例为2.5~1.0时,其生长效果最佳[6];黄颡鱼Pelteobagrusfulvidraco日粮中ALA与LA的比例为1.17和2.12时,其增重率最高且饲料系数最低[7]。但EFA之间交互作用的机理目前尚不清楚,推测可能与其改变细胞膜结构,或者其变构效应对脂肪酸去饱和酶和竞争性底物的影响有关[8]。
团头鲂Megalobramaamblycephala是中国主要的淡水养殖品种之一。目前关于团头鲂对EFA需要量的研究尚未见报道,刘玮等[9]在不同脂肪源对团头鲂幼鱼生长影响的研究中发现,团头鲂的EFA应同时包含LA和ALA,且对LA的需求要比对ALA更大。Takeuchi等[10]认为,鲤Cyprinuscarpio的EFA应包括1%的LA和1%的ALA,草鱼Ctenopharyngodonidella[11]的EFA与鲤相似,为0.5%~1.0%的ALA和1.0%的LA。鉴于团头鲂同属鲤科鱼类,对EFA的需要量应该比较相近,因此,本试验在前人研究的基础上[12],通过在含35%蛋白质和7%脂肪的基础日粮中添加LA(3个水平)和ALA(3个水平),探讨LA和ALA的不同含量对团头鲂幼鱼生长性能、形体指标、体成分和消化酶活性的影响,从而确定团头鲂幼鱼对这两种EFA的最适需要量,以期为团头鲂的脂肪酸需求研究和饲料油脂的选择提供参考。
1材料与方法
1.1材料
试验在南京农业大学水产动物营养和生态实验室进行。试验用鱼为购自上海松江浦南水产良种场的团头鲂“浦江1号”夏花。
1.2方法
1.2.1 试验设计与试验饲料 试验设3个LA水平(0.5%、1.0%、1.5%,占饲料质量比)和3个ALA水平(0.5%、0.9%、1.3%),采用3×3双因子设计方法配制成9种饲料,记为L0.5A0.5、L0.5A0.9、L0.5A1.3、L1.0A0.5、L1.0A0.9、L1.0A1.3、L1.5A0.5、L1.5A0.9、L1.5A1.3,分别投喂9组鱼,每组设4个重复。以酪蛋白和明胶为主要蛋白源,玉米淀粉为糖源,羧甲基纤维素为黏合剂,并填充微晶纤维素、矿物质等制成等氮等能的基础日粮。基础日粮配方(均为质量分数,%)为:酪蛋白32.00、明胶8.00、玉米淀粉30.00、微晶纤维素15.50、羧甲基纤维素3.00、预混料1.00、磷酸二氢钙1.90、沸石粉2.00、抗氧化剂0.10、氯化钠0.50、油脂6.00。以鱼油、豆油、花生油、亚麻油、油酸和棕榈酸为脂肪源,通过几种油脂的不同配比来调节日粮中LA和ALA的水平。饲料营养组成及油脂配制见表1,饲料脂肪酸组成见表2。将各组饲料逐级混合均匀,再加水拌匀,用QRLS-150Ⅱ型电动绞肉机制成颗粒,成型后先进行破碎再经20~40目(粒径为380~830 μm)筛两次筛分,25 ℃下风干,置于冰箱(-20 ℃)中保存备用。
1.2.2 饲养管理 试验前先于试验环境下投喂商品料暂养,驯化10 d后,选取体格健康、无畸形体质量为(0.80±0.02)g的团头鲂鱼苗720尾,随机投放36个水族箱(直径为52 cm,水深为50 cm)中,每箱20尾。试验期间,每3天换水一次,每次换水量为总水量的30%。每天7:00、12:00、17:00投饲,日投饲率为鱼体质量的3%~5%,投喂之前吸出粪便,饲料投喂持续20 min,投喂结束后30 min,捞出残饵烘干称重。试验周期为56 d。试验用水为曝气自来水,水温为(27±3)℃,pH为6.8~8.0,溶解氧>5 mg/L。
1.2.3 指标的测定与计算
表1饲料营养组成及油脂配制
Tab.1Approximatecompositionoftheexperimentaldietsandpreparationofthedietaryfat
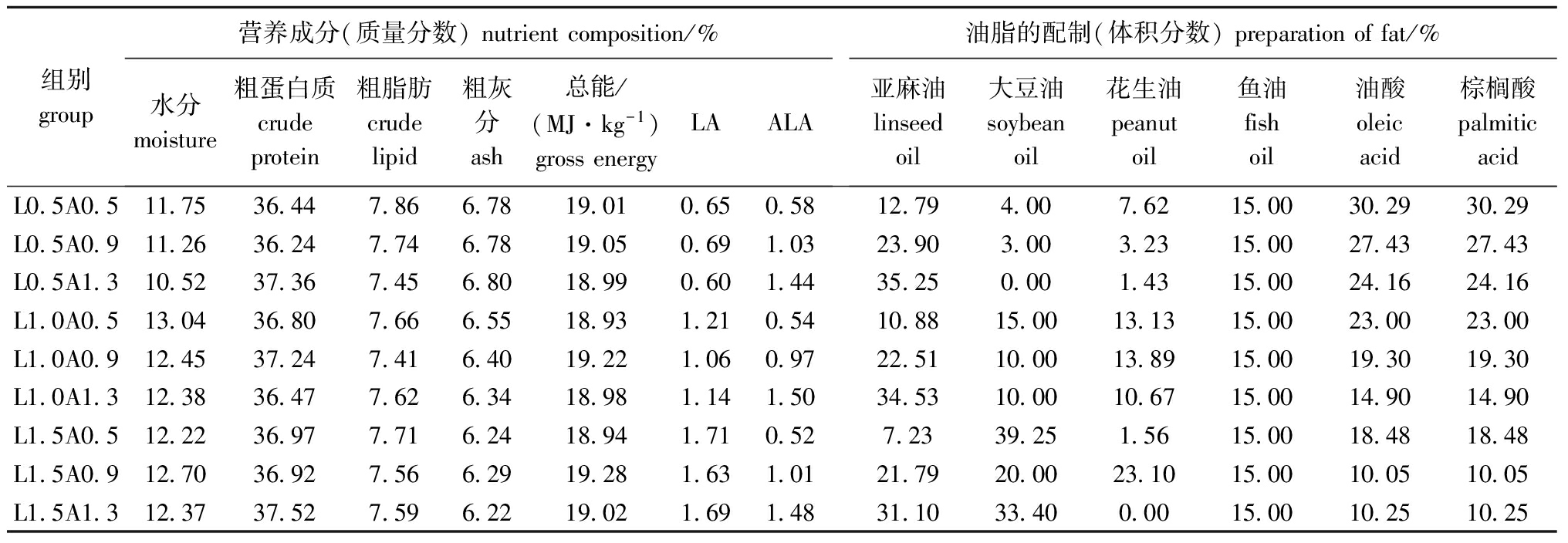
组别group营养成分(质量分数)nutrientcomposition/%水分moisture粗蛋白质crudeprotein粗脂肪crudelipid粗灰分ash总能/(MJ·kg-1)grossenergyLAALA油脂的配制(体积分数)preparationoffat/%亚麻油linseedoil大豆油soybeanoil花生油peanutoil鱼油fishoil油酸oleicacid棕榈酸palmiticacidL0 5A0 511 7536 447 866 7819 010 650 5812 794 007 6215 0030 2930 29L0 5A0 911 2636 247 746 7819 050 691 0323 903 003 2315 0027 4327 43L0 5A1 310 5237 367 456 8018 990 601 4435 250 001 4315 0024 1624 16L1 0A0 513 0436 807 666 5518 931 210 5410 8815 0013 1315 0023 0023 00L1 0A0 912 4537 247 416 4019 221 060 9722 5110 0013 8915 0019 3019 30L1 0A1 312 3836 477 626 3418 981 141 5034 5310 0010 6715 0014 9014 90L1 5A0 512 2236 977 716 2418 941 710 527 2339 251 5615 0018 4818 48L1 5A0 912 7036 927 566 2919 281 631 0121 7920 0023 1015 0010 0510 05L1 5A1 312 3737 527 596 2219 021 691 4831 1033 400 0015 0010 2510 25
表2各组试验饲料脂肪酸的组成
Tab.2Thefattyacidcompositionoftheexperimentaldietsw/%
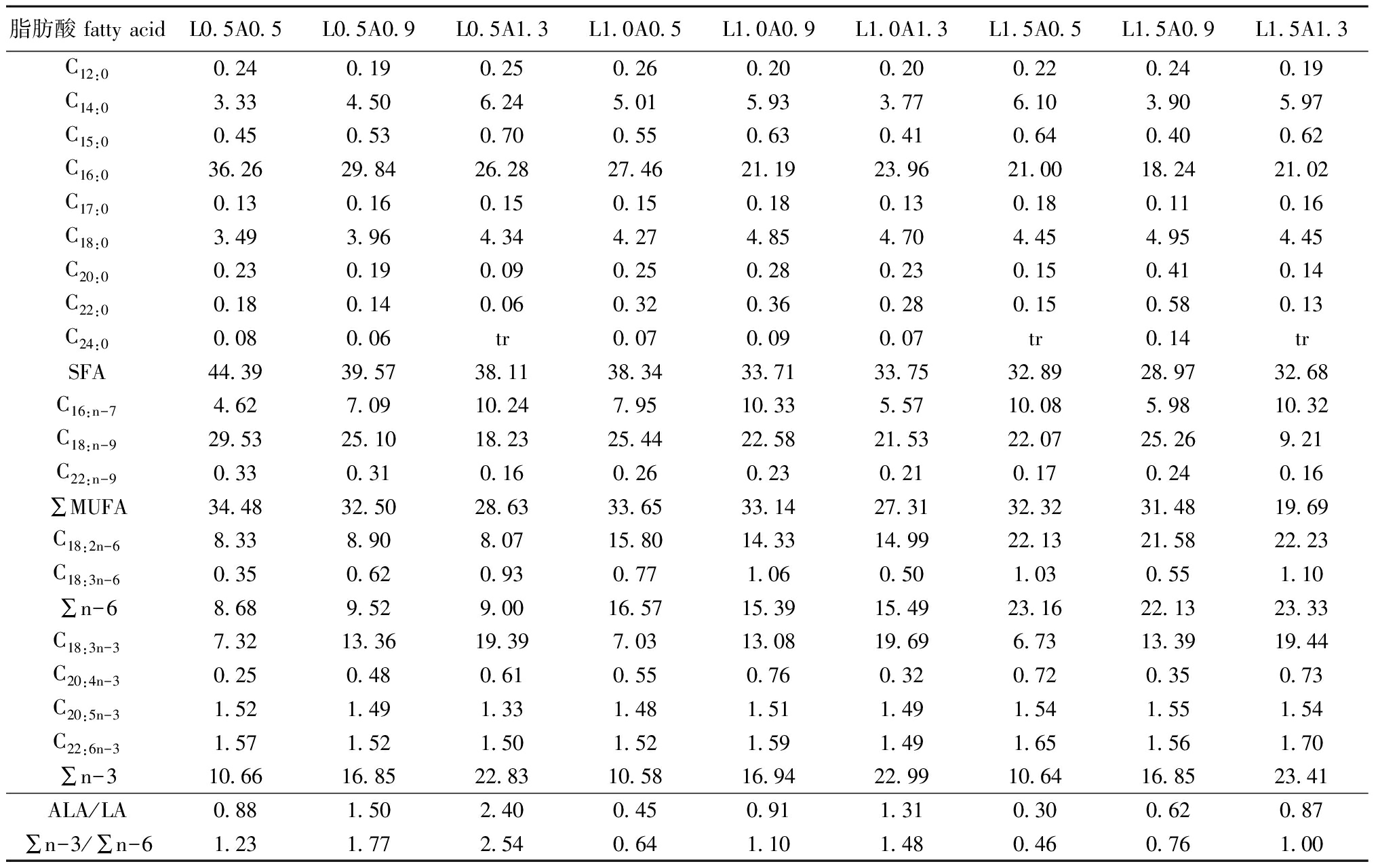
脂肪酸fattyacidL0 5A0 5L0 5A0 9L0 5A1 3L1 0A0 5L1 0A0 9L1 0A1 3L1 5A0 5L1 5A0 9L1 5A1 3C12:00 240 190 250 260 200 200 220 240 19C14:03 334 506 245 015 933 776 103 905 97C15:00 450 530 700 550 630 410 640 400 62C16:036 2629 8426 2827 4621 1923 9621 0018 2421 02C17:00 130 160 150 150 180 130 180 110 16C18:03 493 964 344 274 854 704 454 954 45C20:00 230 190 090 250 280 230 150 410 14C22:00 180 140 060 320 360 280 150 580 13C24:00 080 06tr0 070 090 07tr0 14trSFA44 3939 5738 1138 3433 7133 7532 8928 9732 68C16:n-74 627 0910 247 9510 335 5710 085 9810 32C18:n-929 5325 1018 2325 4422 5821 5322 0725 269 21C22:n-90 330 310 160 260 230 210 170 240 16∑MUFA34 4832 5028 6333 6533 1427 3132 3231 4819 69C18:2n-68 338 908 0715 8014 3314 9922 1321 5822 23C18:3n-60 350 620 930 771 060 501 030 551 10∑n-68 689 529 0016 5715 3915 4923 1622 1323 33C18:3n-37 3213 3619 397 0313 0819 696 7313 3919 44C20:4n-30 250 480 610 550 760 320 720 350 73C20:5n-31 521 491 331 481 511 491 541 551 54C22:6n-31 571 521 501 521 591 491 651 561 70∑n-310 6616 8522 8310 5816 9422 9910 6416 8523 41ALA/LA0 881 502 400 450 911 310 300 620 87∑n-3/∑n-61 231 772 540 641 101 480 460 761 00
注: tr表示痕量
Note:tr shows trace level
(1)生长性能与营养成分。试验鱼养殖56 d后,停饲24 h,测定总质量,计算增重率、特定生长率、饲料系数、蛋白质效率,并随机从每箱取6尾鱼测量体长、体质量,解剖取其肝胰脏及全部内脏称重,计算肥的方法测定饲料和鱼体中的水分、粗蛋白质和灰分含量,干物质烘干(105 ℃)至恒重,通过失重法测定;用凯氏定氮仪(2300Kjeltec Analyzer Unit,FOSS TECATOR,Sweden)测定粗蛋白含量;用马福炉(550 ℃)燃烧满度、肝胰脏指数和脏体指数。同时取肠道,并将剩余的所有幼鱼用4 ℃预冷的盐度为8.6的生理盐水冲洗,然后用滤纸吸干水分,于-20 ℃下保存备用。参照AOAC[13]失重法测定灰分含量;参照Folch等[14]的方法测定粗脂肪含量。每个样品至少测定3个平行。增重率(WG)、特定生长率(SGR)、饲料系数(FCR)、蛋白质效率(PER)、肥满度(CF)、肝体指数(HSI)、脏体指数(VSI)的计算公式为
WG=(末均质量-初均质量)/初均质量×100%,
SGR=(ln末均质量-ln初均质量)/养殖天数×100%,
FCR=投饵量/(末体质量-初体质量),
PER=(末均质量-初均质量)/(饲料摄食量×饲料蛋白质含量),
CF=鱼体质量/鱼体长3×100%,
HSI=肝胰脏质量/全鱼质量×100%,
VSI=内脏质量/全鱼质量×100%。
(2)消化酶。将肠道解冻之后准确称重,使用去离子水按质量比为1∶9进行冰浴匀浆,以3000 r/min离心10 min,收集上清液标号分装待测,于4 ℃下保存,24 h内测定完毕。采用福林-酚法测定总蛋白酶[15]。采用南京建成公司的试剂盒测定各种消化酶活性。蛋白酶活力单位定义为:在27 ℃条件下,每分钟水解酪素产生相当于1 μg酪氨酸所需的酶量为1个酶活力单位。脂肪酶活力单位定义为:在27 ℃条件下,每克组织蛋白在本反应体系中与底物反应1 min,每消耗1 μmol底物为1个酶活力单位。淀粉酶活力单位定义为:每毫克蛋白在27 ℃下与底物作用30 min,水解10 mg淀粉定义为1个酶活力单位。
(3)脂肪酸。饲料样品中脂肪的提取参照Folch等[14]的方法。油脂的皂化及甲酯化方法参照Christie[16]的方法,略有改进。样品皂化甲酯化后,用气相色谱-质谱仪进行分析。分析仪器为岛津GCMS-QP2010 Plus气质联用仪,色谱柱为HP-5MS(30 m×0.25 mm×0.25 μm);色谱柱升温程序为初温50 ℃,以10 ℃/min升至150 ℃并保持3 min,以3 ℃/min升至230 ℃保持3 min;进样方式为分流进样,分流比为10∶1,进样量为1 μL,载气为高纯氮气,气流为1.3 mL/min。检索NIST质谱图库,比较样品质谱图与图库中标准质谱图,即可确定样品中脂肪酸种类,采用面积归一化法计算各脂肪酸的相对含量。
1.3数据处理
试验数据均用平均值±标准误(means±S.E.)表示。采用SPSS 18.0软件进行单因素方差分析(One-Way ANOVA)。当差异显著时,以饲料LA和ALA添加水平为主要影响因子,进行双因素方差分析,采用Duncan法进行组间多重比较。
2结果与分析
2.1LA和ALA含量对幼鱼生长性能的影响
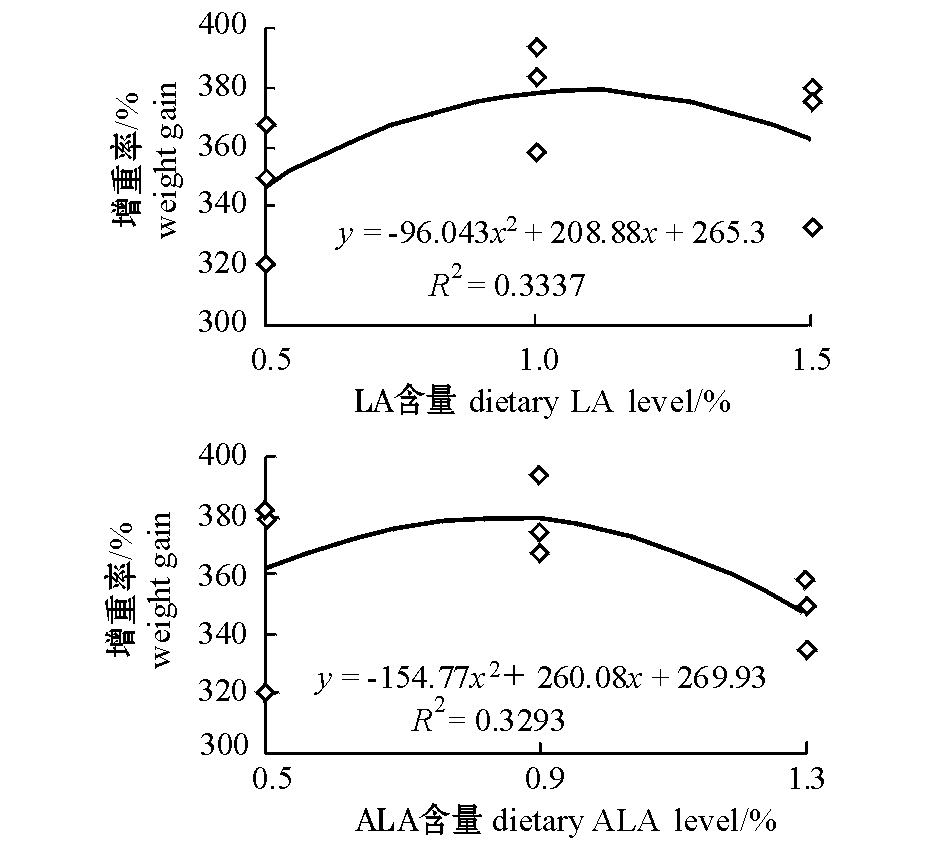
养殖试验期间,各试验组幼鱼肉眼未发现组织病变。从表3可见:饲料中LA和ALA含量对团头鲂幼鱼WG和SGR的影响极显著(P<0.01);当饲料中LA的添加量为0.5%时,幼鱼的WG、SGR和PER均显著低于其他两个LA组(P<0.05);而当ALA添加量为0.9%时,幼鱼的WG、SGR和PER均显著高于1.3%组(P<0.05),但与0.5%组无显著性差异(P>0.05)。同时发现:LA与ALA之间存在交互作用,当饲料中LA含量为1.0%且ALA的含量为0.9%时,其WG和SGR均达到最高,显著高于L0.5A0.5、L0.5A1.3和 L1.5A1.3组(P<0.05),但与其他组无显著性差异(P>0.05);L1.0A0.5组PER为各组最高且与L1.0A0.9、L1.5A0.5和L1.5A0.9组无显著性差异(P>0.05),但显著高于其他组(P<0.05)。观察FCR发现,当饲料中ALA为1.3%时,显著高于其他两个ALA组(P<0.05),而LA添加量对其无显著影响(P>0.05)。各试验组存活率无显著性差异(P>0.05)。通过二次回归分析得到增重率(y)与LA(x)的关系式为y=-96.043x2+208.88x+265.3(R2=0.3337),当增重率最高时LA为1.09%,其回归曲线见图1。同时建立增重率(y)与ALA(x)的关系式为y=-154.77x2+260.08+269.93(R2=0.3293),当增重率最高时ALA为0.84%,其回归曲线见图1。
表3饲料中亚油酸和亚麻酸含量对团头鲂幼鱼生长性能的影响
Tab.3Effectofdietarylinoleicacidandlinolenicacidlevelsongrowthperformanceinjuvenilebluntsnoutbream
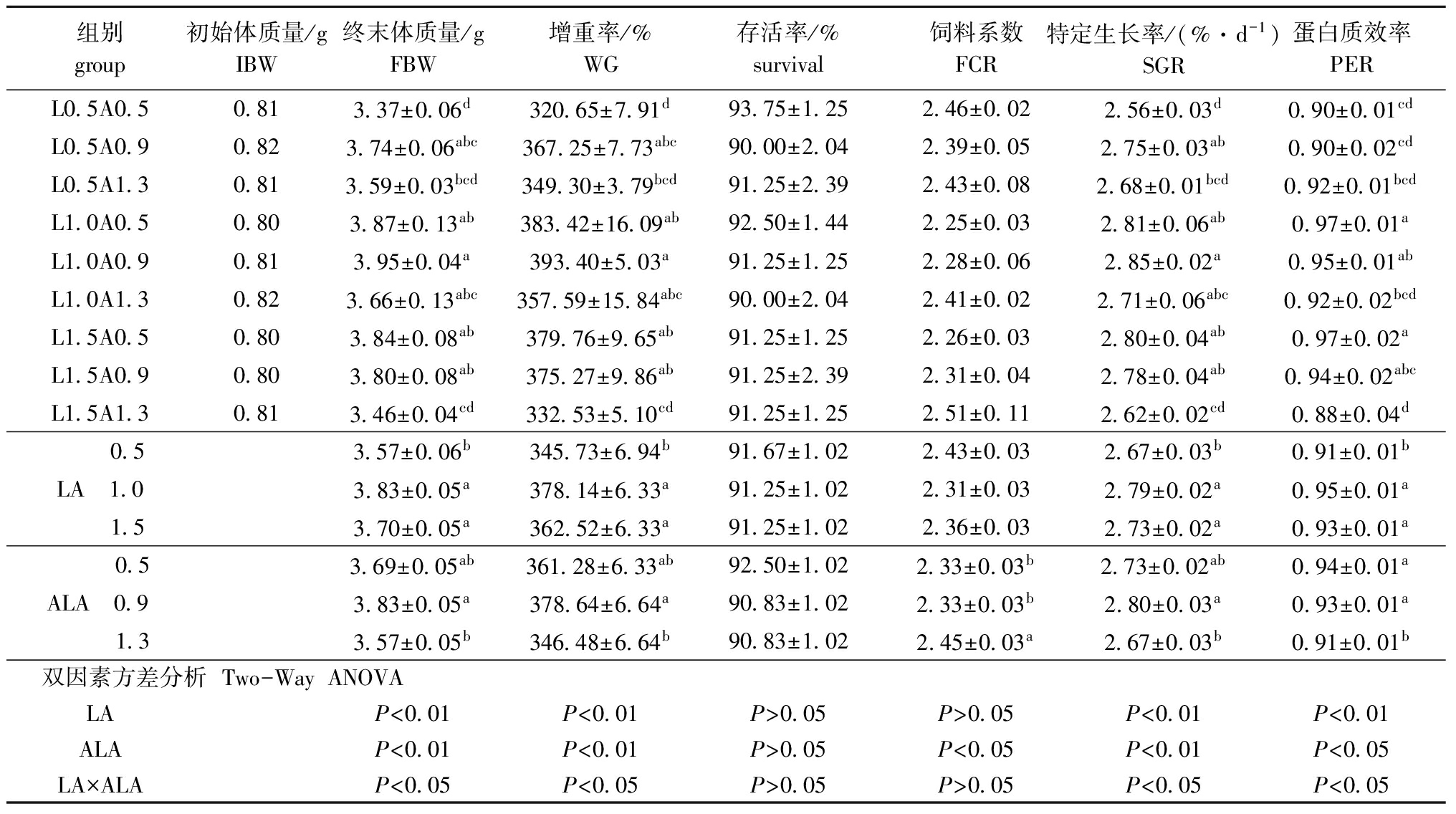
组别group初始体质量/gIBW终末体质量/gFBW增重率/%WG存活率/%survival饲料系数FCR特定生长率/(%·d-1)SGR蛋白质效率PERL0 5A0 50 813 37±0 06d320 65±7 91d93 75±1 252 46±0 022 56±0 03d0 90±0 01cdL0 5A0 90 823 74±0 06abc367 25±7 73abc90 00±2 042 39±0 052 75±0 03ab0 90±0 02cdL0 5A1 30 813 59±0 03bcd349 30±3 79bcd91 25±2 392 43±0 082 68±0 01bcd0 92±0 01bcdL1 0A0 50 803 87±0 13ab383 42±16 09ab92 50±1 442 25±0 032 81±0 06ab0 97±0 01aL1 0A0 90 813 95±0 04a393 40±5 03a91 25±1 252 28±0 062 85±0 02a0 95±0 01abL1 0A1 30 823 66±0 13abc357 59±15 84abc90 00±2 042 41±0 022 71±0 06abc0 92±0 02bcdL1 5A0 50 803 84±0 08ab379 76±9 65ab91 25±1 252 26±0 032 80±0 04ab0 97±0 02aL1 5A0 90 803 80±0 08ab375 27±9 86ab91 25±2 392 31±0 042 78±0 04ab0 94±0 02abcL1 5A1 30 813 46±0 04cd332 53±5 10cd91 25±1 252 51±0 112 62±0 02cd0 88±0 04d 0 53 57±0 06b345 73±6 94b91 67±1 022 43±0 032 67±0 03b0 91±0 01bLA 1 03 83±0 05a378 14±6 33a91 25±1 022 31±0 032 79±0 02a0 95±0 01a 1 53 70±0 05a362 52±6 33a91 25±1 022 36±0 032 73±0 02a0 93±0 01a 0 53 69±0 05ab361 28±6 33ab92 50±1 022 33±0 03b2 73±0 02ab0 94±0 01aALA 0 93 83±0 05a378 64±6 64a90 83±1 022 33±0 03b2 80±0 03a0 93±0 01a 1 33 57±0 05b346 48±6 64b90 83±1 022 45±0 03a2 67±0 03b0 91±0 01b 双因素方差分析 Two-WayANOVA LAP<0 01P<0 01P>0 05P>0 05P<0 01P<0 01ALAP<0 01P<0 01P>0 05P<0 05P<0 01P<0 05LA×ALAP<0 05P<0 05P>0 05P>0 05P<0 05P<0 05
注:同列中标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significant differences at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
2.2LA和ALA含量对幼鱼形体指标的影响
从表4可见:饲料中LA和ALA含量对团头鲂HSI和VSI无显著影响(P>0.05),但随着饲料中LA和ALA含量的增加HSI均呈下降趋势,L0.5A0.5组的HSI达到2.80,为各组最高;LA为1.0%组的VSI略小于其他两个LA组,而ALA为1.3%组的VSI略高于其他两个ALA组;团头鲂幼鱼的CF受LA的影响显著(P<0.05),LA为1.0%组的CF显著高于其他两个LA组(P<0.05),ALA对CF影响不显著(P>0.05),但0.9%组的CF略高于其他两个ALA组。
表4饲料中亚油酸和亚麻酸含量对团头鲂幼鱼形体指标的影响
Tab.4EffectofdietaryLAandALAlevelsonmorphometricindexofjuvenilebluntsnoutbream
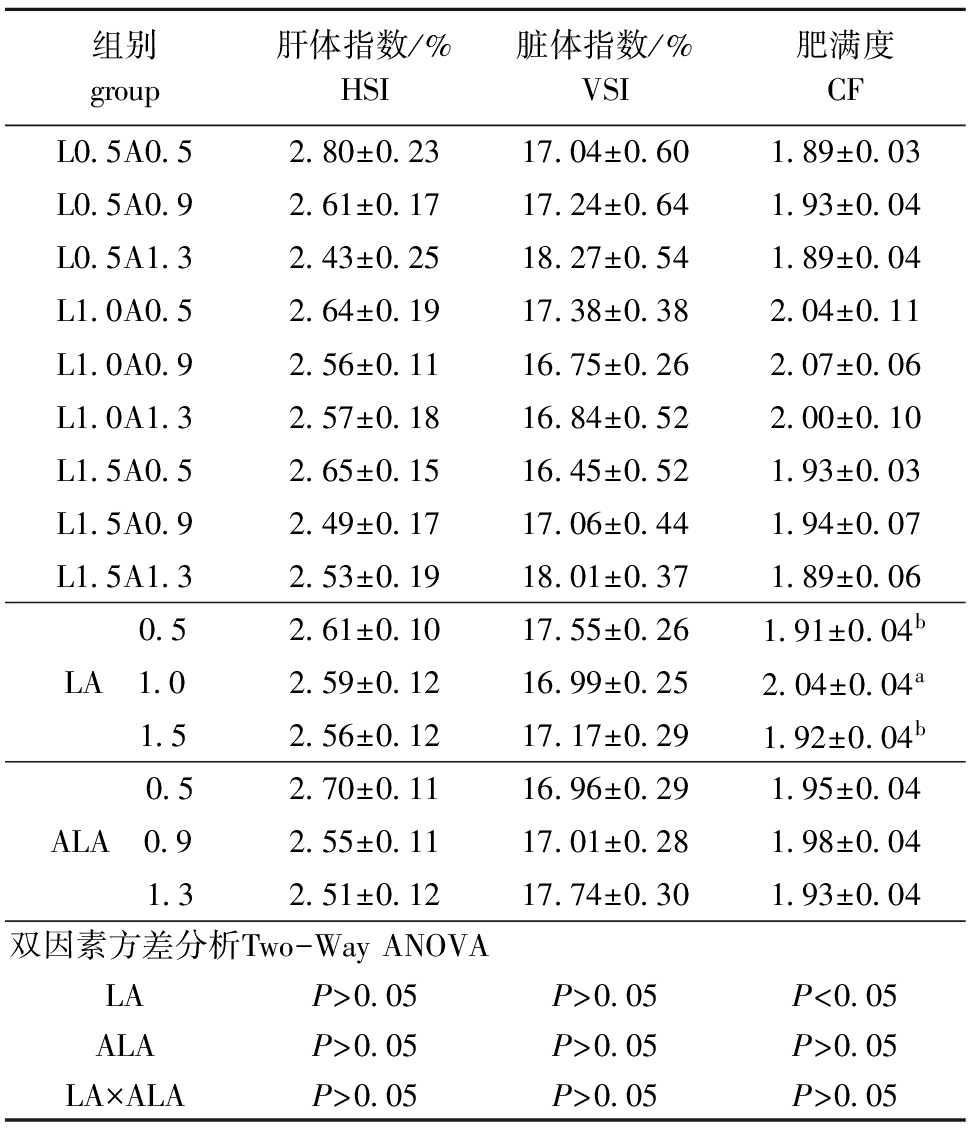
组别group肝体指数/%HSI脏体指数/%VSI肥满度CFL0 5A0 52 80±0 2317 04±0 601 89±0 03L0 5A0 92 61±0 1717 24±0 641 93±0 04L0 5A1 32 43±0 2518 27±0 541 89±0 04L1 0A0 52 64±0 1917 38±0 382 04±0 11L1 0A0 92 56±0 1116 75±0 262 07±0 06L1 0A1 32 57±0 1816 84±0 522 00±0 10L1 5A0 52 65±0 1516 45±0 521 93±0 03L1 5A0 92 49±0 1717 06±0 441 94±0 07L1 5A1 32 53±0 1918 01±0 371 89±0 06 0 52 61±0 1017 55±0 261 91±0 04bLA 1 02 59±0 1216 99±0 252 04±0 04a 1 52 56±0 1217 17±0 291 92±0 04b 0 52 70±0 1116 96±0 291 95±0 04ALA 0 92 55±0 1117 01±0 281 98±0 04 1 32 51±0 1217 74±0 301 93±0 04双因素方差分析Two-WayANOVALAP>0 05P>0 05P<0 05ALAP>0 05P>0 05P>0 05LA×ALAP>0 05P>0 05P>0 05
2.3LA和ALA含量对幼鱼体组成的影响
从表5可见,饲料中LA和ALA对全鱼的粗蛋白质与粗灰分含量均无显著影响(P>0.05)。LA 为1.0%组的全鱼粗蛋白质含量略高于其他两个LA组,但粗蛋白质含量随ALA添加量的增加呈下降趋势;LA 为0.5%组的全鱼水分含量显著高于其他两个LA组(P<0.05);LA为0.5%组的全鱼粗脂肪含量显著低于其他两个LA组(P<0.05);ALA对全鱼水分和粗脂肪含量均无显著影响(P>0.05);LA和ALA均对肝胰脏脂肪含量的影响显著(P<0.05),LA 为0.5%组显著高于其他两个LA组(P<0.05),ALA为0.9%组显著低于其他两个ALA组(P<0.05),但LA和ALA对肝胰脏脂肪含量不存在交互作用,L0.5A0.5组的肝胰脏脂肪含量为各组最高。
2.4LA和ALA含量对幼鱼消化酶活性的影响
从表6可见:饲料中LA和ALA对团头鲂肠道淀粉酶活性无显著影响(P>0.05);LA为1.0%组的肠道脂肪酶活性显著高于LA为0.5%组(P<0.05),但与1.5%组无显著性差异(P>0.05),ALA 为1.3%组显著低于其他两个ALA 组(P<0.05),此外两种EFA对脂肪酶存在交互作用,L0.5A0.5和L1.5A1.3组显著低于L1.0A0.5和L1.0A0.9组(P<0.05),其他组之间无显著性差异(P>0.05);LA为0.5%组的肠道蛋白酶活性显著低于其他两个LA组(P<0.05),ALA为1.3%组的蛋白酶活性显著低于其他两个ALA组(P<0.05)。
3讨论
本试验中通过在等氮等能的纯合饲料基础上添加不同水平的LA和ALA,在各组饲料中提供等量的EPA和DHA来研究团头鲂幼鱼对这两种脂肪酸的需求量,由于饲料中EFA过量或缺少时都会对鱼类的增重率产生影响[17],所以本试验中以团头鲂幼鱼的增重率作为主要评判指标来研究幼鱼对这两种脂肪酸的适宜需求量。结果表明:增重率随LA含量的增加而逐渐升高,当LA添加量为1.0%时达到最高,而LA增加到1.5%时增重率有所下降但不显著;当ALA添加量为0.5%和0.9%时,增重率无显著差异,但当ALA达到1.3%时对团头鲂生长有一定的阻碍作用。Glencross等[18]研究表明:斑节对虾的增重率随饲料中ALA含量的增加而升高,当ALA达到2.6%时其增重率最高,再增加时就对其生长产生消极影响;LA对生长虽有促进作用,但过量时对生长的抑制作用可能与ALA的交互作用有关。Smith等[5]研究砂鲈对LA和ALA的需要量时发现,随LA含量的增加其增重率升高,最适添加量为1.8%,当添加量为2.3%时增重率明显下降,但ALA对增重率影响不显著。本试验结果与上述研究相似,团头鲂幼鱼同样对LA和ALA的需要量有一个适宜范围,添加量过多或过少都会影响其生长,参照Zuridah等[19]的方法进行二次回归分析,得出当LA为1.09%和ALA为0.84%时可使增重率分别达到最高。本试验中发现,LA和ALA对增重率的影响存在一定的交互作用,Glencross等[18]认为,饲料中LA和ALA的交互作用对增重率的影响与这两种EFA在饲料中的平衡(即饲料中LA和ALA应保持适宜水平和比例)密切相关,这种平衡性主要体现在LA和ALA在体内进行生物合成HUFA过程中两者对△6和△5去饱和酶系统底物的竞争性抑制[20]。本试验中发现,各组饲料系数普遍偏高,推测可能与纯合饲料适口性较差和消化吸收率低有关;LA对饲料系数影响不大,但当ALA添加过量后会导致饲料系数升高,这可能与过量ALA会阻碍团头鲂幼鱼生长有关。
表5饲料中亚油酸和亚麻酸含量对团头鲂幼鱼全鱼体组成的影响(湿质量)
Tab.5EffectofdietaryLAandALAlevelsonwholebodycomposition(wetweightbasis)ofjuvenilebluntsnoutbream
w/%
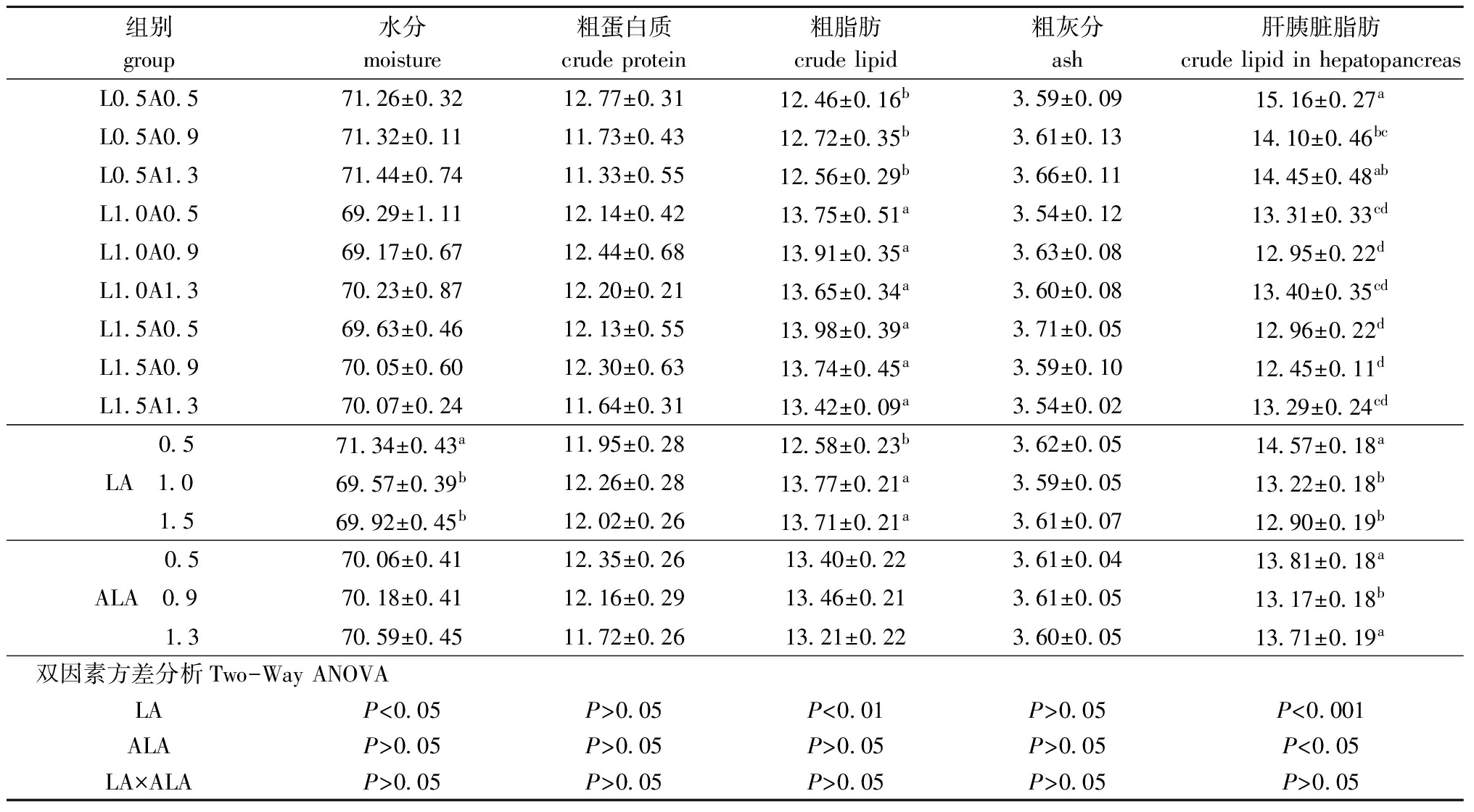
组别group水分moisture粗蛋白质crudeprotein粗脂肪crudelipid粗灰分ash肝胰脏脂肪crudelipidinhepatopancreasL0 5A0 571 26±0 3212 77±0 3112 46±0 16b3 59±0 0915 16±0 27aL0 5A0 971 32±0 1111 73±0 4312 72±0 35b3 61±0 1314 10±0 46bcL0 5A1 371 44±0 7411 33±0 5512 56±0 29b3 66±0 1114 45±0 48abL1 0A0 569 29±1 1112 14±0 4213 75±0 51a3 54±0 1213 31±0 33cdL1 0A0 969 17±0 6712 44±0 6813 91±0 35a3 63±0 0812 95±0 22dL1 0A1 370 23±0 8712 20±0 2113 65±0 34a3 60±0 0813 40±0 35cdL1 5A0 569 63±0 4612 13±0 5513 98±0 39a3 71±0 0512 96±0 22dL1 5A0 970 05±0 6012 30±0 6313 74±0 45a3 59±0 1012 45±0 11dL1 5A1 370 07±0 2411 64±0 3113 42±0 09a3 54±0 0213 29±0 24cd 0 571 34±0 43a11 95±0 2812 58±0 23b3 62±0 0514 57±0 18aLA 1 069 57±0 39b12 26±0 2813 77±0 21a3 59±0 0513 22±0 18b 1 569 92±0 45b12 02±0 2613 71±0 21a3 61±0 0712 90±0 19b 0 570 06±0 4112 35±0 2613 40±0 223 61±0 0413 81±0 18aALA 0 970 18±0 4112 16±0 2913 46±0 213 61±0 0513 17±0 18b 1 370 59±0 4511 72±0 2613 21±0 223 60±0 0513 71±0 19a双因素方差分析Two-WayANOVALAP<0 05P>0 05P<0 01P>0 05P<0 001ALAP>0 05P>0 05P>0 05P>0 05P<0 05LA×ALAP>0 05P>0 05P>0 05P>0 05P>0 05
表6饲料中亚油酸和亚麻酸含量对团头鲂幼鱼肠道消化酶活性的影响
Tab.6EffectofdietaryLAandALAlevelsonactivitiesofintestinaldigestiveenzymesinjuvenilebluntsnoutbream
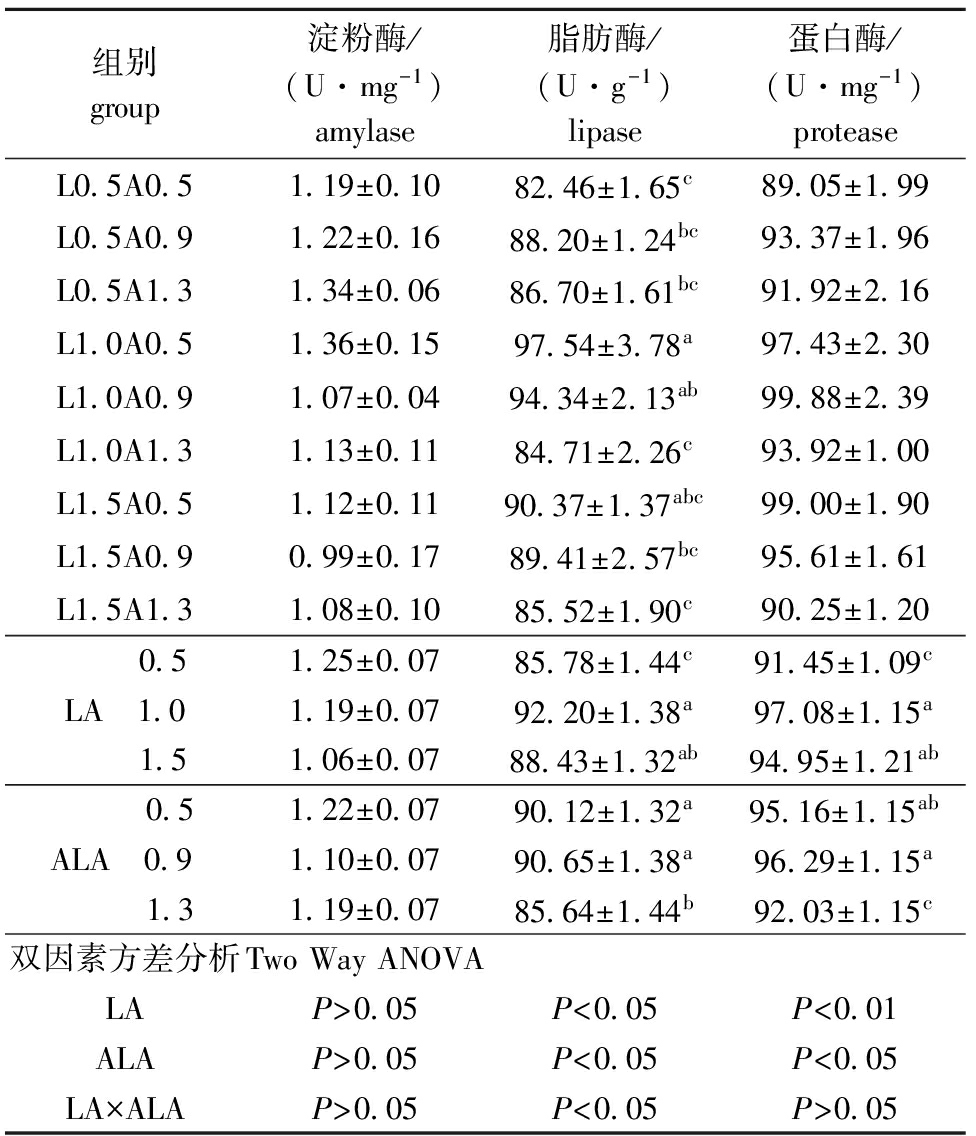
组别group淀粉酶/(U·mg-1)amylase脂肪酶/(U·g-1)lipase蛋白酶/(U·mg-1)proteaseL0 5A0 51 19±0 1082 46±1 65c89 05±1 99L0 5A0 91 22±0 1688 20±1 24bc93 37±1 96L0 5A1 31 34±0 0686 70±1 61bc91 92±2 16L1 0A0 51 36±0 1597 54±3 78a97 43±2 30L1 0A0 91 07±0 0494 34±2 13ab99 88±2 39L1 0A1 31 13±0 1184 71±2 26c93 92±1 00L1 5A0 51 12±0 1190 37±1 37abc99 00±1 90L1 5A0 90 99±0 1789 41±2 57bc95 61±1 61L1 5A1 31 08±0 1085 52±1 90c90 25±1 20 0 51 25±0 0785 78±1 44c91 45±1 09cLA 1 01 19±0 0792 20±1 38a97 08±1 15a 1 51 06±0 0788 43±1 32ab94 95±1 21ab 0 51 22±0 0790 12±1 32a95 16±1 15abALA 0 91 10±0 0790 65±1 38a96 29±1 15a 1 31 19±0 0785 64±1 44b92 03±1 15c双因素方差分析TwoWayANOVALAP>0 05P<0 05P<0 01ALAP>0 05P<0 05P<0 05LA×ALAP>0 05P<0 05P>0 05
Takeuchi等[21]研究了EFA对虹鳟Oncorhynchusmykiss的营养功能,发现EFA缺乏可使该鱼肝脏脂质特别是中性脂肪大量积累,而磷脂含量大幅降低。其他学者在大菱鲆Scophthalmusmaximus[22]和鲑鱼Oncorhychusketa[23]等鱼类中也观察到,缺乏EFA时鱼类肝脏中脂质积累增加并且肝质量相对增大。本试验结果表明,LA为0.5%组的鱼体肝胰脏脂肪含量显著高于其他两个LA组,LA对鱼体肝体指数的影响虽不显著但趋势相似,这些表明,当LA添加量为0.5%时不能满足鱼体需要,导致EFA缺乏。饲料中ALA对鱼体肝胰脏脂肪含量和肝体指数的影响结果显示,添加0.9%的ALA时团头鲂幼鱼肝脏表现的更为健康。Lee等[24]对星斑川鲽Platichthysstellatus的研究发现,当EFA缺乏时全鱼的粗脂肪含量也有所降低。本试验中发现:LA为0.5%组的全鱼粗脂肪含量显著小于LA为1.0%和1.5%组;ALA对全鱼粗脂肪含量的影响虽不显著,但ALA为0.9%组还是要稍高于其他两个ALA组,由此认为,LA为1.0%和ALA为0.9%时,更能满足鱼体EFA的需要。
本试验中发现:LA为1.0%时团头鲂幼鱼的肥满度显著高于0.5%和1.5%组,LA对全鱼粗蛋白质含量的影响无显著性差异,但1.0%组粗蛋白质含量稍高于其他两个LA组;ALA对肥满度无显著影响,但ALA为0.9%时为3组中最高。薛敏等[25]认为,鱼类的生长效果和鱼体品质与饲料中EFA的适宜含量和比例密切相关。结合本试验中当LA为1.0%和ALA为0.9%时,鱼体肥满度、全鱼粗蛋白质、粗脂肪含量较高,肝胰脏脂肪含量较低,说明此时饲料中EFA的含量是适宜的。
当考虑LA与ALA的交互作用影响时,L1.0A0.9、 L1.5A0.5、L1.5A0.9组的相关指标均较好,而L1.0A0.5、L1.0A1.3、L1.5A1.3组也未表现出EFA极度缺乏或者过量症状,仅L0.5A0.5、L0.5A0.9、L0.5A1.3组表现出EFA不足的可能症状,故从对形体指标和机体成分的影响综合分析,团头鲂幼鱼对LA、ALA均需要,但对LA的需求更大,当LA为0.5%时可能会产生EFA缺乏,当LA为1.5%和ALA为1.3%时也能耐受。
鱼类消化酶活性的高低能直接反映对营养物质的消化吸收能力,提高鱼体的消化酶活性就能提高鱼对营养物质的消化能力,鱼类对营养物质的吸收也会随之增加[26]。本试验结果显示:当LA的添加量为1.0%时,肠道脂肪酶活性最大;ALA添加水平为1.3%时能显著降低脂肪酶活性。作者推测,这两种EFA可能通过消化酶影响鱼体消化吸收,从而造成对鱼体体脂沉积的改变,但有待进一步试验验证。饲料中LA和ALA对蛋白酶的影响显著,当LA过低和ALA过高时都会导致蛋白酶活性降低,虽然EFA对蛋白酶活性的影响未显著改变鱼体组织中蛋白质的积累,但是可以通过提高团头鲂对蛋白质的利用率,促进鱼体生长。
综上所述,从团头鲂幼鱼的生长性能、形体指标、体成分和消化酶数据来看,团头鲂幼鱼对LA的需要量为1.0%~1.5%,对ALA的需要量为0.5%~0.9%。通过二次回归方程分析得出,当LA为1.09%和ALA为0.84%时,团头鲂幼鱼生长较好,各项生理机能指标正常。
参考文献:
[1] Watanabe T,Ogino C,Koshiishi Y,et al.Requirement of rainbow trout for essential fatty acids[J].Bulletin of the Japanese Society of Scientific Fisheries,1974,40:493-499.
[2] 刘穗华,曹俊明,黄燕华,等.饲料中不同亚麻酸/亚油酸比对凡纳滨对虾幼虾生长性能和脂肪酸组成的影响[J].动物营养学报,2010,22(5):1413-1421.
[3] Glencross B D,Smith D M.The dietary linoleic and linolenic fatty acids requirements of the prawnPenaeusmonodon[J].Aquaculture Nutrition,1999,5(1):53-63.
[4] Sargent J,Henderson R J,Tocher D R.The lipids[M]//Halver J E. Fish Nutrition.2nd ed.New York:Academic Press,1989:153-218.
[5] Smith D M,Hunter B J,Allan G L,et al.Essential fatty acids in the diet of silver perch (Bidyanusbidyanus):effect of linolenic and linoleic acids on growth and survival[J].Aquaculture,2004,236:377-390.
[6] Blanchard G,Makombu J G,Kesternont P.Influence of different dietary 18:3n-3/18:2n-6 ratio on growth performance,fatty acid composition and hepatic ultrastructure in Eurasian perch,Percafluviatilis[J].Aquaculture,2008,284(1/4):144-150.
[7] Tan X Y,Luo Z,Xie P,et al.Effect of dietary linolenic acid/linoleic acid ratio on growth performance,hepatic fatty acid profiles and intermediary metabolism of juvenile yellow catfishPelteobagrusfulvidraco[J].Aquaculture,2009,296:96-101.
[8] Garg M L,Sebokava E,Thomson A B R,et al.Δ6-desaturase activity in liver microsomes of rats fed diets enriched with cholesterol and/or ω3 fatty acids[J].Biochem J,1988,249:351-356.
[9] 刘玮,戴年华,任本根,等.不同脂肪源饲料对团头鲂稚鱼生长的影响[J].水产学报,1997,21(1):44-48.
[10] Takeuchi T,Watanabe T.Requirement of carp for essential fatty acids[J].Bulletin of the Japanese Society of Scientific Fisheries,1977,43(4):541-551.
[11] Takeuchi T,Watanabe K,Yong W Y,et al.Essential fatty acids of grass carpCtenopharyngodonidella[J].Bulletin of the Japanese Society of Scientific Fisheries,1991,57:467-473.
[12] Li X F,Liu W B,Jiang Y Y,et al.Effects of dietary protein and lipid levels in practical diets on growth performance and body composition of blunt snout bream (Megalobramaamblycephala) fingerlings[J].Aquaculture,2010,303:65-70.
[13] AOAC.Official Methods of Analysis[M].15th ed.Arlington:Association of Official Analytical Chemists,1990:684.
[14] Folch J,Lees M,Stanley G H S.A simple method for the isolation and purification of total lipids from animal tissues[J].The Journal of Biological Chemistry,1957,226(1):497-509.
[15] Lowry O P,Rosebrough N J,Farr A L,et al.Protein measurement with the folin-phenol reagent[J].The Journal of Biological Chemistry,1951,193(1):265-275.
[16] Christie W W.A simple procedure for rapid transmethylation of glycerolipids and cholesteryl esters[J].Journal of Lipid Research,1982,23:1072-1075.
[17] Zeitoun I H,Ullrey D E,Magee W T,et al.Quantifying nutrient requirements of fish[J].J Fish Res Board Can,1976,33:167-172.
[18] Glencross B D,Smith D M,Thomas M R,et al.The effect of dietary n-3 and n-6 fatty acid balance on the growth of the prawnPenaeusmonodon[J].Aquaculture Nutrition,2002,8(1):43-51.
[19] Zuridah O,Shim M K F.Quantitative requirements of linolenic and docosahexaenoic acid for juvenilePenaeusmonodon[J].Aquaculture,1997,157:277-295.
[20] Henderson R J,Tocher D R.The lipid composition and biochemistry of freshwater fish[J].Progress in Lipid Research,1987,26(4):281-347.
[21] Takeuchi T,Watanabe T.Effects of various polyunsaturated fatty acids on growth and fatty acid composition of rainbow trout,Oncorhynchusketa[J].Bulletin of the Japanese Society of Scientific Fisheries,1982,48:1745-1752.
[22] Cowey C B,Owen J M,Adron J W,et al.Studies on the nutrition of marine flatfish[J].Bri J Nutr,1986,36:479-486.
[23] Takeuchi T,Watanabe T,Nose T.Requirement for essential fatty acids of chum salmon (Oncorhynchusketa) in fresh water environment[J].Bulletin of the Japanese Society of Scientific Fisheries,1979,45:1319-1323.
[24] Lee S M,Lee J H,Kim K D.Effect of dietary essential fatty acids on growth,body composition and blood chemistry of juvenile starry flounder (Platichthysstellatus)[J].Aquaculture,2003,225:269-281.
[25] 薛敏,李爱杰,张显娟.牙鲆幼鱼对EPA和DHA的营养需求[J].水产学报,2004,28(3):285-291.
[26] 李卫芬,沈涛,陈南南,等.饲料中添加枯草芽孢杆菌对草鱼消化酶活性和肠道菌群的影响[J].大连海洋大学学报,2012,27(3):31-35.
Effectsofdietarylinoleicandlinolenicacidlevelsongrowth,bodycompositionanddigestiveenzymeactivitiesinjuvenilebluntsnoutbreamMegalobramaamblycephala
WANG Yu-heng1,2, LIU Wen-bin2, WANG Hui-chong1,CHEN Jun1, LUO Gui-lan1,XING Jun1
(1.Department of Animal Husbandry & Veterinary Medicine,Jiangsu Polytechnic College of Agriculture and Forestry, Zhenjiang 212400,China;2.Key Laboratory of Aquaculture Nutrition of Jiangsu Province,College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:Juvenile blunt snout breamMegalobramaamblycephalawith initial body weight of (0.80±0.02) g were randomly allotted into 36 tanks at a rate of 20 fish per tank and fed nine purified diets containing three linoleic acid(LA) levels (0.5%, 1.0% and 1.5%) and three α-linolenic acid(ALA) levels (0.5%, 0.9% and 1.3%)with tetraplication at water temperature of (27±3)℃ for 8 weeks. Weight gain, specific growth rate and protein efficiency ratio were shown to be increased first and then decreased significantly with increase in dietary LA and ALA levels(P<0.05),the maximum in the fish fed the diets containing 1.0% LA and 0.9% ALA. There was significantly higher food conversion ratio in the fish fed the diet containing 1.3% ALA than that in the fish in other groups(P<0.05) without significant difference in the fish fed the diets containing LA(P>0.05). The fish fed the diet containing 1.3% ALA had significantly higher condition factor (CF) than the other fish fed the diets containing ALA(P<0.05), and no significant differences in CF were found in the fish fed the diets containing LA. The fat content in whole body was found to be significantly increased with increase in dietary LA levels(P<0.05) while moisture and hepatopancreatic fat content was decreased with increase in dietary LA levels. No significant difference in condition factor, and moisture and fat in whold fish body was observed in the fish fed the diet containing ALA(P<0.05), though the minimal lipid content in the fish fed the diet containing 1.3% ALA. Also, there was significantly higher lipid content in hepatopancreas of the fish fed the diet containing 0.5% LA than that in the other groups(P<0.05). The fish fed the diet containing 0.5% LA had significantly lower activities of intestine lipase and protease than that the fish in the other groups(P<0.05), the minimum in the fish fed the diet containing the maximal ALA. It is concluded that 1.09% LA and 0.84% ALA are of the optimal for growth and best carcass quality in juvenile blunt snout bream.
Key words:Megalobramaamblycephala; linoleic acid; linolenic acid; growth performance; digestive enzyme
DOI:10.3969/J.ISSN.2095-1388.2014.04.010
文章编号:2095-1388(2014)04-0373-08
收稿日期:2013-12-03
基金项目:现代农业产业技术体系建设专项——国家大宗淡水鱼类产业技术体系资金资助(nycytx-49-21)
作者简介:王煜恒(1985—), 男, 硕士,助教。E-mail:yuhengyg@163.com
中图分类号:S963
文献标志码::A