表1各组饲料营养组分
Tab.1Approximatecompositionofthetestdietsw/%

饲料diet水分moisture粗蛋白质crudeprotein粗脂肪crudefat粗灰分crudeash粗纤维crudefiber碳水化合物carbohydrate冰鲜杂鱼64 320 04 44 70 66 6A配合饲料7 444 78 212 10 617 6B配合饲料7 546 114 512 00 519 9
摘要:以体质量为40 g的大口黑鲈Micropterussalmoides为试验对象,分别投喂冰鲜杂鱼(对照)、A配合饲料(脂肪含量8.2%)和B配合饲料(脂肪含量14.5%),饲养试验共进行3个月,试验结束时测量各组鱼的生长性状,并检测其肝脏中两种脂蛋白脂肪酶基因LPLtype1和LPLtype2 mRNA的表达量。结果表明:喂食冰鲜杂鱼的大口黑鲈平均体质量增加率显著高于喂食两种配合饲料的大口黑鲈(P<0.05);喂食B配合饲料的大口黑鲈肝脏中 LPLtype1 和LPLtype2 mRNA的相对表达量与对照组、喂食A配合饲料的组存在显著性差异(P<0.05),饲料脂肪水平越高,LPLtype1和LPLtype2 mRNA的表达量也越高。研究表明,脂蛋白脂肪酶LPLtype1和LPLtype2基因编码的蛋白都具有分解贮存在肝脏细胞中多余脂肪的功能,且LPLtype2与LPLtype1基因可能存在更加精细的分工, LPLtype2比LPLtype1更易受饲料脂肪含量的调节,推测LPLtype2在参与分解肝细胞的脂肪中可能起到更大的作用。
关键词:大口黑鲈;脂蛋白脂肪酶;配合饲料;基因表达
大口黑鲈Micropterussalmoides又名加州鲈,是一种原产于北美的广温性肉食性鱼类,目前,大口黑鲈的养殖主要靠投喂冰鲜杂鱼,开发适合的人工配合饲料已成为大口黑鲈养殖业的研究热点。喂食人工配合饲料的大口黑鲈肝脏易受到损伤[1],因此,开展饲料中脂肪含量对鱼体生长、脂肪代谢及其基因表达影响的研究具有重要意义。
脂蛋白脂肪酶(Lipoprotein lipase,LPL)的作用主要是催化乳糜微粒和极低密度脂蛋白中的甘油三酯水解,产生供机体组织利用的脂肪酸和单酰甘油[2-3]。大口黑鲈两种LPL的全长cDNA已得到克隆,并运用实时定量PCR方法检测了脂蛋白脂肪酶mRNA的组织分布,发现LPLtype1和LPLtype2均在肝脏中表达量最高,这可能与肝脏是最主要的营养诱导性贮脂部位有关[4]。
有关饲料中不同脂肪水平对大口黑鲈营养吸收、生长、肌肉组织成分、非特异性免疫,以及与生长相关的基因表达影响的研究已有报道[5-8],但从分子水平分析饲料脂肪水平对大口黑鲈脂肪代谢的研究还很少。本研究中,不仅检测了不同脂肪水平饲料对大口黑鲈生长性能的影响,还从分子水平检测了对肝脏中两个脂蛋白脂肪酶基因mRNA表达量的影响,分析了饲料中的脂肪含量与生长及肝脏脂肪代谢基因的相互关系,旨在为研究大口黑鲈对外源脂肪的适应和调节能力提供基础。
1.1材料
试验用鱼为中国水产科学研究院珠江水产研究所良种基地人工繁殖大口黑鲈,体质量约为40 g。
1.2方法
1.2.1 人工配合饲料的制备 试验用冰鲜杂鱼为冰冻的蓝圆鲹Decapterusmaruadsi,俗名池鱼。A、B两种人工配合饲料的鱼油添加量分别为6%(质量分数,下同)和12%,面粉添加量分别为20%、14%,其余原料均为进口鱼粉42%、国产鱼粉10%、豆粕15%、复合维生素1%、复合矿物质4%、乌贼膏2%,将各原料充分混匀,用制粒机制成直径为4.5 mm的颗粒饲料,制粒温度为40~45 ℃,自然风干,过筛后于-20 ℃下保存备用。经测定,A、B两种配合饲料和冰鲜杂鱼的粗脂肪含量分别为8.2%、14.5%和4.4%,占各饲料干质量的8.9%、15.7%和12.3%(表1)。
表1各组饲料营养组分
Tab.1Approximatecompositionofthetestdietsw/%

饲料diet水分moisture粗蛋白质crudeprotein粗脂肪crudefat粗灰分crudeash粗纤维crudefiber碳水化合物carbohydrate冰鲜杂鱼64 320 04 44 70 66 6A配合饲料7 444 78 212 10 617 6B配合饲料7 546 114 512 00 519 9
1.2.2 饲养管理 选择健康的大口黑鲈270尾,随机分为3组,每组设3个重复,分别放入已消毒的水泥池(8 m3)中养殖,每池30尾。3组分别喂食冰鲜杂鱼、A配合饲料和B配合饲料。养殖条件相同,饲料用水均为充分曝气的自来水,每两天进行一次排污,测量水温和pH值,并根据水质的具体情况换30%~50%的曝气水,每日上、下午各投喂1次,少量投饵,喂食至鱼不再抢食为止,饲养试验共进行3个月。试验过程中计算试验鱼的存活率,测量每组鱼的初始平均体质量(W0)和终末平均体质量(Wt),并按下式计算[9-10]:
平均体质量增加率=(Wt-W0)/W0×100%,
饲料系数=总摄食量/(终末鱼体总质量-初始鱼体总质量)。
1.2.3 肝脏中两种LPL mRNA表达量的检测 饲养结束后,停食24 h。从对照组和试验组分别取6尾大口黑鲈,用MS222麻醉,取其肝脏,用TRIzol(Invitrogen,USA)快速提取肝脏总RNA。以18S作为内参基因设计引物(表2),用ABI 7300型荧光定量PCR仪检测大口黑鲈LPLtype1和LPLtype2 mRNA在各组大口黑鲈肝脏中的表达量。荧光定量所得数据,用2-△△CT法计算LPL基因的相对表达量,用Excel软件计算平均值和标准误。
表2引物序列
Tab.2Primersinthestudy

引物primer 序列sequence(5′-3′)LPLtype1-FATACATGGCTGGACGGTAACLPLtype1-RGTGAGGTCTCCAGCGATTCLPLtype2-FCACACAACGTTCAGATGTACACLPLtype2-RCATACAGTGAGACAGTGAGTGAAG18S-FGGACACGGAAAGGATTGACAG18S-RCGGAGTCTCGTTCGTTATCGG
1.3数据处理
采用SPSS 13.0软件进行单因素方差分析(One-Way ANOVA)和Duncan多重比较,显著性水平设为0.05。
2.1饲料脂肪水平对大口黑鲈生长的影响
从表3可见:喂食冰鲜杂鱼的对照组大口黑鲈的平均体质量增加率最大,为139.15%,与喂食B配合饲料和A配合饲料的组存在显著性差异(P<0.05),喂食冰鲜杂鱼组的大口黑鲈生长速度明显快于喂食人工配合饲料的鱼。
表3饲料脂肪水平对大口黑鲈存活率和生长速度的影响
Tab.3EffcetsofdietarylipidlevelsonsurvivalandgrowthrateoflargemouthbassMicropterussalmoide
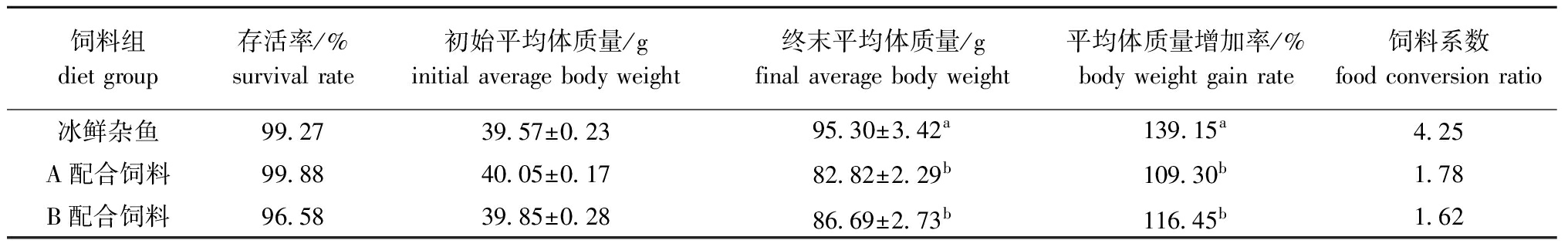
饲料组dietgroup存活率/%survivalrate初始平均体质量/ginitialaveragebodyweight终末平均体质量/gfinalaveragebodyweight平均体质量增加率/%bodyweightgainrate饲料系数foodconversionratio冰鲜杂鱼A配合饲料B配合饲料99 2799 8896 5839 57±0 2340 05±0 1739 85±0 2895 30±3 42a82 82±2 29b86 69±2 73b139 15a109 30b116 45b4 251 781 62
注:同列中标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters within the same column are significant differences at the 0.05 probability level,with the same letters within the same column being not significant differences
解剖各组大口黑鲈取其肝脏组织观察发现,喂食配合饲料的大口黑鲈肝脏出现不同程度的病变,表现为肝脏肿大,色泽变淡,外表无光泽,严重的鱼体内脾已为黑褐色。饲养过程中也发现,喂食配合饲料的大口黑鲈食欲不振,游动缓慢。
2.2饲料脂肪水平对大口黑鲈肝脏中LPLtype1mRNA、LPLtype2mRNA表达量的影响
从图1可见,大口黑鲈肝脏中LPLtype1 mRNA与LPLtype2 mRNA的表达相似,均为喂食高脂肪含量的B配合饲料组鱼的肝脏中表达量最高,与喂食冰鲜杂鱼和A配合饲料的组存在显著性差异(P<0.05)(图1)。

注:标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters are significant differences at the 0.05 probability level, and the means with the same letters are not significant differences
图1 试验各组大口黑鲈肝脏中 LPLtype1、LPLtype2 mRNA的相对表达量
Fig.1 The relative expression levels of large mouth bass LPLtype1,and LPLtype2 mRNA in livers of large mouthbass Micropterus salmoide in the experiment
本试验中,喂食冰鲜杂鱼的对照组大口黑鲈的平均体质量增加率明显高于喂食两种配合饲料的鱼,且喂食配合饲料的大口黑鲈肝脏出现不同程度的病变,表现出食欲不振,游动缓慢等现象,说明大口黑鲈这种肉食性养殖鱼类对人工配合饲料还没有形成很好的适应性。关胜军等[11]对大口黑鲈投喂人工配合软饲料和冰鲜杂鱼的生长对比试验结果也表明,从投喂第20天开始,喂食冰鲜杂鱼的大口黑鲈体质量显著高于喂食人工配合饲料的鱼,与本研究结果相似。冰鲜杂鱼中的粗脂肪含量占到了饲料干质量的12.3%,但由于其中各种脂肪和蛋白质所占的比例或其结合形式,易于被鱼类所吸收,所以不影响肉食性鱼类的健康生长。人工配合饲料虽然营养丰富,但与天然饵料相比其营养成分存在较大差异,而大口黑鲈对人工配合饲料还未形成很好的适应性,所以人工配合饲料影响了鱼体的健康生长,使其生长速度减慢。但也有学者认为,人工配合饲料对肉食性水产动物的生长没有显著影响[12-13],这可能是由于养殖种类的不同,以及人工配合饲料适口性的差异和水产动物对人工配合饲料适应性的差异造成试验结果的不同。
大口黑鲈脂蛋白脂肪酶LPLtype1和LPLtype2基因在喂食配合饲料与喂食冰鲜杂鱼时相比,在肝脏出现了上调表达,且在喂食脂肪含量最高的B配合饲料组大口黑鲈肝脏中表达量最高,与喂食冰鲜杂鱼组和低脂肪饲料A组有显著性差异,说明本研究中的两种人工配合饲料,特别是B配合饲料中的脂肪含量已明显高于大口黑鲈对脂肪的需求量,而鱼体吸收的多余脂肪被贮存在鱼类最主要的营养诱导性贮脂部位肝脏中,脂蛋白脂肪酶是脂肪代谢的关键酶,在分解肝脏内多余的脂肪中起重要作用[14-15],其表达受饲料中脂肪含量的调节。有研究表明,真鲷Pagrosomusmajor的LPL基因在肝脏也存在营养诱导性表达[16],饥饿、高脂食物均是其表达诱导因子。杨奇慧等[17]也发现,喂食配合饲料的军曹鱼Rachycentroncanadum肝脏脂肪酶活性明显比喂食冰鲜鱼时高。Panserat等[18]采用cDNA Microarray技术分析了用不同脂肪水平的饲料饲喂虹鳟Oncorhynchusmykiss后其肝脏组织基因表达变化的情况,发现饲料脂肪水平诱导了虹蹲41个肝脏基因的表达发生变化,其中包括脂蛋白脂肪酶基因的上调表达。
本试验中,喂食低脂肪和高脂肪配合饲料的试验鱼肝脏中LPLtype1 mRNA表达量分别是对照组鱼的1.3倍和3.0倍,而LPLtype2 mRNA表达量分别是对照组鱼的1.7倍和3.0倍。这说明LPLtype1与LPLtype2两个基因具有相似的功能,且LPLtype2基因对饲料中的脂肪含量更为敏感,更易受饲料中高脂肪含量的调节。氨基酸序列分析表明,大口黑鲈LPLtype1与LPLtype2之间的同源性为43.5%,LPLtype2氨基酸序列比LPLtype1少119个,主要表现为N端部分序列缺失,但主要功能域仍保留着[4]。在大马哈鱼卵巢中也发现了两个LPL基因,分别被命名为LPL1和LPL2,其氨基酸同源性仅为31%,在卵巢中,LPL1 mRNA表达量在4月份出现一个明显峰值,而LPL2 mRNA表达量在6月份出现一个明显峰值,推测脂蛋白脂肪酶基因也调节着卵巢成熟的季节变化发育,并可能存在一定的功能分工[19]。
参考文献:
[1] Halver J E.Fish Nutrition.second edition[M].London:Academic Press,1988:185-200.
[2] Scanu A.Serum high-density lipoprotein:effect of change in structure on activity of chicken adipose tissue lipase[J].Science,1966,153:640-641.
[3] 谭正怀.脂蛋白脂酶的组织特异性表达及其调节[J].国外医学:内分泌学分册,2000,20(6):320-324.
[4] 朱择敏,马冬梅,白俊杰,等.大口黑鲈两种脂蛋白脂肪酶基因cDNA的克隆及表达特征分析[J].水产学报,2013,37(5):641-650.
[5] 樊佳佳,白俊杰,李胜杰,等.大口黑鲈 “优鲈 1 号” 选育群体肌肉营养成分和品质评价[J].中国水产科学,2012,19(3):423-429.
[6] 陈乃松,肖温温,梁勤朗,等.饲料中脂肪与蛋白质比对大口黑鲈生长、体组成和非特异性免疫的影响[J].水产学报,2012,36(8):1270-1280.
[7] Yun B,Xue M,Wang J,et al.Effects of lipid sources and lipid peroxidation on feed intake,growth,and tissue fatty acid compositions of largemouth bass (Micropterussalmoides)[J].Aquaculture International,2013,21:97-110.
[8] Chen N S,Jin L N,Zhou H Y,et al.Effects of dietary arginine levels and carbohydrate-to-lipid ratios on mRNA expression of growth-related hormones in largemouth bass,Micropterussalmoides[J].General and Comparative Endocrinology,2012,179(1):121-127.
[9] 李超,张其中,杨莹莹,等.复方中草药对草鱼生长和血细胞数量的影响[J].水产科学,2012,31(1):7-11.
[10] 杜震宇,刘永坚,郑文晖,等.三种脂肪源和两种降脂因子对鲈生长、体营养成分组成和血清生化指标的影响[J].水产学报,2002,26(6):542-550.
[11] 关胜军,吴锐全,谢骏,等.两种饲料对大口黑鲈生长、消化道指数和消化酶活性的影响[J].饲料工业,2007,28(2):32-36.
[12] 杨志刚,阙有清,纪连元,等.以配合饲料替代杂鱼对中华绒螯蟹生长及消化酶活性的影响[J].大连海洋大学学报,2013,28(3):81-85.
[13] 刘汉元,吴宗文,高启平,等.投喂浮性膨化饲料与冰鲜鱼养殖南方大口鲇的效果对比[J].中国水产,2009(11):58-60.
[14] Luo G,Xu J H,Teng Y J,et al.Effects of dietary lipid levels on the growth,digestive enzyme,feed utilization and fatty acid composition of Japanese sea bass (LateolabraxjaponicusL.) reared in freshwater[J].Aquaculture Research,2010,41(2):210-219.
[15] 赵巧娥,朱邦科,沈凡,等.饲料脂肪水平对鳡幼鱼生长、体成分及血清生化指标的影响[J].华中农业大学学报,2012,31(3):357-363.
[16] 梁旭方,白俊杰,劳海华,等.真鲷脂蛋白脂肪酶基因表达与内脏脂肪蓄积营养调控定量研究[J].海洋与湖沼,2003,34(6):625-631.
[17] 杨奇慧,周歧存,郑海娟,等.不同饲料对军曹鱼组织消化酶活力的影响[J].水产科学,2008,27(12):633-636.
[18] Panserat S,Ducasse-Cabanot S,Plagnes-Juan E,et al.Dietary fat level modifies the expression of hepatic genes in juvenile rainbow trout (Oncorhynchusmykiss) as revealed by microarray analysis[J].Aquaculture,2008,275(1/4):235-241.
[19] Ryu Y W,Tanaka R,Kasahara A,et al.Molecular cloning and transcript expression of genes encoding two types of lipoprotein lipase in the ovary of cutthroat trout,Oncorhynchusclarki[J].Zoological Science,2013,30(3):224-237.
Abstract:Largemouth bassMicropterussalmoideswith mean body weight of 40 g were fed frozen fresh fish (as control), formulated diet A (fat level 8.2%) and formulated diet B (fat level 14.5%) for 3 months, and mRNA expression levels of two lipoprotein lipases (LPL), LPLtype1 and LPLtype2, were detected in livers of the largemouth bass. The results showed that there was significantly higher average body weight gain in the fish fed the frozen trash fish than the fish fed formulated diet A and formulated diet B (P<0.05). The fish fed formulated diet B had significant differences in hepatic expression levels of LPLtype1 and LPLtype 2 mRNA from the largemouth bass fed formulated diet A and the fish fed the frozen fresh fish (P<0.05), with the higher expression levels of LPLtype1 and LPLtype2 mRNA in the fish fed the higher dietary fat level. The findings indicate that LPLs play an important role in hydrolysis of the extra fat in hepato cytes. There are more precise function divisions between LPLtype1 and LPLtype 2 genes, and LPLtype 2 is more susceptible to dietary fat concentration than LPLtype 1 does, showing more important function in lipoprotein metabolism hepatocytes.
Key words:largemouth bass; lipoprotein lipase; formulated diet; gene expression
DOI:10.3969/J.ISSN.2095-1388.2014.04.007
文章编号:2095-1388(2014)04-0360-04
收稿日期:2013-11-28
基金项目:国家自然科学基金资助项目(31001107);农业部公益性行业科研专项(200903045);国家科技支撑计划项目(2012BAD26B03)
中图分类号:Q96
文献标志码::A