表1引物序列信息
Tab.1Sequencesofprimersusedinthisexperiment
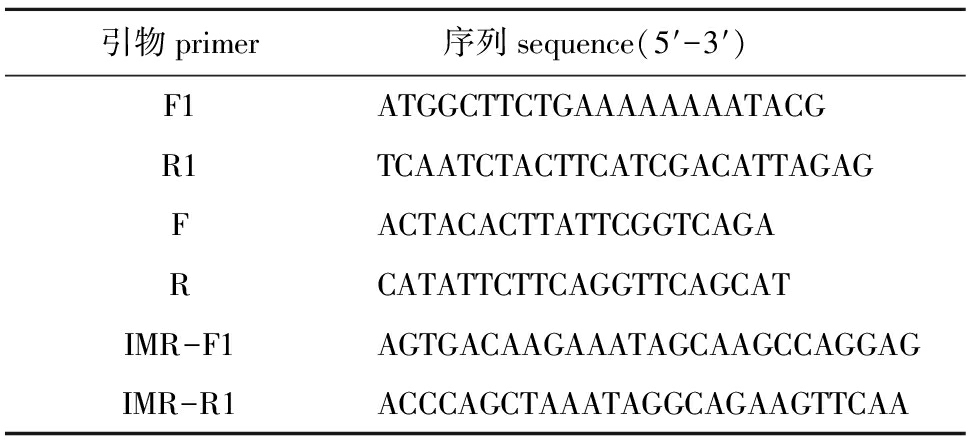
引物primer 序列sequence(5′-3′)F1ATGGCTTCTGAAAAAAAATACGR1TCAATCTACTTCATCGACATTAGAGFACTACACTTATTCGGTCAGARCATATTCTTCAGGTTCAGCATIMR-F1AGTGACAAGAAATAGCAAGCCAGGAGIMR-R1ACCCAGCTAAATAGGCAGAAGTTCAA
摘要:热激蛋白(HSP)是生物适应环境温度变化的重要媒介分子,本试验中克隆了多子小瓜虫IchthyophthiriusmultifiliisHSP70(Im HSP70)基因的ORF,采用荧光定量RT-PCR法,在水温为20、25、30 ℃的条件下检测了HSP70基因在多子小瓜虫幼虫、滋养体和包囊3个不同发育阶段的表达情况。结果表明:Im HSP70基因的ORF为1995 bp,预测编码为664 aa;Im HSP70蛋白的二级结构主要以α-螺旋和无规卷曲为主,空间构型包括N端ATPase功能域和C端多肽结合功能域;与其他物种HSP70蛋白序列进行同源性比较发现,Im HSP70与螅状独缩虫CarchesiumpolypinumHSP70的同源性最高,为78.08%;Im HSP70与分类地位同为纤毛门的螅状独缩虫、嗜热四膜虫Tetrahymenathermophila、变藓棘毛虫Sterkiellahistriomuscorum的HSP70聚在一个分支;3种温度下幼虫的HSP70表达量均最低,20 ℃和25 ℃时,HSP70基因在滋养体中的表达量显著高于幼虫和包囊(P<0.05),而30 ℃时,HSP70基因在包囊中的表达量显著高于滋养体和幼虫(P<0.05);30 ℃时HSP70基因在包囊中的表达量显著高于25 ℃(P<0.05)。研究表明,试验所用多子小瓜虫的HSP70基因在30 ℃时仍大量表达,且能感染试验鱼,推测该虫株为热带型多子小瓜虫, HSP70基因在多子小瓜虫对抗外界高温环境中可能发挥着重要的作用。
关键词:多子小瓜虫;热激蛋白70(HSP70);基因表达
多子小瓜虫Ichthyophthiriusmultifiliis是一种能感染淡水鱼类的重要纤毛虫,主要寄生于鱼的体表和鳃,引起“白点病”,对鱼的种类及年龄均无严格选择性,分布很广,在世界范围内能引起养殖鱼类大量死亡,在水产养殖和观赏鱼贸易中可造成重大经济损失[1-3]。多子小瓜虫的生活史分成感染性幼虫、寄生的滋养体和繁殖的包囊三个阶段[4],其幼虫阶段和包囊阶段都是在水体中完成,因此,水温是其生存和繁衍后代最重要的因素之一。水温的变化对多子小瓜虫的包囊孵化[5]、幼虫活力[5]、感染率[6]和繁殖率[7]都有一定的影响。多数研究者[8-11]认为,小瓜虫病适宜发生的水温为15~25 ℃,当水温在30 ℃左右时,多子小瓜虫包囊的存活率仅约10%,而且包囊都不能孵化[5],因而在多子小瓜虫的防控实践中,有将水温调高到28 ℃以上防治小瓜虫的报道[12-14]。也有研究者发现,水温在26~29 ℃时,小瓜虫病依然发生,并能感染淡水鱼[15]。笔者最近在养殖的过程中亦发现,在30 ℃左右水温时多子小瓜虫仍能大量感染草鱼。因此,揭示在高温环境中多子小瓜虫感染和存活的生理机制成为寄生虫防治中迫切需要解决的问题。张其中等[5]研究表明,水温在4 ℃左右或28~32 ℃时,多子小瓜虫都不能孵化,但有少部分虫体以包囊形式存活下来,推测当温度降到适宜时,包囊能孵化为幼虫,成为再次暴发小瓜虫病的根源。但多子小瓜虫高温应激的分子机制目前尚未见报道。
热激蛋白(Heat-shock proteins,HSPs)是生物适应环境温度变化的重要媒介分子,过高或过低的温度都会诱导细胞或机体产生应激反应,迅速合成HSP,并作为分子伴侣参与蛋白质的合成、折叠、装配、运转和降解等过程,以维持细胞蛋白自稳,提高细胞对应激源的耐受性,增强抗氧化作用,使细胞维持正常的生理功能[16-17]。HSP70为HSPs中最保守、最重要的一簇,其在大多数生物中含量较多,在应激反应中最敏感[18],在调节细胞凋亡[19-20]、细胞衰老[21-22]和生育[23]过程中均起着重要的作用。研究表明,环境温度升高时,可以增强HSP70基因的表达,进而促进细胞的存活,抑制细胞凋亡[24]。当温度升高时,嗜热四膜虫Tetrahymenathermophila在生长、饥饿和接合生殖等生理或发育状态下,HSP70基因的表达水平随温度的升高而增加[17]。同样,可用HSP70检测不同地域生物的耐热能力[16]。选用保守的HSP70作为分子标记来研究同种生物在不同温度诱导下的表达变化规律,可以更好地认识物种耐热的机制。本研究中,克隆了寄生于草鱼的多子小瓜虫HSP70基因(Im HSP70)的开放阅读框(ORF),并研究了在3种不同温度下多子小瓜虫HSP70基因在幼虫、滋养体和包囊3个不同发育阶段的表达情况,旨在为从分子水平探讨多子小瓜虫的温度适应机理提供方法和依据。
1.1材料
1.1.1 多子小瓜虫来源 寄生有多子小瓜虫的草鱼Ctenopharynodonidellus取自广东省清远市某草鱼苗种场,苗种场养殖水温为(29±3)℃, 草鱼体长为(8.5±0.53)cm,体质量为(13.35±2.51)g。运回实验室后暂养于用活性碳除氯后的自来水中, 水温为(25±1)℃。
1.1.2 试验鱼 RR-B系剑尾鱼Xiphophorushellerii体长为(5.64±0.41)cm,体质量为(6.05±2.12)g,取自珠江水产研究所水生实验动物研究中心。
1.2方法
1.2.1 试验设计 将108尾试验鱼平均分为9组,暂养于9个0.1 m3的小池中,暂养用水为除氯后的自来水,适应5 d后,再与寄生有多子小瓜虫的草鱼, 在不同温度(20±1)、(25±1)、(30±1)℃的水中混养,每个温度设3个重复,每个重复中将12尾剑尾鱼和2尾携带多子小瓜虫的草鱼混养在一起。
1.2.2 不同温度下多子小瓜虫成虫、包囊和幼虫的获得 取被多子小瓜虫严重感染的剑尾鱼(体表有很多的白点),轻轻刮鱼体表面,将一定量的水连同多子小瓜虫滋养体倒入培养皿中,轻轻转动培养皿,用吸管将集聚在中央的滋养体吸到另一个培养皿中,用蒸馏水反复清洗3次,直至除去大部分黏液。将滋养体移入装有灭菌蒸馏水的离心管中,参照张其中等[5]的方法,将收集的滋养体分别在(20±1)、(25±1)、(30±1)℃恒温中培育,形成包囊和孵化出幼虫。
1.2.3 总RNA的提取及cDNA的合成 分别将不同温度下得到的多子小瓜虫滋养体、幼虫和包囊富集于离心管底部,每个样品加入1 mL的TRIzol Reagent (Invitrogen,USA),于-70 ℃下保存。参照TRIzol Reagent说明书对保存的样品进行总RNA的提取,用10 g/L琼脂糖凝胶电泳检测总RNA的完整性,用分光光度计检测其浓度和纯度,将高质量的总RNA于-70 ℃下保存备用。取1 μg总RNA,通过Transcriptor First Strand cDNA Synthesis Kit试剂盒(Roche,Germany)合成cDNA第一链。
分别将GenBank中已报道的纤毛类嗜热四膜虫T.thermophila(GenBank:JQ697041)、螅状独缩虫Carchesiumpolypinum(GenBank:AY561304) HSP70 的mRNA 序列在多子小瓜虫基因组数据库ImDB(www.ich.ciliate.org/blast/)中进行Blast比对,找到同源序列,再把获得的序列通过NCBI(www.ncbi.nlm.nih.gov/Blast/)进行再次比对确认,得到多子小瓜虫HSP70的预测基因序列。用Primer Premier 5.0软件设计引物F1、R1(表1),用PCR扩增HSP70基因的ORF,扩增产物通过E.Z.N.A.TM Gel Extraction kit试剂盒(Omega公司)纯化回收,连接到pGM-T18载体(TaKaRa公司)中,转化至EscherichiacoliDH5α感受态细胞中,挑取3个阳性克隆,送上海生物工程有限公司测序。
1.2.4 序列分析 用Blast程序 (http://blast.ncbi.nlm.nih.gov/Blast.cgi) 对测序结果进行同源性检索。使用在线软件SMART (http://smart.embl-heidelberg.de/)对氨基酸序列进行结构和功能域分析。经Predictprotein (https://www. predictprotein.org/)在线预测蛋白质的二级结构,利用Swiss-model(http://swissmodel. expasy.org/)服务器预测3-D结构。使用Clustal W软件将克隆的多子小瓜虫及其他物种HSP70基因的氨基酸序列进行多重比对,用Mega 4.1软件构建NJ系统发育树。
1.2.5 荧光定量RT-PCR 利用Beacon Designer 8.0 软件设计HSP70特异引物F、R(表1),进行实时荧光定量PCR扩增,以18S RNA作为内参基因,设计引物为IMR-F1、IMR-R1[4](表1),用实时定量PCR检测各基因在各样品中的表达量。反应体系(20 μL):10 μL SYBR®Premix Ex TapTM(TaKaRa公司),0.4 μL ROX Reference Dye (TaKaRa公司),引物各0.4 μL,cDNA 1 μL,ddH2O 7.8 μL。反应程序:95 ℃下预变性10 min;95 ℃下变性15 s,60 ℃下退火30 s,72 ℃下延伸30 s,共进行40个循环;最后在95 ℃下反应15 s,60 ℃下反应30 s,95 ℃下反应15 s。
表1引物序列信息
Tab.1Sequencesofprimersusedinthisexperiment

引物primer 序列sequence(5′-3′)F1ATGGCTTCTGAAAAAAAATACGR1TCAATCTACTTCATCGACATTAGAGFACTACACTTATTCGGTCAGARCATATTCTTCAGGTTCAGCATIMR-F1AGTGACAAGAAATAGCAAGCCAGGAGIMR-R1ACCCAGCTAAATAGGCAGAAGTTCAA
1.3数据处理
以各温度下幼虫、滋养体和包囊的cDNA为样品,每个样品设置3个重复样,用实时荧光定量PCR扩增仪7300测定目的基因的丰度,应用2-△△CT分析方法,通过ABI7300系统初步统计,用SPSS 17.0软件进行差异显著性分析。
2.1多子小瓜虫HSP70基因ORF序列分析
以多子小瓜虫滋养体cDNA为模板,采用引物F1和R1,PCR 扩增得到一条1995 bp的条带,符合预期大小。经Blast比对及ORF分析后,确认该序列为多子小瓜虫HSP70其因的ORF(GenBank登录号:KF626379);将其与多子小瓜虫基因组序列比对发现,Im HSP70无内含子,ORF全长为1995 bp,预测编码为664个氨基酸,理论相对分子质量为72 510,等电点为5.42。正电荷残基(Arg+Lys)85个,负电荷残基(Asp+Glu)112个,整个蛋白质带-27价电荷,为膜外蛋白。
经Predictprotein分析,Im HSP70的二级结构以α-螺旋和无规卷曲为主(图1);经Swiss-model及SMART分析,Im HSP70蛋白的空间结构在N端含有一个高度保守的ATP酶功能域,在C端含有一个高度保守的多肽结合功能域(图2、图3)。
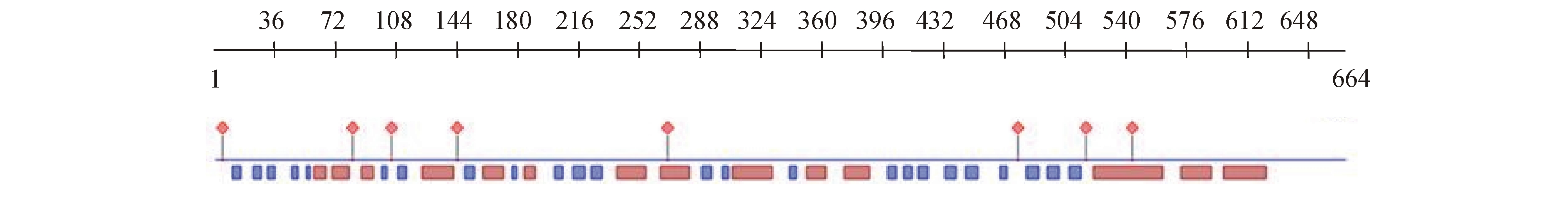
注:菱形为蛋白结合区域,红色方框为α-螺旋,蓝色方框为β-折叠,其余为无规卷曲
Note:Rhombus shows protein binding region,red box shows α-helix,blue box shows β-sheet,and the other denotes random coil
图1 Im HSP70蛋白分子二级结构预测图
Fig.1 The deduced secondary structure of the HSP70 from Ichthyophthirius multifiliis

图2 Im HSP70蛋白分子功能域预测图
Fig.2 The deduced domains of the HSP70 from I.multifiliis
2.2同源性及系统进化分析
将得到的氨基酸序列与GenBank中其他寄生虫比较,并通过软件Clustal W计算同源性。结果显示,Im HSP70与其他物种的相似性为54.94%~78.08%(表2),其中与螅状独缩虫相似性最高(78.08%)。将上述比对结果采用NJ法重复1000次构建bootstrap验证的系统发育树(图4)。结果显示:哺乳类、两栖类、爬行类、鸟类聚为一个分支;无脊椎动物果蝇(NP_731651)、旋毛形线虫(AAO63753)等聚为另外一个分支;纤毛类的螅状独缩虫(AAS68531)、多子小瓜虫(Im HSP70)、嗜热四膜虫(AAK29100)、变藓棘毛虫(AED86994)聚为一个分支。
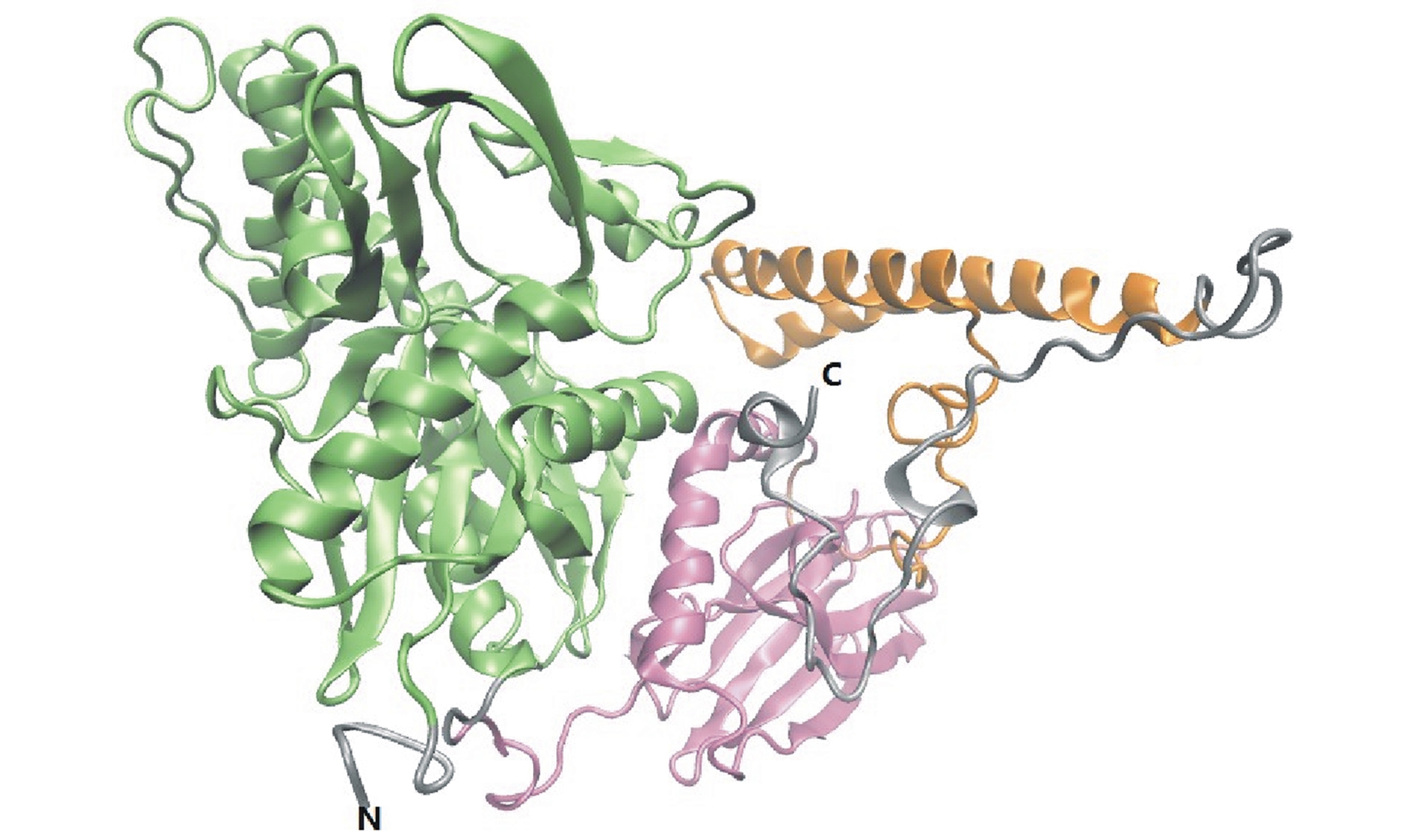
注:绿色表示ATPase domain,粉红色表示peptide-binding domain,橙色表示C-terminal subdomain
Note:Green in color shows ATPase domain,pink in color shows peptide-binding domain,and orange in color shows C-terminal subdomain
图3 Im HSP70蛋白分子三级结构预测图
Fig.3 Tertiary structure of the deduced HSP70 from I.multifiliis
表2ImHSP70氨基酸序列与其他物种的相似性
Tab.2IdentityofHSP70aminoacidinIchthyophthiriusmultifiliiswithotherspecies
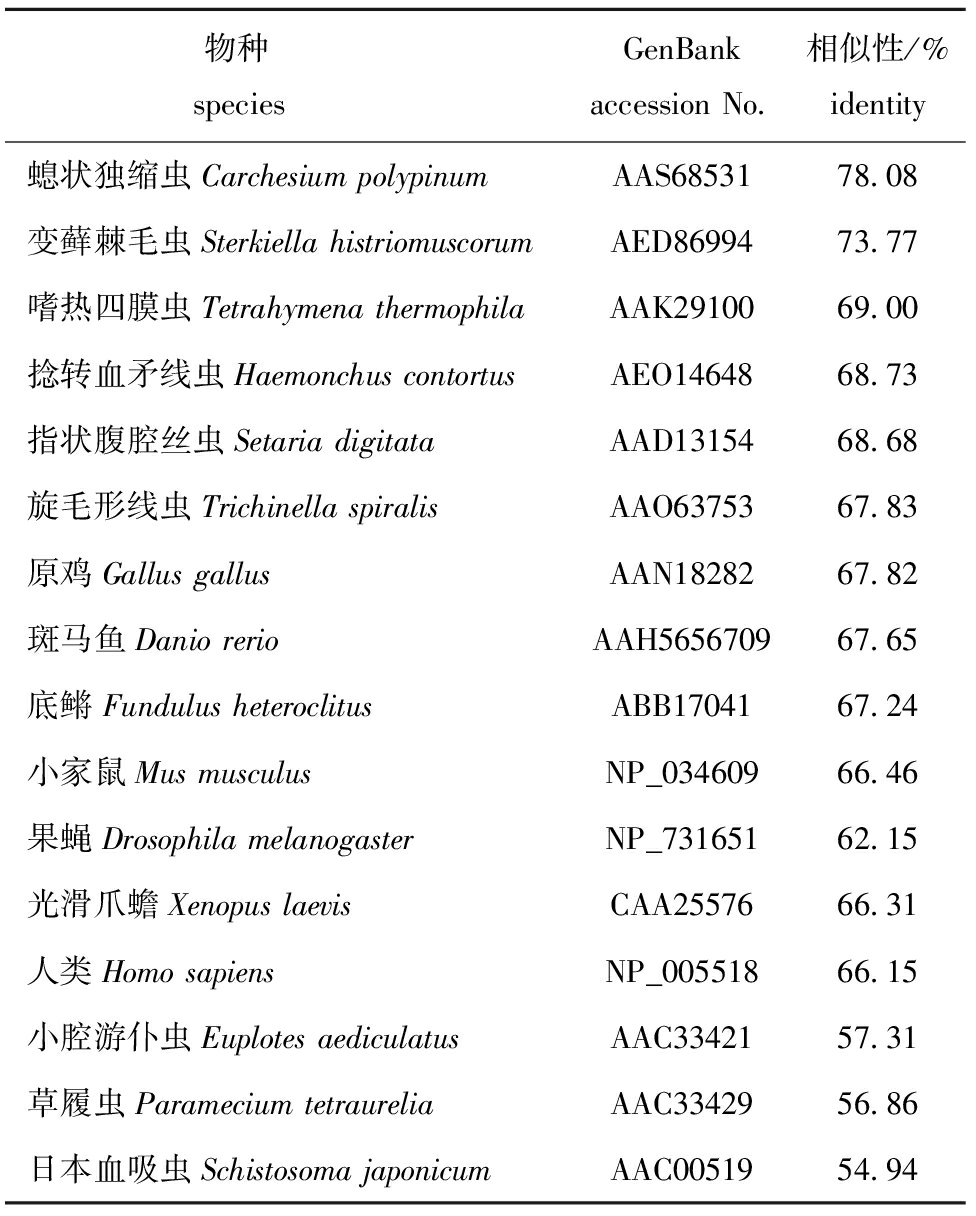
物种 speciesGenBankaccessionNo 相似性/%identity螅状独缩虫CarchesiumpolypinumAAS6853178 08变藓棘毛虫SterkiellahistriomuscorumAED8699473 77嗜热四膜虫TetrahymenathermophilaAAK2910069 00捻转血矛线虫HaemonchuscontortusAEO1464868 73指状腹腔丝虫SetariadigitataAAD1315468 68旋毛形线虫TrichinellaspiralisAAO6375367 83原鸡GallusgallusAAN1828267 82斑马鱼DaniorerioAAH565670967 65底鳉FundulusheteroclitusABB1704167 24小家鼠MusmusculusNP_03460966 46果蝇DrosophilamelanogasterNP_73165162 15光滑爪蟾XenopuslaevisCAA2557666 31人类HomosapiensNP_00551866 15小腔游仆虫EuplotesaediculatusAAC3342157 31草履虫ParameciumtetraureliaAAC3342956 86日本血吸虫SchistosomajaponicumAAC0051954 94
2.3不同温度下ImHSP70mRNA在不同发育阶段相对表达水平的比较
采用实时荧光定量PCR法,分析温度为20、25、30 ℃时多子小瓜虫HSP70基因在3个不同发育阶段(幼虫、滋养体和包囊)的相对表达量。结果显示:20 ℃和25 ℃时,Im HSP70基因在滋养体中的表达量最高,且显著高于其他两个阶段(P<0.05),包囊中表达量次之,幼虫中表达量最低;30 ℃时,Im HSP70基因在包囊中的表达量最高,且显著高于其他两个阶段(P<0.05),滋养体中次之,幼虫中最低(图5)。3个发育阶段中,表达量最大的是25 ℃时滋养体,分别是25 ℃时幼虫、包囊中表达量的179倍和54倍。
分别对多子小瓜虫幼虫、滋养体和包囊在20、25和30 ℃时的表达情况进行分析。结果表明:幼虫中HSP70基因在30 ℃时表达略有增强(P>0.05),分别是25 ℃和20 ℃时的1.75倍和1.28倍;滋养体中HSP70的表达量在25 ℃时显著增强(P<0.05),在30 ℃时又显著降低(P<0.05),呈先升后降的变化趋势;包囊中HSP70的表达量呈先降后升的变化趋势,在25 ℃时表达量显著降低(P<0.05),30 ℃时表达量又显著升高(P<0.05)。
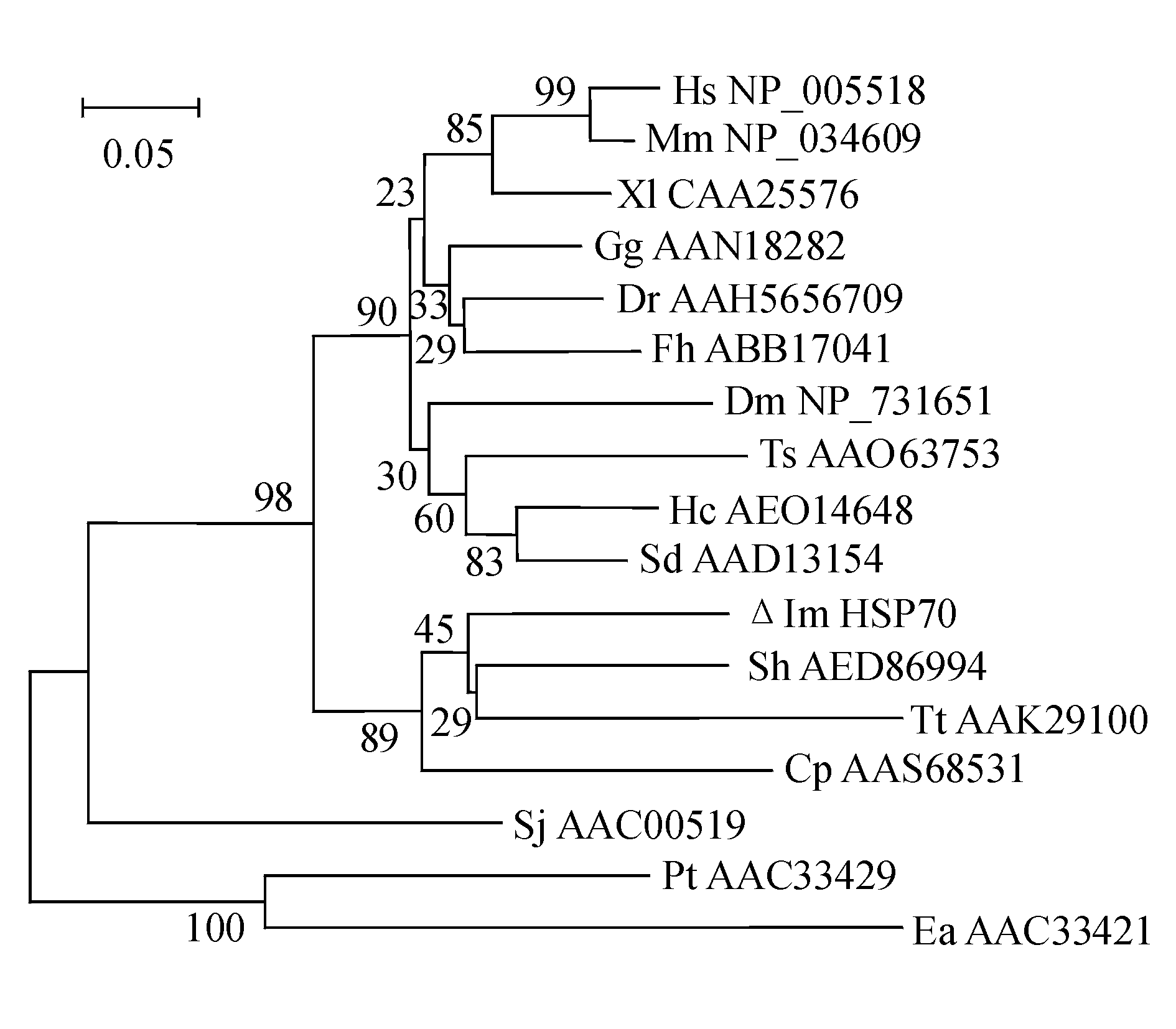
图4 Im HSP70与其他物种HSP70基因氨基酸序列的系统进化树
Fig.4 Phylogenetic tree of HSP70 from I.multifiliis and other species
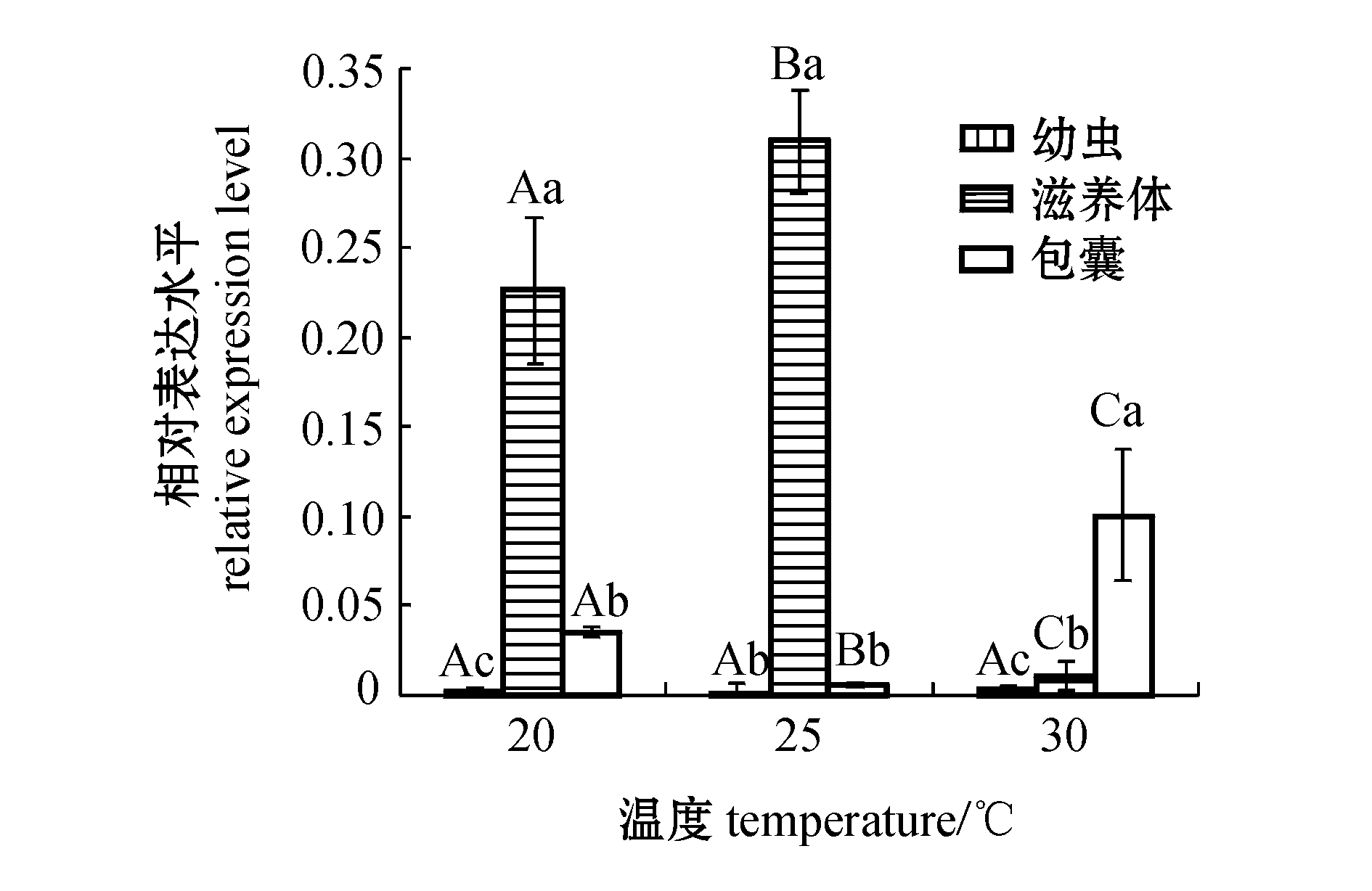
注:标有不同小写字母表示同一温度下不同阶段体之间有显著性差异(P<0.05);不同大写字母表示同一阶段体不同温度之间差异显著(P<0.05)
Note:Different letters indicate significant differences at the same temperature in different stages(P<0.05);Different capital letters indicate significant differences in the same stage at different temperature (P<0.05)
图5 小瓜虫不同发育阶段HSP70 mRNA在不同温度下的相对表达量
Fig.5 Relative expression levels of Im HSP70 mRNA in different stages of I.multifiliis at different temperature
3.1多子小瓜虫HSP70基因序列与结构特征
有研究表明,HSP70可能是寄生虫-宿主相互作用的一个重要的分子[25]。HSP70的存在,可以促进感染的宿主细胞成为自然杀伤细胞(NK-cell)介导毒性的靶细胞[26]。HSP70家族中,共有21种蛋白质,主要包括诱导型HSP70、热激同源蛋白70(heat shock cognate 70,HSC70)、葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)、葡萄糖调节蛋白75等[27],其中诱导型HSP70基因的一个显著特征是不含内含子[28]。用本研究中克隆得到的多子小瓜虫HSP70基因的ORF与多子小瓜虫基因组序列比对发现,多子小瓜虫HSP70基因不含内含子,克隆出来的可能属于诱导型HSP70基因。冯立芳等[17]克隆出嗜热四膜虫的HSP70基因,明建华等[29]克隆出团头鲂的HSP70基因,均验证了这个特征。Im HSP70蛋白的二级结构主要以α-螺旋和β-折叠为主,这与脊椎动物的HSP70相似[30]。同源性分析表明,多子小瓜虫HSP70与其他原生动物HSP70的氨基酸序列相似性高,与同为纤毛门的螅状独缩虫、嗜热四膜虫、变藓棘毛虫聚在一个分支上,而与哺乳类、鸟类等相距甚远,说明根据HSP70序列分析的结果与传统的分类结果是一致的。而冯立芳等[17]克隆出嗜热四膜虫的5个HSP70,编码序列各不相同。Raphaela等[31]分析发现,HSP70家族中有着不同的基因型成员,说明HSP70具有多态性,而且在功能上也是有差异的。多子小瓜虫HSP70是否存在其他的类型,还有待进一步研究。
3.2多子小瓜虫HSP70基因表达与发育、温度的相关性
多数寄生虫生活史复杂,具有不同的发育阶段。HSP70基因在不同发育阶段的表达量是否有差异,也是揭示寄生虫抵抗不同环境条件而生存的关键。前人的研究表明,在寄生虫的不同发育阶段,HSP70的表达存在差异。del Cacho 等[32]对柔嫩艾美耳球虫Eimeriatenella的研究发现,在球虫的发育、成熟和入侵过程中,孢子生殖阶段的HSP70表达量呈递增水平,利用HSP70的特异性单克隆抗体通过免疫组化等技术分析显示,HSP70表达于孢子形成阶段;HSP70出现在早期感染阶段可能与虫体在宿主体内受到的应激有关,也可能与子孢子的形成有关。Neumann等[33]对曼氏血吸虫Schistosomamansoni在不同发育阶段的HSP70研究发现,HSP70只表达于胞蚴、童虫和成虫,在尾蚴中不表达,在胞蚴和尾蚴的转型期HSP70转录终止;但尾蚴转化为童虫和成虫受42 ℃热应激处理后,HSP70表达升高,6 h达到最高水平。冯立芳等[17]的研究也发现,嗜热四膜虫在生长、饥饿和接合生殖等生理或发育状态下,HSP70的表达量也是不同的。与其结果相似的是,本研究中通过对3种不同温度下,HSP70 mRNA在多子小瓜虫3个发育阶段的表达量的研究发现,在幼虫、包囊和成虫3个发育阶段,HSP70表达量有显著的差异,而且在幼虫阶段表达量最低。Abernathy等[34]利用多子小瓜虫表达序列标签信息比较发现,多子小瓜虫在幼虫、滋养体、包囊的转录因子包括抑动抗原和表质蛋白均表达不同。 Yi等[35]发现,木兰科植物厚朴Magnoliaofficinalis和槐属植物苦豆子Sophoraalopecuroides的甲醇提取物对小瓜虫幼虫有着很强的杀灭活性,且提取物对幼虫阶段的毒力要显著强于包囊阶段;Ling等[36]也得出同样的结论。本研究结果表明,多子小瓜虫HSP70 在幼虫阶段的表达量最低,可能与不同生活史阶段有关。
多子小瓜虫对温度的耐受性存在着明显的差异,分为温带型和热带型[7],温带型的适宜水温为16 ℃,热带型的适宜水温在16~24 ℃。冯立芳等[16]在研究螅状独缩虫的耐热能力时发现,不同纬度地域的螅状独缩虫,其HSP70高表达的阀值也是不同的。本研究中,多子小瓜虫取自水温为29 ℃下的感染草鱼,这表明多子小瓜虫在29 ℃时仍对草鱼具有致病性,故推测该多子小瓜虫为热带型。del Cacho 等[37]对柔嫩艾美耳球虫Eimeriatenella野生株和 2 种早熟株的子孢子阶段的 HSP70 表达研究发现,随着虫株毒力的减弱其子孢子的 HSP70 表达水平呈递减趋势,表明 HSP70 在柔嫩艾美耳球虫子孢子中的表达与其致病性相关。HSP70在不同的生物中作为一种抗应激相关因子,当受到外界刺激时,以合成表达HSP70来提高自身的抵抗力。本研究中,剑尾鱼在30 ℃水温中仍能感染多子小瓜虫病,可能与多子小瓜虫高表达的HSP70有一定的关系。随着孵育温度的升高,在滋养体中的表达量先上升后降低,在包囊中的表达量先降低后上升。 多子小瓜虫受到热刺激时,HSP70 mRNA转录水平随之出现明显的增加。而当热刺激超过HSP70蛋白的耐受能力范围时,高HSP70的表达量可能反馈调节抑制HSP70基因的表达[38]。多子小瓜虫的幼虫和包囊阶段是生活在水体中,包囊的形成是多子小瓜虫对不良环境的一种很好的适应性,而幼虫却没有这种保护机制,这也可能是包囊与幼虫HSP70表达量不同的原因之一。 水温30 ℃时,滋养体中HSP70也有一定的表达量,说明在30 ℃时多子小瓜虫滋养体仍具有生物活性。而在包囊中HSP70表达量显著高于滋养体和幼虫,说明包囊的形成有利于抵抗高温的环境。HSP70在包囊中的大量表达也许是多子小瓜虫病在大约30 ℃的高温时仍能暴发的重要分子机制。因此,有必要对不同温度型的多子小瓜虫在不同温度下以及不同型HSP70在耐热机制中的功能作进一步探讨。
参考文献:
[1] Wei J Z,Li H,Yu H.Ichthyophthiriasis:emphasis on the epizootiology[J].Applied Microbiology,2013,57(2):91-101.
[2] 黄琪琰.水产动物疾病学[M].上海:上海科学技术出版社,1993:180-193.
[3] Dickerson H,Clark T.Ichthyophthiriusmultifiliis:a model of cutaneous infection and immunity in fishes[J].Immunol Reviews: Immune Systems of Ectothermic Vertebrates,1998,166(1):377-384.
[4] Olivier J,Carlo P,Domenica D B,et al.Non-invasive detection and quantification of the parasitic ciliateIchthyophthiriusmultifiliisby real time PCR[J].Diseases of Aquatic Organisms,2005,65(3):251-255.
[5] 张其中,张占会,陈达丽,等.水温对多子小瓜虫的影响[J].生态科学,2010,29(2):116-120.
[6] Mojtaba A,Kurt B.Temperature-dependent protection againstIchthyophthiriusmultifiliisfollowing immunization of rainbow trout using live theronts[J].Diseases of Aquatic Organisms,2006,72(3):269-273.
[7] Price D J,Clayton M G.Genotype-environment interactions in the susceptibility of the common carp,Cyprinuscarpio,toIchthyophthiriusmultifiliisinfections[J].Aquaculture,1999,173(1/4):149-160.
[8] 战文斌.水产动物病害学[M].北京:中国农业出版社,2004:223-233.
[9] Xu D H,Klesius P H,Shoemaker C A,et al.The early development ofIchthyophthiriusmultifiliisin channel catfish in vitro[J].Journal of Aquatic Animal Health,2000,12:290-296.
[10] Xu D H,Klesius P H.Two year study on the infectivity ofIchthyophthiriusmultifiliisin channel catfishIctaluruspunctatus[J].Diseases of Aquatic Organisms,2004,59:131-134.
[11] Noe J G,Dickerson H W.Sustained growth ofIchthyophthiriusmultifiliisat low temperature in the laboratory[J].Internation Journal for Parasitology,1995,81(6):1022-1024.
[12] 钱龙,艾涛,谢恒修.温室培育乌鳢鱼苗对小瓜虫病的防治[J].中国水产,1999(10):33.
[13] 邓永强,汪开毓,黄小丽.鱼类小瓜虫病的研究进展[J].大连水产学院学报,2005,20(2):149-153.
[14] 陈爱平,江育林,钱冬,等.小瓜虫病[J].中国水产,2011(8):37-38.
[15] 梁长辉.盛夏小瓜虫病的防治探讨[J].渔业致富指南,2011(10):11.
[16] 冯立芳,缪伟.不同纬度螅状独缩虫耐热能力及Hsp70 mRNA表达水平的比较[J].动物学报,2008,54(3):525-530.
[17] 冯立芳,畅悦,袁冬霞,等.嗜热四膜虫五个Hsp70 基因的表达分析[J].动物学研究,2011,32(3):267-276.
[18] 黄芬,何彰华,李存,等.热激蛋白70的研究进展[J].生物技术通讯,2011,22(6):883-886.
[19] Beere H M,Wolf B B,Cain K,et al.Heat-shock protein 70 inhibits apoptosis by preventing recruitment of procaspase-9 to the Apaf-1 apoptosome[J].Nature Cell Biology,2000,2(8):469-475.
[20] Ravagnan L,Gurbuxani S,Susin S A,et al.Heat-shock protein 70 antagonizes apoptosis-inducing factor[J].Nature Cell Biology,2001,3(9):839-843.
[21] Kumar Y,Tatu U.Stress protein flux during recovery from simulated ischemia:induced heat shock protein 70 confers cytoprotection by suppressing JNK activation and inhibiting apoptotic cell death[J].Proteomics,2003,3(4):513-526.
[22] Zhao Z G,Shen W L.Heat shock protein 70 antisense oligonucleotide inhibits cell growth and induces apoptosis in human gastric cancer cell line SGC-7901[J].World Journal of Gastroenterology,2005,11(1):73-78.
[23] Aruda A M,Baumgartner M F,Reitzel A M,et al.Heat shock protein expression during stress and diapause in the marine copepodCalanusfinmarchicus[J].Journal of Insect Physiology,2011,57(5):665-675.
[24] 韩燕,王淑红,孟照俊,等.热处理对HeLa细胞增殖、凋亡及HSP70表达的影响[J].陕西医学杂志,2011,40(4):394-396.
[25] Yang J,Yang L L,Lv Z Y,et al.Molecular cloning and characterization of a HSP70 gene fromSchistosomajaponicum[J].Parasitology Research,2012,110(5):1785-1793.
[26] Bottger E,Multhoff G,Kun J F,et al.Plasmodiumfalciparum-infected erythrocytes induce granzyme B by NK cells through expression of Host-Hsp70[J].PLoS One,2012,7(2):1-11.
[27] 杨秉芬,孙启鸿,曹诚.热激蛋白70研究进展[J].生物技术通讯,2009,20(5):716-719.
[28] Franzellitti S,Fabbri E.Differential HSP70 gene expression in the Mediterranean mussel exposed to various stressors[J].Biochemical and Biophysical Research Communications,2005,336(4):1157-1163.
[29] 明建华,谢骏,刘波,等.团头鲂HSP70 cDNA的克隆、序列分析以及热应激对其mRNA表达的影响[J].中国水产科学,2009,16(5):635-648.
[30] 田照辉,徐绍刚,王巍,等.西伯利亚鲟热休克蛋白HSP70 cDNA的克隆、序列分析和组织分布[J].大连海洋大学学报,2012,27(2):150-157.
[31] Raphaela de C G,Suely L G.Comparative expression analysis of members of the Hsp70 family in the chytridiomyceteBlastocladiellaemersonii[J].Gene,2007,386(1):24-34.
[32] del Cacho E,Gallego M,Pereboom D,et al.Eimeriatenella:hsp70 expression during sporogony[J].J Parasitol,2001,87(5):946-950.
[33] Neumann S,Ziv E,Lantner F,et al.Regulation of Hsp70 gene expression during the life cycle of the parasitic helminthSchistosomamansoni[J].European Journal of Biochemistry,1993,212(2):589-596.
[34] Abernathy J,Xu D H,Peatman E,et al.Gene expression profiling of a fish parasiteIchthyophthiriusmultifiliis:insights into development and senescence-associated avirulence[J].Comparative Biochemistry and Physiology,Part D,2011,6(4):382-392.
[35] Yi Y L,Lu C,Hu X G,et al.Antiprotozoal activity of medicinal plants againstIchthyophthiriusmultifiliisin goldfish (Carassiusauratus)[J].Parasitol Research,2012,111:1771-1778.
[36] Ling F,Wang J G,Lu C,et al.Effects of aqueous extract ofCapsicumfrutescens(Solanaceae) against the fish ectoparasiteIchthyophthiriusmultifiliis[J].Parasitol Research,2012,111:841-848.
[37] del Cacho E,Gallego M,López-Bernad F,et al.Differences in Hsp70 expression in the sporozoites of the original strain and precocious lines ofEimeriatenella[J].Parasitology,2005,91(5):1127-1131.
[38] Kiang J G,Tsokos G C.Heat shock protein 70 kDa:molecular biology,biochemistry,and physiology[J].Pharmacology & Therapeutics,1998,80(2):183-201.
Abstract:In this paper, heat-shock protein(HSP70)gene ORF (open reading frame),as an important medium molecule for change in environmental temperature, was cloned in parasiteIchthyophthiriusmultifiliis, and the expression of the gene was studied in theront,trophont and tomont of the parasite at water temperature of 20, 25, and 30 ℃ by RT-PCR. It was found that Im HSP70 gene ORF was 1995 bp encoding a putative protein of 664 amino acid residues. The gene structure analysis revealed that the Im HSP70 was primarily comprised of α-helix and randon coil-based in secondary structure, and the N-terminal ATPase domain and C-terminal peptide-binding domain in spatial configuration. Comparison with other known HSP70 protein indicated that the Im HSP70 had the maximal similarity (78.08% identity) to that inCarchesiumpolypinum. Phylogenetic analysis revealed thatI.multifiliiswasclustered into a branch withC.polypinum,TetrahymenathermophilaandSterkiellahistriomuscorumby the Im HSP70 gene. The fluorescence quantitative RT-PCR showed that the minimal expression levels of Im HSP70 were observed in theront stage at all the experimental temperature, significantly higher level in trophont than that in theront and tomont at 20 ℃ and 25 ℃(P<0.05),and the maximal level in tomont at 30 ℃. There were higher expression levels in theront and trophont stages in 30 ℃ than that in 25 ℃(P<0.05). Even at 30 ℃,theI.multifiliisstrain showed relatively higher gene expression level and had infectivity to the fish. We can speculate that HSP70 may play an important role in fighting against the external environment temperature change due to the parasite belonging to the tropical type.
Key words:Ichthyophthiriusmultifiliis; heat-shock protein (HSP70); gene expression
DOI:10.3969/J.ISSN.2095-1388.2014.04.005
文章编号:2095-1388(2014)04-0347-07
收稿日期:2013-12-03
基金项目:现代农业产业技术体系建设专项资金资助项目(CARS-46);农业部“948”项目(2008-G4,2011-Z11)
中图分类号:Q175
文献标志码::A