虾夷马粪海胆TLR基因cDNA克隆及表达分析
王轶南,于卓,刘洋,刘学伟,王姣姣,常亚青
(大连海洋大学 农业部北方海水增养殖重点实验室,辽宁 大连 116023)
摘要:采用同源克隆和cDNA末端快速扩增(RACE)技术克隆获得一条虾夷马粪海胆StrongylocentrotusintermediusTLR基因的全长cDNA序列SiTLR-1(GenBank:HQ259110),并采用实时定量PCR技术分析了其在组织中的分布以及在致病弧菌Vibriofortis、β-D葡聚糖和dsRNA刺激后的表达情况。结果表明:SiTLR-1全长序列为3637 bp,形成16个α螺旋、33个β折叠;SiTLR-1蛋白有两个跨膜区段,在725~750位有跨膜区,发现1个信号肽(1~32aa)、1个亮氨酸重复富集区(LRR);SiTLR-1在检测的各组织中均有表达,在体腔液中表达量显著高于围口膜、管足和齿间肌(P<0.05);经V.fortis、β-D-葡聚糖刺激后,体腔液中的SiTLR-1表达量显著上升,刺激后12 h达到最高值;经dsRNA刺激后,体腔液中的SiTLR-1表达变化较小,仅在3 h时略有升高。研究表明,TLR基因参与虾夷马粪海胆的免疫应答,克隆获得的SiTLR-1可特异性识别细菌和β-D-葡聚糖。
关键词:虾夷马粪海胆;TLR;RACE;定量PCR
TLR是一类重要的模式识别受体(pattern recognition receptor,PRR),其通过识别病原相关模式分子,激活先天免疫系统产生炎症因子、抗微生物肽等,以抵御入侵病原,同时作为预警信号,向抗原呈递细胞发出警报,从而启动获得性免疫系统。TLR识别的信号反应主要通过胞内接头蛋白髓样分化因子88介导,而后NF·Kb被激活,引起机体的天然免疫应答,启动适应性免疫应答,导致各种不同炎性细胞因子分泌,从而在多种生物对微生物感染的监测和免疫应答的诱导中起着必不可少的作用[1]。近年来,对水产动物TLR的研究正逐步开展,先后获得了河豚Fugurubripes[2]、牙鲆Paralichthysolivaceus[3]、凡纳滨对虾Litopenaeusvannamei[4]、栉孔扇贝Chlamysfarreri[5-6]和刺参Apostichopusjaponicus[7]等的TLR基因。海胆属棘皮动物门,在系统进化中占据特殊位置,有关海胆的免疫学研究越来越受到重视。对紫球海胆Strongylocentrotuspurpuratus的测序研究发现,其存在大量免疫受体基因,包括TLR[8]基因家族等,但有关其他海胆TLR的研究较少。虾夷马粪海胆S.intermedius又称中间球海胆,原产于日本北海道及以北沿海,在俄罗斯远东地区也有分布,大连海洋大学于1989年将其从日本引进中国[9]。本研究中,对虾夷马粪海胆TLR基因的克隆及其组织表达情况进行了研究,以期为相关研究提供参考。
1材料与方法
1.1材料
试验用2龄虾夷马粪海胆取自大连海洋大学农业部北方海水增养殖重点实验室,处理前于16~18 ℃海水中暂养7 d。
M-MLV反转录酶、EX Taq DNA聚合酶、pMD 19-T Vector均购自宝生物(大连)有限公司,PCR引物由该公司合成。DEPC、氨苄青霉素、钠盐、IPTG、X-GAL、Tryptone、YeastExtract均购自于上海生工生物工程有限公司。
1.2方法
1.2.1 cDNA第一条链的合成 抽取5枚健康海胆活体的体腔液混合,按照RNAprep Pure Tissue Kit总RNA提取试剂盒[天根生化科技(北京)有限公司]方法提取虾夷马粪海胆体腔液总RNA。采用紫外分光光度计与10 g/L琼脂糖凝胶电泳检测RNA的浓度及完整性,于-80 ℃下保存备用。
在0.2 mL的PCR管中加入100 ng总RNA、1 μL Oligo(dT),再加入RNase-free水至6 μL,混合均匀。于70 ℃下保温10 min,冰上放置2 min。反应体系(10 μL):5×M-MLV Buffer 2 μL,dNTP Mixture(各10 mmol/L)0.5 μL,40 U/μL RNase Inhibitor 0.25 μL,200 U/μL RTase M-MLV(RNase H-)0.25 μL, 用RNase-free补足至10 μL。42 ℃下保温60 min,70 ℃下保温15 min,冰上冷却得到cDNA第一条链,于-80 ℃下保存备用。
1.2.2 cDNA全序列的克隆与分析 根据已发表的紫球海胆TLR基因比对获得保守区,利用Primer 5.0进行比对并设计核心片段引物TLR-F1、TLR-R1(表1)。以上述合成的第一链cDNA作为模板进行PCR扩增。PCR反应体系(25 μL):cDNA 1 μL,TLR-F1 1 μL,TLR-R1 1 μL,10×Ex Tap Buffer(Mg2+Plus)2.5 μL,dNTP Mixture(各2.5 mmol/L)2 μL,5 U/μL Ex DNA聚合酶0.125 μL,灭菌双蒸水17.375 μL。PCR扩增程序:94 ℃下预变性4 min;95 ℃下变性30 s,55 ℃下退火30 s,72 ℃下延伸1 min,共进行35个循环;最后在72 ℃下再延伸7 min,4 ℃下保温。取5 μL扩增产物溶解于2 μL Loading buffer中,经10 g/L琼脂糖凝胶电泳检测PCR扩增产物。
根据SMARTⅡ Oligo Nucleotide提供的接头引物[Universal Primer Mix(UPM)和Nested Universal primer(NUP)],利用获得的部分cDNA序列设计RACE引物TLR-F2、TLR-R2(表1)。用SMARTTMRACE cDNA扩增试剂盒(Clontech公司)进行RACE克隆。反应体系(25 μL):cDNA 1 μL, TLR-F 20.5 μL,TLR-R2 0.5 μL,10×Ex Tap Buffer(Mg2+Plus)2.5 μL,dNTP Mixture(各2.5 mmol/L)2 μL,Ex DNA聚合酶0.13 μL,灭菌双蒸水18.37 μL。PCR扩增程序:95 ℃下预变性5 min;94 ℃下变性30 s,72 ℃下退火、延伸3 min,进行5个循环;94 ℃下变性30 s,70 ℃下退火30 s,72 ℃下延伸3 min,进行5个循环;94 ℃下变性30 s,68 ℃下退火30 s,72 ℃下延伸3 min,进行30个循环;最后在72 ℃下再延伸10 min,4 ℃下保温5 min。
使用AxyPrep DNA试剂盒回收cDNA片段后,连接到pMD 19-T Vector载体上,将连接好的质粒转入至感受态大肠杆菌中,再将细菌培养液均匀涂布于含Amp(50 μg/mL)、PTG(2.4 μg/mL)、X-GAL(4 μg/mL)的LB培养基上培养,挑取阳性克隆送宝生物(大连)有限公司测序。将所得序列用BlastX软件进行同源性分析。用NCBI中的Blast程序进行序列同源性比对和相似性搜索,用DNAMan 软件进行序列拼接获得cDNA全长序列。
表1TLR基因克隆所用引物
Tab.1OligonucleotideprimersusedingenecoloningofTLR

引物primer 序列sequence(5′-3′)TLR-F1ATCTGAAACTGCTTCCAAACGACTLR-R1AGAGAGGGCTTGGATTTCGTTTLR-F2CGAGATTTCTTTAGTCCCTTGCTLR-R2TGTAAAGAAGCCGATGAACAGATTUPMLong:CTAATACGACTCACTATAGGGCAAGC-AGTGGTAACAACGCAGAGTShort:CTAATACGACTCACTATAGGGCNUPAAGCAGTGGTAACAACGCAGAGTQPCR-FTCAAATGGAGCCCGTATGTAGAGQPCR-RCTAATGTCCCCTGCTCTGCCAβ-actin-FAGAGGCGTAGAGGGAAAGACβ-actin-RACAGGGAAAAGATGGCACAGA
1.2.3 序列分析 使用ExPASyCM程序预测蛋白结构域,使用Prosite和Psipred程序预测二级结构;用SingalP程序查找信号肽,用Tmhmm程序搜寻跨膜区;采用Swiss-model软件预测空间结构,用Rasmol软件查看模型;采用Mega 5程序,以邻位相连法(Neighbor-joining)构建进化树。
1.2.4 组织表达分析 分别取5枚海胆的体腔液、肠、管足、齿间肌、围口膜等组织,混合后按“1.2.1”节方法提取RNA并反转录成cDNA,以β-actin基因为内参。在ABI 7500 Real-time PCR扩增仪上进行RT-PCR,按照SYBR Premix Ex TaqTMⅡ使用说明,采用SYBR Green嵌合荧光法进行实时定量PCR扩增反应。PCR反应体系(20 μL):SYBR Premix Ex TaqTMⅡ(2×)10 μL,上下游引物(10 μmol/L)各0.8 μL,ROX Reference Dye Ⅱ(50×)0.4 μL,DNA模板1 μL,灭菌双蒸水7 μL。PCR扩增程序:95 ℃下预变性30 s;95 ℃下变性5 s,56 ℃下退火30 s,共进行40个循环。
1.2.5 应激表达分析 将健康海胆分为3组,每组设3个重复,每组45枚,分别向每组海胆体腔注射致病弧菌Vibriofortis(107cfu/mL)[10]、β-D-葡聚糖(1 mg/mL)、dsRNA(25 mg/L),剂量为50 μL/枚,作为刺激组,刺激3、6、12、24 h后各取3个存活个体的体腔液,混合后提取RNA并反转录成cDNA;设置1个对照组,设3个重复,共15枚海胆,取3枚海胆的体腔液,混合后直接提取RNA并反转录成cDNA。以β-actin基因作内参,按“1.2.4”节方法进行RT-PCR。
2结果与分析
2.1基因序列
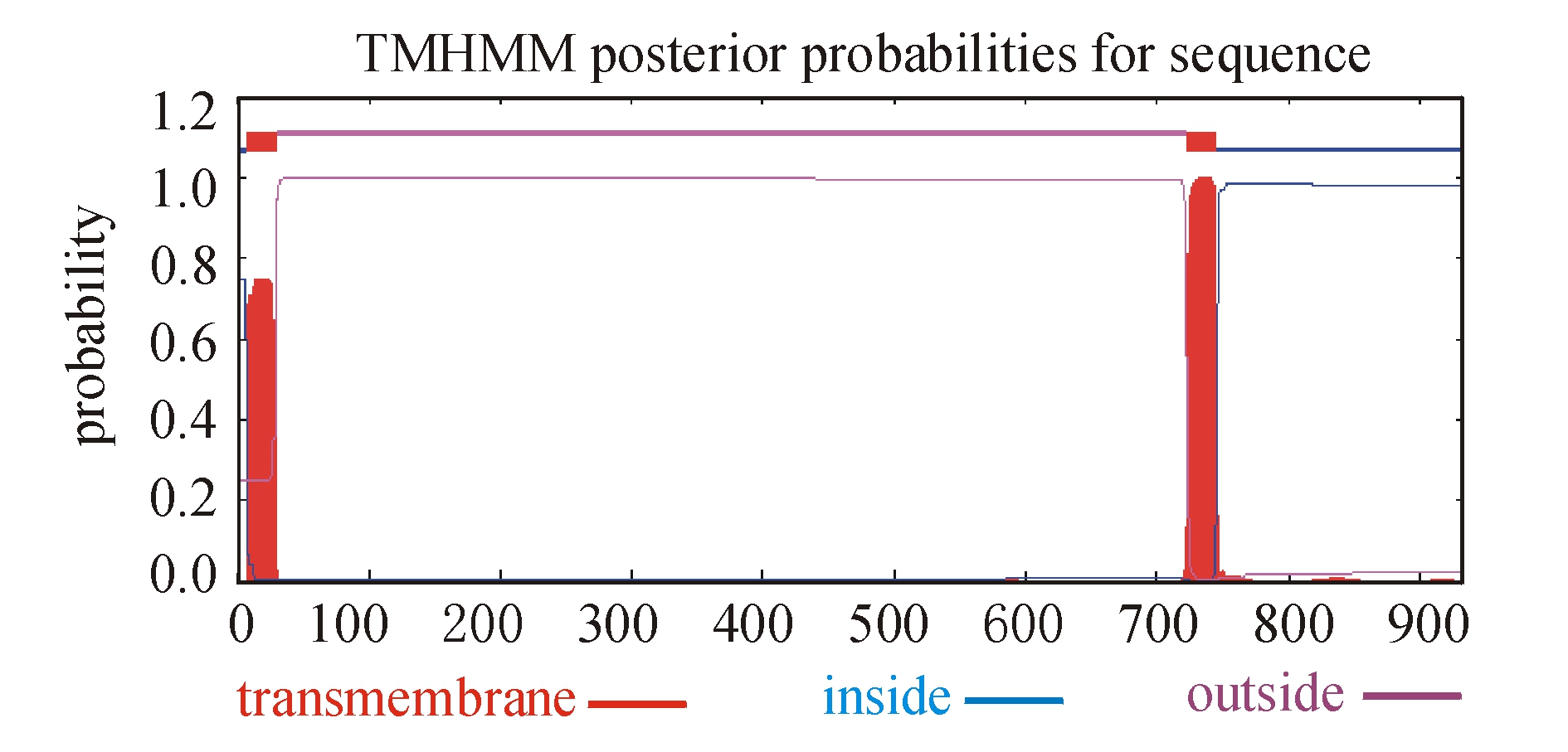
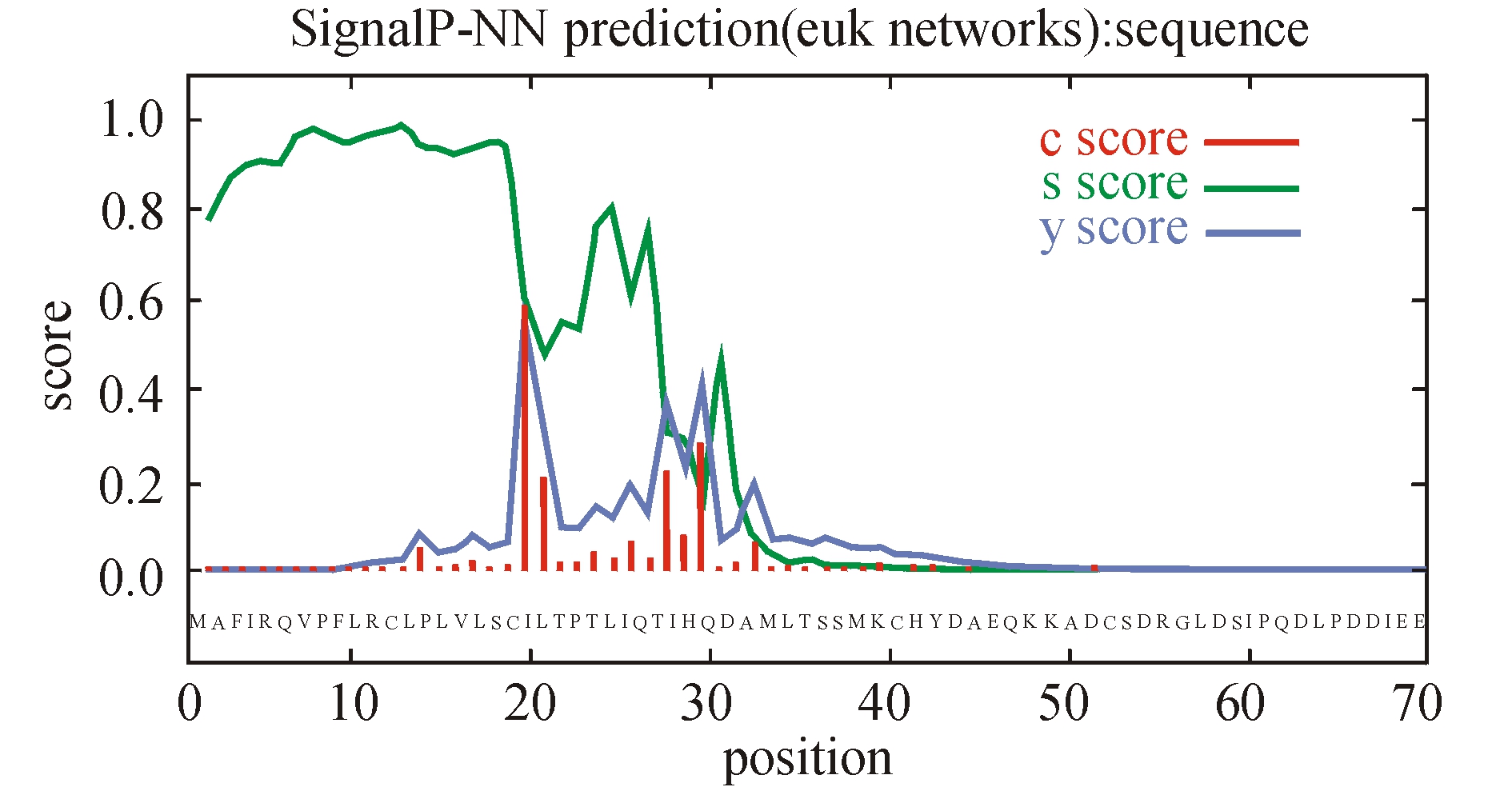
将PCR、5′RCAE和3′RCAE获得的3个片段拼接后得到3637 bp 的TLR全长cDNA序列(图1)。该序列包括一个86 bp 5′非编码区(UTR)、749 bp 3′非编码区和2802 bp开放阅读框(ORF)。在序列的3′UTR,有3个RNA不稳定基序(RNA instability motif)ATTTA结构。SiTLR-1 cDNA可编码934个氨基酸的前体蛋白,预测该蛋白的相对分子质量约为107 300,等电点约为4.94。将获得的全长cDNA序列暂命名为 SiTLR-1,并提交至GenBank,获得序列编号为HQ259110,编码蛋白序列为ADP08783.1。二级结构预测结果显示,该序列形成了16个α螺旋、33个β折叠。对SiTLR-1蛋白的跨膜区进行分析显示,725~750位有跨膜区(图2)。用SingalP软件分析,该序列在0~42aa区域存在信号肽(图3)。将推断的氨基酸序列用Prosite软件分析发现,有1个信号肽(1~32aa)、1个亮氨酸重复富集区(LRR)和1个TIR结构域(778~923aa)。
2.2空间结构模拟
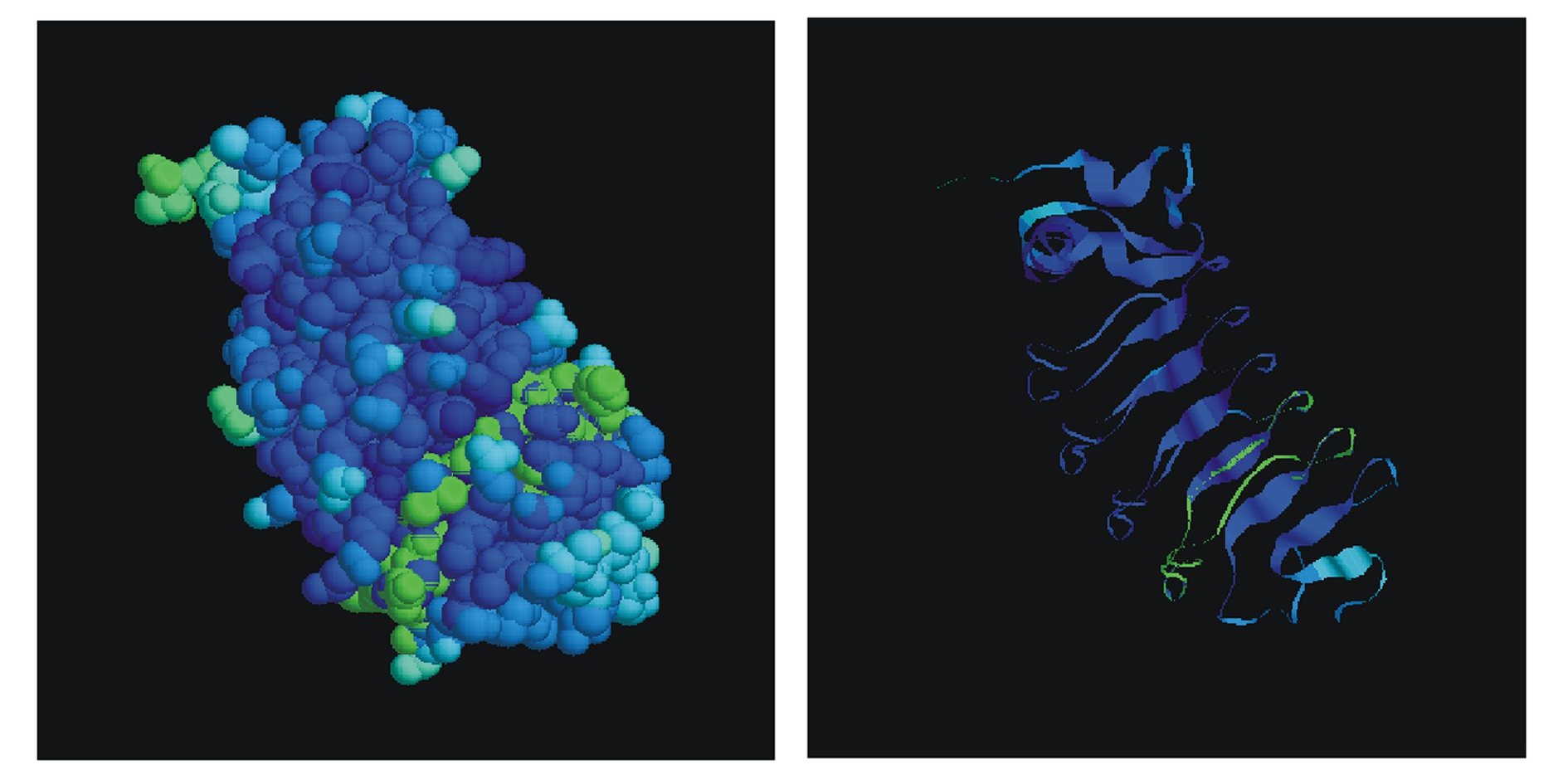
采用空间结构预测软件Swiss-model及模型查看软件RASMOL对获得的SiTLR-1的空间结构进行预测,结果如图4所示(左图为Spacefill空间结构,右图为Ribbons空间结构)。
2.3同源性分析
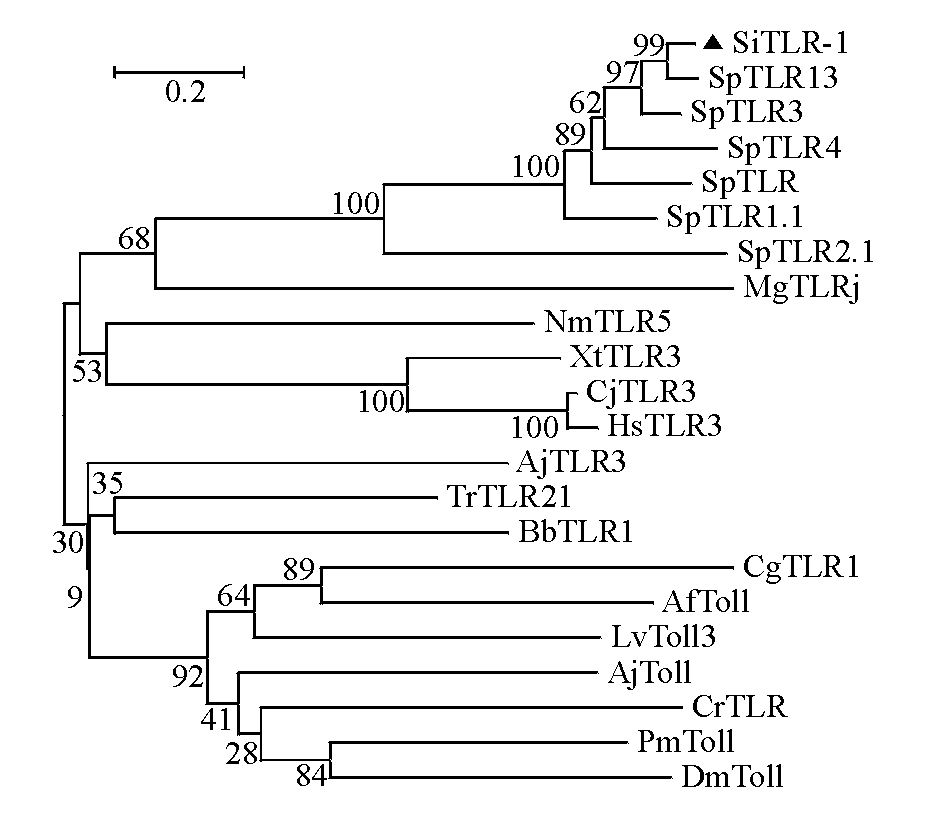
利用Mega 5软件对来自紫海胆等不同物种的22个TLR氨基酸序列(表2)进行了同源性分析,以邻位相连法构建进化树,设定Bootstrap值为500。结果显示,进化树分为两支, SiTLR-1与紫海胆TLR13同源性最高,为99%;SiTLR-1与紫海胆TLR最相近,与其他紫海胆同属一小分支,与紫贻贝及其他陆生动物具有同源性,其他水产动物占据另一支(图5)。
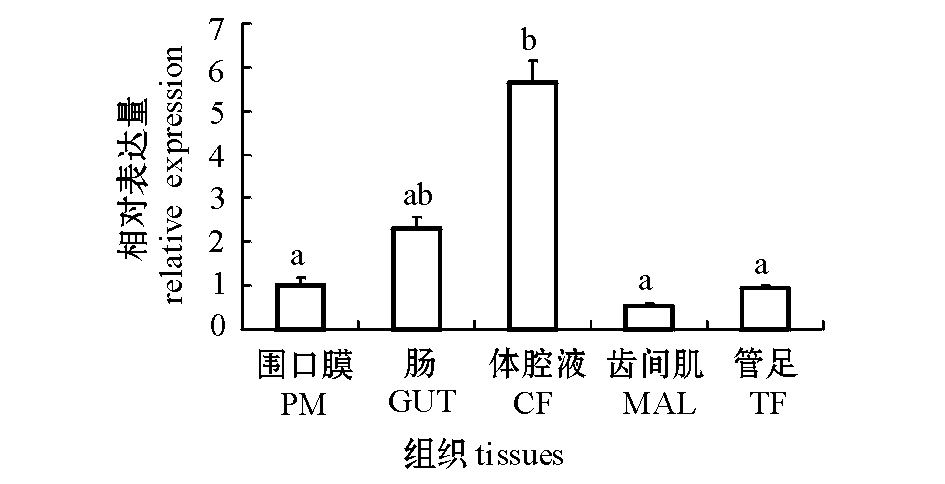
2.4虾夷马粪海胆不同组织中SiTLR-1的表达
采用实时定量PCR分析虾夷马粪海胆SiTLR-1基因在特异组织中的相对表达量。由图6可见,TLR基因mRNA在所有检测组织中均进行转录,但是在不同组织中的表达量有差异。mRNA在体腔液中表达量最高,并与围口膜、齿间肌、管足组织存在显著性差异(P<0.05)。
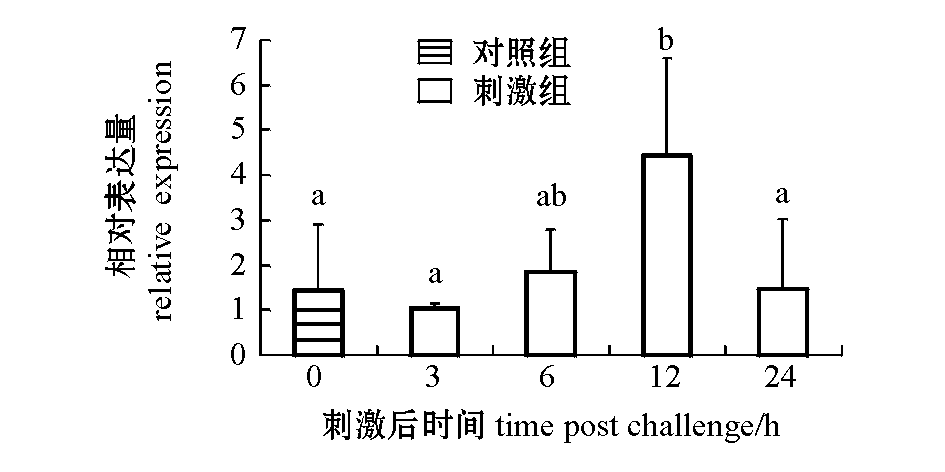
2.5细菌刺激后SiTLR-1的表达
经V.fortis刺激后,虾夷马粪海胆SiTLR-1在体腔液中的表达见图7。SiTLR-1在体腔液中的表达量于细菌刺激后6 h时有轻微上调;刺激后12 h时,表达量急剧上升,达到最高值(为对照组的4.435倍)(P<0.05);随着时间的延长,表达量减少,24 h时又回到对照组水平。
表2系统发育分析所用TLR蛋白序列
Tab.2TheTLRproteinsequencesusedforphylogeneticanalysis
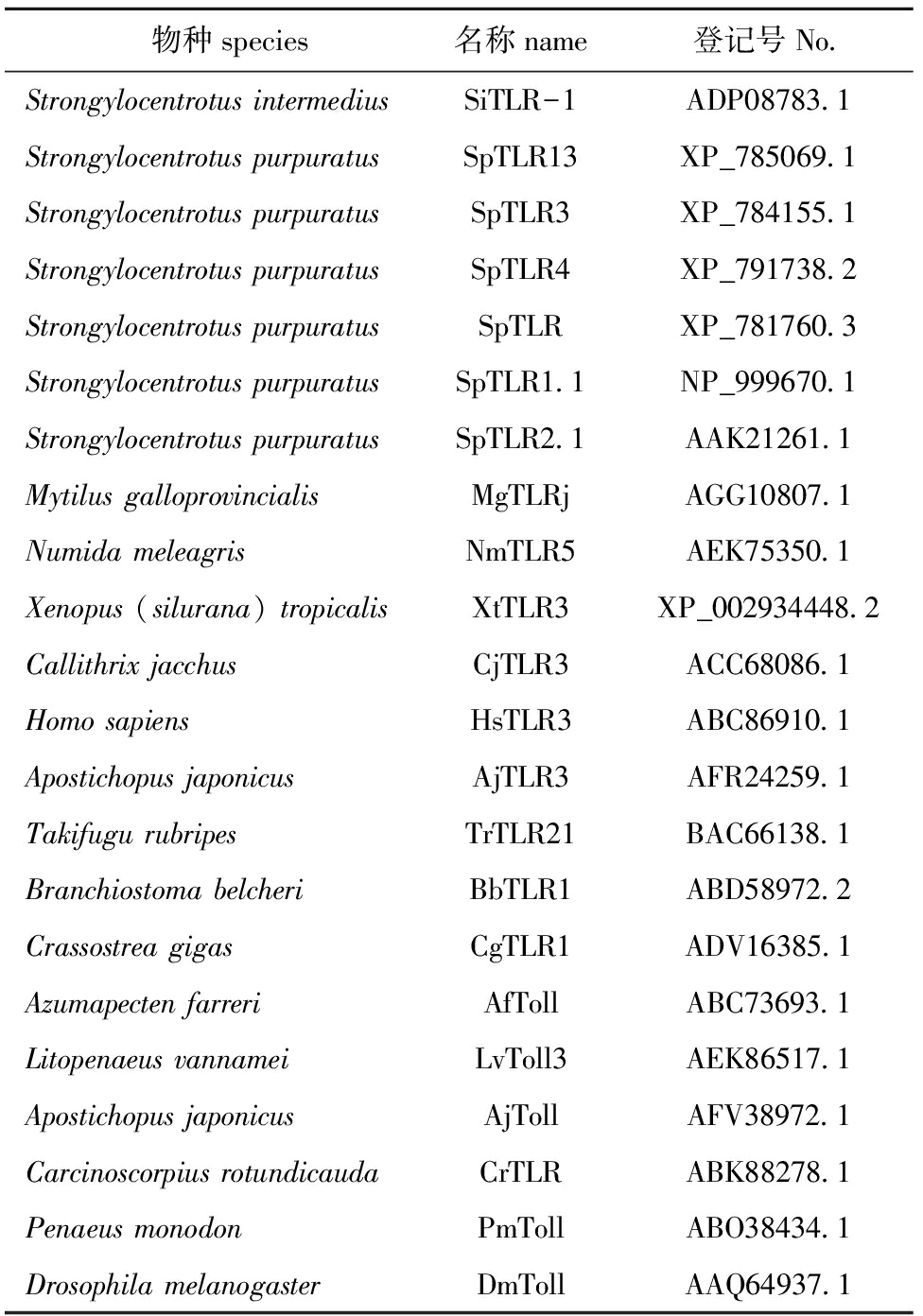
物种species名称name登记号No StrongylocentrotusintermediusSiTLR-1ADP08783 1StrongylocentrotuspurpuratusSpTLR13XP_785069 1StrongylocentrotuspurpuratusSpTLR3XP_784155 1StrongylocentrotuspurpuratusSpTLR4XP_791738 2StrongylocentrotuspurpuratusSpTLRXP_781760 3StrongylocentrotuspurpuratusSpTLR1 1NP_999670 1StrongylocentrotuspurpuratusSpTLR2 1AAK21261 1MytilusgalloprovincialisMgTLRjAGG10807 1NumidameleagrisNmTLR5AEK75350 1Xenopus(silurana)tropicalisXtTLR3XP_002934448 2CallithrixjacchusCjTLR3ACC68086 1HomosapiensHsTLR3ABC86910 1ApostichopusjaponicusAjTLR3AFR24259 1TakifugurubripesTrTLR21BAC66138 1BranchiostomabelcheriBbTLR1ABD58972 2CrassostreagigasCgTLR1ADV16385 1AzumapectenfarreriAfTollABC73693 1LitopenaeusvannameiLvToll3AEK86517 1ApostichopusjaponicusAjTollAFV38972 1CarcinoscorpiusrotundicaudaCrTLRABK88278 1PenaeusmonodonPmTollABO38434 1DrosophilamelanogasterDmTollAAQ64937 1
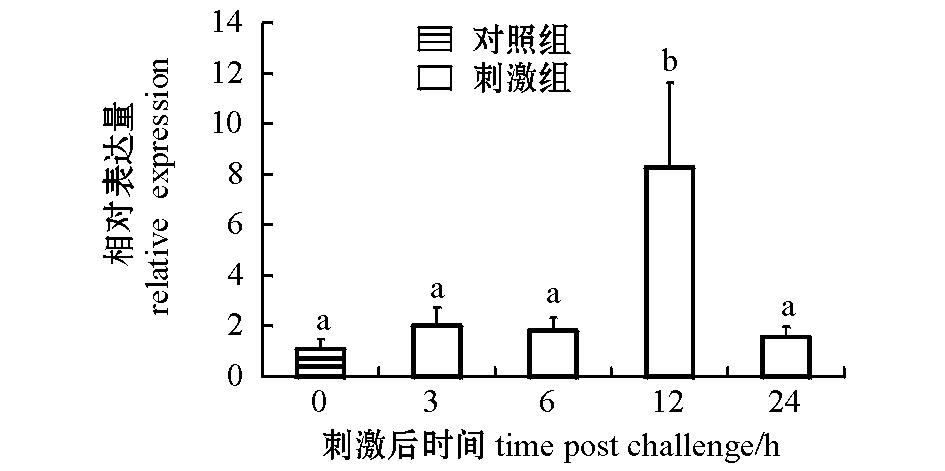
2.6β-D-葡聚糖刺激后SiTLR-1的表达
经β-D-葡聚糖刺激后,虾夷马粪海胆SiTLR-1在体腔液中的表达见图8。在β-D-葡聚糖刺激下,前6 h中SiTLR-1在体腔液中的表达量处于较低水平;12 h时,SiTLR-1表达量明显上升,并达到了最高值(为对照组的8.275倍)(P<0.05);随着时间的延长,SiTLR-1的表达量减少,24 h时又回到对照组水平。
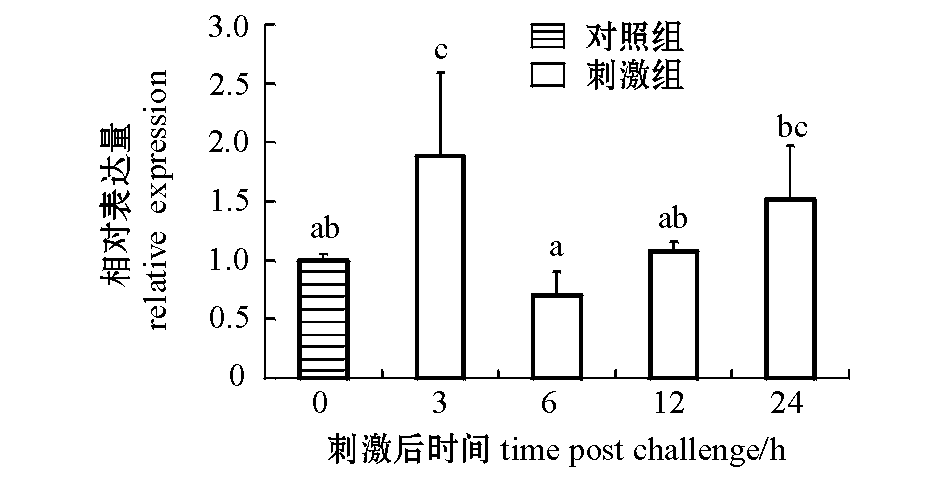
2.7dsRNA刺激后SiTLR-1的表达
经dsRNA刺激后,虾夷马粪海胆SiTLR-1在体腔液中的表达见图9。在dsRNA刺激后3 h,TLR基因表达量显著上升(为对照组的1.88倍),(P<0.05);随着时间的延长表达量减少,6、12、24 h时表达量均与对照组无显著性差异(P>0.05)。
3讨论
典型的TLRs蛋白结构包含一个由20~25个亮氨酸重复序列 (leucine-rich repeat,LRR)组成的螺旋形外功能区、一个跨膜区和一个细胞质Toll-白介素-1受体 (Toll-interleukin-1 receptor,TIR) 区,其中LRR 可识别病原体分子,TIR在信号传导过程中起重要作用[11]。本研究中所得SiTLR-1序列长3637 bp,与紫球海胆TLR1.2相似度达到91%。其编码蛋白有LRR、TIR结构域和跨膜区,编码的蛋白序列与其他物种的TLR蛋白序列具有较高的相似性,表明成功克隆了虾夷马粪海胆TLR基因的一条全长cDNA序列。对紫球海胆、绿海胆Lytechinusvariegates基因组研究显示,其分别存在庞大的TLR家族,紫球海胆中多达253个TLR序列,绿海胆中相对较少,但也有67个[12]。虾夷马粪海胆中也可能存在多个TLR成员,还需开展更深入地研究。
在已报道的几种海洋无脊椎动物,如凡纳滨对虾、栉孔扇贝、刺参、紫海胆、草鱼Ctenopharyngodonidella等中,TLR的组织表达均较为广泛[3-7,13],如Qiu等[14]发现,在栉孔扇贝的血细胞、肌肉、外套膜、心脏、性腺、腮中都检测到TLR。SiTLR-1在虾夷马粪海胆的体腔细胞、围口膜、肠、齿间肌、管足中均有表达, 与相关研究一致,且SiTLR-1在体腔液中的表达量最高,显示其与海胆免疫关系密切。
TLR的种类繁多,特异性识别的病原分子也不尽相同,已发现的TLR家族主要有TLR1~TLR10,其中TLR1主要识别三酰脂多糖[15];TLR2能识别多种病原微生物的产物, 主要识别革兰氏阳性菌的标记蛋白[16];TLR3主要特异性识别dsRNA[17];TLR4主要识别革兰阴性杆菌的脂多糖,还包括脂蛋白、肽聚糖等分子[18];TLR5主要识别细菌鞭毛,TLR7、TLR8 和 TLR9 识别的病原分子是病毒和细菌的核酸[19]; TLR6主要识别二酰基脂蛋白和酵母多糖[20];而TLR10的主要识别物质和信号通路目前尚不清楚。本研究中,SiTLR-1经过弧菌和β-D-葡聚糖刺激后的结果很相似,都是在刺激后12 h时表达量达到峰值,并在24 h开始下降,说明SiTLR-1对V.fortis和β-D-葡聚糖特异性识别较强且有一定的时效性。另外,经dsRNA 刺激后6、12、24 h时,SiTLR-1在体腔液中的表达量与对照组无显著性差异,表明其对dsRNA的特异性识别不明显,SiTLR-1属于哪种TLR还有待于进一步研究。
β-actin基因作为一种广泛参与真核细胞各生理过程中的管家基因,常用作分子系统发育分析及荧光定量分析的内标,在相关研究中应用广泛[21]。在虾夷马粪海胆的研究实例中也有不少应用β-actin作为内参基因,如杨晓飞等[22]对虾夷马粪海胆Vasa基因的表达进行了研究,丁君等[23]对虾夷马粪海胆硬脂酰辅酶A去饱和酶和蛋白酪氨酸磷酸酶基因的表达进行了研究。其具有序列高度保守的特征,同时还具有mRNA表达数量高、数量稳定、几乎不随年龄产生变化的特点[24-25]。杨爱馥等[26]研究发现,刺参β-actin基因在LPS刺激前后的体腔液细胞、肠道和呼吸道中的表达量无显著差异。但是,2005年,Nair等[27]发现,用LPS对海胆进行刺激后,体腔液中actin蛋白表达量也有升高。2011年,Dheilly等[28]发现,在紫海胆受到免疫刺激后,actin蛋白也随免疫基因表达量的升高而升高。因此,本研究中以β-actin基因作为内参得到的表达量可能低于实际水平。
参考文献:
[1] Pasare C,Medzhitov R.Toll-like receptors:linking innate and adaptive immunity[J].Microbes and Infection,2004,6(15):1382-1387.
[2] Oshiumi H,Tsujita T,Shida K,et al.Prediction of the prototype of the human Toll-like receptor gene family from the pufferfish,Fugurubripes,genome[J].Immunogenetics,2003,54:791-800.
[3] Hirono I,Takami M,Miyata M T,et al.Characterization of gene structure and expression of two Toll-like receptors from Japanese flounder,Paralichthysolivaceus[J].Immunogenctics,2004,56(1):38-46.
[4] 叶旻玉,刘利平,戴习林,等.凡纳滨对虾Toll样受体基因cDNA片段的克隆及序列分析[J].上海水产大学学报,2008,17(3):263-267.
[5] Qiu Limei,Song Lingsheng,Yu Yundong,et al.Identification and characterization of a myeloid differentiation factor 88(MyD88) cDNA from Zhikong scallopChlamysfarreri[J].Fish & Shellfish Immunology,2007,23(3):614-623.
[6] Wang M,Yang J,Zhou Z,et al.A primitive Toll-like receptor signaling pathway in mollusk Zhikong scallopChlamysfarreri[J].Dev comp Immunol,2011,35(4):511-520.
[7] Hongjuan S,Zunchun Z,Ying D,et al.Identification and expression analysis of two Toll-like receptor genes from sea cucumber(Apostichopusjaponicus)[J].Fish & Shellfish Immunology,2013,34:147-158.
[8] Roach J C,Glusman G,Rowen L,et al.The evolution of vertebrate Toll-like receptors[J].Proc Natl Acad Sci USA,2005,102:9577-9582.
[9] 王子臣,常亚青.虾夷马粪海胆人工育苗的研究[J].中国水产科学,1997,4(1):60-67.
[10] Wang Y N,Feng N S,Li Q,et al.Isolation and characterization of bacteria associated with a syndrome disease of sea urchinStrongylocentrotusintermediusin North China[J].Aquaculture Research,2012,44(5):691-700.
[11] Hibino T,Loza-Col l M,Messier C,et al.The immune gene repertoire encoded in the purple sea urchin genome[J].Developmental Biology,2006,300(1):349-365.
[12] Buckley K M, Rast J P.Dynamic evolution of Toll-like receptor multigene families in echinoderms[J].Department of Immunology,2012(3):133-136.
[13] 隗黎丽,吴华东,熊六凤.柱状黄杆菌对草鱼TLRs基因表达水平的影响[J].大连海洋大学学报,2013,28(4):378-382.
[14] Qiu L,Song L,Xu W,et al.Molecular cloning and expression of a Toll receptor gene homologue from Zhikong Scallop,Chlamysfarreri[J].Fish & Shellfish Immunology,2007,22(5):451-466.
[15] Miyake K.Innate immune sensing of pathogens and danger signals by cell surface Toll-like receptors[J].Seminars Immunol,2007,19(1):3-10.
[16] 唐军.Toll样受体一个新发现的介导天然免疫的古老家族(上、下) [J].国外医学:免疫学分册,2001,24(2):57261.
[17] Yang C,Su J.Molecular identification and expression analysis of Toll-like receptor 3 in common carpCyprinuscarpio[J].Journal of Fish Biology,2010,76:1926-1939.
[18] Zhao W,An H Z,Zhou J,et al.Hyperthermia differentially regulates TLR4 and TLR2 mediated innate immune response[J].Immunol Letters,2007,108(2):137-142.
[19] Simon R,Samuel C E.Activation of NF-[kappa]B-dependent gene expression bySalmonellaflagellinsFliC and FljB[J].Biochem Biophys Res Commun,2007,355(1):280-285.
[20] Opsal M A,Vage D I,Haves B,et al.Genomic organization and transcript profiling of the bovine toll-like receptor gene cluster TLR6-TLR1-TLR10[J].Gene,2006,384:45-50.
[21] 江建平,周开亚.从12S rRNA基因序列研究中国蛙科24种的进化关系[J].动物学报,2001,47(1):38-44.
[22] 杨晓飞,常亚青,姜玉声,等.虾夷马粪海胆(Strongylocentrotusintermedius)Vasa基因的克隆与表达[J].生物技术通报,2010,12:142-147.
[23] 丁君,孙巍,常亚青.虾夷马粪海胆硬脂酰辅酶A去饱和酶和蛋白酪氨酸磷酸酶基因的克隆与表达[J].大连海洋大学学报,2012,27(6):489-494.
[24] 胡松年,闫隆飞.肌动蛋白与真核生物的进化[J].动物学报,1999,45(4):400-447.
[25] Voigt K,Cozijnsen A J,Kroymann J,et al.Phylogenetic relationships between members of the crucifer pathogenicLeptosphaeriamaculansspecies complex as shown by mating type(MAT1-2),actin,and β-tubulin sequences[J].Molecular Phylogenetics and Evolution,2005,37:541-557.
[26] 杨爱馥,周遵春,董颖,等.仿刺参cyt b和β-actin基因表达稳定性比较[J].中国农业科技导报,2010,12(1):79-84.
[27] Nair S V,Del Valle H,Gross P S,et al.Macroarray analysis of coelomocyte gene expression in response to LPS in the sea urchin. Identification of unexpected immune diversity in an invertebrate[J].Physiol Genomics, 2005, 22(1):33-47.
[28] Dheilly N M,Birch D,Nair S V,et al.Ultrastructural localization of highly variable 185/333 immune response proteins in the coelomocytes of the sea urchin,Heliocidariserythrogramma[J].Immunol Cell Biol,2011,89(8):861-869.
CloningandexpressionanalysisofTLRcDNAfromseaurchinStrongylocentrotusintermedius
WANG Yi-nan, YU Zhuo, LIU Yang, LIU Xue-wei, WANG Jiao-jiao, CHANG Ya-qing
( Key Laboratory of Mariculture & Stock Enhancement in North China’s Sea, Ministry of Agriculture, Dalian Ocean University, Dalian 116023, China)
Abstract:One complete cDNA of TLR named SiTLR-1(GenBank:HQ259110) was cloned from sea urchinStrongylocentrotusintermediusthrough degenerate primer PCR amplification and SmartTMRACE technology. Expression distribution in different tissue after challenge withVibriofortis,β-D glucosan,and dsRNA were assessed using quantitative real-time PCR (qRT-PCR).The full-length cDNA sequence of SiTLR-1 is 3637 bp,with 16 α-helix,33 β-sheet;composed of 1 transmembrane domain (725-750aa),a putative signal peptide (1-32aa), and a leucine-rich repeat (LRR).SiTLR-1 was assessed in all tested tissues (peristomial membrane,gut,coelomic fluid, muscle in Aristotles lantern,tube feet),the expression level in coelomic fluid was significantly higher than the others(P<0.05); the expression level of SiTLR-1 in coelomic fluid was strongly up-regulated after challenge withV.fortisand β-D glucosan,reach the highest point at 12 h; the expression level of SiTLR-1 showed no significant difference after challenge with dsRNA, just weakly up-regulated at 3 h. The findings showed that, TLR genes participated in the immune response of sea urchinS.intermedius, SiTLR-1 can specifically identify bacteria and β-D glucosan.
Key words:Strongylocentrotusintermedius; TLR; RACE; qRT-PCR
DOI:10.3969/J.ISSN.2095-1388.2014.04.002
文章编号:2095-1388(2014)04-0329-07
收稿日期:2013-11-01
基金项目:国家“863”计划重大项目(2012AA10A412);辽宁省教育厅项目(L2012263);辽宁省科技计划项目(2007203004)
作者简介:王轶南(1980—), 女, 博士,助理研究员。E-mail:E-mail:wangyinan@dlou.edu.cn
通信作者:常亚青(1967—), 男,教授, 博士生导师。E-mail:yqchang@dlou.edu.cn
中图分类号:S917
文献标志码::A