鮰爱德华菌单克隆抗体的制备及其在黄颡鱼“红头病”研究中的应用
李强,黄华,张显昱,叶仕根,李华
(大连海洋大学 辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁 大连 116023)
摘要:以黄颡鱼Pelteobagrusfulvidraco“红头病”病原——鮰爱德华菌EdwardsiellaictaluriA86为抗原,利用杂交瘤技术制备了鮰爱德华菌黄颡鱼分离株的菌体单抗5D11、1B8、1G7、3G8、5A9、3H8,其效价分别为1∶1280、1∶1280、1∶2560、1∶320、1∶160和1∶80。结果表明:6株单抗与11株鮰爱德华菌黄颡鱼分离株均可以结合,与迟缓爱德华菌、气单胞菌、大肠杆菌、链球菌、弧菌等10株参考菌株均无交叉反应,单抗5D11和1B8可与鮰爱德华菌参考菌株结合。应用免疫荧光和免疫组织化学法检测了鮰爱德华菌对黄颡鱼的侵染规律。结果表明:黄颡鱼经人工注射鮰爱德华菌A86感染6 h后,在其肝、肾、脾、心、肠和胃中检测到了阳性细菌,其中脾脏中最多,心脏中最少;感染24 h后,脑中检测到阳性细菌;30 h后,鳃中显示有阳性信号;54 h后,在眼的外边缘检测到少量阳性细菌。研究结果可为进一步研究鮰爱德华菌在黄颡鱼体内的致病机理提供技术手段及基础,对揭示黄颡鱼“红头病”的发病机制具有重要意义。
关键词:黄颡鱼;红头病;鮰爱德华菌;单克隆抗体
黄颡鱼Pelteobagrusfulvidraco“红头病”是一种新型传染病,近年来在中国辽宁、吉林、湖北、重庆、江苏、广东等地流行,导致黄颡鱼死亡率高达50%[1],前期研究已证实,该病为鮰爱德华菌感染所致[2-3]。疾病的正确诊断是科学防治的基础,而免疫检测是病原快速检测的最有效技术之一。免疫学检测技术一般采用多克隆抗体[4-6]或单克隆抗体[7-11]作为检测工具。多克隆抗体虽然具有检测灵敏度高等优点,但其成本高、产量少,并易受到动物组织及其他病原体干扰而出现假阳性,给实际应用带来不便。单克隆抗体可以特异性识别单一抗原决定簇,能够在实验室通过细胞培养而得到批量生产,在诊断上具有专一性强、重复性好、操作简便等优点,有较高的使用价值[12]。目前,已有学者制备了针对溶藻弧菌Vibrioalginolyticus[13]、副溶血弧菌V.parahaemolyticus[14]、哈维弧菌V.harveyi[15]、鱼肠道弧菌V.ichthyoenteri[16]、嗜水气单胞菌Aeromonashydrophila[10]、豚鼠气单胞菌A.caviae[11]、迟缓爱德华菌Edwardsiellatarda[17]、海豚链球菌Streptococcusiniae[18]、黄海希瓦菌Shewanellasmarflavi[7-8]等水产动物常见致病菌的单克隆抗体,并进行了实验室和临床应用。本研究中,利用杂交瘤技术制备了稳定分泌抗黄颡鱼“红头病”病原——鮰爱德华菌的单克隆抗体杂交瘤细胞株,并对单抗进行了特性分析,以此为工具进一步研究该菌对黄颡鱼的侵染规律,旨在为该病的快速诊断及防治奠定基础。
1材料与方法
1.1材料
试验用4周龄雌性Balb/C小白鼠,购于大连医科大学SPF实验动物中心。
鮰爱德华菌E.ictaluri(ATCC 33202)、迟缓爱德华菌(SU 100)、大肠杆菌Escherichiacoli(ATCC 29532)、嗜水气单胞菌(BSK-70)、海豚链球菌(KCTC 3657)、杀鲑气单胞菌A.salmonicida(MT 004)、鳗弧菌V.anguillarum(HUFP 5001)、溶藻弧菌(KCCM 40513)、副溶血弧菌(KCTC 2471)、创伤弧菌V.vulnificus(ATCC 29306)、哈维弧菌 (ATCC 14126)均由韩国釜庆大学疾病预防实验室赠送;鮰爱德华菌黄颡鱼分离株A51、A52、A53、A54、A55、A86、A89、A90、A92、A95和A96均由辽宁省海洋生物资源恢复与生境修复重点实验室提供[19]。
HAT购于GIBCO公司;二甲基亚砜购于上海生工生物工程有限公司;聚乙二醇(PEG1500)、弗氏完全佐剂、不完全佐剂、碱性磷酸酶(AP)标记的羊抗小鼠Ig、辣根过氧化物酶(HRP)标记的羊抗小鼠Ig、异硫氰酸荧光素(FITC)标记的羊抗小鼠Ig、氯化硝基四唑蓝(NBT)、5-溴-4-氯-3吲哚-磷酸(BCIP)、二氨基联苯胺(DAB)均购于Sigma公司。
1.2方法
1.2.1 抗原的制备 将鮰爱德华菌A86用淡水营养琼脂平板(NA)于28 ℃下培养18~24 h,用无菌的0.01 mol/L磷酸缓冲液(PBS,pH 7.4)制成菌悬液,用体积分数为0.5%的福尔马林灭活24 h,以6000g离心30 min,用PBS冲洗2次,血球板计数,调节细菌密度为1×109cells/mL,于-20 ℃下冻存备用。
1.2.2 免疫Balb/c小鼠 取灭活的鮰爱德华菌A86注射Balb/C小鼠,共免疫4次。基础免疫,菌悬液(密度为1×109cells/mL)与弗氏完全佐剂1∶1混合,剂量为0.1 mL/只,腹腔注射;2周后加强免疫,菌悬液与弗氏不完全佐剂等比例混合,腹腔注射;之后每隔1周加强免疫1次,从尾静脉注射抗原,共2次。最后一次免疫后第3天取脾脏用于细胞融合。
1.2.3 细胞的融合 将免疫小鼠的脾细胞与骨髓瘤细胞SP2/0在融合剂PEG1500的作用下,进行细胞融合,融合后的细胞用RPMI-1640不完全培养液(含体积分数为20%的血清和1%的HAT)重悬后接种到有饲养细胞的96孔板内,37 ℃下经5%CO2培养。在HAT选择性培养液中培养两周后,检测杂交瘤细胞培养上清液。
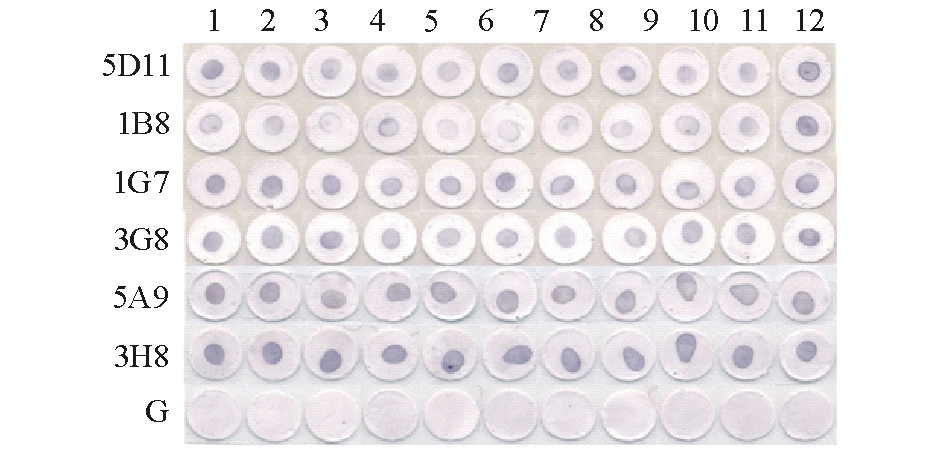
1.2.4 阳性杂交瘤细胞的筛选 采用斑点酶联免疫吸附法(Dot-ELISA)。具体方法如下:将孔径0.2 μm的硝酸纤维素膜(NC膜)用打孔器打成6 mm的规格,放入96孔酶标板中;将鮰爱德华菌A86密度调整为5×108cells/mL,取2 μL菌悬液包被到大小适合的NC膜上,室温风干;每孔加入200 μL 3%的牛血清白蛋白(BSA),于37 ℃下封闭1 h;用PBST洗涤3次,每次5 min(下同);然后每孔加入100 μL杂交瘤细胞培养上清液,用SP2/0培养上清作为阴性对照,37 ℃下孵育1 h;洗涤后滴加100 μL AP标记的羊抗小鼠Ig(1∶1000),37 ℃下孵育1 h;洗涤后再滴加100 μL NBT-BCIP应用液,显色5~10 min,显色时间以NC膜上出现明显蓝紫色斑点为标准,用PBST冲洗,终止反应。以出现蓝紫色斑点,与背景反差强烈为强阳性,与背景反差较强为阳性,与背景反差较弱为弱阳性,不出现斑点或斑点微弱为阴性。
1.2.5 用有限稀释法克隆阳性杂交瘤 经过Dot-ELISA法检测为阳性的杂交瘤细胞培养孔,用培养液吹打起杂交瘤细胞后,取100个左右的杂交瘤细胞加入10 mL细胞培养液中,混合均匀后,滴加到有饲养细胞的96孔板内,每孔100 μL。选取只有一个杂交瘤细胞的培养孔,待杂交瘤细胞长满孔底2/3以上时,取其上清液用Dot-ELISA法检测是否有目的抗体存在。
1.2.6 单克隆抗体特异性的测定 用Dot-ELISA法,选择11株参考菌株(6株淡水菌株,5株海水菌株)以及从辽宁、广东地区患“红头病”黄颡鱼中分离的11株鮰爱德华菌进行单抗特异性检测。菌株于28 ℃下培养24 h,用无菌PBS调节菌悬液密度为5×108cells/mL,分别包被NC膜。一抗为单克隆抗体,取SP2/0培养上清作为阴性对照。
1.2.7 单克隆抗体效价的测定 用密度为5×108cells/mL的鮰爱德华菌A86包被NC膜,用Dot-ELISA法进行检测。单克隆抗体用PBS按1∶5、1∶20、1∶40、1∶160、1∶320、1∶640、1∶1280、1∶2560、1∶5120倍稀释,同时设置阴性对照。
1.2.8 免疫印迹 按文献[20]中的方法进行SDS-PAGE凝胶电泳后,取出凝胶转移至电泳转移槽中,加入转移缓冲液,稳流200 mA,转移5 h;转移后的NC膜用30 g/L BSA于4 ℃下封闭12 h;用PBST洗涤3次,每次5 min(下同);将NC膜浸在单抗中(5D11、1B8、1G7用PBS按1∶100倍稀释,3G8和5A9按1∶50倍稀释;3H8按1∶10倍稀释),37 ℃下孵育1 h,同时用SP2/0培养上清作为阴性对照;洗涤后,加入AP标记的羊抗鼠Ig(1∶1000),37 ℃下孵育1 h;洗涤后,再加入NBT/BCIP应用液,于室温下显色,最后用去离子水清洗,终止反应。
1.2.9 人工感染后黄颡鱼各组织中鮰爱德华菌的分布 采用腹腔注射方式进行黄颡鱼感染试验,用无菌PBS调整鮰爱德华菌A86密度为5×108cells/mL,注射剂量为0.2 mL/尾,共注射16尾,对照组注射等量灭菌生理盐水。饲养水温控制在(25±1)℃,每天观察并记录感染后鱼的症状,每天换水1次。感染后,分别在6、10、24、30、48、54 h对黄颡鱼进行解剖取样,每次2尾,将鱼的心、肝、肾、脾、肠、胃、鳃、脑和眼组织分别用波恩氏液固定和冷冻包埋剂(OCT)包埋。
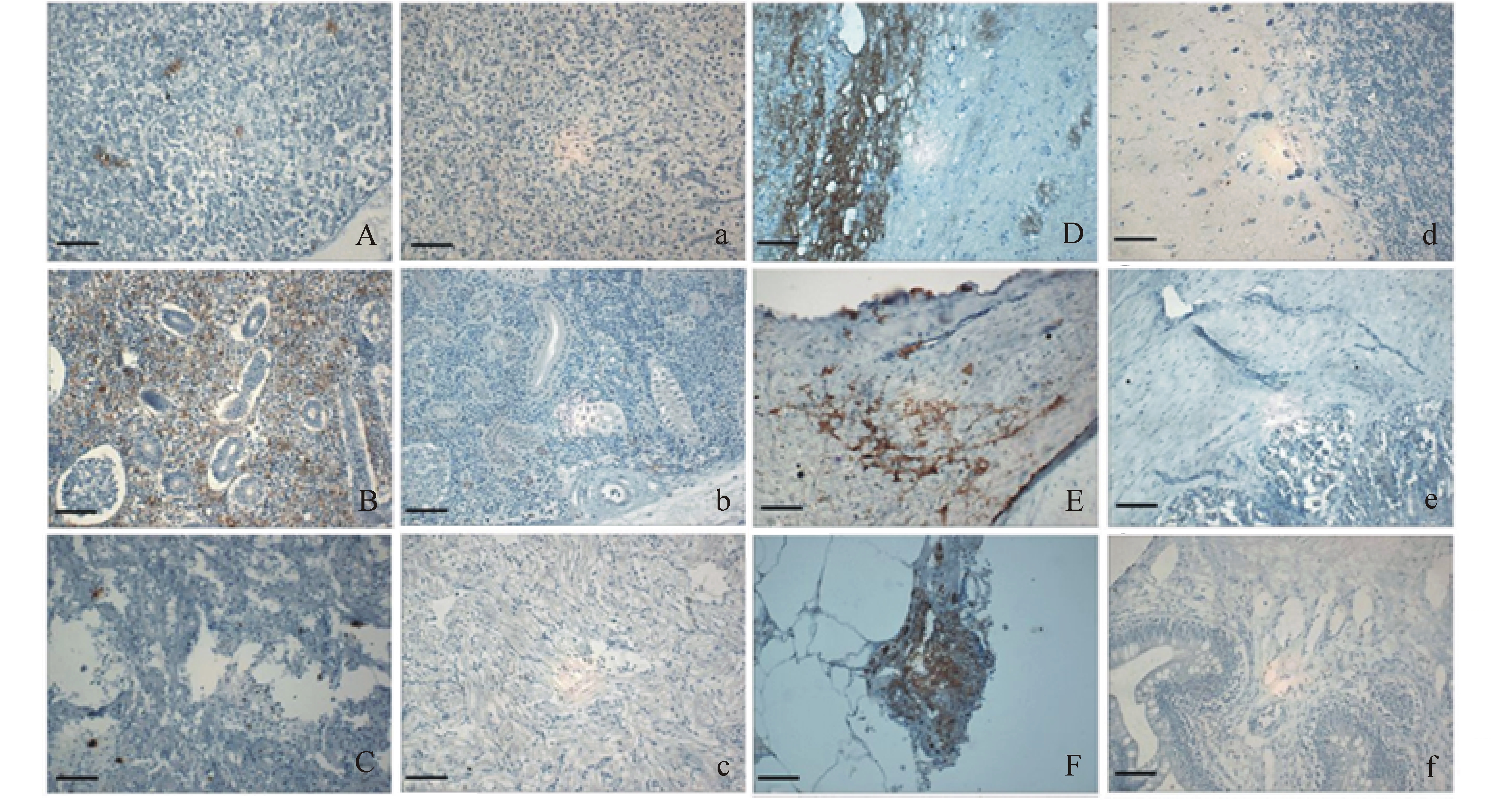
将冷冻包埋的组织制成厚度为5 μm的冰冻切片,用丙酮固定15 min;加入单克隆抗体5D11,37 ℃下孵育45 min;用PBS洗涤3次,每次5 min;加入FITC标记的羊抗小鼠Ig(1∶256),37 ℃下孵育45 min;洗涤后用甘油封片,在荧光显微镜下观察并拍照。
用波恩氏液固定组织,按常规方法进行石蜡包埋和切片,切片水化后用3%的过氧化氢处理20 min;用PBST洗涤3次,每次5 min;用柠檬酸盐缓冲液(pH 6.0)进行抗原热修复;用3%的BSA封闭1 h后加入单克隆抗体5D11,37 ℃下孵育45 min;洗涤后加入HRP标记的羊抗小鼠Ig(1∶100),37 ℃下孵育45 min;洗涤后用DAB避光显色15 min,用Gill苏木精衬染5 min,用甘油封片,在光镜下观察并拍照。
2结果
2.1杂交瘤细胞株
经过筛选和3次克隆后,共获得了6株稳定分泌抗鮰爱德华菌A86的单克隆抗体的杂交瘤细胞,编号分别为5D11、1B8、1G7、3G8、5A9、3H8。
2.2抗体的效价及特异性
经Dot-ELISA法检测,6株单克隆抗体5D11、1B8、1G7、3G8、5A9、3H8的效价分别为1∶1280、1∶1280、1∶2560、1∶320、1∶160和1∶80。5D11、1B8和1G7均显示了较高的效价。
经Dot-ELISA法测定:单抗5D11和1B8与鮰爱德华菌参考菌株存在强烈的阳性反应;6株单克隆抗体与迟缓爱德华菌、嗜水气单胞菌、杀鲑气单胞菌、大肠杆菌、海豚链球菌、鳗弧菌、副溶血弧菌、创伤弧菌、哈维弧菌、溶藻弧菌参考菌株均无交叉反应(图1);6株单克隆抗体与11株鮰爱德华菌黄颡鱼分离株的反应结果均为阳性(图2)。
2.3Western-blot反应
6株单克隆抗体与鮰爱德华菌A86的免疫印迹结果显示,单克隆抗体5D11和1B8均在相对分子质量为12 000蛋白处有一条明显的反应条带,其他4株单抗均无条带出现(图3)。
2.4黄颡鱼各组织中鮰爱德华菌的分布
注射30 h后,鱼体下颌发红,肛门红肿外突,胃外壁有血丝,鱼体上浮。免疫荧光和免疫组织化学均显示,从试验鱼体内组织中可检测到阳性细菌。总体规律为:在感染初期,鱼体部分组织内出现少量细菌;随着感染时间的延长,感染的组织部位增多,且感染部位的细菌量增加。注射6 h后,在肝、肾、脾、心、肠和胃中就检测到了阳性细菌,其中脾脏中最多,心脏中最少;注射24 h后,脑中检测到阳性细菌;注射30 h后,鳃中检测到阳性信号;注射54 h后,在眼的外边缘检测到少量阳性细菌(图4、图5)。
3讨论
本试验中以鮰爱德华菌黄颡鱼分离株A86为免疫原,采用杂交瘤技术,成功获得了6株能稳定分泌抗鮰爱德华菌的单抗杂交瘤细胞。通过棋盘滴定法测得抗体效价:5D11为1∶1280,1B8为1∶1280,1G7为1∶2560,3G8为1∶320,5A9为1∶160,3H8为1∶80,其中有3株抗体效价较高。
单克隆抗体特异性鉴定结果显示,仅2株单抗与鮰爱德华菌结合,6株单抗与迟缓爱德华菌、弧菌等10株参考菌均无交叉反应;而之前研究的鮰爱德华菌多克隆抗体与迟缓爱德华菌和弧菌属的部分细菌存在较强交叉反应[21-22],抗该菌外膜蛋白的多克隆抗体与迟缓爱德华菌、海豚链球菌和创伤弧菌也存在微弱交叉反应[23]。由此可见,本试验中制备的针对鮰爱德华菌的单抗特异性强,为该菌的快速检测技术的建立奠定了良好的基础。有报道证实,鮰爱德华菌与迟缓爱德华菌相似度很高,用16~23 s间序列区分不开[24]。而本研究中获得的2株抗体5D11和1B8能与鮰爱德华菌参考菌株反应,但不与迟缓爱德华菌参考菌株反应;这2株抗体有可能为区分鮰爱德华菌和迟缓爱德华菌提供一种可行的手段,但需要进一步研究证实。Panangala等[25]利用羊多克隆抗体证明,鮰爱德华菌相对分子质量为12 000、18 000、30 000、37 000、70 000的5种蛋白具有强抗原性,本试验中获得的5D11和1B8两株抗体均可特异性识别相对分子质量为12 000的蛋白,而其余4株抗体与转印后NC膜上的蛋白不结合。分析原因可能是免疫印迹中参与反应的是蛋白质变性后的线性表位,而4株抗体识别的是鮰爱德华菌构象型抗原表位。特异性试验结果表明,这4株抗体能与鮰爱德华菌的分离株反应,却不能与鮰爱德华菌的参考菌株反应,分析原因可能是这4株抗体结合的抗原决定簇分布于鮰爱德华菌黄颡鱼分离株上,而在参考菌株中不存在,而是否分布于其他分离株中还有待于进一步研究。
免疫组织化学技术是利用抗原抗体的特异性反应在微观世界原位地确定组织及细胞结构化学成分,具有定性可靠、定位准确的特点。因此,可利用该技术对病原菌在体内的感染情况进行定位,研究病原菌的侵染途径,目前这一方法已在水产动物病原菌侵染途径的研究中得到了广泛的应用。Vandebraak等[26]应用双重免疫组织化学方法,研究了鳗弧菌在斑节对虾淋巴组织中的定植情况。夏永娟等[27]利用免疫组织化学及组织学H.E染色技术,对鳗弧菌人工感染厚点牙鲆肝组织进行了组织病理学及细菌的定位研究。Maniatis等[28]用抗杀鱼巴斯德菌的单抗,将单抗与免疫组织化学技术相结合,检测了海鳗组织中该菌的感染情况。Decosterea等[29]对黄杆菌的高毒力株与低毒力株黏附定植于黑鳉鳃的能力做了研究,结果表明,黄杆菌对鳃组织的黏附在致病机制中起重要作用。
本研究中利用单抗5D11,通过间接免疫荧光和免疫组织化学方法,对人工感染鮰爱德华菌的黄颡鱼各组织进行了检测。结果显示,鮰爱德华菌腹腔注射感染黄颡鱼后,病原菌首先定植于肝、肾、脾、心、肠和胃等内脏组织,随后到达脑,最后到达鳃和眼,由此证实,鮰爱德华菌可以通过黄颡鱼血脑屏障感染脑组织,引发“红头病”。金晓航[30]利用抗迟缓爱德华菌单抗,通过免疫组织化学法,对腹腔注射感染迟缓爱德华菌牙鲆的肝、肾、脾、胃和肠进行了检测,发现肝、肾、脾有较强阳性反应,胃和肠中结果为阴性,确定肝、肾、脾为易感器官。本研究中,免疫组织化学结果显示,注射6 h后,在黄颡鱼肝、肾、脾、心、肠和胃中就检测到了阳性细菌,其中脾脏中最多,心脏中最少;注射24 h后,脑中检测到阳性细菌,其组织分布与迟缓爱德华菌的分布明显不同,这可能与鮰爱德华菌的侵染机制有关,还需进一步深入研究。
目前,对于鮰爱德华菌感染斑点叉尾鮰的发病机理已有报道。研究发现,该菌可通过几条途径感染鱼类:一是经鼻孔侵入嗅神经,然后进入脑内,最后侵害颅骨和皮肤;二是通过肠壁进入血液,经过血液循环到达机体各组织器官,引起败血症。另外,鳃也是鮰爱德华菌入侵的一个重要器官,Nusbaum等[31-32]用同位素标记该菌,斑点叉尾鮰浸泡感染该菌后,最先在鳃的上皮内发现大量细菌,其后依次在肝、后肾、肠道和脑中出现。浸泡5 min后,在循环血液中分离出了鮰爱德华菌,发现该菌能较快突破鱼体各屏障而进入血液,并迅速扩散到全身。由于本研究中,采用腹腔注射方式进行人工感染,结合上述研究,初步分析注射入黄颡鱼腹腔中的鮰爱德华菌,通过体液循环和毛细血管快速进入内脏各组织中,然后经血液循环突破血脑屏障,依次到达心、脑、鳃等组织。
参考文献:
[1] 叶仕根.黄颡鱼“红头病”一种新的细菌性传染病[J].科学养鱼,2008(1):56-57.
[2] Ye S G,Li H,Qiao G,et al.First case ofEdwardsiellaictaluriinfection in China farmed yellow catfishPelteobagrusfulvidraco[J].Aquaculture,2009,292(1/2):6-10.
[3] Craig J L,Seyed H G,J Russell Hayman,et al.Plasmid and serological differences betweenEdwardsiellaictaluristrains[J].Applied and Environmental Microbiology,1993,59(9):2830-2836.
[4] 王印庚,谢建军,荣小军,等.养殖刺参腐皮综合征2种致病菌间接荧光抗体快速检测方法[J].中国水产科学,2010,17(2):329-336.
[5] 樊景凤,李光,王斌,等.间接免疫荧光抗体技术检测凡纳滨对虾红体病病原——副溶血弧菌[J].海洋环境科学,2007,26(6):501-503.
[6] 谢建军,王印庚,张正.养殖刺参腐皮综合征两种致病菌Dot-ELISA快速检测[J].海洋科学,2007,31(8):59-64.
[7] 景宏丽,李强,吴秋仙,等.黄海希瓦氏菌单抗介导的间接ELISA检测技术的建立[J].大连海洋大学学报,2010,25(6):547-550.
[8] 吴秋仙,李强,李华,等.应用双抗体夹心酶联免疫方法检测仿刺参病原菌——黄海希瓦氏菌AP629[J].中国农业科技导报,2011,13(1):117-121.
[9] Delamare A P,Echeverrigaray S,Duarte K R,et al.Production of a monoclonal antibody againstAeromonashydrophilaand its application to bacterial identification[J].J Appl Microbiol,2002,92:936-940.
[10] 郭闯,方苹,郭立新,等.嗜水气单胞菌气溶素单克隆抗体的制备及初步应用[J].水产科学,2007,26(3):167-170.
[11] 黄艺丹,汪开毓,郑建,等.鱼类致病性豚鼠气单胞菌单克隆抗体-胶体金检测方法的建立[J].水生生物学报,2010,34(3):509-516.
[12] 黄华,杜天舒,李强,等.单克隆抗体在水产病原微生物检测中的应用[J].中国农业科技导报,2012,14(2):145-150.
[13] 宋晓玲,黄倢,史成银.溶藻弧菌单克隆抗体的制备及应用[J].水产学报,2001,25(6):522-527.
[14] 池信才,王军,鄢庆枇,等.大黄鱼病原副溶血弧菌单克隆抗体制备及其应用[J].海洋科学,2007,31(8):1-5.
[15] 郝贵杰,沈锦玉,曹铮,等.抗哈维氏弧菌单克隆抗体杂交瘤细胞系的建立及其特性鉴定[J].细胞与分子免疫学杂志,2007,23(9):838-840.
[16] 吴晓春,邓灯,刘慧,等.鱼肠道弧菌单克隆抗体的制备及应用[J].大连海洋大学学报,2013,28(3):259-263.
[17] 金晓航,黄威权,夏永娟.抗迟缓爱德华氏菌单克隆抗体的制备及初步鉴定[J].细胞与分子免疫学,2000,16(2):65.
[18] Klesius P,Evans J,Shoemaker C,et al.Rapid detection and identification ofStreptococcusiniaeusing a monoclonal antibody based indirect fluorescent antibody technique[J].Aquaculture,2006,258(1/4):180-186.
[19] 李强,刘海燕,黄华,等.鮰爱德华菌黄颡鱼分离株外膜蛋白的抗原性分析[J].广东海洋大学学报,2011,31(3):85-89.
[20] 郝贵杰,潘晓艺,徐洋,等.奥尼罗非鱼免疫球蛋白单克隆抗体的制备及其初步应用[J].大连海洋大学学报,2013,28(1):7-11.
[21] Li Q,Jing H L,Li H,et al.Characterization and application of monoclonal antibodies againstShewanellamarisflavi,a novel pathogen ofApostichopusjaponicas[J].Chinese Journal of Oceanology and Liminology,2011,29(5):832-838.
[22] 李华,李重实,李明.抗鲶爱德华氏菌多克隆抗体的制备及特性分析[J].中国海洋大学学报,2010,40(10):29-32.
[23] 李重实,李强,刘海燕.鲶爱德华氏菌间接酶联免疫快速检测法的建立[J].广东海洋大学学报,2010,30(4):17-21.
[24] Frederick M A,Roger B,Robert E K,et al.Current protocols in molecular biology(Vol.2)[M].New York:Greene Publishing Associates and Wiley-Interscience,1987:1011-1021.
[25] Panangala V S,van Santen V L,Shoemaker C A,et al.Analysis of 16S-23S intergenic spacer regions of the rRNA operons inEdwardsiellaictaluriandEdwardsiellatardaisolates from fish[J].Journal of Applied Microbiology,2005,99:657-669.
[26] Vandebraak C B,Bottrrblom M H A,Taverne N,et al.The roles of haemocytes and the lymphoid organ in the clearance of injectedVibriobacteria inPenaeusmonodonshrimp[J].Fish & Shellfish Immunology,2002,13(4):293-309.
[27] 夏永娟,黄威权,蒋国良.鳗弧菌感染牙鲆的组织学和免疫组织化学观察[D].西安:第四军医大学,2000.
[28] Maniatis D,Morris D J,Adams A.Detection ofPhotobacteriumdamselasubspeciesPiscicidain fixed tissue sections using immunohistochemistry and antigen retrival immunohistochemistry[J].Journal of Fish Diseases,2000,23(5):343-347.
[29] Decosterea A,Haesebroucka F,Charlierb G,et al.The association ofFlavobacteriumcolumnarestrains of high and low virulence with gill tissue of black mollies (Poeciliasphenops)[J].Veterinary Microbiology,1999,67:287-298.
[30] 金晓航.迟缓爱德华氏菌抗独特型单克隆抗体的制备[D].西安:第四军医大学,2000.
[31] Nusbaum K E,Morrison E E.Communications:Entry of35S-labeledEdwardsiellaictaluriinto channel catfish[J].Journal of Aquatic Animal Health,1996,8(2):146-149.
[32] Nusbaum K E,Morrison E E.Edwardsiellaictaluribacteraemia elicits shedding ofAeromonashydrophilacomplex in latently infected channel catfish,Ictaluruspunctatus(Rafinesque)[J].Journal of Fish Diseases,2002,25(6):343-350.
PreparationofmonoclonalantibodytopathogenEdwardsiellaictaluriandapplicationinred-headdiseaseofyellowcatfishPelteobagrusfulvidraco
LI Qiang, HUANG Hua, ZHANG Xian-yu,YE Shi-gen, LI Hua
(Key Laboratory of Marine Bio-resources Restoration and Habitat Reparation in Liaoning Province, Dalian Ocean University, Dalian 116023, China)
Abstract:Six hybridomas (5D11,1B8,1G7,3G8,5A9 and 3H8) were prepared from Balb/C mice immunized intraperitoneally withEdwardsiellaictaluriA86(E.ictaluriA86),a pathogen of red-head disease in yellow catfishPelteobagrusfulvidraco, to secrete mAb againstE.ictaluriA86, with valence of 1∶1280 in 5D11, 1∶1280 in 1B8,1∶2560 in 1G7,1∶320 in 3G8,1∶160 in 5A9 and 1∶80 in 3H8. Bacterial cross-reaction showed that these mAbs specifically recognizedE.ictaluriA86, but showed no cross reactivity to other referred bacteria. It is worth noting that mAbs 5D11 and 1B8 were found to react withE.ictalurireferred strains. Immunofluorescence and immunohistochemistry test of the infection rule ofE.ictaluristrains in yellow catfish showed thatE.ictaluriwas detected in liver, kidney, spleen, heart, intestines, and stomach as early as 6 h after infection, the maximum in spleen, and the minimum in heart; positive signal was found in brain 24 h later, and positive signal was found in gill 30 h after infection. With the time elapse, a small amount of positive bacteria was detected around the edges of eyes 54 h after infection.
Key words:Pelteobagrusfulvidraco; red-head disease;Edwardsiellaictaluri; monoclonal antibody
DOI:10.3969/J.ISSN.2095-1388.2014.04.001
文章编号:2095-1388(2014)04-0323-06
收稿日期:2013-11-28
基金项目:辽宁省高等学校优秀人才支持计划项目(LJQ2011075);国家海洋局海洋公益性科研专项(201405003)
作者简介:李强(1979—), 男, 博士,副教授。E-mail:liqiang@dlou.edu.cn
通信作者:李华(1958—), 女, 博士,教授。E-mail:lihua@dlou.edu.cn
中图分类号:S941.4
文献标志码::A