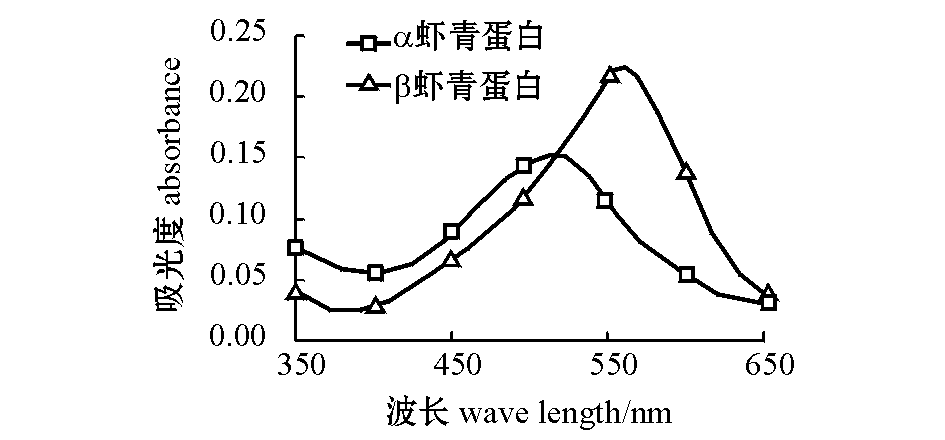
图1 α和β虾青蛋白的紫外可见光谱图
Fig.1 Visible absorption spectra of α and β crustacyanin
摘要:采用远紫外圆二色光谱法对提取自南美白对虾Litopenaeusvannamei壳中的β虾青蛋白的理化性质进行了研究。结果表明:该蛋白是一种以α螺旋(含量为69%)为主要二级结构存在的二聚物,相对分子质量约为75 000,最大吸收波长为580 nm;在40 ℃以下加热以及外加盐未加热时,该蛋白会出现可逆变性,升温至40 ℃以上、改变溶液pH均会对二级结构造成破坏,引起蛋白不可逆变性;加热30 min时,α螺旋损失率最大,约为50%;外加盐在升温时会加速蛋白的不可逆变性,其加速能力与盐浓度成反比;从南美白对虾壳与美国龙虾壳中提取的虾青蛋白在吸收光谱、离子柱亲合力等上有明显区别。研究表明,南美白对虾壳中的虾青蛋白具有水溶性、热不稳定性和遇热显色等性质,可作为食品着色剂或温度敏感指示剂。
关键词:南美白对虾;类胡萝卜蛋白;β虾青蛋白;圆二色光谱;二级结构
虾壳在虾熟制过程中会出现红变现象,这主要是由于虾壳中的类胡萝卜素结合蛋白受热变性而释放出的类胡萝卜素引起的[1],类胡萝卜素同时也是其他水生生物的重要颜色来源[2-3]。虾壳中类胡萝卜蛋白主要由α、β和γ虾青蛋白等亚基蛋白构成,而α与β型是虾青蛋白的主要组成物质,分别占总量的48%和20%。当虾壳被剥离活体后,α型会自动发生不可逆降解,生成相对分子质量约为45 000 的β虾青蛋白,从而增加了β虾青蛋白的含量[4]。
圆二色光谱(Circular dichroism,CD)技术早在1969年就被Greenfield等[5]应用于蛋白质构象的研究中。在其后的半个世纪里,CD技术多次被证明在蛋白质结构研究方面是一种快捷的、可靠的方法[6-9]。光学活性物质对左、右圆偏振光的吸收存在一定的差异,这种差异形成的曲线则反映了蛋白质的构象和二级结构等相关信息。蛋白质的CD光谱主要分为远紫外光区(180~250 nm)、近紫外光区(250~320 nm)和紫外可见光区(320~700 nm)3个波长范围。在规则的蛋白质二级结构中,酰胺键是高度有序排列的,这种排列决定了不同的蛋白质会产生不同的CD谱带,表现在谱带的位置、吸收强弱等方面。蛋白质二级结构主要有4种类型:α螺旋结构,在192 nm处有一正谱带,在222、208 nm处有两个负特征谱带;β折叠结构,在195 nm处有一正谱带,在218 nm处有一负谱带;β转角结构,在205 nm处有一正谱带,在220~230 nm和180~190 nm处分别有两条负谱带;其余则为无规则卷曲结构。从不同种类虾壳中提取的虾青蛋白在红变现象上虽然一致,但它们在分子量、光谱性质、与离子交换柱的结合能力,以及对温度的敏感程度等理化性质上却存在很大差异[10-12 ]。国内在此领域的研究较少。本研究中,以湛江盛产的南美白对虾Litopenaeusvannamei虾壳为原料提取虾青蛋白,采用远紫外CD技术从二级结构的角度对虾青蛋白的理化性质进行了分析。
1.1材料
南美白对虾虾壳取自亚洲海产(湛江)有限公司。
试验仪器主要有UV-1800紫外可见分光光度计(日本岛津公司)、LC-20AD 高效液相色谱仪(日本岛津公司)、圆二色光谱仪(Jasco-725型,日本Jasco公司)、Alpha 2-4型真空冷冻干燥机(德国Martin Christ公司)。试验用水为超纯水,磷酸氢二钠、磷酸二氢钠、EDTA等试剂均为国产分析纯。
1.2方法
1.2.1 β虾青蛋白的提取与纯化 将虾壳用冰水洗净后于4 ℃下干燥、粉碎。用预冷的10% EDTA溶液浸泡(料液比为25 g虾壳∶1 L溶液)10 h(4 ℃)。过滤后,向滤液中加入饱和度为55%的硫酸铵,4 ℃下静置10 h。离心(10 000×g,4 ℃,20 min)后,用50 mmol/L磷酸盐缓冲液(pH为7.0)溶解沉淀。加入饱和度为20%的硫酸铵后4 ℃下静置10 h。二次离心后弃沉淀,再向清液中加入饱和度为50%的硫酸铵。4 ℃下静置10 h后离心所得沉淀即为粗蛋白,将多次提取的粗蛋白收集后通过真空冷冻干燥法浓缩、保存。
在使用高效液相色谱纯化前,需将提取的粗蛋白用保存液透析数次,以尽量减少硫酸铵对纯化的影响。试验选用离子交换柱(5 mm×50 mm Mono Q阴离子交换柱)。流动相:溶剂A为50 mmol/L磷酸盐缓冲液(pH为7.0),溶剂B为含1.0 mol/L氯化钠的50 mmol/L磷酸盐缓冲液(pH为7.0)。梯度洗脱程序:10~80 min内溶剂B的体积分数从0上升至70%,90 min时增加至100%并维持10 min,115 min时降为0。流速为0.5 mL/min,进样量为1 mL。
1.2.2 样品处理 将纯化后的β虾青蛋白分为若干组,溶于50 mmol/L磷酸缓冲液(pH 7.0)中。分别加入0、0.1、1.0、2.0、5.0 mol/L氯化钠,加热温度分别为25、40、50、60、80 ℃,加热时间分别为1、5、30、90 min;用0.1 mol/L盐酸和0.1 mol/L氢氧化钠调节pH为3~11。考查蛋白质对外加盐、温度、加热时间和pH的稳定性。
1.2.3 CD光谱的测定 在Jasco-725型圆二色光谱仪上进行CD光谱测量,光源系统用氮气保护(流量为15 L/min),试验均采用2 mm光程石英样品池。测量参数:扫描波长为200~240 nm,扫描时间为50 nm/min,分辨率为0.1 nm,响应时间为1 s,累积次数3次,在室温下进行测定[13]。CD光谱用平均残基摩尔椭圆度表示,单位为deg·cm2/dmol。利用圆二色光谱仪附带的杨氏法二级结构分析软件CDpro对二级结构含量进行计算。
2.1β虾青蛋白的分子质量
经高效液相分离纯化,按洗脱先后顺序共有3个峰:在20%(体积分数,下同) B液条件下洗脱出,并在520 nm处有最大的吸收片段,定义为α虾青蛋白;在40% B液条件下洗脱出,并在580 nm处有最大吸收片段,定义为β虾青蛋白;最后在100% B液条件下被洗脱出,并在500 nm处有最大吸收片段,该片断被定义为虾青蛋白的变性产物。Timme等[14]研究了从南非龙虾Jasuslalandii壳中提取虾青蛋白,结果表明,α、β虾青蛋白的洗脱浓度分别为0.4、0.2 mol/L B液浓度,且最大吸收峰分别为525、560 nm。Zagalsky[15]研究了从欧洲龙虾、美国龙虾、棘皮动物、腔肠动物等无脊椎动物中提取类胡萝卜蛋白,结果表明,β虾青蛋白约占虾壳类胡萝卜含量的20%,其最大吸收波长在585~590 nm。图1为经高效液相色谱纯化后,α与β虾青蛋白的光谱图,从南美白对虾壳中提取出的虾青蛋白,经Mono Q 阴离子交换柱纯化,分别在40%、20% B液条件下洗脱出的峰。

图1 α和β虾青蛋白的紫外可见光谱图
Fig.1 Visible absorption spectra of α and β crustacyanin
图2为虾青蛋白纯化前后的聚丙烯酰胺凝胶电泳图(SDS-PAGE,凝胶浓度为5%~20%,使用考马斯亮蓝R-250染色)。泳道3为在40% B液条件下的洗脱峰,显示相对分子质量约为75 000,推测该片断为β虾青蛋白。泳道1为粗蛋白电泳条带,在250 000上方有一相对分子质量约为350 000的条带。根据Chayen等[4]的报道,α虾青蛋白是由β虾青蛋白组成的一个八面体圆柱形结构,它可以发生不可逆的降解,生成β虾青蛋白。Dellisanti等[10]在使用X-衍射扫描α虾青蛋白四级结构时,发现从欧洲龙虾Homarusgammarus壳中提取的α虾青蛋白的相对分子质量约为305 000。再结合最大吸收波长,推测该条带为α虾青蛋白。泳道2中出现在37 000附近的条带则证明了α虾青蛋白在实验室条件下极易发生降解。
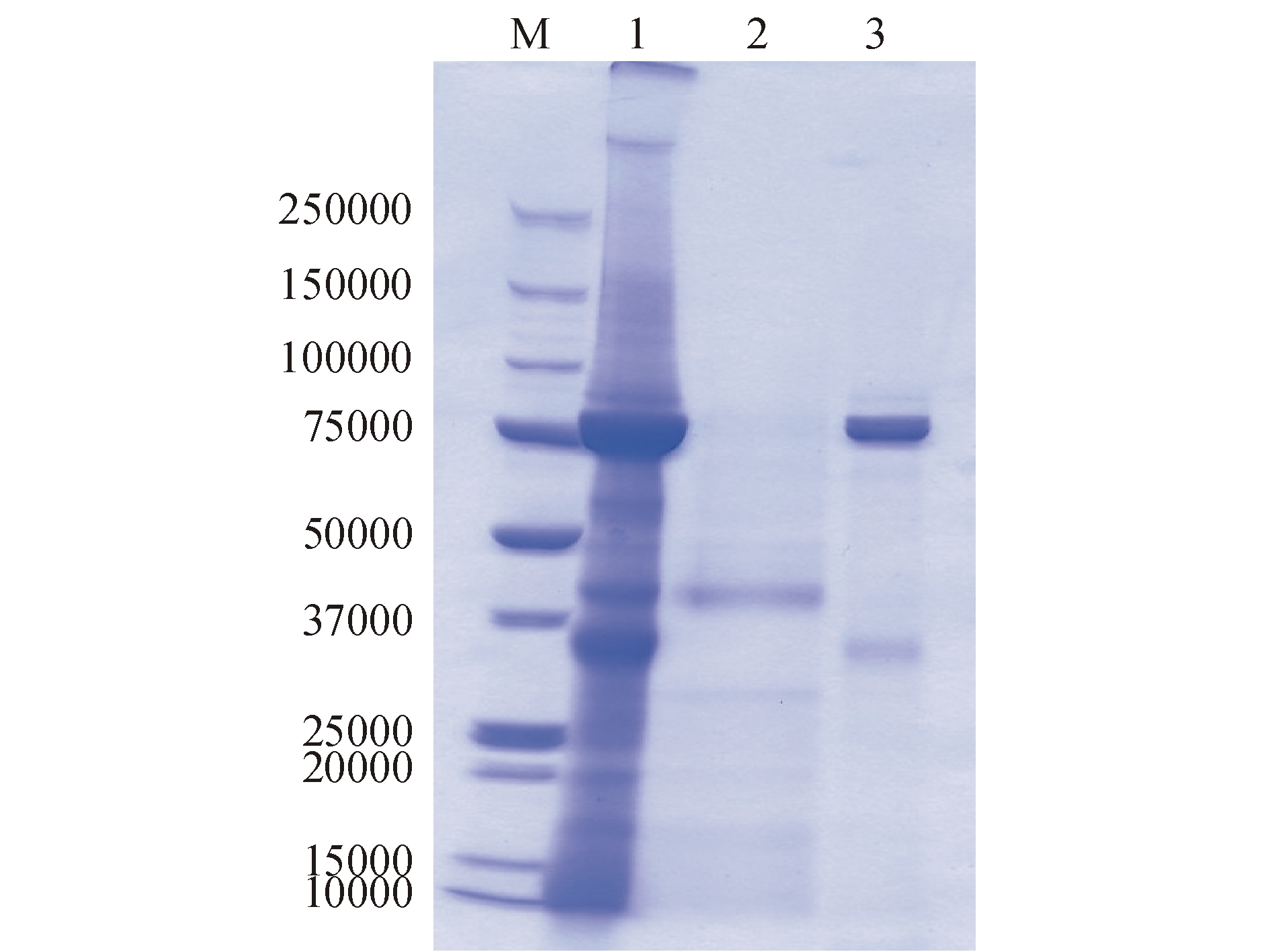
注:M为Marker;1为粗虾青蛋白;2为α虾青蛋白;3为β虾青蛋白
Note: M,Marker;1,crude crustacyanin;2,α crustacyanin;3,β crustacyanin
图2 虾青蛋白聚丙烯酰胺凝胶电泳图
Fig.2 Electrophoresis of sodium dodecyl sulphate for crustacyanin
2.2pH对β虾青蛋白性质的影响
从图3可见:β虾青蛋白在pH为6~8时,α螺旋含量较大,约为60%。当pH值由6下降至3时,α螺旋含量不断下降,最低值出现在pH为5时(7.81%);当pH值由8上升至11时,α螺旋含量亦不断下降,最低值出现在pH为10时(46.64%)。Zagalsky[15]研究表明,从欧洲龙虾壳中提取的β虾青蛋白pH的稳定范围为5.0~8.5,Timmes等[14]研究表明,从南非龙虾中提取的β虾青蛋白pH的稳定范围为5~9。总体而言,升高或降低溶液的pH值都会使α螺旋含量发生下降。这主要是由于pH值的变化对维持二级结构稳定的氢键(分子内和分子间的氢键)造成了破坏,使β虾青蛋白空间构象发生改变而产生不可逆变性。此外,蛋白质本身同时具有酸碱基团这一特殊性质,也促进了它在酸碱条件下的变性。
2.3温度及加热时间对β虾青蛋白性质的影响
图4为β虾青蛋白在不同温度下加热30 min时的圆二色光谱图,内嵌图为α螺旋含量随温度变化的曲线。β虾青蛋白的二级结构主要是α螺旋,含量约为69% (25 ℃),这与Dellisanti等[10]关于虾青蛋白的报道一致。随着温度的升高,α螺旋含量不断降低,从最初的69%降至29%。
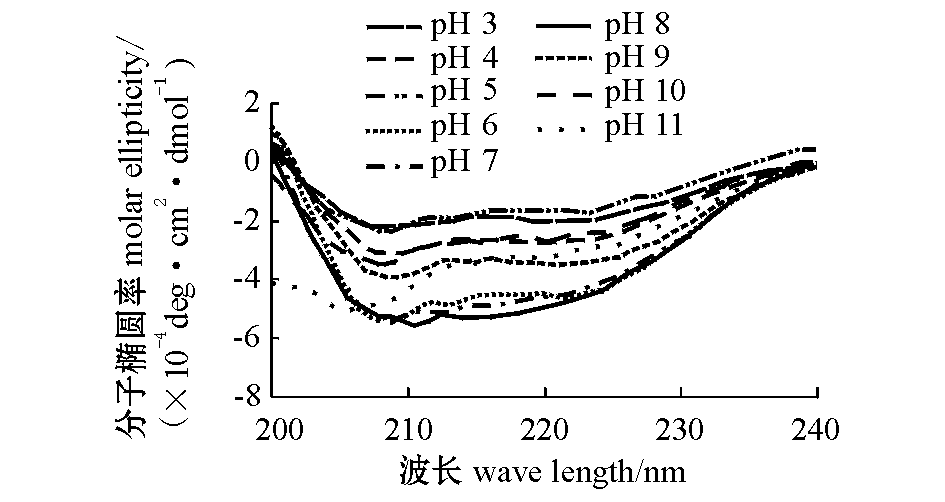
图3 pH对β虾青蛋白的远紫外圆二色光谱的影响
Fig.3 Far-UV circular dichroism spectra of β crustacyanin at different pH values
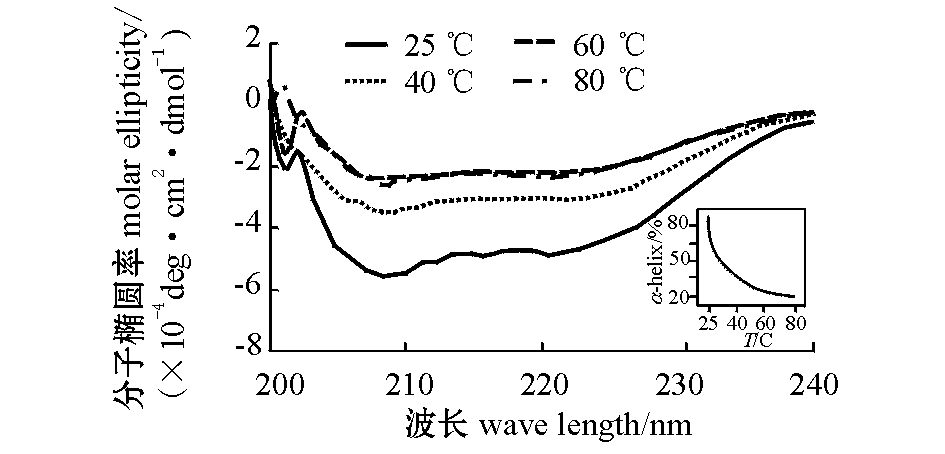
图4 加热温度对β虾青蛋白的远紫外圆二色光谱的影响(内嵌图为α-螺旋含量变化曲线)
Fig.4 Far-UV circular dichroism spectra of β crustacyanin at different temperatures(Insert: change curve of the α helix content)
图5为β虾青蛋白在恒定温度下不同加热时间时的圆二色光谱图。从图中可见,随着加热时间的延长,β虾青蛋白在208 nm和222 nm处的峰值明显降低,通过CDpro软件计算可得初始和终末α螺旋含量分别为:40 ℃下,由62.4%下降至31.6%;50 ℃下,由52.4%下降至41.3%;60 ℃下,由30.8%下降至10.3%;80 ℃下,由10.5%下降至3.3%。初始加热温度越高,α螺旋的损失率越大,即40 ℃时损失率为49.4%,50 ℃时为21.2%,60 ℃时为66.6%,80 ℃时为68.6%。
总体而言,β虾青蛋白在高温、长时间加热的条件下,会对α螺旋造成不可逆破坏;初始温度越高,加热时间越长,α螺旋损失就越大。加热30 min时,α螺旋损失率最大,平均为50%。这是因为水分子对蛋白质结构有一定的破坏能力,高温下水分子的剧烈运动会加速温度对氢键的破坏,使蛋白质二级结构发生改变,从而导致其变性;30 min的加热时间对超过50%的α螺旋造成破坏,即产生了大量的变性蛋白,这些蛋白质沉淀会聚集在未变性蛋白的周围,形成一层保护膜,从而阻止蛋白质的进一步变性。虾青蛋白变性后会失去对类胡萝卜素的结合能力,这些色素的释放会导致虾壳在加热过程中发生红变。温度越高、加热时间越长,氢键破坏越严重,蛋白质变性越明显,释放的色素也越多,因而虾壳也越红。
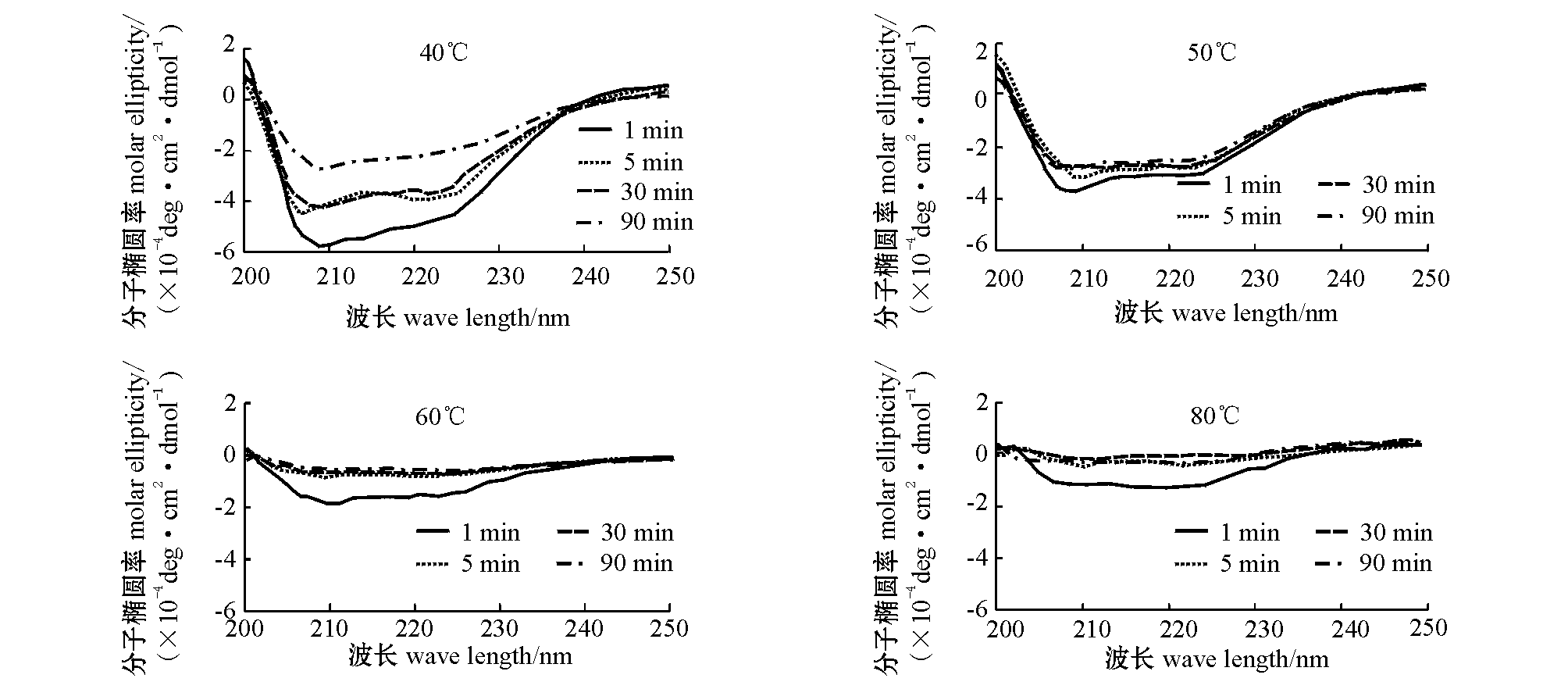
图5 不同温度下加热时间对β虾青蛋白的远紫外圆二色光谱的影响
Fig.5 Far-UV circular dichroism spectra of β crustacyanin at different temperature and treating time
2.4外加盐对β虾青蛋白性质的影响
图6为β虾青蛋白在不同氯化纳浓度下加热30 min时的圆二色光谱图。从图中可见,随温度的上升α螺旋含量下降明显。通过CDpro软件计算可得:在0.1 mol/L盐浓度下,α螺旋含量由初始室温时的76.14%降至80 ℃时的28.29%,损失率超过50%;在其余盐浓度下,降幅均为50%左右。在0.1 mol/L盐浓度下室温时,α螺旋含量略高于无盐室温组(69%)(图3),而其余盐浓度组的初始α螺旋含量均低于无盐组。这表明低盐浓度可以诱导α螺旋生成,而高盐浓度则不能。将5.0 mol/L盐浓度组稀释10倍后测量其α螺旋含量后发现,基本与0.1 mol/L盐浓度组相当,这表明由盐引起的虾青蛋白变性是可逆的。升温时α螺旋含量的下降趋势与外加盐浓度成反比。这可能是由于高盐浓度降低了水分含量,继而减缓了α螺旋含量的下降。2.0 mol/L盐浓度组40 ℃和60 ℃时,α螺旋含量略有上升,表明2.0 mol/L氯化钠可以在高温(60 ℃)下诱导α螺旋生成。
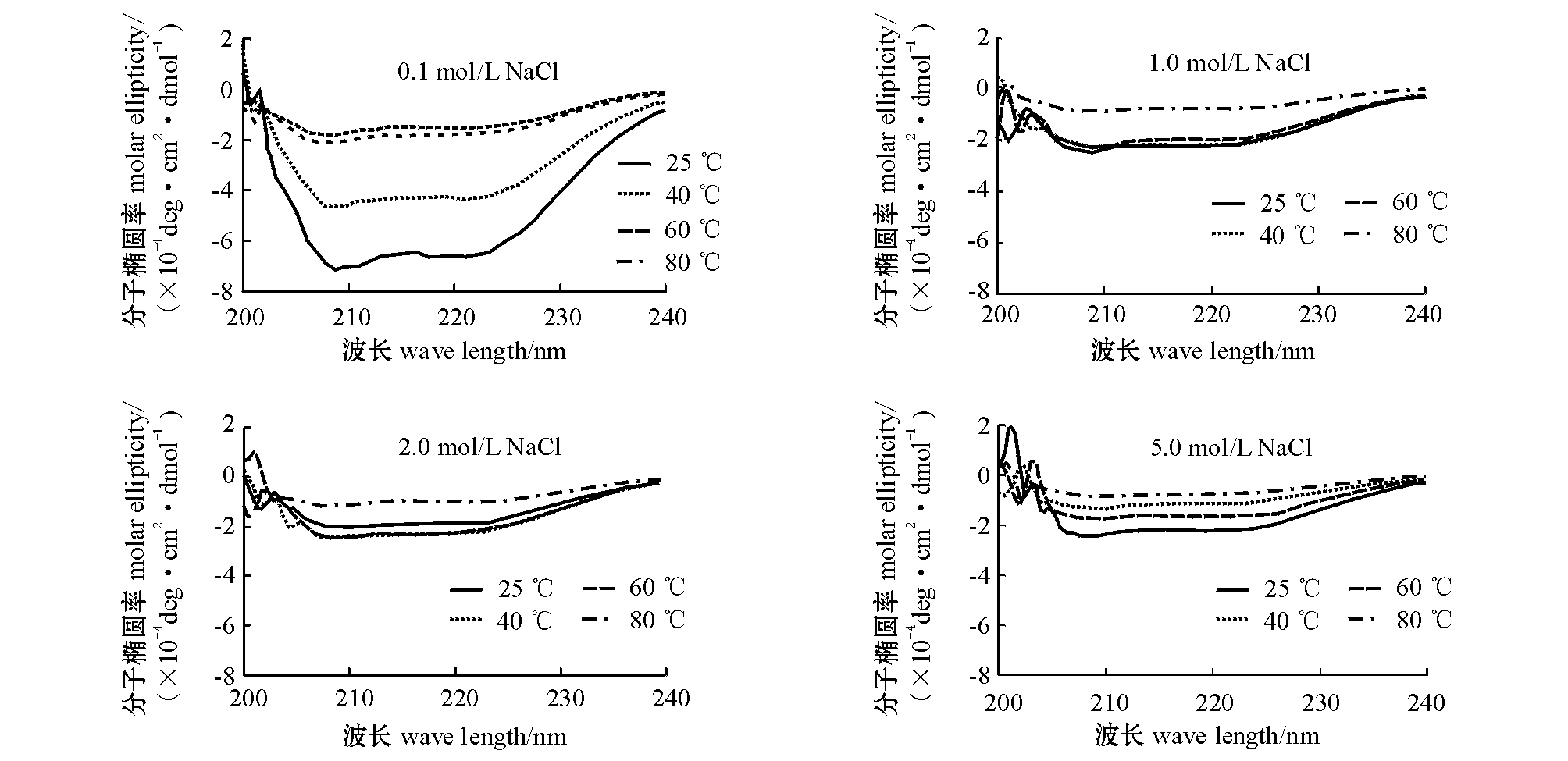
图6 不同外加氯化纳浓度下温度对β虾青蛋白的远紫外圆二色光谱的影响
Fig.6 Far-UV circular dichroism spectra of β crustacyanin at different NaCl concentrations
综上所述,从南美白对虾壳中提取的β虾青蛋白是一种热极不稳定、pH稳定范围狭窄的大分子蛋白质。温度的升高、加热时间的增加、溶液酸碱性的变化和外加盐等均会使蛋白质发生可逆或不可逆的变性。
参考文献:
[1] Cianci M,Rizkallah P J,Olczak A,et al.Structure of lobster apocrustacyanin A1using softer X-rays[J].Acta Crystallogr D,2001,57:1219-1229.
[2] 姜志强,崔培,秦强,等.类胡萝卜素在锦鲤组织器官中的沉积与分布[J].大连海洋大学学报,2012,27(1):22-26.
[3] 闻海波,聂志娟,曹哲明,等.不同颜色珍珠的三角帆蚌组织中类胡萝卜含量的分析[J].大连海洋大学学报,2012,27(3):265-268.
[4] Chayen N E,Cianci M,Grossmann J G,et al.Unravelling the structural chemistry of the colouration mechanism in lobster shell[J].Acta Crystallogr D,2003,59:2072-2082.
[5] Greenfield N J,Fasman G D.Computed circular dichroism spectra for the evaluation of protein conformation[J].Biochemistry-US,1969,8:2108-2116.
[6] Greenfield N J.Methods to estimate the conformation of proteins and polypeptides from circular dichroism data[J].Anal Biochem,1996,235:1-10.
[7] Morrisett J D,David J S K,Pwnall H J,et al.Interaction of an apolipoprotein (ApoLP-Alanine) with phosphatidylcholine[J].Biochemistry-US,1973,12:1290-1299.
[8] Sreerama N,Venyaminov S Y,Woody R W.Estimation of protein secondary structure from circular dichroism spectra:inclusion of denatured proteins with native proteins in the analysis[J].Anal Biochem,2000,287:243-251.
[9] Yang J T,Wu C S,Martinez H M.Calculation of protein conformation from circular dichroism[J].Method Enzymol,1986,130:208-269.
[10] Dellisanti C D,Spinelli S,Cambillau C,et al.Quarternary structure of alpha-crustacyanin from lobster as seen by small-angle X-ray scattering[J].FEBS Lett,2003,544:189-193.
[11] Ferrari M,Folli C,Pincolini E,et al.Structural characterization of recombinant crustacyanin subunits from the lobsterHomarusamericanus[J].Acta Crystallogr F,2012,68:846-853.
[12] Polívka T,Frank H A,Enriquez M M,et al.X-ray crystal structure and time-resolved spectroscopy of the blue carotenoid violerythrin[J].J Phys Chem B,2010,114:8760-8769.
[13] Clarke D T.Circular dichroism in protein folding studies[J].Current Protocols in Protein Science,2012,28:1-17.
[14] Timme E,Walwyn D,Bailey A.Characterisation of the carotenoprotein found in carapace shells ofJasuslalandii[J].Comp Biochem Phys B,2009,153:39-42.
[15] Zagalsky P F.Invertebrate carotenoproteins[J].Method Enzymol,1985,111:216-247.
Abstract:Circular dichroism spectroscopy was used to investigate the physicochemical properties of β crustacyanin extracted from shells of Pacific white leg shrimpLitopenaeusvannamei. The β crustacyanin with molecular weight of 75 000 and λmax580 nm consists of carotenoprotein and carotenoids, mainly in α helix form and contains more than 60% of α helices. This large molecule subunit showed a reversible denaturation exposed to conditions of heat below 40 ℃ and addition of saline before heating. The complex was thermal unstable at over 40 ℃, and the pH change led to the protein denaturation and irreversible. The complex showed the maximal loss ratio of α helix, nearly 50% when it was heated for 30 min. Addition of salt resulted in formation of the irreversible protein,with inverse proportion to salt concentrations. There were significant differences in the physicochemical properties including absorbance spectra and the affinity to ionic column of β crustacyanin extracted from Pacific white leg shrimp and American losterHomarusspecies. It is concluded that the complex showing water soluble,thermal unstable and coloring on heating has a potential as food colorant or temperature indicator.
Key words:Litopenaeusvannamei; carotenoprotein; β crustacyanin; circular dichroism; secondary structure
DOI:10.3969/J.ISSN.2095-1388.2014.03.015
文章编号:2095-1388(2014)03-0276-05
收稿日期:2013-10-09
基金项目:国家虾产业技术体系建设专项资金资助项目(CARS-47);广东省海洋渔业科技攻关重大项目(A201008102);广东省科技团队项目(2011A020102005);广东省海洋渔业科技推广专项科技攻关与研发项目(A201209C02)
中图分类号:S985.2
文献标志码::A