Cu离子浓度对杂交鲟幼鱼行为、血液指标和抗氧化酶的影响
宋波澜,张华
(河北农业大学 海洋学院,河北 秦皇岛 066003 )
摘要:在实验室条件下,设置0.1、0.5、1.0 mg/L 3个Cu离子浓度组和1个空白对照组,研究了Cu离子对体质量为(803.1±35.5)g的杂交鲟(欧洲鳇HusohusoLinnaeus♀×小体鲟AcipenserruthenusLinnaeus♂)的行为指标、血液指标和血清中抗氧化酶活性的影响。试验采样分24、48、72 h 3个时间段。结果表明:Cu离子对杂交鲟的行为指标和血液参数有相同的影响趋势,即随着Cu离子浓度的增大,杂交鲟的呼吸频率和摆尾频率逐渐增大,血清中的红细胞数和血红蛋白含量逐渐增多,但随着暴露于Cu离子中时间的延长,4种指标逐渐降低;Cu离子对杂交鲟白细胞数以及CAT和SOD酶活性的影响表现出一定的剂量效应关系,即随着Cu离子浓度的增大,白细胞数以及CAT和SOD活性呈先升高后降低,而在相同Cu离子浓度下,随着暴露于Cu离子中时间的延长,白细胞数和抗氧化酶活性均明显降低。研究表明,低浓度Cu离子对杂交鲟抗氧化酶活性和免疫细胞有明显的诱导作用,而高浓度Cu离子则抑制其免疫和抗氧化功能。
关键词:杂交鲟;铜离子;行为指标;血液指标;抗氧化酶
铜是水生动物必需的微量营养元素,参与动物有机体多种酶的形成,在动物生长发育过程中起着十分重要的作用[1]。铜也是有毒重金属元素,过量的铜会在体内富集,对蛋白质和酶产生毒害作用,轻则引起动物机体代谢紊乱,重则导致机体死亡[2]。关于Cu离子对鱼类行为和生理功能的影响国内外已有一些报道,但不同浓度的Cu离子对不同种鱼类的影响程度却不尽相同[3-7]。
鲟鱼Sturgeon隶属于硬骨鱼纲Dsteichthyes、鲟形目Acipenseriformes,是当今最具经济价值的大型优质珍稀鱼类之一[8]。其中杂交鲟由于其具有易饲养、耗饲少、抗病能力强、成活率高、生长速度快等优势,已成为中国主要的养殖鲟类[9]。目前,关于杂交鲟人工养殖和基础生理学的研究较多[9-11],但关于重金属离子对其生理生化影响的研究少见。本研究中,以不同浓度的重金属Cu离子对杂交鲟进行处理,研究杂交鲟行为和生理指标的变化规律,对于判断养殖水体中污染物的毒性、评价环境质量具有一定的作用,对养殖生产也有一定的指导意义。
1材料与方法
1.1材料
试验于2013年4—5月于河北农业大学海洋学院科研中心育苗室进行。试验用鱼为河北省秦皇岛市海浪花市场购买的杂交鲟(欧洲鳇HusohusoLinnaeus♀×小体鲟AcipenserruthenusLinnaeus♂)幼鱼,体质量为(803.1±35.5)g,体长为(61.2±1.3)cm,选择体质健状、规格相近的幼鱼120尾用于试验。
1.2方法
1.2.1 试验设计 试验在聚乙烯塑料水族箱(100 cm×78 cm ×60 cm)中进行。试验前在水箱中驯养5 d以上,期间连续充气,溶解氧≥6.0 mg/L,水温为(20.0±1.0)℃,pH为7.2~7.4。试验前一天停止喂食,试验采用静水法对杂交鲟进行染毒处理。用分析纯硫酸铜配制成1.0 mg/mL的母液,根据杂交鲟96 h LC50值确定试验浓度。试验设0.1、0.5、1.0 mg/L 3个Cu离子浓度组和1个空白对照组,每组均设9个重复,每个重复放3尾鱼。试验开始后于24、48、72 h时取样,分别从每个组的每个重复水箱中取1尾鱼作为样品。
1.2.2 测定指标及方法
(1)行为生理指标。使用摄像机从试验水槽正上方拍摄鱼的游泳行为,每次拍摄持续600 s,然后将录像转换成MPEG4视频文件,在计算机上分析摆尾频率和呼吸频率[12]。
用摄像机观察记录一定时间内杂交鲟的摆尾次数和鳃张合次数,并按下式计算摆尾频率(FTB,次/s)和呼吸频率(FR,次/s):
FTB=TTB/t,
FR=TRR/t。
其中:TTB为每尾鱼在被观察期间的摆尾次数;t为观察时间(s);TRR为每尾鱼在被观察期间的呼吸次数。
(2)血液指标。用经肝素钠浸润的注射器从鱼体尾动脉采血,用染色稀释法镜检计数红白细胞,用比色法在血红蛋白比色计内记录血红蛋白含量。
(3)抗氧化酶指标。使用南京建成生物工程研究所的试剂盒测定血清中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性。采用羟胺法测定SOD活力, 酶活力单位定义为: 每毫升反应液中SOD抑制率达50%时所对应的SOD量为1个SOD酶活力单位(U)。采用钼酸铵显色测定CAT活性, 酶活力单位定义为: 每毫升血清每秒钟分解1 μmol双氧水的量为1个CAT酶活力单位(U)。
1.3数据处理
试验数据均用平均值±标准差表示,试验数据用Excel进行常规计算后,用SPSS 17.0进行统计分析,采用单因素方差分析(One-Way ANOVA)进行显著性检验,采用Duncan法进行多重比较,显著性水平设为0.05。
2结果与分析
2.1Cu离子处理后杂交鲟行为生理指标的变化
从表1可见:试验24 h和48 h时,0.1、0.5 mg/L Cu离子浓度组与对照组杂交鲟的呼吸频率在同一时间内无显著性差异(P>0.05),而1.0 mg/L浓度组则与对照组有显著性差异(P<0.05);72 h时,3个Cu离子浓度组的呼吸频率均显著低于对照组(P<0.05)。同一浓度下,对照组杂交鲟的呼吸频率各时间段间无显著性差异(P>0.05),而3个Cu离子浓度组杂交鲟的呼吸频率均随暴露时间的延长减慢,72 h时呼吸频率均显著降低(P<0.05)。
试验24 h和48 h时,3个Cu离子浓度组杂交鲟的摆尾频率在同一时间内均显著高于对照组(除0.1 mg/L浓度组48 h时外);72 h时,3个Cu离子浓度组间无显著性差异(P>0.05),但均显著低于对照组(P<0.05)。同一浓度下,对照组杂交鲟的摆尾频率各时间段间无显著性差异(P>0.05),而3个Cu离子浓度组则随着暴露时间的延长,活动放缓,摆尾频率显著减慢(P<0.05),运动能力降低。
表1Cu离子浓度对杂交鲟呼吸频率和摆尾频率的影响(n=9)
Tab.1EffectofCu2+ontherespiratoryfrequencyandtailbeatingfrequencyinhybridstrugeon(n=9)
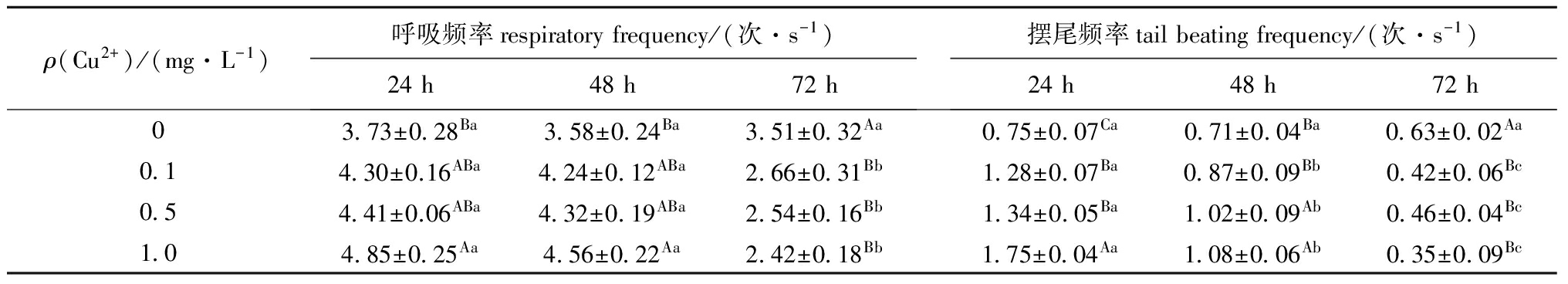
ρ(Cu2+)/(mg·L-1)呼吸频率respiratoryfrequency/(次·s-1)24h48h72h摆尾频率tailbeatingfrequency/(次·s-1)24h48h72h03 73±0 28Ba3 58±0 24Ba3 51±0 32Aa0 75±0 07Ca0 71±0 04Ba0 63±0 02Aa0 14 30±0.16ABa4 24±0 12ABa2 66±0 31Bb1 28±0 07Ba0 87±0 09Bb0 42±0 06Bc0 54 41±0.06ABa4 32±0 19ABa2 54±0 16Bb1 34±0 05Ba1 02±0 09Ab0 46±0 04Bc1 04 85±0 25Aa4 56±0 22Aa2 42±0 18Bb1 75±0 04Aa1 08±0 06Ab0 35±0 09Bc
注:同一列数据中标有不同大写字母者表示同一时间内各浓度间差异显著(P<0.05),相同大写字母表示组间无显著性差异 (P>0.05);同一行数据标有不同小写字母者表示同一浓度各时间段间差异显著(P<0.05),相同小写字母表示组间无显著性差异 (P>0.05),下同
Note:The different capital letters within the same column indicate significant difference (P<0.05) in different concentrations at the same time phase, and the same letters show no significant difference (P>0.05). Different letters indicate significant difference (P<0.05) in the same concentration at different time phase, and the same letters denote no significant difference,et sequentia (P>0.05)
2.2Cu离子处理后杂交鲟血液生理指标的变化
从表2可见:经Cu离子处理后,杂交鲟血液白细胞数随Cu离子浓度的增大呈先升高后降低的趋势。试验24、48 h时,0.1 mg/L浓度组的白细胞数最多,显著高于其他组(除0.5 mg/L浓度组24 h时外)(P<0.05),而1.0 mg/L浓度组均最低;72 h时, 0.1 mg/L浓度组略高于对照组(P>0.05),二者均与0.5、1.0 mg/L浓度组有显著性差异(P<0.05)。同一浓度下,对照组各时间段间均无显著性差异(P>0.05),而3个Cu离子浓度组的白细胞数随暴露时间的延长均逐渐降低,除0.1 mg/L浓度组外,其他两浓度组均在72 h时显著降低(P<0.05)。
表2Cu离子浓度对杂交鲟白细胞数的影响(n=9)
Tab.2EffectofCu2+concentrationonWBCnumberinhybridstrugeon(n=9)
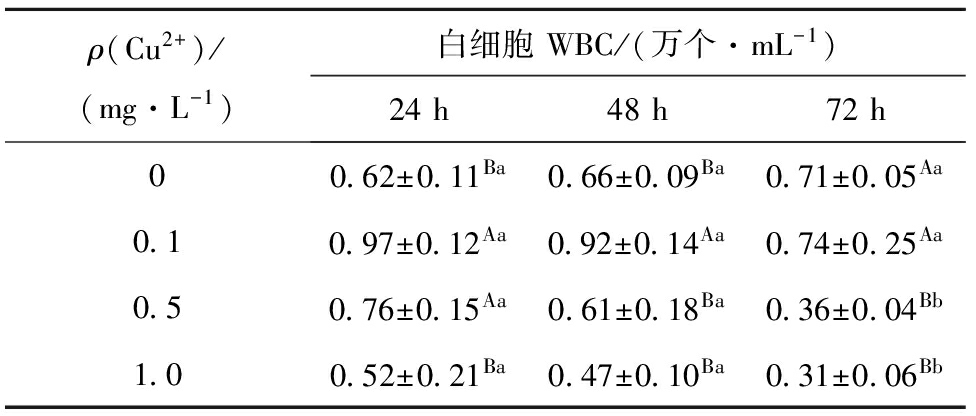
ρ(Cu2+)/(mg·L-1)白细胞WBC/(万个·mL-1)24h48h72h00 62±0 11Ba0 66±0 09Ba0 71±0 05Aa0 10 97±0 12Aa0 92±0 14Aa0 74±0 25Aa0 50 76±0 15Aa0 61±0 18Ba0 36±0 04Bb1 00 52±0 21Ba0 47±0 10Ba0 31±0 06Bb
从表3可见:经Cu离子处理后,24 h和48 h时,杂交鲟的红细胞数随Cu离子浓度的增大逐渐增多,而72 h时红细胞数则随Cu离子浓度的增大而逐渐减少;24 h和48 h时,1.0 mg/L浓度组红细胞数最高,显著高于其他组(除0.5 mg/L浓度组48 h时外)(P<0.05),而对照组最低;72 h时,对照组红细胞数最高,与0.1 mg/L浓度组无显著性差异(P>0.05),但二者均显著高于其他浓度组(P<0.05)。同一浓度下,对照组杂交鲟的红细胞数各时间段间无显著性差异(P>0.05),3个Cu离子浓度组的红细胞数随着暴露时间的延长逐渐降低,除0.1 mg/L浓度组外,其他两浓度组红细胞数在72 h时均显著降低(P<0.05)。
杂交鲟血红蛋白含量的变化趋势与红细胞数的变化趋势相同。试验24和48 h时,血红蛋白含量随Cu离子浓度的增大而逐渐升高,1.0 mg/L浓度组最高,对照组最低,3个Cu离子浓度组均显著高于对照组(P<0.05);而72 h时,血红蛋白含量则随Cu离子浓度的升高而逐渐降低,对照组与0.1 mg/L浓度组无显著性差异(P>0.05),二者均显著高于0.5、1.0 mg/L浓度组(P<0.05)。同一浓度下,对照组的血红蛋白含量各时间段间无显著性差异(P>0.05),3个Cu离子浓度组血红蛋白含量随着暴露时间的延长均逐渐降低,均在72 h时显著降低(P<0.05)。
表3Cu离子浓度对杂交鲟红细胞数和血红蛋白含量的影响(n=9)
Tab.3EffectofCu2+concentrationonRBCnumberandhemoglobincontentinhybridstrugeon(n=9)

ρ(Cu2+)/(mg·L-1)红细胞RBC/(万个·mL-1)24h48h72h血红蛋白hemoglobin/(mg·L-1)24h48h72h050.23±2.31Ca48.32±5.12Ba45.91±2.15Aa41 5±0 4Ca43 7±1 0Ba40 1±0 3Aa0 151.83±5.42Ca44.92±2.53Ba44.13±3.74Aa47 8±0 3Ba47 3±0 4ABa40 2±1 4Ab0 562.11±4.90Ba53.24±4.24Aa28.98±5.63Bb49 6±0 2Ba46 3±1 3ABa32 2±1 0Bb1 070.87±1 41Aa58.07±4 95Ab32.15±2 42Bc54 5±0 9Aa50 0±1 2Ab34 4±1 7Bc
2.3Cu离子处理后杂交鲟抗氧化酶活性的变化
从表4可见:经Cu离子处理后,杂交鲟血清中SOD酶活性随Cu离子浓度的增加呈先升高后降低的趋势。试验24、48 h时,0.1 mg/L SOD酶活性最高,显著高于同一时间内的其他组(P<0.05);72 h时,0.1 mg/L组与对照组无显著性差异(P>0.05),两组均显著高于其他组(P>0.05)。同一浓度下,对照组的SOD酶活性各时间段间均无显著性差异(P>0.05),而3个Cu离子浓度组的SOD酶活性均随暴露时间的延长明显降低,24 h时SOD酶活性最高,72 h酶活性最低。
杂交鲟CAT酶活性同样也随Cu离子浓度的增加呈先升高后降低的趋势。同一时间内,0.1 mg/L浓度组CAT酶活性最高,均显著高于其他各组(P<0.05),0.5 mg/L浓度组次之。同一浓度下,对照组CAT酶活性各时间段间均无显著性差异(P>0.05),而3个Cu离子浓度组CAT酶活性均随暴露时间的延长而降低,除1.0 mg/L组外,其余两浓度组在72 h时均显著降低(P<0.05)。
表4Cu离子浓度对杂交鲟血清中SOD和CAT活力的影响(n=9)
Tab.4EffectofCu2+concentrationontheSODandCATactivitiesinhybridstrugeon(n=9)

ρ(Cu2+)/(mg·L-1)超氧化物歧化酶SOD/(U·mL-1)24h48h72h过氧化氢酶CAT/(U·mL-1)24h48h72h0101.21±25.46Ba93.21±12.43Ba96.02±23.33Aa66.04±3.10Ca55.90±4.50Ca63.04±2.12Ba0 1161.14±4.95Aa132.04±11.31Ab122.13±6.36Ab184.12±21.21Aa173.21±3.54Aa128.19±11.31Ab0 590.98±5.46Ba86.17±4.23Ba43.21±3.63Bb102.23±7.78Bb115.88±2.12Ba67.12±5.36Bc1 022.89±1.49Ca17.03±1.07Cb12.87±0.66Cc63.01±4.40Ca59.02±4.90Ca55.85±5.12Ca
3讨论
3.1Cu离子浓度对杂交鲟行为生理指标的影响
水生动物在水中通常用鳃呼吸用鳍游泳。因此,用呼吸频率和摆尾频率最能直接反映水生动物的行为能力[11-12]。本研究中发现,随着水中Cu离子浓度的增大,杂交鲟应激反应比较活跃,杂交鲟的呼吸频率和摆尾频率随之增大,这是杂交鲟直观行为的应激反应;随着Cu离子处理时间的延长,杂交鲟活力受到损害,呼吸频率和摆尾频率均明显降低。这可能是由于Cu离子处理时间越长,重金属在鱼体内富集越多,从而抑制鱼体正常的生理生态过程,毒性加深,杂交鲟自身已无法抵御这种毒性,行为能力开始慢慢减弱,最终可能导致死亡。在对泥鳅[13]和中华鲟[14]的毒性研究中也发现了相似的规律。中华鲟幼鱼在不同质量浓度的Cu离子中表现出不同程度的中毒症状,在最高Cu离子浓度组,中华鲟幼鱼暴露4~6 h后首先表现为失去平衡游泳的能力,鳃盖煽动频率加快,然后随时间的延长而减慢。
3.2Cu离子浓度对杂交鲟血液生理指标的影响
铜对水生动物的免疫功能具有重要的调节作用,参与铁的吸收和代谢,在血红素合成、免疫防御中发挥重要作用[15]。白细胞是鱼类体内一种能吞噬异物、具有免疫和自我保护能力的免疫细胞。本研究结果表明,低浓度Cu离子对杂交鲟血液中白细胞有明显的诱导作用;高浓度Cu离子则使血液中白细胞数降低,说明适当浓度的Cu离子有利于免疫功能的增强,而当浓度超过临界点的时候则会抑制免疫调节,Cu离子处理时间越长,免疫功能所受到的损伤越大[16-17]。这与Pipe等[18]关于Cu离子浓度对紫贻贝免疫调节作用的研究结果类似,该研究发现,0.02、0.05 mg/kg Cu离子可显著提高贝类血细胞的数量,0.20 mg/kg Cu离子则可激活吞噬细胞活性。Lee等[17]对斑节幼虾的Cu离子毒性试验中也证实了这一点。在中等浓度的Cu离子刺激下能产生最强的免疫能力,超过或低于这个浓度时免疫功能则受到抑制。红细胞和血红蛋白主要是与鱼体内氧的供应有直接关系的物质,而氧的供应与鱼类的运动能力直接相关[12]。同一时间段内,随着重金属浓度的不断增大,杂交鲟应激反应增强,运动能力增强,需要更多的氧气消耗,从而刺激体内的红细胞数和血红蛋白含量不断增多[19]。
3.3Cu离子浓度对杂交鲟血清中CAT和SOD活性的影响
诱发机体产生过量的活性氧,从而造成有机体的氧化损伤,是Cu离子对水生动物产生毒性效应的主要原因。而生物体内对应的抗氧化酶系统能消除活性氧损伤,水生动物的抗氧化酶系统与重金属的浓度相关[2]。CAT和SOD是广泛存在于生物体内的抗氧化防御性功能酶[20],其受到外界环境因素如温度、盐度、饵料、重金属浓度等因子的影响很大[4,7]。本研究结果表明,Cu离子对杂交鲟血清中CAT和SOD酶活性的影响表现出一定的剂量效应关系,即血清中CAT和SOD活性随着Cu离子浓度的增加而升高,当Cu离子浓度增加到一定量时酶活性反而降低。而在同一Cu离子浓度下,随着暴露于Cu离子中的时间延长,杂交鲟的抗氧化酶活性明显降低。说明随着处理时间的延长,鱼类所受的损害在加剧。在对黑鲷[3]、黄河鲤[4]、牙鲆[7]等的铜胁迫研究中,这些鱼均表现出低浓度诱导、高浓度抑制酶活性的变化规律。国外研究将之称为毒物兴奋效应,是一种普遍现象[21-22]。
4结语
本研究结果表明,杂交鲟幼鱼短暂地暴露在不同浓度的Cu离子溶液中,会导致相应损害和应激反应。首先受影响的是杂交鲟的呼吸和运动能力,Cu离子浓度越大,呼吸和运动越快。而杂交鲟血液中红细胞数和血红蛋白含量也有相同的变化趋势,说明其与运动供氧直接相关。而在同一Cu离子浓度下,随着处理时间的延长,呼吸和运动先加快后减慢,说明杂交鲟受Cu离子毒性的影响随时间而加大。白细胞数和抗氧化酶活性随Cu离子浓度的增加先升高后降低,表明低浓度Cu离子诱导杂交鲟潜在的免疫功能,而高浓度Cu离子则抑制免疫和抗氧化功能,毒物兴奋效应非常明显。
参考文献:
[1] Linder M C,Haze G H,Azam M.Copper biochemistry and molecular biology[J].Am J Clin Nutr,1996,63(5):797-811.
[2] Lopes P A,Pinheiro T,Santos M C.Response of antioxidant enzymes in freshwater fish populations(Leuciscusalburnoidescom-plex) to inorganic pollutants exposure[J].Science of the Total Environment,2001,281(1):153-163.
[3] 沈盎绿,马胜伟,贾秋红.黑鲷受铜、镉胁迫的生理反应[J].海洋渔业,2007,29(3):257-262.
[4] 高春生,王春秀,张书松.水体铜对黄河鲤肝胰脏抗氧化酶活性和总抗氧化能力的影响[J].农业环境科学学报,2008,27(3):1157-1162.
[5] 朱毅,张瑞涛.砷、铜、苯酚对鲤鱼的联合毒性研究[J].应用与环境生物学报,2001,7(3):262-266.
[6] 周新文,朱国念,孙锦荷.Cu、Zn、Pb、Cd 及混合重金属离子对鲫鱼DMA 甲基化水平的影响[J].中国环境科学,2002,21(6):549-552.
[7] 王凡,赵元凤,吕景才,等.铜对牙鲆CAT、SOD和GSH-PX活性的影响[J].华中农业大学学报,2007,26(6):836-838.
[8] 王吉桥,姜志强,胡红霞.主要养殖鲟鱼的生物学特征[J].水产科学,1998,17(6):34-38.
[9] 孙大江,曲秋芝,张颖,等.中国的鲟鱼养殖[J].水产学杂志,2011,24(4):67-70.
[10] 曹德福,田丽娇.杂交鲟人工繁殖及苗种培育技术[J].水利渔业,2000,20(1):7.
[11] 李丹,林小涛,李想,等.水流对杂交鲟幼鱼游泳行为的影响[J].淡水渔业,2008,38(6):46-51.
[12] 宋波澜,林小涛,王伟军,等.不同流速下红鳍银鲫趋流行为与耗氧率的变化[J].动物学报,2008,54(4):686.
[13] 贾秀英.四种重金属对泥鳅呼吸强度的影响[J].浙江大学学报:农业与生命科学版,2001,27(5):556-558.
[14] 姚志峰,章龙珍,庄平.铜对中华鲟幼鱼的急性毒性及对肝脏抗氧化酶活性的影响[J].中国水产科学,2010,17(4):731-738.
[15] Berntssen M H G,Hylland K,Wende L,et al.Toxic levels of dietary copper in Atlantic salmon (SalmosalarL.) parr[J].Aquat Toxicology,1999,46(2):87-99.
[16] Jing G,Li Y,Xie L,et al.Metal accumulation and enzyme activities in gills and digestive gland of pearl oyster (Pinctadafuca-ta) exposed to copper[J].Comparative Biochemistry and Physiology,2006,144(2):184-190.
[17] Lee M H,Shiau S Y.Dietary copper requirement of juvenile grass shrimp,Penaeusmonodon,and effects on non-specific immune responses[J].Fish & Shellfish Immunology,2002,13:259-270.
[18] Pipe R K,Coles J A,Carissan F M M,et al.Copper induced immunomodulation in the marine mussel,Mytilusedulis[J].Aquatic Toxicology,1999:43-54.
[19] 南旭阳.铜离子对鲫鱼红细胞、白细胞和血红蛋白含量的影响[J].江西科学,2002,20(1):34-36.
[20] 崔敏,郭冉,夏辉.用饲料酵母替代鱼粉对大菱鲆幼鱼生长及免疫机能的影响[J].大连海洋大学学报,2012,27(1):58-63.
[21] Beaumont A R,Newman P B.Low levels of tributyhin reduce growth of marine microalgae[J].Mar Pollut Bull,1986,17(10):457-461.
[22] Stebbing A R D.Hormesis the stitulation of growth by low levels of inhibitions[J].Sci Tol Envir,1982,22(1):213-234.
EffectofCu2+concentrationonbehavior,bloodindicesandantioxidantenzymeactivityinjuvenilehybridstrugeon
SONG Bo-lan, ZHANG Hua
(College of Ocean, Agricultural University of Hebei, Qinhuangdao 066003, China)
Abstract:The influence of Cu2+concentration(0, 0.1, 0.5 and 1.0 mg/L) on behavior, blood parameters and antioxidant enzyme activity was studied in hybrid strugeon(European huso sturgeonHusohusoLinnaeus ♀×sterletAcipenserruthenusLinnaeus ♂) with body weight of (803.1±35.5)g for 24 h, 48 h and 72 h in a laboratory. The results showed that respiratory frequency, tail beating frequencies, and levels of red blood cell (RBC) and hemoglobin were increased with increase in concentration of Cu2+, and then decreased with Cu2+exposure elapse. The number of white blood cell (WBC), and catalase (CAT) and superoxide dismutase (SOD) activities were found to be dose-dependent, first increase, and then decrease with increase in concentrations of Cu2+. In the same concentration of Cu2+, however, the number of WBC and activities of antioxidant enzymes were decreased with Cu2+exposure elapse. The findings indicate that low concentration of Cu2+leads to induction of activities of antioxidant enzymes and activation of immune cells while high level of Cu2+results in inhibition of immune cells and activities of antioxidant enzymes.
Key words:hybrid strugeon; copper ion; behavior index; blood index; antioxidant enzyme
DOI:10.3969/J.ISSN.2095-1388.2014.03.008
文章编号:2095-1388(2014)03-0241-05
收稿日期:2013-08-15
基金项目:河北省科技支撑计划项目(10220505);河北农业大学青年基金资助项目(QJ201205);广东普通高校重点实验室开放基金资助项目(J201304)
作者简介:宋波澜(1979—), 男,博士,讲师。E-mail:39610321@qq.com
中图分类号:S965.215
文献标志码::A



