褐篮子鱼虹彩病毒病的诊断
雷燕1、2,戚瑞荣1、2,唐绍林1、2,肖洋1、2,马家好1,王雪鹏3
(1.广州利洋水产科技有限公司, 广东 广州 510515;2.广州金水动物保健品有限公司,广东 广州 510515;3.山东农业大学 动物 科技学院,山东 泰安 271018)
摘要:对福建省东山县每年6—10月网箱养殖褐篮子鱼Siganusfuscescens暴发的不明原因疾病(死亡率达80%)进行了研究。濒死褐篮子鱼从网箱底层游至水面,主要症状是体色发黑,开始游动快,之后变慢,最后呈现游动失衡状态直至死亡。解剖可见脾脏和肾脏肿大、出血,胃肠空虚,肠道发红。通过对流行病学调查发现,该病具有明显的传染性,从病鱼肝脏、脾脏和肾脏中未分离到致病菌,也未检测到大量寄生虫。对病鱼组织病理切片观察,其肝脏、脾脏和肾脏出现大量肿大细胞。参考OIE设计虹彩病毒的检测引物,以从自然发病鱼的各种组织提取的DNA作为模板,检测结果显示,病鱼的各种组织均能扩增出与预期大小片段相符的特异性产物。经过克隆测序比对显示,扩增条带的基因序列与肿大细胞病毒属的真鲷虹彩病毒(RSIV)、石斑鱼虹彩病毒(GIV)和传染性脾肾坏死病毒(ISKNV)核苷酸序列同源性分别为98.6%、97.4%和93.2%。利用MCP序列构建系统发育树,结果显示, 导致褐篮子鱼发病死亡的病毒为肿大细胞病毒属的虹彩病毒, 暂命名为褐篮子鱼虹彩病毒(SFIV)。
关键词:褐篮子鱼;虹彩病毒;诊断;肿大细胞病毒;组织病理变化
褐篮子鱼Siganusfuscescens隶属于鲈形目、篮子鱼科、篮子鱼属,俗称泥鯭、臭肚、象鱼、雉鱼、羊婴、娘唉,主要分布于西太平洋,在中国东南沿海也有较多的种群[1],生活水深为1~50 m。褐篮子鱼喜食海藻、海中浮游生物和附着物,其肉质细嫩,肉味鲜美,蛋白质含量高,富含n-3高度不饱和脂肪酸,深受人们的喜爱[2]。褐篮子鱼作为一种杂食性鱼类,具有养殖成本低、抗病力强、清洁网衣等优点,已成为海水养殖的新对象。近年来,褐篮子鱼随着人工养殖的增多,发病也越来越严重。国内学者对其养殖模式、营养代谢、生长发育等方面的研究报道较多[3-5],但对其疾病方面的研究较少。
自2012年6月开始,福建省东山市网箱养殖的褐篮子鱼陆续开始大面积发病,病鱼主要症状为身体发黑,开始游动快,之后无力,最后呈现游动失衡状态直至死亡。该病在个别养殖海域死亡率高达80%,给养殖业者造成了很大的经济损失。本研究中,通过对患病鱼进行微生物学、流行病学、组织病理学进行研究,结合分子生物学鉴定,证实褐篮子鱼发病病原为虹彩病毒。
1材料与方法
1.1材料
研究用患病褐篮子鱼于2012年8月取自福建省东山县一个典型的网箱养殖褐篮子鱼发病养殖场,共取3尾濒临死亡的发病鱼,1尾正常的褐篮子鱼。
2×Taq PCR MasterMix、琼脂糖凝胶DNA回收试剂盒均购自天根生化科技(北京)有限公司。2216E和脑心浸液琼脂购自青岛海博生物技术有限公司。
1.2方法
1.2.1 引物设计 检测引物使用OIE推荐的虹彩病毒特异性引物[6],上下游引物序列为
P1:5′ CTCAAACACTCTGGCTCATC 3′,
P2:5′ GCACCAACACATCTCCTATC 3′。
预扩增片段长度为570 bp,引物由上海英俊生物技术有限公司合成。
参照文献[7]中的方法,比对并合成MCP全长扩增引物,引物序列为
MCP-F:5′ ATGTCTGCAATCTCAGGTGCAAAC-
GTAA 3′,
MCP-R:5′ CAGGATAGGGAAGCCTGCGGCG 3′。
预扩增片段长度为1362 bp,引物由上海英俊生物技术有限公司合成。
1.2.2 流行病学调查及临床检查 对发病养殖场的水温以及发病鱼的鱼龄、苗种来源、传染性、发病率和死亡率进行调查,观察病鱼在养殖池中的活动情况,分别取未发病鱼和发病鱼,置于解剖盘中,观察体表症状,然后打开腹腔,观察内脏组织器官病变。
1.2.3 细菌分离 无菌条件下,使用2216E和脑心浸液琼脂培养皿,以平板划线法从患病鱼的肝、肾、脑等处分离细菌,接种后运回实验室,置于28 ℃恒温培养箱中培养48 h,观察细菌的生长情况。
1.2.4 寄生虫检查 鳃丝采取水浸片法,即取少许鳃丝于载玻片上,加一滴清水(或海水),用镊子将组织分散,加上盖玻片,稍加压平,然后在显微镜下观察。
肝脏、肾脏、肌肉和肠道采用压片法,即取少许组织于载玻片上,轻轻盖上另一载玻片,轻压使受检组织压成一透明薄片,然后在显微镜下观察。
血液用涂片法,即滴一滴血液于载玻片上,盖上盖玻片,然后在显微镜下观察。
1.2.5 DNA的提取 分别取鱼样品的脑、脾、肾等组织器官,研磨后于-20 ℃下反复冻融3次备用,用酚-氯仿法提取各组织的DNA,于-20 ℃下保存备用。
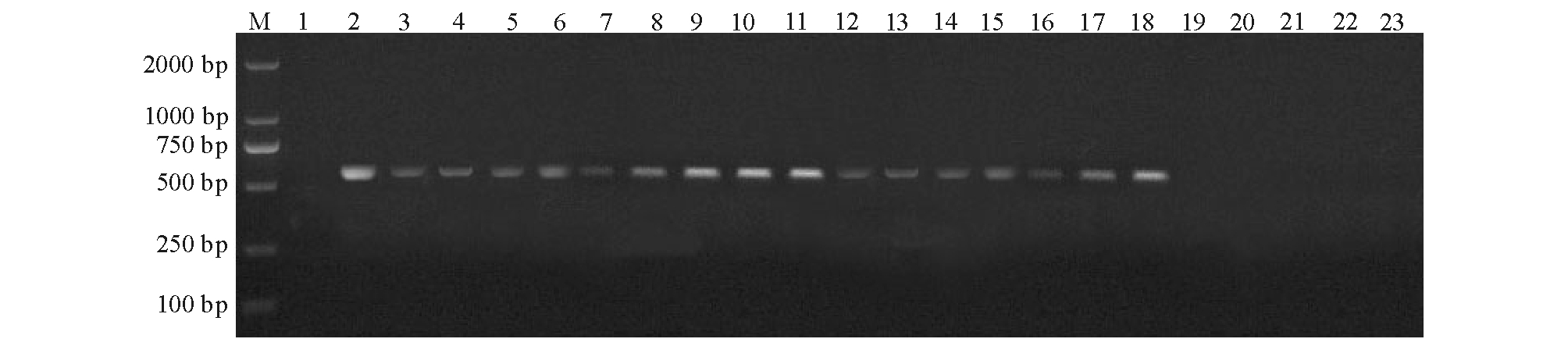
1.2.6 PCR检测 采用引物P1和P2,以20 μL反应体系进行PCR:2×Taq PCR MasterMix 10 μL,灭菌双蒸水6 μL,DNA模板3 μL,上下游引物各0.5 μL。PCR反应程序:95 ℃下预变性5 min;95 ℃下变性30 s,55 ℃下退火30 s, 72 ℃下延伸30 s,共进行30个循环;最后在72 ℃下再延伸10 min,于4 ℃下保存。用10 g/L琼脂糖凝胶电泳检测结果。
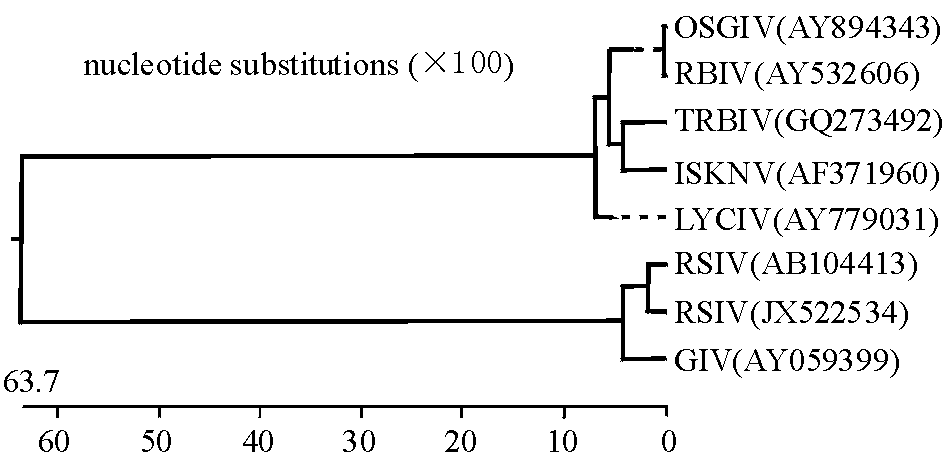
1.2.7 MCP基因的扩增及分析 采用引物MCP-F和MCP-R扩增MCP全长序列,将PCR扩增产物经10 g/L琼脂糖凝胶电泳,扩增出1362 bp(含有一个完整的ORF)的预期大小片段,切取目的片段并用琼脂糖凝胶DNA回收试剂盒纯化回收,送上海英俊生物技术有限公司测序,分别用上下游引物正反两次测序,测序结果提交至GenBank。应用DNAstar 5.0 软件对MCP测序基因序列(GenBank登录号:JX522534)与GenBank中下载的7种虹彩病毒代表株进行核苷酸序列同源性分析,构建系统发育树。
1.2.8 病理学观察 在解剖并完成细菌分离后,分别取未发病鱼和发病鱼的肝脏、脾脏、肾脏、鳃和肠道等组织,经波恩氏液固定24 h,用梯度酒精脱水、二甲苯透明、石蜡包埋、切片(5~6 μm),用苏木精-伊红(H.E)染色,在Nikon E800显微镜下观察并拍照。
2结果
2.1流行发病情况和病鱼解剖观察
该病在该养殖海域连续十年发病,主要发生于6—10月高温期,11月以后很少。发病初褐篮子鱼死亡少,一天几尾,之后死亡数每天增加,高峰期每天死亡几百尾,持续5~10 d,之后死亡数下降,逐渐不死或每天死亡1~5尾。病鱼主要症状是体色发黑,开始游动快,之后变慢,最后呈现游动失衡状态直至死亡。有时涨潮和退潮时在“潮头”集群、呼吸,体色还没有变黑,但头顶两眼间呈黄色或淡红色,不久体色变黑,黑身后几个小时死亡。褐篮子鱼发过病的网箱之后一般不会再发病,且发病具有典型的传染特征,多从一个网箱养殖海域传到另外一个网箱养殖海域。一个养殖场内有相邻网箱相互传染的特点。解剖可见病鱼空肠、空胃,肠道微红,脾脏和肾脏肿大,胆囊肿大,内充满墨绿色浓稠的胆汁,其他组织器官无明显变化。
2.2细菌
4尾褐篮子鱼的肝脏和肾脏接种2216E和脑心浸液琼脂培养皿,恒温培养48 h后未见细菌长出。
2.3寄生虫
经显微镜观察,4尾褐篮子鱼的体表、鳃、肝脏、肾脏、胆囊、肌肉、肠道、血液中均未观察到大量寄生虫。
2.4PCR扩增
利用设计的特异性引物,对4尾褐篮子鱼的各器官组织样品进行PCR检测,得到与目的条带大小相符的特异性片段,其中3尾“黑身”发病鱼的肝、脾、肾、脑、鳃、肠中均能扩增出长570 bp的目的条带(图1),1尾体色正常的鱼未扩增出目的条带。
2.5MCP序列分析
本研究中引用的虹彩病毒参考毒株包括真鲷虹彩病毒(RSIV)、传染性脾肾坏死病毒(ISKNV)、大菱鲆红体病虹彩病毒(TRBIV)、条石鲷虹彩病毒(RBIV)、斜带石斑鱼虹彩病毒(OSGIV)、大黄鱼虹彩病毒(LYCIV)、石斑鱼虹彩病毒(GIV),核苷酸序列同源性和遗传进化分析结果见图2。结果表明,MCP测序基因序列(GenBank登录号:JX522534)先与真鲷虹彩病毒(RSIV)聚为一支,再与石斑鱼虹彩病毒(GIV)聚为一支,而其他5种彩虹病毒聚为另一支,说明该病毒与真鲷虹彩病毒亲缘关系最近。
2.6组织病理变化
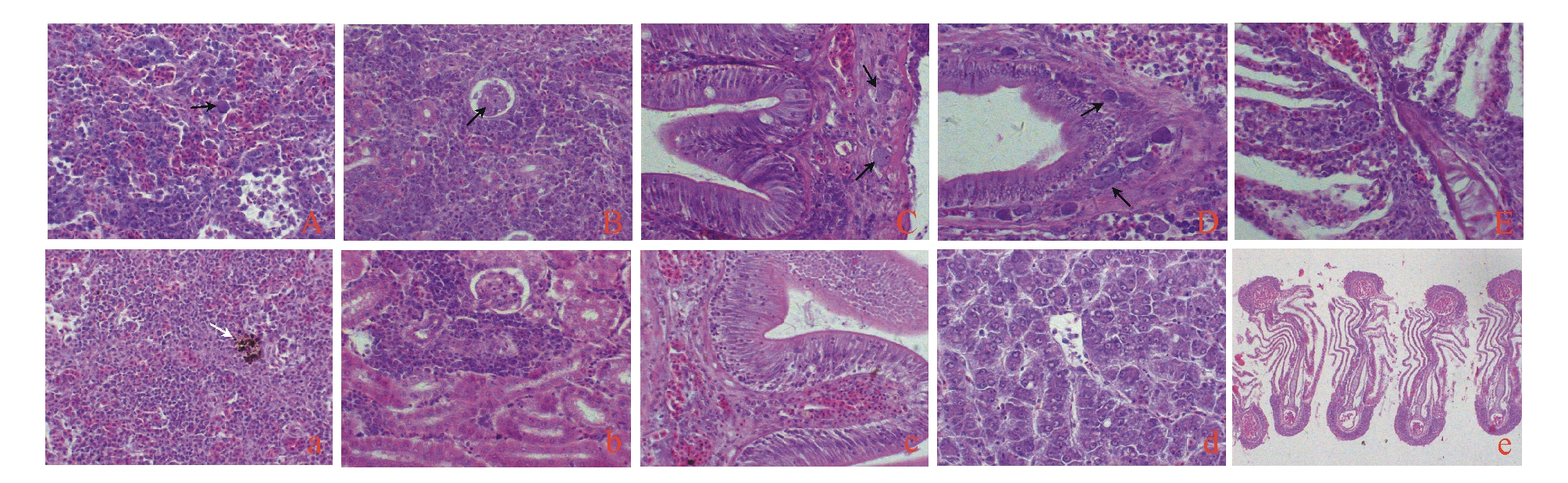
经过染色观察,患病褐篮子鱼的主要器官肝、脾、肾、肠、鳃等均发生了不同程度的病理变化(图3)。
褐篮子鱼的脾脏是感染褐篮子鱼虹彩病毒病变最严重的器官。病理切片观察显示:采集的发病鱼都有数量众多的肿大细胞,在出现肿大细胞的同时,病变较轻的发生局灶性坏死,严重者整个脾脏结构紊乱,脾实质细胞稀疏,脾组织发生大面积严重坏死,脾脏淤血,可见大量红细胞(图3-A)。此外,脾脏黑色素巨噬细胞中心消失。
病鱼的肾脏组织中也有肿大细胞,位于肾小球内,但数量较脾脏中少,肾小管轻微颗粒变性,肾脏实质细胞稍显稀疏(图3-B)。
病鱼的肠固有膜层也有个别肿大细胞,其形态与脾脏中出现的肿大细胞非常相似,肠黏膜下层中无肿大细胞,但有轻度淤血,而肠黏膜上皮层中也未发现肿大细胞存在,病变不明显(图3-C);健康鱼的肠有轻微淤血(图3-c)。
病鱼肝脏胆管中也观察到了肿大细胞,肝脏轻微淤血,肝实质细胞稍显稀疏(图3-D);健康鱼肝脏基本正常(图3-d)。
病鱼鳃中也发现了大量肿大细胞,这些细胞位于鳃小叶中央的毛细血管和鳃丝的结缔组织中(图3-E)。
3讨论
本研究中,综合病鱼症状、流行情况、组织病理、特异性引物的PCR 扩增和测序结果,判断引起福建东山地区网箱养殖褐篮子鱼黑身并大量死亡的病因,是感染了褐篮子鱼虹彩病毒,虹彩病毒在其他种属鱼类中已有大量报道,但在篮子鱼科中属首次报道。
黑身是养殖海水鱼常见的一种疾病症状,各种传染病及各种应激因素都能引起,网箱养殖褐篮子鱼由于虹彩病毒引起的黑身具有明显的流行规律,每年都在同一季节发生,发病症状相同,传染性强,发病后用抗菌药物无效,恢复后具有免疫力,符合病毒病的发病规律。通过临床流行病学调查和PCR检测,确定褐篮子鱼黑身是感染了虹彩病毒。利用MCP序列构建的系统发育树显示,导致褐篮子鱼发病死亡的病毒为肿大细胞病毒属虹彩病毒,暂命名为褐篮子鱼虹彩病毒(Siganusfuscescensiridovirus,SFIV)。褐篮子鱼虹彩病毒隶属于虹彩病毒科、肿大细胞病毒属,是危害海水鱼类的重要病原之一。据报道,虹彩病毒能够引起牙鲆、真鲷、条石鲷、鲶鱼、大菱鲆、石斑鱼、大黄鱼、半滑舌鳎、云斑尖塘鳢等多种海水养殖鱼类发病[8-18],潜伏期一般为5~15 d,最高死亡率可达100%。研究表明,虹彩病毒可通过垂直和水平两种途径在仔稚鱼、幼鱼和成鱼间进行传播。有研究者在病鱼的脾肾等器官中发现大量病毒粒子,这说明病毒的感染具有组织特异性,使病毒能够在其靶器官中大量复制;另外,由于脾、肾是鱼类的造血器官,病毒能很快地随着血液循环扩散到性腺进行垂直传播[19]。
通过组织病理观察发现,经PCR检测虹彩病毒阳性组织对应的病理切片中出现了许多嗜碱性的肿大细胞,病毒感染导致病鱼多个器官组织发生不同程度的病理变化,尤其是脾和肾等免疫器官。因此,褐篮子鱼虹彩病毒的感染类型应属于全身性感染。病理学研究表明,褐篮子鱼的脾脏是虹彩病毒易感器官,与其他器官组织的病理变化相比,脾脏的病变最为显著,表现为出现大量的嗜碱性肿大细胞、大面积的组织坏死和红细胞浸润。根据MCP序列构建的进化树显示,褐篮子鱼虹彩病毒属于细胞肿大病毒属的虹彩病毒,此类病毒的特征性病理变化是在各种器官组织中出现大量的嗜碱性肿大细胞。病理切片显示,嗜碱性肿大细胞的数量也以脾脏中最多,且在患褐篮子鱼虹彩病毒病的所有器官组织中均能发现肿大细胞的存在。
参考文献:
[1] 胡则辉,徐君卓,柴学军,等.褐篮子鱼Siganusfuscescens(Houttuyn)的生物学特性及浙江沿海分布[J].现代渔业信息,2008,23(12):13-15.
[2] 马强,刘静.蓝子鱼科的系统研究概况及我国蓝子鱼科的研究展望[J].南方水产,2006,2(4):69-74.
[3] 刘鉴毅,章龙珍,庄平,等.点篮子鱼人工繁育技术研究[J].海洋渔业,2009,31(1):73-81.
[4] 冯广朋,章龙珍,庄平,等.海水网箱养殖长鳍篮子鱼的摄食与生长特性[J].海洋渔业,2008,30(1):37-42.
[5] 赵峰,庄平,章龙珍,等.篮子鱼繁殖生物学研究进展[J].海洋渔业,2007,29(4):365-370.
[6] Wang C S,Shih H H,Ku C C,et al.Studies on epizootic iridovirus infection among red sea bream,Pagrusmajor(Temminck & Schlegel),cultured in Taiwan[J].J Fish Dis,2003,26:127-133.
[7] 王庆,曾伟伟,刘春,等.云斑尖塘鳢肿大细胞病毒属虹彩病毒的分离与鉴定[J].水生生物学报,2010,34(6):1150-1156.
[8] Inouye K,Yamano K,Maeno Y,et al.Iridovirus infection of cultured red sea bream,Pagrusmajor[J].Fish Pathology,1992,27(1):19-27.
[9] 李华,孙志鹏,李强,等.条石鲷检出的虹彩病毒特性研究[J].病毒学报,2011,27(2):158-164.
[10] Rodge H D,Kobs M,Macarmey A,et al.Systemic iridovirus infection in freshwater angelfish,Pterophyllumscalare(Lichtenstein)[J].Journal of Fish Diseases,1997,20(1):69-72.
[11] Weng S P,Wang Y Q,He J G,et al.Outbreaks of an iridovirus in red drum,Sciaenopsocellata(L.),cultured in southern China [J].Journal of Fish Diseases,2002,25(11):681-685.
[12] Shi C Y,Wang Y G,Yang S L,et al.The first report of an iridovirus-like agent infection in farmed turbot,Scophthalmusmaximus,in China[J].Aquaculture,2004,236(1/4):11-25.
[13] Chua H C,Ng M L,Woo J J,et al.Investigation of outbreaks of a novel disease,sleepy grouper disease,affecting the brown-spoted grouper,EpinephelustauvinaForskal[J].Journal of Fish Diseases,1994,17(4):417-427.
[14] 张正,荣小军,王印庚,等.一种病毒感染引起半滑舌鳎腹水症的病理学观察[J].大连海洋大学学报,2013,28(3):287-292.
[15] Jung S J,Oh M J.Iridovirus-like infection associated with high mortalities of striped beakperch,Oplegnathusfasciatus(Temmink et Schlegel),in southern coastal areas of the Korean Peninsula[J].Journal of Fish Diseases,2000,23(3):223-226.
[16] McGrogan D G,Ostland V E,Byrne P J,et al.Systemic disease involving an iridovirus-like agent in cultured tilapia,Oreochromisniloticus[J].Journal of Fish Diseases,1998,21(2):149-152.
[17] 孙志鹏,徐祥,李强,等.真鲷虹彩病毒辽宁株跨膜蛋白(ORF049L)基因的克隆及表达[J].大连海洋大学学报,2013,28(2):148-153.
[18] Sudthongkong C,Miyata M,Miyazaki T.Iridovirus disease in two ornamental tropical freshwater fishes:African lampeye and dwarf gourami[J].Diseases of Aquatic Organisms,2002,48(3):163-173.
[19] 吴成龙,孔晓瑜,史成银.鱼类细胞肿大虹彩病毒病研究进展[J].动物医学进展,2007,28(3):70-74.
DiagnosisofiridovirusdiseaseinspinefootSiganusfuscescens
LEI Yan1,2,QI Rui-rong1,2,TANG Shao-lin1,2,XIAO Yang1,2,MA Jia-hao1,WANG Xue-peng3
(1.Guangzhou Liyang Aqua-Technology Co. Ltd., Guangzhou 510515,China;2.Guangzhou Jinshui Animal Health Products Co. Ltd.,Guangzhou 510515,China; 3. College of Animal Science and Technology,Shandong Agricultural University, Tai’an 271018,China)
Abstract:An unknown disease with massive mortality of 80% was studied in spinefootSiganusfuscescenscultured in sea net cages in Dongshan County, Fujian Province from June to October. The morbid spinefoot from the cage bottom floating to the surface showed the symptoms of black body, rapid movement, and then slowstagnant, finally imbalance, even death. The postmortem examination revealed that morbid spinefoot had obviously swollen spleen and kidney with petechial haemorrhages, devoid of stomach, and bloody intestine. Epidemiological survey showed the disease had obvious infectious, and that no pathogenic bacteria and parasites were found from the organs including liver, spleen and kidney. Many enlargement and necrosis cells were histopathologically observed in the liver, spleen and kidney. The specific products with predicted size were obtained from all diseased tissues by the primers designed according to the sequence of OIE. Comparative analysis of nucleotide sequences with the GenBank databases using Blast database network service indicated that the putative gene products from infected gobies shared 98.6% identity with red sea bream iridovirus(RSIV), 97.4% identity with grouper iridovirus(GIV)and 93.2% identity with infectious spleen and kidney necrosis virus (ISKNV). The phylogenetic tree was constructed based on neighbor-joining analyses of the MCP gene sequences, indicating that the pathogen in present study was a member of genusMegalocytivirus, named as tentativeSiganusfuscescensiridovirus (SFIV).
Key words:Siganusfuscescens; iridovirus; diagnosis;Megalocytivirus; pathological change
DOI:10.3969/J.ISSN.2095-1388.2014.03.007
文章编号:2095-1388(2014)03-0236-05
收稿日期:2013-08-26
基金项目:中国博士后基金资助项目(2012T50625);山东省优秀中青年科学家科研奖励基金资助项目(BS2011HZ012);浙江省科技计划项目(2012C22072,2012F20029);浙江省自然科学基金资助项目(Y14C190013)
作者简介:雷燕(1983—), 男,硕士研究生。E-mail:leikunnuy@163.com
通信作者:王雪鹏(1980—),男,博士,副教授。E-mail:xpwang@sdau.edu.cn
中图分类号:S965.399
文献标志码::A