剂量/(mg·kg-1)CAT/(U·mg-1)SOD/(U·mg-1)MDA/(nmol·mg-1)03.12±0.32a121.32±5.18a58.33±3.89d505.19±0.45b138.83±1.51b48.03±5.64a1504.00±0.65c126.97±4.43c64.98±2.54b2502.92±0.83a113.33±3.13d104.60±6.60c
摘要:在水温(20.0±0.2)℃条件下,采用口灌方法,研究了不同用药剂量的甲砜霉素对体质量为(82.30±13.59)g的松浦镜鲤肝胰脏的毒性作用。分别选取1、3、5倍的正常用药推荐剂量,并将用药期设为3倍剂量的最大推荐使用期限,即以0、50、150、250 mg/kg(体质量)的剂量对试验鱼连续口灌甲砜霉素15 d,每天一次,并设口灌蒸馏水组为对照组,于停药24 h时采集各组试验鱼的肝胰脏组织,测定试验鱼肝胰脏中过氧化氢酶(CAT)、超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量,并对其组织切片进行观察。结果表明:随着用药剂量的增加,试验鱼肝胰脏中SOD和CAT活性表现为先激发后抑制的趋势, SOD和CAT活性在1倍用药剂量时,达到峰值;随着用药剂量的增加,试验鱼肝胰脏中MDA含量先降低后升高,在1倍用药剂量时,MDA含量为最低,高剂量用药组肝胰脏中MDA含量显著高于对照组(P<0.05)。组织切片观察表明,随着用药剂量的增加,试验鱼肝胰脏组织受到的损伤加重。研究表明,甲砜霉素对松浦镜鲤的肝胰脏具有一定的毒性,且随着用药剂量的增加毒性急剧增大,甲砜霉素的用药剂量对松浦镜鲤肝胰脏的免疫功能也有一定影响。
关键词:松浦镜鲤;甲砜霉素;肝胰脏;毒理学
应用于水产疾病防控及评价的氯霉素类药物主要有氯霉素、甲砜霉素和氟苯尼考[1]。甲砜霉素(TAP)是第二代氯霉素类广谱抗菌药物[2],TAP与氯霉素具有相似的抗菌机理和抗菌作用[3-4]。TAP是长效性药物,在肝脏中不易被分解,但在体内的抗菌作用比氯霉素强[2],对耐氯霉素的细菌具有抗菌作用。氟苯尼考是第三代氯霉素类广谱抗菌药物,虽具有较好的抗菌效果[5-8],但由于其价格昂贵,限制了该药的应用与推广。由于氯霉素在水产品中的残留对生物体的健康构成了较大的威胁[9],且在水产养殖中部分药物会以原型或代谢物形式随粪便等排泄物排出,污染生态环境和威胁公共卫生安全。在欧盟及美国、日本等国家规定,氯霉素在可食用组织中为“零残留”。因此,具有抗菌效果好和物美价廉等优点的TAP,作为氯霉素的替代药物在水产动物疾病防控及治疗方面被广泛应用[10]。
松浦镜鲤(Songpu mirror carp )是黑龙江水产研究所利用德国镜鲤第四代选育系(F4)与散鳞镜鲤杂交而成功选育得到的一个镜鲤新品种[11]。本研究中,研究了不同用药剂量的甲砜霉素对松浦镜鲤肝胰脏的毒性作用,旨在为其在水产养殖中的应用提供科学依据。
1.1材料
试验用松浦镜鲤体质量为(82.30±13.59)g,购自黑龙江省呼兰冷水性鱼类实验站。暂养7 d后,随机选取规格相近、体质健康的鱼进行试验,用药前停饲24 h。试验在方形自动循环水族缸(110 cm×55 cm×55 cm)中进行,试验期间水温保持在(20.0±0.2)℃,溶氧大于6 mg/L。
药品与试剂主要有TAP标准品(含量98.5%)为德国DR.Ehrenstorfer公司产品,TAP原粉(含量98.9%)购自浙江海翔药业股份有限公司,无水乙醇、甲醛等试剂均为分析纯。
试验仪器主要有KD-P摊片机、YT-6C生物组织摊烤片机、YB-6LF包埋机、YGQ-2158J切片机和LEICA DM4000 B显微镜等。
1.2方法
1.2.1 用药方案及样品的采集 设3个试验组和1个对照组,每组设3个重复,每个重复组放30尾鱼。试验方案的设定参考《中华人民共和国药典》[12]和《新编渔药手册》[13],选取1个非用药对照组,1、3、5倍正常用药推荐剂量试验组,并将用药期设为3倍剂量的最大推荐使用期限,即以0、50、150、250 mg/kg(体质量)剂量连续口灌用药15 d,每天一次。停药24 h时采样,从每组取半数试验鱼于冰盘上解剖,采集其肝胰脏,保存于波恩氏液中,用于组织观察;取剩余试验鱼,在冰盘上解剖,采集其肝胰脏,于超低温冰箱(-80 ℃)中冷冻保存,用于酶活性的测定。
1.2.2 样品的处理 用波恩氏液浸泡肝胰脏组织48 h以上,采用常规方法制作石蜡切片,主要参照芮菊生等[14]的方法。用H.E染色法染色,主要参照张正等[15]的方法。
准确称取肝胰脏组织,按照质量与体积比为1∶9(g∶mL),加入预冷的淡水鱼类生理盐水,用匀浆器匀浆,分别按不同检测指标及试剂盒要求的速度和时间离心,取上清液于超低温冰箱(-80 ℃)中冷冻保存。每个检测指标的样本数为5,均设3个重复样。
1.2.3 指标的测定 分别采用南京建成生物工程研究所的过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和丙二醛(MDA)试剂盒测定肝胰脏组织中CAT、SOD的活性和MDA的含量。
(1)CAT酶活力单位定义为:每克组织蛋白中过氧化氢每秒钟分解吸光度为0.50~0.55的底物中的CAT相对量为一个CAT酶活力单位(U),计算公式为
CAT活力=log(OD1/OD2)×2.303/60×A/B。
其中:A为血红蛋白的稀释倍数(包括样品测试前的稀释倍数和取样量在反应液中的稀释倍数);B为样本中每毫升血红蛋白克数。
(2)SOD酶活力单位定义为:每毫克组织蛋白在1 mL反应液中SOD抑制率达50%时所反应的SOD量为一个SOD活力单位(U),计算公式为
总SOD活力(U/mL)=(对照管吸光度-测定管吸光度)/50%×反应体系的稀释倍数×样品测试前的稀释倍数。
(3)MDA含量定义为:每毫克组织蛋白中所含MDA的纳摩尔数。计算公式为
MDA含量=(测定管吸光度-测定空白管吸光度)/(标准管吸光度-标准空白管吸光度)×标准品浓度/待测样本蛋白浓度。
2.1肝胰脏中CAT、 SOD活性和MDA含量
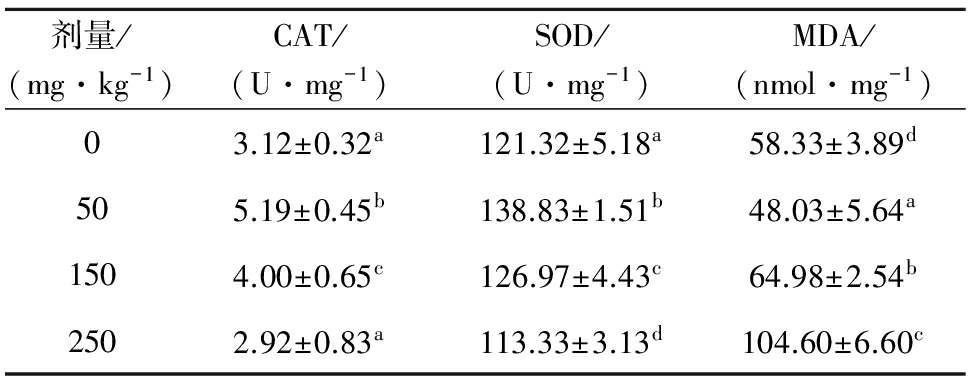
从表1可见:试验鱼肝胰脏中的CAT、SOD活性随用药剂量的增加呈先增加后降低的趋势,而MDA含量的变化趋势则相反,呈先降低后升高的趋势。1倍和3倍剂量用药组肝胰脏中的CAT、SOD活性均显著高于对照组(P<0.05),其中1倍剂量用药组活性最高,5倍剂量用药组活性最低。说明在一定浓度范围内,TAP对松浦镜鲤肝胰脏的CAT、SOD活性产生诱导作用,当浓度超过一定范围时,则转变为抑制作用。3倍和5倍剂量用药组肝胰脏中的MDA含量显著高于对照组(P<0.05),1倍剂量用药组肝胰脏中的MDA含量显著低于对照组(P<0.05),其中5倍剂量用药组MDA含量最高,1倍剂量用药组MDA含量最低。结果显示,在高剂量TAP作用下,MDA含量显著升高。
表1不同剂量用药组松浦镜鲤肝胰脏中的CAT、SOD活性和MDA含量
Tab.1ActivitiesofCAT,andSODandMDAcontentsinhepatopancreasoftheSongpumirrorcarpinjectedatdifferentdoses

剂量/(mg·kg-1)CAT/(U·mg-1)SOD/(U·mg-1)MDA/(nmol·mg-1)03.12±0.32a121.32±5.18a58.33±3.89d505.19±0.45b138.83±1.51b48.03±5.64a1504.00±0.65c126.97±4.43c64.98±2.54b2502.92±0.83a113.33±3.13d104.60±6.60c
注:同列中标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters within the same column are significant differences at the 0.05 probability level, and the means with the same letters within the same column are not significant differences
2.2肝胰脏组织切片
松浦镜鲤肝胰脏组织的电子显微观察结果(图1)表明:与对照组(图1-A)相比,1倍剂量用药组肝胰脏组织中出现大量淋巴细胞、单核细胞浸润(图1-B);3倍剂量用药组肝胰脏组织中部分肝细胞核溶解,肝细胞完整性受损,成空泡状(图1-C);5倍剂量用药组肝胰脏组织中肝细胞受损程度较3倍剂量用药组更为严重,有多数肝细胞出现结构模糊不清、细胞膜破裂、细胞核解体、染色浅淡的现象(图1-D)。
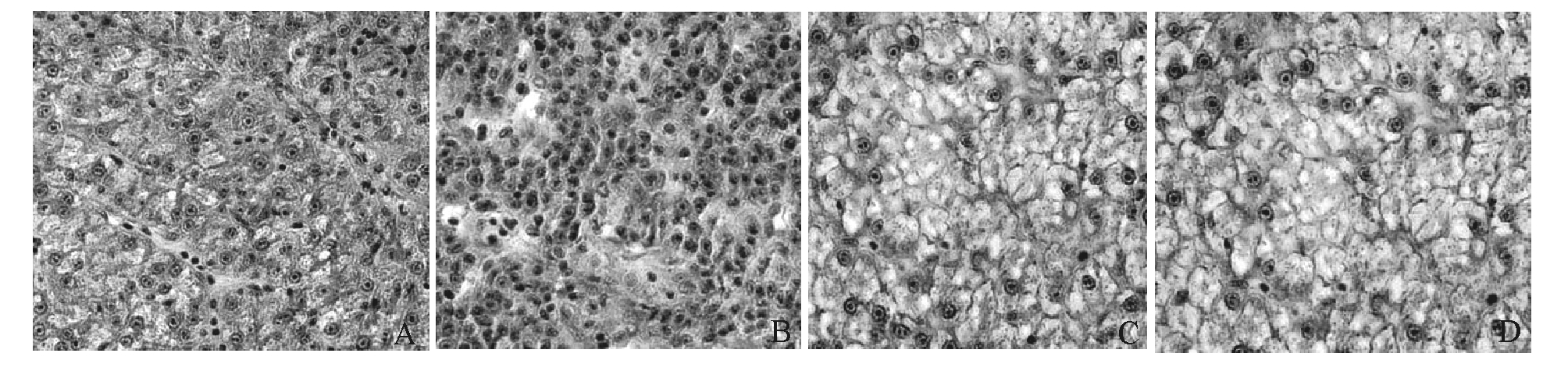
注:A 对照组, B 用药剂量为50 mg/kg的组,C 用药剂量为150 mg/kg的组, D 用药剂量为250 mg/kg的组
Note:A,contral group; B, 50 mg/kg group; C, 150 mg/kg group;D, 250 mg/kg group
图1 各试验组松浦镜鲤肝胰脏组织切片(×400)
Fig.1 Histological sections of hepatopancreas in the Songpu mirror carp in various groups(×400)
CAT是一种评价污染物对水生生物毒性影响的良好分子生物标志物,广泛存在于鱼体内[16]。外源性污染物进入生物细胞后,会导致大量超氧阴离子自由基![]() ·)产生。
·)产生。![]() ·是化学性质中最活泼的活性氧,几乎能与细胞内的每一类有机物和有机酸等发生反应,速度常数还非常高,故而具有非常强的破坏性,但它可以被CAT酶分解。CAT酶是存在于生物体内非常重要的抗氧化防御性功能酶,可与谷胱甘肽过氧化物酶(GPx)等抗氧化酶一起,清除体内
·是化学性质中最活泼的活性氧,几乎能与细胞内的每一类有机物和有机酸等发生反应,速度常数还非常高,故而具有非常强的破坏性,但它可以被CAT酶分解。CAT酶是存在于生物体内非常重要的抗氧化防御性功能酶,可与谷胱甘肽过氧化物酶(GPx)等抗氧化酶一起,清除体内![]() ·,因而在生物体的抗氧化防御系统中占有重要地位。本研究中,TAP对各试验组肝胰脏中CAT活性的影响表现为先诱导后抑制的趋势,在1倍用药剂量时肝胰脏中CAT酶活性达到最高,这说明随着用药浓度的增加,氧自由基增加,从而刺激机体产生大量的CAT酶来清除体内自由基;而在3倍用药剂量和5倍用药剂量时,鲤体内氧自由基增加,但是CAT酶活性下降,这可能是因为TAP对鲤肝胰脏组织结构已造成了损伤,导致CAT酶的产生受到抑制。
·,因而在生物体的抗氧化防御系统中占有重要地位。本研究中,TAP对各试验组肝胰脏中CAT活性的影响表现为先诱导后抑制的趋势,在1倍用药剂量时肝胰脏中CAT酶活性达到最高,这说明随着用药浓度的增加,氧自由基增加,从而刺激机体产生大量的CAT酶来清除体内自由基;而在3倍用药剂量和5倍用药剂量时,鲤体内氧自由基增加,但是CAT酶活性下降,这可能是因为TAP对鲤肝胰脏组织结构已造成了损伤,导致CAT酶的产生受到抑制。
SOD酶对机体的氧化与抗氧化平衡起着至关重要的作用,可将![]() ·从体内清除,是机体防御过氧化损害系统的关键酶之一[17],可反映动物机体在受胁迫的环境下对外界不良影响的抵御能力,是用来衡量抗氧化能力的指标[18]。SOD酶活性的高低可反映鱼体内活性氧的水平和细胞受氧化损伤的程度。本研究中,TAP通过口灌方式进入鱼体,TAP作为外源性物质进入机体后,致使松浦镜鲤产生大量的氧自由基,在低于1倍用药剂量时,机体在体内氧自由基增加的诱导下,促使肝胰脏中SOD的活性增加,随着用药量的增加,在3倍用药剂量和5倍用药剂量时,肝胰脏中的SOD活性显著降低。TAP对各试验组肝胰脏中SOD活性的影响与对CAT活性的影响大致相同。
·从体内清除,是机体防御过氧化损害系统的关键酶之一[17],可反映动物机体在受胁迫的环境下对外界不良影响的抵御能力,是用来衡量抗氧化能力的指标[18]。SOD酶活性的高低可反映鱼体内活性氧的水平和细胞受氧化损伤的程度。本研究中,TAP通过口灌方式进入鱼体,TAP作为外源性物质进入机体后,致使松浦镜鲤产生大量的氧自由基,在低于1倍用药剂量时,机体在体内氧自由基增加的诱导下,促使肝胰脏中SOD的活性增加,随着用药量的增加,在3倍用药剂量和5倍用药剂量时,肝胰脏中的SOD活性显著降低。TAP对各试验组肝胰脏中SOD活性的影响与对CAT活性的影响大致相同。
MDA是自由基氧化生物膜中的多不饱和脂肪酸发生脂质过氧化作用的产物,机体受自由基攻击的严重程度可以通过MDA含量的高低反映出来,氧自由基可以通过两种途径引起细胞的损伤:一种是通过脂氢过氧化物的分解产物,另一种是通过生物膜中多不饱和脂肪酸(PUFA)的过氧化。因此,常常通过测定MDA的含量来体现机体内的脂质过氧化程度,同时也能间接反映细胞损伤的程度。动态检测SOD活性、MDA含量能比较准确的反映出机体内自由基代谢状况及组织的损伤程度[19]。本研究中,MDA含量的变化趋势与SOD、CAT活性的变化趋势相反,呈先降低后升高的趋势。这说明松浦镜鲤受到TAP胁迫时,在1倍用药剂量下,松浦镜鲤体内的抗氧化酶被激活,机体的抗氧化防御系统处于活泼状态,能够消除大量的氧自由基来保护自身不受氧化损伤。而3倍和5倍用药剂量时,会刺激机体产生更多的氧自由基,自由基就会大量累积,然而大量累积的自由基会影响酶的活力,导致活性氧不能及时清除,降低机体的适应能力和健康水平,从而导致机体的中毒反应[20]。
本研究中,对松浦镜鲤肝胰脏组织切片的观察表明,随着用药剂量的增加,TAP对鱼体肝胰脏造成了一定的损伤。在1倍用药剂量时,TAP对肝胰脏无明显损伤;而随着用药剂量的增加,在3倍用药剂量时,松浦镜鲤肝胰脏出现肝细胞核异常及空泡变性;在5倍用药剂量时,肝细胞空泡变性更加严重,肝细胞结构模糊不清,部分细胞溶解。这说明TAP对松浦镜鲤肝胰脏损伤严重。
综上所述,TAP对松浦镜鲤肝胰脏具有较强毒性,松浦镜鲤的抗氧化系统是TAP作用的重要靶点,TAP通过刺激机体抗氧化系统发挥毒性作用。高剂量TAP对机体抗氧化系统产生抑制作用,导致活性氧不能及时清除,损害机体正常免疫功能,肝胰脏组织结构及功能损伤严重,从而导致机体中毒。试验过程中虽未出现鱼类死亡的现象,但TAP对鲤的肝胰脏还是产生了一定的损伤,因此,在甲砜霉素应用于水产养殖动物疾病预防和控制中时,应严格按照用法用量进行用药,谨防过度用药或延长用药时间,以免对养殖对象造成机体损伤。
参考文献:
[1] Kummerer K.Drugs in the environment emission of drugs,diagnostic aids and disinfectants into waste water by hospitals in relation to other sources:a review[J].Chemosphere,2001,45:957-969.
[2] 杨洪波,王荻,卢彤岩.氯霉素类药物的药理学在水产动物中的研究现状[J].水产学杂志,2013,26(4):61-64.
[3] 田中二良.水产药详解[M].北京:农业出版社,1977:241-249.
[4] 林庆华.抗生素在兽医临床应用上的进展[J].福建畜牧兽医,2000,22(3):39-44.
[5] 李建,马向东.氟甲砜霉素在水产养殖病害中的作用[J].科学养鱼, 2000(10):35.
[6] 蒋定国,杨大进.动物性食品中氯霉素残留检测技术的研究概况[J].中国食品卫生杂志,2002,14(2):44-47.
[7] Wu Y B,Wang Z S,Liao X T,et al.Effects of enroflixacin on microorganisms in wet lands[J].Acta Ecologica Sinica,2006,26(8):2640-2645.
[8] Hirsch R,Ternes T A,Haberer K,et al.Occurrence of antibiotics in the aquatic environment[J].Sci Total Environ,1999,225:109-118.
[9] 徐仲钧,余旭平.甲砜霉素散对鸡巴氏杆菌病治疗及毒性试验[J].中国兽药杂志,1996,30(2):34-35.
[10] 郝凯,过世东,胥传来.水产品中甲砜霉素残留的ELISA检测方法研究[J].食品工业科技, 2006(2):186-189.
[11] 杨洪波,王荻,卢彤岩.甲砜霉素在松浦镜鲤体内的药物代谢动力学研究[J].大连海洋大学学报,2013,28(3):298-302.
[12] 邵明立,马晓伟,吴浈,等.中华人民共和国药典二部[M].北京:中国医药科技出版社,2010:144-145.
[13] 杨先乐,战文斌,李健,等.新编渔药手册[M].北京:中国农业出版社,2005:103-109,186-187.
[14] 芮菊生,杜懋琴,陈海明,等.组织切片技术[M].上海:人民教育出版社,1980:3-19.
[15] 张正,荣小军,王印庚,等.一种病毒感染引起半滑舌鳎腹水症的病理学观察[J].大连海洋大学学报, 2013,28(3):287-292.
[16] 郑德崇,黄琪琰,蔡完其,等.草鱼出血病的组织病理研究[J].水产学报,1986,10(2):151-159.
[17] 孟顺龙.除草剂阿特拉津对鲤鱼的毒性影响研究[D].南京:南京农业大学, 2007.
[18] 徐立红,张甬元,陈宜瑜.分子生态毒理学研究进展及其在水环境保护中的意义[J].水生生物学报,1995,19(2):171-185.
[19] 陈娟娟.低聚果糖对奥尼罗非鱼生长、血清生化指标和肠道微生物的影响[D].南宁:广西大学,2011.
[20] 赵晶晶.中草药对点带石斑鱼生理生化指标和抗病力的影响[D].天津:天津农学院, 2012.
Abstract:The toxicity of thiamphenicol [0 (as control group), 50, 150, 250 mg/kg body weight, 5 times as high as toxic dose] to hepatopancreas of Songpu mirror carpCyprinuscarpioSongpu(body weight 82.30 g±13.59 g)was studied at water temperature of (20.0±0.2)℃ by daily oral administration for 15 days. The activities of catalase (CAT), and superoxide dismutase (SOD) and malondialdehyde content in hepatopancreas were determined and histological observation of the hepatopancreas was conducted 24 h after stopping oral administration. Results showed that the activities of CAT, and SOD were found a trend of first enhancement and then decline, the peak in 50 mg/kg group, and the content of MDA showed a trend of first decline and then enhancement with the increase in thiamphenicol dosage, the minimum in 50 mg/kg group. There was significantly higher MDA content in high doses group than that in the control group. The histological observation showed that the hepatopancreas damage was aggravating with the increase in the drug dosage, indicating that thiamphenicol has certain dose-dependant toxicity, and certain effect on immunity in Songpu mirror carp. So we should pay more attention to thiamphenicol dosage in use.
Key words:Songpu mirror carp; thiamphenicol; hepatopancreas; toxicology
DOI:10.3969/J.ISSN.2095-1388.2014.03.006
收稿日期:2013-09-16
基金项目:公益性行业(农业)科研专项(201203085);现代农业产业技术体系建设专项(CARS-46)
中图分类号:S948
文献标志码::A