表1人工感染试验结果
Tab.1Theresultsofchallengedexperiment尾
组别group试验鱼testfish感染后不同时间的死亡数mortalityinnumbersafterchallenged1d2d3d4d5d6d7d1014d死亡总数deathDL01感染组103221000008对照组100000000000
摘要:对自然感染和人工感染嗜水气单胞菌Aeromonashydrophila的杂交鲟(达氏鳇HusodauricusGeorgi♀×史氏鲟AcipenserschrenckiBrandt♂)的组织病理和超微病理变化进行了研究。结果表明:患嗜水气单胞菌病的杂交鲟体表黏液稍增多,鳍基部和腹部轻微发红,鳃丝腐烂、色浅或呈紫黑色,腹腔壁及内脏器官可见出血斑;肝、肾、脾等内脏器官组织病理变化主要表现为循环障碍,微血管扩张,广泛出现充血、出血或溶血;实质细胞经变性发展到坏死,严重时出现弥散性坏死灶。电镜观察显示,病鲟肝、脾、肾组织和细胞内感染大量短杆状细菌,细胞内线粒体普遍发生肿胀、膨大,严重时其嵴状结构消失或溶解。
关键词:杂交鲟;嗜水气单胞菌病;组织病理;超微病理
鲟鱼是最古老的鱼类之一[1],其肉味鲜美,营养丰富,尤其是鱼籽酱产品价格极高,具有很高的经济价值。中国的鲟鱼养殖业在20世纪90年代中后期发展壮大,养殖品种主要有施氏鲟Acipenser schrenckiiBrandt、达氏鳇Huso dauricusGeorgi、西伯利亚鲟A.gueldenstaedtiBrandt、俄罗斯鲟Acipenser guldenstadtiBrandt和杂交鲟等[2]。其中,杂交鲟因适应性强、生长速度快、性成熟早、后代可育、遗传性状较稳定,已成为深受欢迎的鲟鱼养殖品种。近年来,伴随着养殖规模的扩大和养殖产量的提高,鲟鱼的各种疾病频发,严重影响了产业的发展。有关鲟鱼疾病的研究目前尚处于初始阶段,仅见对鲟鱼疾病及其防治方法[3-4]的简单综述,而对鲟鱼病原的研究有嗜水气单胞菌[5-6]、链球菌和乳球菌[7-8]等,且只进行了病原性确认,致病因子和致病机理方面的研究并未涉及。有关鲟鱼病理的研究则报道了:患烂鳃病、胃充气病的中华鲟[9]、杂交鲟[10],鳃小叶上皮细胞增生、脱落,幼鲟胃肠大量充气;患肝性脑病[11]的施氏鲟幼鱼肝脂肪变性和水样变性,脑组织液化性坏死;患心外膜囊肿病[12]的鲟鱼,心外膜增生和肿大,可导致施氏鲟、俄罗斯鲟和杂交鲟死亡;对患败血症[13]的西伯利亚鲟进行了消化道、皮肤和肾脏的组织病理学观察,结果表明,其皮肤和肌肉细胞肿胀、空泡化,肾小管上皮颗粒变性和水泡变性,肠道黏膜变性、坏死,胃壁平滑肌变性、坏死。但对杂交鲟嗜水气单胞菌病的病理学系统研究目前尚未见报道。
2010年夏季,辽宁某鲟鱼养殖场养殖的杂交鲟(达氏鳇Huso dauricusGeorgi♀×史氏鲟Acipenser schrenckiBrandt♂)发生疾病,死亡率高,造成了严重的经济损失。作者在对病鱼进行细菌分离和病原性确认(另文发表)的基础上,进行了自然发病鱼和人工感染鱼的组织病理和超微病理观察,旨在为探索该病的致病机制和有效防治方法提供参考。
1.1材料
试验用病鱼取自辽宁某鲟鱼养殖水库,体质量为800~1000g。人工感染用健康鲟体长为10~15cm,体质量为(50±10)g,取自同一地区未发病养殖场,在室内养殖室暂养一周无异常后用于感染试验。
人工感染用菌株DL01,为从自然发病鱼体内分离到的优势菌,经生理生化和16SrDNA特异性引物鉴定为嗜水气单胞菌Aeromonas hydrophila,对鲟鱼的致病性已确认(另文发表)。
1.2方法
1.2.1 人工感染试验 设置DL01感染组和空白对照两组,每组各10尾鱼。将分离自患病鲟鱼的嗜水气单胞菌在营养琼脂上培养18 h,用无菌生理盐水洗脱,稀释成密度为5×107cells/mL的菌悬液。感染组腹腔注射菌悬液,剂量为200 μL/尾,空白组注射相同剂量的无菌生理盐水。饲养水温为22 ℃,24 h充气,每天换水一次,换水量不超过1/3。试验进行两周,每天观察并记录鱼的发病和死亡情况,及时固定典型病鱼,用于病理学观察。
1.2.2 病理组织切片的制备 取5尾自然发病鱼和2尾健康鱼的肝脏、脾脏、肾脏和心脏组织块,用波恩氏液和体积分数为2.5%的戊二醛固定。取5尾人工感染病鱼的相同组织,仅用波恩氏液固定。
将固定后的组织经梯度酒精脱水、二甲苯透明、石蜡包埋后,使用Laica 2315切片机切片,厚度为5 μm。切片用苏木精-伊红染色、中性树胶封片,在Motic Images Advanced 3.2病理图像采集系统下观察并拍照。
1.2.3 电镜切片的制备 各组织块经2.5%戊二醛前固定,用0.1 mol/L磷酸缓冲液冲洗、1%锇酸后固定,再用0.1 moL/L磷酸缓冲液冲洗,分别用梯度酒精脱水、90%酒精+丙酮(体积比为1∶1)浸透,用丙酮+包埋剂(体积比为1∶1)再浸透,用包埋剂包埋、模板固定,60 ℃下烘干,用LKB-8800超薄切片机切片,用醋酸铀-柠檬酸铅双重染色,在JEM100-XII投射电镜下观察并拍照。
2.1临床症状
自然发病典型病鲟体表黏液稍增多,鳍基部和腹部轻微发红;鳃颜色浅,严重者鳃丝腐烂甚至呈暗紫色;剖检病鱼,腹腔壁可见出血斑(图1-A),腹腔中有少量红色腹水,鳔以及性腺上有出血点;肝脏颜色浅、花白(图1-B),并有出血灶;脾脏略肿大,颜色稍浅。
用光学显微镜检查病鱼的鳃、皮肤和内脏组织水浸片,并未发现可致病的寄生虫。
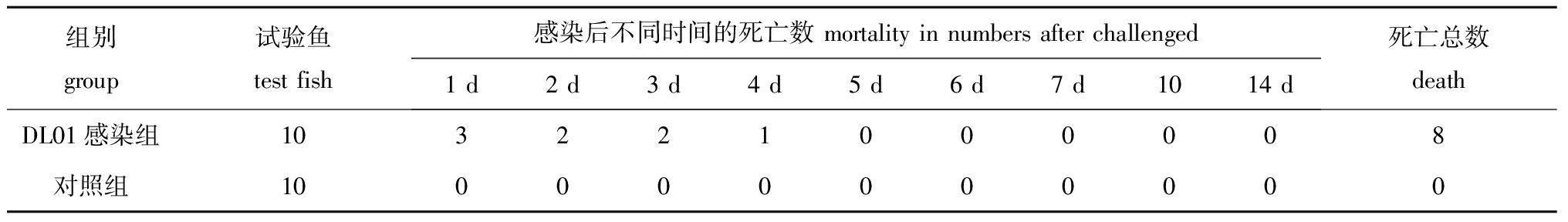
人工感染试验显示,感染第1天,鲟鱼就出现病症并死亡,一周内累积死亡率达80%,之后再无死亡,对照组死亡率为0(表1)。人工感染病鱼症状为胸鳍基部以及腹部鳞片基部轻微充血发红,肛门红肿,剖检腹腔中有红色腹水,肝脏充血并有出血点,脾脏肿大,肠道充血发红(图1-C)。
表1人工感染试验结果
Tab.1Theresultsofchallengedexperiment尾

组别group试验鱼testfish感染后不同时间的死亡数mortalityinnumbersafterchallenged1d2d3d4d5d6d7d1014d死亡总数deathDL01感染组103221000008对照组100000000000
2.2组织病理变化
2.2.1 肝脏 自然发病鲟病情较轻时,肝组织病理变化主要表现为血液循环障碍,肝血窦及中央静脉扩张,可见细胞肿胀,严重时血管内皮细胞肿胀,血管腔内溶血(图1-D),同时在肝脏组织尤其在血管周围普遍出血,可见较多的含铁血黄素沉积。随着病情的发展,病变累及肝实质。肝细胞界限尚清楚,细胞肿胀,胞质中出现空泡,这些空泡逐渐合并后形成大的空泡,呈明显的空泡变性,此时肝血窦受压;病情进一步发展,肝脏出现弥散性坏死灶(图1-E),坏死区疏松、淡染,大部分坏死肝细胞核消失,部分肝细胞则出现核固缩和核碎裂。伴随大量的出血和溶血,肝脏组织明显贫血。肝脏被膜透明变性,被膜外有少量出血(图1-F)。
人工感染病鱼的肝血窦扩张,充血、出血,可见大量棕黄色的含铁血黄素颗粒,尤其在肝静脉周围较集中(图1-G),而肝细胞的病变则不显著。
2.2.2 脾脏 自然发病鲟病情较轻时,脾脏组织致密,脾脏红、白髓可区分出,淋巴细胞丰富,脾索中红细胞数量相对较少(图1-H)。在脾脏周边部可见大量红细胞肿胀,其胞质内有粉红色细颗粒,脾窦扩张,动脉、静脉和毛细血管内红细胞肿胀(图1-I)。病变加重时,脾脏组织疏松、贫血,血管内红细胞大量溶血,淋巴细胞显著减少,在血管周围出现局灶性坏死(图1-J)。坏死灶呈现出血性和贫血性两种状态。坏死组织细胞结构消失,呈现细胞核消失、核碎裂和核浓缩的改变,严重时局部坏死组织崩解。
人工感染病鱼的脾脏致密,红、白髓界限不分明,可见含铁血黄素,但较肝脏组织少。个别红细胞胀大变圆,胞质中出现粉红色颗粒,为溶血前的变化。
2.2.3 肾脏 自然发病鲟肾脏的病变主要发生在肾间质。病鱼肾间质疏松,淋巴细胞坏死脱落,贫血(图1-K);肾小体和肾小管变化较轻,肾小管轻微颗粒变性,出现细胞管型;肾小体毛细血管球萎缩,囊腔扩大(图1-L)。
人工感染病鱼肾脏的变化主要表现为肾间质疏松,可见充血和出血改变,但程度不及自然病鱼严重。
2.2.4 心脏 与Icardo[14-15]的报道相同,鲟鱼的心脏分为心外膜下层、心外膜、心肌层和心内膜。心外膜具一个个卵圆形的“结节”,这些“结节”外层由致密结缔组织形成,每个结节间由疏松结缔组织或脂肪组织连接,“结节”的内部是腔室(图1-M),内有粒细胞、巨噬细胞、胶原纤维、淋巴细胞和血管等[15]。
自然发病和人工感染鲟鱼心脏的病理变化主要发生在心肌细胞,严重时可见心肌纤维扭曲、排列紊乱,纤维断裂崩解,横纹由不清晰到完全消失(图1-N)。
2.3超微结构观察
用超薄电镜观察发现,自然发病鲟的肝脏、脾脏和肾脏均未发现病毒颗粒及病毒包涵体,在3个脏器的细胞及组织内均发现大量短杆状细菌(图1-O),长度为1.0~1.5 μm。3个器官的实质细胞超微病理主要表现为线粒体普遍肿胀、膨大,严重时其嵴状结构消失或解体(图1-P);内质网和高尔基体等细胞器则病变较轻,只见略微肿胀。
患嗜水气单胞菌病杂交鲟的临床症状为,体表黏液稍增多,鳍基部和腹部轻微发红,鳃丝腐烂、色浅或呈紫黑色;腹腔壁及内脏器官可见出血斑,与嗜水气单胞菌引起的败血症相似[13];将分离的优势菌人工感染健康杂交鲟,可以复制出与自然发病鱼相似症状,经鉴定为嗜水气单胞菌(另文发表);电镜观察显示,在病鲟肝脏、脾脏和肾脏组织内发现大量长度为1.0~1.5 μm的短杆状细菌,这与嗜水气单胞菌能够侵入宿主细胞内部[16]的特性一致。综上,无论杂交鲟的临床症状、人工感染试验,还是超微观察结果,均证明该病是由嗜水气单胞菌感染引起的。
从病理变化的进程可以看出,嗜水气单胞菌的毒素是通过各循环系统进入组织,引起各脏器损伤的。无论是肝脏还是脾脏、肾脏,病理变化首先从血管及血细胞开始,且遍及各脏器的各个部位,充血、出血和溶血变化以血管腔及其周围更严重,呈棕黄色的血源性色素沉着,在血管附近较为集中,如肝中央静脉。与之相比,肝脏实质细胞和肾小管等病理变化出现的较晚,程度也相对较轻。
组织病理观察结果表明,杂交鲟主要脏器病理变化的共同特点是,各脏器均出现了局部循环障碍,肝、肾、脾组织的微血管扩张,广泛出现充血、出血、溶血到贫血的病理过程,进而引起实质细胞颗粒变性和空泡变性,病情严重时发展到坏死,形成弥散性坏死灶。这种实质细胞的变性和坏死灶的形成,无疑会导致鱼体死亡。这种病理变化特点与异育银鲫[17]、鲤[18]和剑尾鱼[19 ]等的嗜水气单胞菌病病理变化特点相同。其原因是致病性嗜水气单胞菌的各种毒素,如溶血素、肠毒素、细胞毒素和细胞外酶等能够使红细胞裂解、组织细胞溶解,组织的渗透性增加,杀伤白细胞,损伤毛细血管,引起败血症[20]。提示在养殖生产中,在疾病出现早期,当病变尚处于变性阶段,及早采取治疗措施是可以使鱼恢复健康的,但到疾病晚期,疾病发展到实质器官坏死阶段,就难以挽回损失。因此,早发现、早治疗是关键。
线粒体是对各种损伤最为敏感的细胞器之一。在细胞损伤时常发生线粒体病理性改变。本研究中超微病理显示,肝、肾、脾脏细胞内的线粒体普遍发生肿胀、膨大,严重时其嵴状结构消失或溶解。这种线粒体形态和结构上的病理性改变,正是实质细胞病变的超微病理反应,也是组织细胞能够大量变性和坏死的原因。据报道,镉离子、氯氰菊酯、病毒和细菌胞外产物等[21-24]都能造成水产动物发生此类细胞病变。由于线粒体是细胞内重要的能量代谢场所,线粒体的病变使细胞供能不足,能量代谢受到破坏,促使心、鳃、肝、肾等生命活动重要器官的细胞发生变性、坏死,从而造成全身多器官功能障碍,甚至衰竭,最终导致鱼体死亡[24]。
鲟鱼心脏的形态和组织结构比较特殊。随着养殖鲟鱼个体的发育,其心脏外膜增厚,显微镜下观察外膜的结节增多。2002年,Icardo[14-15]对养殖纳氏鲟Acipensernaccarii心脏的组织学进行了研究,发现体质量为0.5、4.0、8.0 kg的鲟鱼心脏最显著的特征是位于心外膜下层的“花椰菜”样的“结节”,“结节”的腔室内含有丰富的粒细胞、巨噬细胞、胶原纤维、淋巴细胞和血管,并认为这些“结节”是鲟鱼心脏的正常结构。而国内学者认为,鲟鱼心外膜肿大为一种病理变化[12],是导致鲟鱼死亡的主要原因。本研究中发现,随鲟鱼个体的生长,其心脏外膜增厚,健康个体也如此。关于鲟鱼心脏形态变化及其与疾病的关系还需深入研究和探讨。

注:A 病鱼腹腔壁出血点(→);B 病鱼肝脏花白(→);C 人工感染鱼肠道发红并伴有腹水;D 肝血窦扩张(→)、空泡变性(物镜,×400);E 肝脏中央静脉周围坏死区、含铁血黄素沉积(→)(物镜,×400);F 肝脏被膜增厚、透明变形(→)(物镜,×400);G 人工感染鱼肝脏中央静脉周围含铁血黄素沉积(→)(物镜,×400);H 脾脏中的红髓、白髓(→)(物镜,×400);I 脾血管内溶血、脾髓中红细胞肿胀(→)(物镜,×400);J 脾脏组织出现溶血性坏死灶(→)(物镜,×400);K 肾间质疏松、肾小管出现管形(→)(物镜,×400);L 肾小球萎缩(→)(物镜,×400);M 心外膜下层中的“结节”(→)(物镜,×400);N 心肌纤维横纹消失、个别肌纤维断裂,(→)(物镜,×400);O 肝脏细胞内大量短杆状细菌(→)(透射电镜,×20 000);P 细胞中线粒体肿胀、变圆、嵴溶解(→)(透射电镜,×40 000)
Note:A,the petechia in abdominal cavity wall(→) ;B,the pale liver (→);C,the intestinal tract of sturgeon in challenged experiment is ascites and rubescent(→);D,the live sinusoid is ecstatic(→),vacuolar degeneration in the hepatic cells(objective lense,×400);E,necrosis around central veins with hemosiderin (→)(objective lense,×400);F,the glisson capsule is thickened and hyaline degenerated(→)(objective lense,×400);G,the hemosiderin around the central veins of challenged sturgeon (→)(objective lense,×400);H,red pulp(→)and white pulp in spleen(→)(objective lense,×400);I,the intravascular hemolysis and swollen erythrocyte in spleen(→)(objective lense,×400);J,the hemolytic necrosis in the spleen(→)(objective lense,×400);K,loose renal interstitial with cast in renal tubules(→)(objective lense,×400);L,atrophic glomerulus (→)(objective lense,×400);M,a node in subepicardium of sturgeon(→)(objective lense,×400) ;N,cross striation of cardiac muscle fiber is disppeared, and some fibers are fragmented(→) (objective lense,×400);O,rod bacteria in hepatic cells(→)(TEM,×20 000) ;P,swollen mitochondria with lytic cristate(→) (TEM,×40 000)
图1 杂交鲟肝脏、脾脏、肾脏和心脏的组织光镜和透射电镜观察
Fig.1 Histological observation of diseased sturgeon liver,spleen,kidney and heart under light and electron microscopes
参考文献:
[1] 孙大江,曲秋芝,马国军,等.中国鲟鱼养殖概况[J].大连海洋大学学报,2000,15(4):216-221.
[2] 崔禾,何建湘,郑维中.我国鲟鱼产业现状分析及发展建议(连载一、二)[J].中国水产,2006(6):8-10;2006(7):14-15.
[3] 田甜,杨元金,王京树,等.鲟鱼病害研究进展[J].湖北农业科学,2012,51(3):48-53.
[4] 李育东,张忠亮.鲟鱼的常见疾病及防治[J].中国水产,2011(10):63-66.
[5] 司力娜,李绍戊.养殖鲟鱼暴发病病原菌分离及药敏实验[J].水产学杂志,2010,23(4):78-80.
[6] 李圆圆,曹海鹏.鲟源致病性嗜水气单胞菌X1的分离鉴定与药敏特性研究[J].微生物学通报,2008,35(8):1186-1191.
[7] Yang Wuming,Li Aihua.Isolation and characterization ofStreptococcusdysgalactiaefrom diseasedAcipenserschrenckii[J].Aquaculture,2009,294(1/2):14-17.
[8] Chen Minghui,Hung Shaowen,Shyu Chinglin.Lactococcuslactissubsp.lactis infection in bester sturgeon, a cultured hybrid ofHusohuso×Acipenserruthenusin Taiwan[J].Research in Veterinary Science,2012,93:581-588.
[9] 陈弟伟,潘连德,刘健,等.中华鲟烂鳃并发胃充气病的组织病理观察[J].上海海洋大学学报,2010,19(3):352-357.
[10] 刘明生,李川.杂交鲟幼鱼烂鳃病、气泡病组织病理学观察[J].河北渔业,2012(3):28-31.
[11] 潘连德,孙玉华,陈辉,等.施氏鲟幼鱼肝性脑病组织病理学与细胞病理学研究[J].水产学报,2000,24(1):57-63.
[12] 潘连德,李淑云,夏永涛.鲟鱼心外膜囊肿的病理学初步研究[J].水生生物学报,2000,24(5):564-566.
[13] 赵凤岐,曹谨玲,刘青.西伯利亚鲟败血症病理学观察与病原学研究[J].水生生物学报,2009,33(2):316-322.
[14] Icardo J M.The structure of the conus arteriosus of the sturgeon (Acipensernaccarii) heart II:the myocardium, the subepicardium,the subepicardium and conus-aorta transition[J].The Anatomical Record,2002,268:388-398.
[15] Icardo J M.The structure of the conus arteriosus of the sturgeon (Acipensernaccarii) heart I:the conus valves and the subendocardium[J].The Anatomical Record,2002,267:17-27.
[16] Low K W,Goh S G,Lim T M,et al.Actin rearrangements accompanyingAeromonashydrophilaentry into cultured fish cells[J].Journal of Fish Diseases,1998,21:55-65.
[17] 黄琪琰,郑德崇,刘丽燕,等.异育银鲫溶血性腹水病的组织显微病理研究[J].水产学报,1991,15(3):212-218.
[18] 汪开毓.鲤鱼细菌性败血症的病理性研究[J].四川农业大学学报,2004,22(3):257-262.
[19] 林熊伟,常藕琴,王晓辉,等.嗜水气单胞菌对剑尾鱼的致病性及组织病理学研究[J].长江大学学报:自然科学版,2005,2(2):53-56.
[20] Lu C P.PathogenicAeromonashydeophilaand the fish diseases.caused by it[J].Journal of Fisheries of China,1992,16(3):282-288.
[21] 凌善锋,华跃进.镉离子对鲫鱼肾细胞超微结构的影响[J].海洋湖沼通报,2005(1):45-48.
[22] 谢文平,朱新平,陈昆慈,等.氯氰菊酯对草鱼组织Na+/K+-ATP酶活性及肝、鳃超显微结构的影响[J].中国水产科学,2009,16(1):120-126.
[23] 耿毅,汪开毓,李成伟,等.养殖大鲵蛙病毒自然感染的病理形态学观察[J].中国兽医学报,2011(11):17-22.
[24] 耿毅,汪开毓,肖丹,等.嗜麦芽寡养单胞菌胞外产物对斑点叉尾鮰损伤的病理学研究[J].水生生物学报,2010,34(2):345-350.
Abstract:The pathological and ultra-pathological observation were conducted in hybrid strugeon(HusodauricusGeorgi♀×AcipenserschrenckiBrandt♂) infected withAeromonashydrophilanaturally and artificially. The infected sturgeon exhibited slight mucus increase and reddish in color in the abdomen and fin bases, and the gills showed anaemia or congestive and rotted. Some petechial heamorrhagy was observed on abdominal cavity walls and internal organs. The main pathological changes were congestion, heamorrhagy, hemolysis, anemia, micro vessel expansion and circulation dysfunction in internal organs including liver, kidney and spleen. Parenchymal cells were developed from degeneration into conspicuous necrosis in the internal organs, even some diffuse necrotic foci in severe case. The electronic microscopy revealed that there was a large number of short rod bacteria in the cells of internal organs, and swollen and enlarged mitochondria, even lysis of mitochondrial cristae in severe case.
Key words:hybrid strugeon;Aeromonashydrophila; histopathology; ultrastructural pathology
DOI:10.3969/J.ISSN.2095-1388.2014.03.005
文章编号:2095-1388(2014)03-0227-05
收稿日期:2013-10-17
基金项目:国家“十二五”科技支撑计划项目(2011BAD13B03)
中图分类号:S941
文献标志码::A
文章编号:2095-1388(2014)03-0232-04