表1实时定量引物
Tab.1TheprimersforrealtimePCR
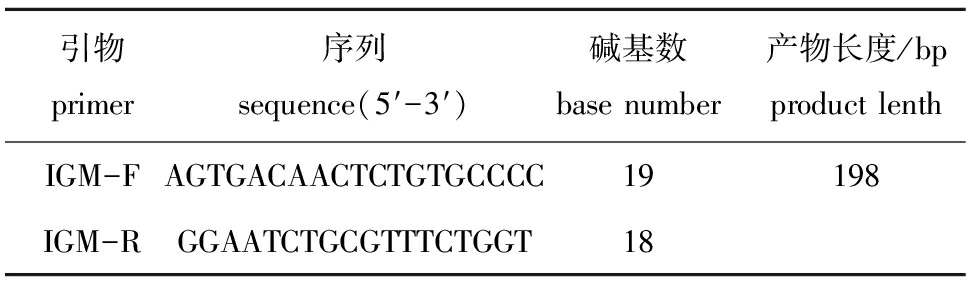
引物primer序列sequence(5′-3′)碱基数basenumber产物长度/bpproductlenthIGM-FAGTGACAACTCTGTGCCCC19198IGM-RGGAATCTGCGTTTCTGGT18
摘要:根据GenBank登录的西伯利亚鲟Acipernserbaerii免疫球蛋白M重链区mRNA(IgHM mRNA)设计引物,进行SYBR green实时定量。结果表明:鲟的脑、鳃、性腺、心脏、后肠、肝脏、肌肉、脾脏8种组织中,IgHM mRNA在脾脏中表达最高,在肝脏和心脏中表达较少,在脑、鳃、性腺、后肠、肌肉5种组织中几乎不表达;在水温22.6~24.5 ℃时,按100 g体质量注射0.1 mL菌液,给体质量为(260.2±37.8)g的西伯利亚鲟注射浓度为2.0×107CFU/mL的维氏气单胞菌Aeromonasveronii,注射后40 h鱼开始死亡,62 h后停止死亡,注射后直至62 h时,处理组脾脏IgHM mRNA表达量一直处于对照组水平,93 h时处理组脾脏IgHM mRNA显著升高(P<0.05),为93 h对照组含量的3.7倍,说明机体已经开始特异性免疫应答。
关键词:西伯利亚鲟;免疫球蛋白M重链区mRNA;实时定量PCR;细菌感染
鲟为古老的软骨硬鳞类,是大型水生经济动物。西伯利亚鲟Acipernserbaerii隶属于鲟形目、鲟科、鲟属,是重要的鲟鱼养殖品种,常被作为软骨硬鳞类生物学模型动物,西伯利亚鲟在天然水体野生状态下抗病力很强,生活在西伯利亚勒拿河的鲟鱼,几乎不会被病原微生物和寄生虫感染[1],然而随着鲟鱼养殖的推广,病害问题日益严重[1-6]。
淋巴细胞在抗原的作用下增殖分化为能产生抗体的细胞分泌免疫球蛋白(immunoglobulin,Ig)。免疫球蛋白由重链和轻链组成,根据重链(heavy chain,H链)恒定区的差异可分为多种类型,已报道的哺乳动物免疫球蛋白包括免疫球蛋白M(IgM)、免疫球蛋白D(IgD)、免疫球蛋白A(IgA)、免疫球蛋白E(IgE)和免疫球蛋白G(IgG)。已报道的硬骨鱼类免疫球蛋白包括IgM、IgD、IgZ和IgT,其中已报道的鲟免疫球蛋白有IgM,多集中在对IgM蛋白酶解片段分析、进化和多样性等方面的研究[7-11]。本研究中,分析了西伯利亚鲟免疫球蛋白M重链区mRNA的组织分布和细菌感染后mRNA的表达变化,旨在为研究鲟抗细菌感染的响应机制提供参考依据。
1.1材料
试验用西伯利亚鲟由北京市水产科学研究所国家级鲟鱼良种场提供,体质量为(260.2±37.8)g,挑选体质健壮、规格基本一致的鱼用于试验。试验前将鱼在实验室玻璃钢循环水池(水体为2 m3)中暂养两周,水温为22 ℃,每日投喂2次,投饲量为鱼体质量的1%。
试验用维氏气单胞菌Aeromonasveronii(X-1-06909)由北京市水产科学研究所水产动物营养与病害防治研究室提供。RNeasy Mini Kit、RNase-Free DNase Set为Qiagen公司产品,RT-PCR试剂盒购于Invitrogen公司,实时定量试剂2×Sybrgreen PCR Master Mix为AB公司产品。
1.2方法
1.2.1 细菌的培养 将菌株X-1-06909活化后接种于营养琼脂斜面上,于28 ℃下培养18 h,用无菌生理盐水(体积分数为0.65%)洗下菌苔,制成菌悬液,10倍梯度稀释,用平板菌落计数法测定菌液浓度,通过预试验确定攻毒浓度。
感染试验:试验设处理组和对照组两组,从处理组取50尾鱼,对照组取30尾,分别放养于2个室内150 L的水族箱中暂养2 d,用充气泵不间断充气。试验时,将处理组的每尾鱼于背部肌肉处注射浓度为2.0×107CFU/mL的菌液,剂量为0.1 mL/100 g(体质量);将对照组每尾鱼以同样剂量注射0.65%的生理盐水。水温控制在22.6~24.5 ℃,感染期间不投喂,尽量减少人为干扰。观察各组鱼的活动情况。
1.2.2 采样 脾脏是重要的免疫器官,免疫球蛋白表达丰度较高,取样准确方便。取攻毒前暂养的鱼3尾,快速深度麻醉后,取其脾脏、肝脏、鳃、心脏、后肠、性腺、脑、肌肉8种组织,用液氮速冻后于-80 ℃下保存,用于检测西伯利亚鲟免疫球蛋白M重链区mRNA的组织分布。
鱼体感染细菌后每隔1 h观察鱼体的活动状况,处理组感染40 h后出现濒临死亡个体,开始采样,62 h后停止死亡。濒临死亡鱼的判断标准:身体失去平衡,翻白漂浮在水面,呼吸微弱。
处理组在感染试验开始后40、44、62、93 h时取样,每次取3尾,记为40、44、62、93 h 处理组;对照组在40、93 h时取样,每次取3尾,记为40、93 h 对照组。将取出的样品鱼快速深度麻醉后,取0.1 g左右脾脏用液氮速冻后,于-80 ℃下保存,用于基因表达变化的分析。
1.2.3 引物的合成 根据西伯利亚鲟IgM重链区cDNA序列(GenBank: AM933672.1),应用软件Primer 5.0设计实时定量PCR引物IGM-F、 IGM-R,由北京擎科生物工程有限公司合成。
表1实时定量引物
Tab.1TheprimersforrealtimePCR

引物primer序列sequence(5′-3′)碱基数basenumber产物长度/bpproductlenthIGM-FAGTGACAACTCTGTGCCCC19198IGM-RGGAATCTGCGTTTCTGGT18
1.2.4 实时定量 使用Qiagen RNA试剂盒提取总RNA,在RNase-Free DNase set柱上处理基因组,采用伯乐紫外分光光度计测定RNA的浓度和OD值,保证OD值为1.9~2.0,用琼脂糖凝胶电泳检验RNA的完整性。使用RT-PCR试剂盒反转录,预先采用普通PCR和琼脂糖凝胶电泳进行体系优化并验证引物的特异性,实时定量采用SYBR Green法, 将待测样品cDNA系列稀释后作为标准品, 构建相对标准曲线,按照田照辉等[12]的方法进行实时定量。 PCR反应条件:94 ℃下预变性10 min;94 ℃下变性15 s,60 ℃下退火15 s,72 ℃下延伸30 s,共进行40个循环。实时定量结束后立即进行熔解曲线分析(仪器为Applied Biosystems 7500 Real-Time PCR System)。
1.3数据处理
使用SPSS 11.5软件进行单因素方差分析(One-Way ANOVA),方差具有齐次性时采用Duncan’s法进行多重比较,方差不具齐次性时采用Games-Howell法进行多重比较。
2.1人工感染后鱼体的变化
试验期间,对照组活动一直正常。而注射唯氏气单胞菌的处理组,在感染40 h后出现失去平衡、呼吸微弱的濒临死亡个体,此时采集的样品鱼鳃发黑,间或发白,肝脏呈土黄至红色,有的样本肝脏带有出血点; 62 h时取出的样品鱼濒临死亡,鳃丝中间发白,表皮已经开始溃烂,后肠有脓血;62 h后取出的样品鱼中,再没有出现死亡鱼。
2.2IgHM mRNA的组织分布
提取的总RNA OD260 nm/OD280 nm值为1.9~2.0,用琼脂糖凝胶电泳检测,结果表明,28S、18S rRNA条带清晰,适合进行反转录。标准曲线斜率为-3.1686,R=0.9963,扩增效率为106.8%,说明该标准曲线可靠。熔解曲线分析有单一的峰,说明产物单一,没有非特异性扩增。无模板阴性对照(NTC)、无反转录酶(NRT)和无RNA(NOT)对照均无信号,表明没有外源污染和基因组污染。实时定量结果显示(图1):脑、鳃、性腺、心脏、后肠、肝脏、肌肉、脾脏8种组织中,IgHM mRNA在脾脏中高表达,在肝脏和心脏中少量表达,在脑、鳃、性腺、后肠、肌肉5种组织中几乎不表达,脾脏表达量远远高于其他7种组织。
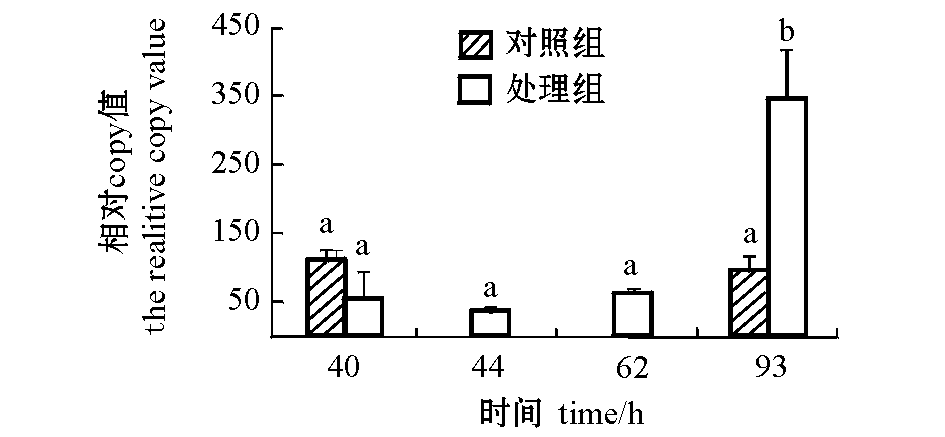
2.3细菌感染后脾脏中IgHM mRNA表达的变化
从图2可见:在本试验条件下,细菌感染后脾脏中IgHM mRNA的表达一直处于对照组水平, 直到93 h时,处理组的表达量骤然升高(P<0.05);40 h 对照组、40 h 处理组、44 h 处理组、62 h 处理组、93 h 对照组间的表达均无显著性差异(P>0.05),其中44 h 处理组的表达量最低(图2)。

图1 西伯利亚鲟免疫球蛋白M重链区mRNA的组织分布
Fig.1 The expression of IgM heavy chain mRNA in different tissues in Siberian sturgeon Acipenser baerii
注:标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters are significant differences at the 0.05 probability level, and the means with the same letters are not significant differences
图2 注射维氏气单胞菌后西伯利亚鲟脾脏中免疫球蛋白M重链区mRNA表达的变化
Fig.2 The changes in IgM heavy chain mRNA expression in spleen of Siberian sturgeon Acipenser baerii injected with Aeromonas veronii
免疫球蛋白是鱼类特异性体液免疫应答中最主要的介质,IgM是最早在鱼类中发现的抗体[13],关于其基因特征、蛋白纯化和细胞发育等的研究已在多种鱼类(如大西洋鲑Salmosalar[14]、斑马鱼Daniorerio[15]等)中开展,IgM是B淋巴细胞最早产生的免疫球蛋白分子,也是B淋巴细胞分化过程中的主要表面标志[11]。
很多鱼类脾脏中IgM有大量表达:欧洲鳗鲡免疫前脾脏中的表达水平仅次于头肾[16],草鱼头肾、中肾和脾脏中高表达[17]。通过实时定量西伯利亚鲟IgHM mRNA在脾脏、脑、鳃、性腺、心脏、后肠、肝脏、肌肉8种组织中的表达,发现在脾脏中表达量最高,表明脾脏是IgM表达的重要场所。头肾和胸腺也是鱼类重要的免疫器官,因为两个组织解剖位置不易确定,本试验中未取这两个组织,但是脾脏的表达量远远高于其他7个组织,高表达量明显,并且脾脏中HSP70 mRNA的表达量也最高[12],所以在攻毒后可以通过监测脾脏中IgM和HSP70 mRNA的表达变化,来研究西伯利亚鲟在注射维氏气单胞菌后的免疫反应。
当机体存在抗原时,淋巴细胞在抗原的作用下,增殖分化为能产生抗体的细胞,分泌免疫球蛋白,血液中球蛋白浓度会升高[18],从而实现体液免疫,它们是机体抗感染的重要屏障。鱼类受细菌侵染时,IgM的表达水平在一定时间内升高:注射灭活嗜水气单胞菌疫苗后,剑尾鱼头肾中IgM的表达量在第4天时达到最高峰[19];鳜受到细菌侵染后IgM的表达水平明显提高[20];用嗜水气单胞菌疫苗浸泡免疫鳜后,脾脏和头肾中IgM mRNA的转录水平在第7天时达到高峰,表达量较高,高峰值分别达到16.3和23.8[21];欧洲鳗鲡在免疫后第21天脾脏免疫球蛋白较免疫前升高,达到极显著水平(P<0.01)[16]。本试验中,在水温为22.6~24.5 ℃时,按每100 g体质量注射0.1 mL菌液,给体质量为(260.2±37.8)g的西伯利亚鲟注射浓度为2.0×107CFU/mL的维氏气单胞菌,在感染后62 h时,处理组脾脏中IgHM mRNA的表达量一直处于对照组水平,处理组从40~62 h陆续出现死亡鱼,62 h后不再死亡,93 h时观察鱼体活动正常,确定已停止死亡,并参照剑尾鱼头肾中IgM表达高峰时间[19],在93 h时取样,此时处理组IgHM mRNA的表达显著升高,为93 h时对照组的3.7倍,说明机体已经开始特异性免疫应答,特异性免疫机能将大大增强。IgM 含量占血清总蛋白浓度的7.5%~18.0%,不同种类的鱼血清IgM 浓度相差很大,大多在3.5~7.0 mg/mL。鱼血清IgM分子重链的恒定氨基酸序列多、结构复杂,可提供多个抗原结合表位,抗鱼类Ig的单抗多数也是只可以识别鱼的Ig重链[22],如果通过血清lgM蛋白的纯化及抗血清的制备,定量血清IgM 水平,与实时定量结果互相验证,可以更准确地反映鱼类感染后抗体产生以及疫苗免疫后抗体生成的情况。
参考文献:
[1] 赵凤岐,曹谨玲,刘青.西伯利亚鲟败血症病理学观察与病原学研究[J].水生生物学报,2009,33(2):316-323.
[2] 马志宏,杨慧,李铁梁,等.西伯利亚鲟(Acipenserbaerii) 致病性维氏气单胞菌的分离鉴定[J].微生物学报,2006,49(10):1289-1294.
[3] 储卫华,于勇.鲟鱼嗜水气单胞菌的分离与鉴定[J].淡水渔业2003,33(2):16-17.
[4] 曹海鹏,杨先乐,王玉洁,等.鲟源致病性豚鼠气单胞菌的分离及其生长特性[J].动物学杂志,2007,42(6):1-6.
[5] 杨治国.嗜水气单胞菌的分离鉴定[J].淡水渔业,2001,31(5):40-41.
[6] 孟彦,肖汉兵,张林,等.施氏鲟出血性败血症病原菌的分离和鉴定[J].华中农业大学学报,2007,26(6):822-826.
[7] 魏巍,刘红柏,王荻,等.施氏鲟免疫球蛋白酶解片段分析[J].水产学杂志,2008,21(2):59-63.
[8] 刘红柏,张颖,卢彤岩,等.中华鲟和达氏鳇血清免疫球蛋白的木瓜蛋白酶水解片段分析[J].水产学杂志,2010,23(3):7-10.
[9] 王荻, 刘红柏.5种鲟鱼免疫球蛋白重链恒定区序列研究[J].遗传,2006,28(10):1247-1253.
[10] Lundqvist M,Stromberg S,Bouchenot C,et al.Diverse splicing pathways of the membrane IgHM pre-mRNA in a Chondrostean,the Siberian sturgeon[J].Developmental and Comparative Immunology, 2009,33:507-515.
[11] 侯月娥,冯娟,杨清华,等.鱼类免疫球蛋白的研究进展[J].黑龙江畜牧兽医:科技版,2010(9):37-39.
[12] 田照辉,徐绍刚,王巍,等.西伯利亚鲟热休克蛋白HSP70 cDNA的克隆、序列分析和组织分布[J].大连海洋大学学报,2012,27(2):150-157.
[13] Wilson M R,Marcuz A,Ginkel F V,et al.The immunoglobulin M heavy chain constant region gene of the channel catfish,Ictaluruspunctatus:an unusual mRNA splice pattern produces the membrane form of the molecule[J].Nucleic Acids Research,1990,18(17):5227-5233.
[14] Hatten F,Fredriksen A,Hordvik I,et al.Presence of IgM in cutaneous mucus,but not in gut mucus of Atlantic salmon,Salmosalar.Serum IgM is rapidly degraded when added to gut mucus[J].Fish & Shellfish Immunology,2001,11(3):267-268.
[15] Donilova N,Hohman V S,Kim E H,et al.Immunoglobulin variable-region diversity in the zebrafish[J].Immunogenetics,2000,52(1/2):81-91.
[16] 冯建军,关瑞章,林鹏,等.欧洲鳗鲡免疫球蛋白M重链基因的原核表达与不同组织中表达变化的定量分析[J].华中农业大学学报,2009,28(6):719-725.
[17] 王欣欣,孙宝剑,昌鸣先,等.草鱼免疫球蛋白M重链基因的克隆及表达[J].水产学报,2008,32(1):13-20.
[18] Adham K,Khairalla A,Abu-Shabana M.Environmental stress in Lake Mary t and physiological response ofTilapiazilliGerv[J].Journal of Environmental Science and Health,Part A:Environmental Science and Engineering and Toxicology,1997,32(9/10):2585-2598.
t and physiological response ofTilapiazilliGerv[J].Journal of Environmental Science and Health,Part A:Environmental Science and Engineering and Toxicology,1997,32(9/10):2585-2598.
[19] 张铃铃,任艳,石存斌,等.实时荧光定量RT-PCR检测剑尾鱼IgM mRNA方法的建立[J].大连水产学院学报,2010,25(2):172-177.
[20] Tian J Y,Sun B J,Luo Y P,et al.Distribution of IgM,IgD and IgZ in mandarin fish,Sinipercachuatsilymphoid tissues and their transcriptional changes afterFlavobacteriumcolumnarestimulation[J].Aquaculture,2009,288(1/2):14-21.
[21] 刘雨果,潘厚军,陈偿,等.嗜水气单胞菌灭活疫苗浸泡后鳜IgM基因表达量和抗体效价的变化[J].淡水渔业,2009,39(6):41-46.
[22] Fuda H,Kiyoshi S,Akihiko H,et al.Serum immunoglobulin M (IgM) during early development of masu salmon(Oncorhynchusmasou)[J].Comparative Biochemistry Physiology,Part A:Physiology,1991,99(4):637-643.
Abstract:Tissue profiles and expression of immunoglobulin M heavy chain mRNA (IgHM mRNA)in normal and bacterial challenging Siberian sturgeonAcipenserbaeriiwith body weight of (260.2±37.8) g were investigated by a primer designed based on Siberian sturgeon in GenBank,and by Sybrgreen real time PCR. The results showed that IgHM mRNA was expressed in abundance in spleen,a little amount of IgHM mRNA expression in liver and heart, and almost no IgHM mRNA expression in gill, hindgut, muscle, gonad and brain. The mortality was observed in the Siberian sturgeon with muscular injection of pathogenic bacteriumAeromonasveroniiwith density of 2.0×107CFU/mL at a dose of 0.1 mL/100 g body weight at water temperature of 22.6-24.5 ℃ 40 h after injection. Sixty-two h after injection, however, no mortality was found in the Siberian sturgeon with IgHM mRNA expression in spleen at a level as that in the fish in the control group. The Siberian sturgeon challenged for 93 h showed as higher 3.7 times IgHM mRNA expression in spleen as that in the fish in the control group, indicating that the challenged Siberian sturgeon had activated specific immune response.
Key words:Acipenserbaerii; immunoglobulin heavy chain mRNA; real time PCR; bacterial infection
DOI:10.3969/J.ISSN.2095-1388.2014.03.003
文章编号:2095-1388(2014)03-0217-04
收稿日期:2013-07-29
基金项目:北京市科技计划项目(D121100003712002);科技部支撑计划项目(2012BAD26B05);北京市现代农业产业技术体系(SCGWZJ20121104-2);农业部公益性行业科研专项(201003055-05)
中图分类号:S917.4
文献标志码::A