
组别group氨氮浓度/(mg·L-1)concentrationofammonianitrogenA14 05 06 08 010 012 0A28 010 012 015 019 024 0A39 012 015 019 024 031 0
摘要:在水温为(22±1)℃、pH为7.6、DO为7.0~8.0 mg/L的条件下,对A1(1.7 g±0.2 g)、A2(3.6 g±0.6 g)、A3(10.3 g±1.5 g)3种不同规格的史氏鲟Acipenserschrencki幼鱼进行非离子氨和氨氮的急性毒性及安全浓度评价。结果表明:氨氮和非离子氨对史氏鲟幼鱼的半致死浓度(LC50)和安全浓度均与幼鱼的体质量呈正相关;氨氮对A1、A2、A3组史氏鲟幼鱼的96 h LC50分别为5.30、10.20、12.30 mg/L,安全浓度分别为0.53、1.02、1.23 mg/L;非离子氨对A1、A2、A3组幼鱼的96 h LC50分别为0.13、0.26、0.28 mg/L,安全浓度分别为0.01、0.03、0.03 mg/L。
关键词:非离子氨;氨氮;史氏鲟;安全浓度
史氏鲟Acipenserschrencki地方名为七粒浮子、鲟鱼,曾用名黑龙江鲟鱼,自然分布于黑龙江流域,为中国黑龙江省特有的亚冷水性鱼类[1]。近年来,史氏鲟养殖从北到南逐步展开。目前,关于史氏鲟的研究主要集中在繁殖、苗种培育、病害防治、饲料营养、生理生化等方面[2-6]。
在鱼类养殖过程中,养殖密度、投喂水平和水体交换量的变化都会导致养殖水体中氨氮浓度的变化,当水体中氨氮达到一定浓度时,会造成养殖水体水质恶化,致病微生物大量滋生,从而诱发多种鱼类疾病,甚至对养殖鱼类产生直接的毒害作用。因此,养殖水体中氨氮的累积是制约鱼类养殖生产的主要因素之一[7-12]。目前,关于氨氮对养殖鱼类急性毒性的研究报道较多,并获得了氨氮对不同鱼类的半致死浓度和安全浓度[13-15],但关于氨氮对史氏鲟幼鱼急性毒性的研究尚未见报道。本研究中通过试验确定了氨氮对史氏鲟幼鱼的半致死浓度和安全浓度,以期为史氏鲟的养殖生产提供参考依据。
1.1材料
试验用史氏鲟幼鱼取自云南阿穆尔鲟鱼集团有限公司盘溪渔场自繁苗种,试验于2012年10月在云南省玉溪市进行。试验开始前挑选健康史氏鲟幼鱼暂养在圆形水槽(直径100 cm,高60 cm)内。试验用水为地下涌水,水温为(22±1)℃, pH为7.6, DO为7.0~8.0 mg/L,进水氨氮浓度0.05 mg/L,换算成非离子氨浓度为0.001 mg/L[16],符合渔业水质标准[17]。
1.2方法
1.2.1 试验设计 试验鱼分为3组:A1组幼鱼体质量为(1.7±0.2)g,体长为(6.8±0.4)cm;A2组幼鱼体质量为(3.6±0.63)g,体长为(9.8±0.62)cm;A3组幼鱼体质量为(10.3±1.5)g,体长为(12.8±1.0)cm。
采用静水试验方法[18], 通过预试验确定毒性试验的浓度范围,即100%死亡浓度(LC100)和0%死亡浓度(LC0)。按照等对数间距法确定氨氮急性毒性试验浓度梯度(表1),每个浓度组设3个重复,每组放10尾鱼。氨氮急性毒性试验装置为有机玻璃瓶(直径15 cm,高30 cm),试液体积为4.5 L。试验以氯化铵为氨氮来源,配制成氯化铵母液,试验时按照试验浓度稀释。急性毒性试验共持续96 h,试验开始后每隔3~6 h观察并记录一次受试鱼的中毒症状及死亡情况,及时清除死鱼。死鱼的判断标准:用玻璃棒轻触鱼尾部,没有反应即认为鱼死亡。
表1不同规格史氏鲟幼鱼急性毒性试验的氨氮浓度
Tab.1TheconcentrationsofammonianitrogenintheacutetoxicitytestforjuvenileAmursturgeonAcipenserschrenckiwithvarioussizes

组别group氨氮浓度/(mg·L-1)concentrationofammonianitrogenA14 05 06 08 010 012 0A28 010 012 015 019 024 0A39 012 015 019 024 031 0
1.2.2 指标的计算 半致死浓度(LC50)的计算采用直线内插法[18],采用线性刻度坐标,绘制死亡百分率对受试物浓度的曲线,根据引起50%死亡率的内插浓度值求出LC50,根据下式计算安全浓度(SC):
SC=0.1×96 h LC50。
非离子氨浓度[19]的计算公式为
C1=1.216×f×C2/100。
其中:C1为非离子氨浓度(mg/L);f为非离子氨占氨氮的摩尔百分比;C2为氨氮浓度(mg/L)。
1.3数据处理
用SPSS 17.0软件对试验数据进行单因素方差分析和Duncan多重比较,显著性水平设为0.05。
2.1氨氮对不同规格史氏鲟幼鱼死亡率的影响
从表2可见:A1组,氨氮浓度为4.0 mg/L时,幼鱼96 h内没有死亡,浓度为12.0 mg/L时,幼鱼在24 h内全部死亡;A2组,氨氮浓度为8.0 mg/L时,幼鱼96 h内没有死亡,浓度为24.0 mg/L时,幼鱼在24 h内全部死亡;A3组,氨氮浓度为9.0 mg/L时,幼鱼96 h内没有死亡,浓度为31.0 mg/L时,幼鱼24 h内全部死亡。随着试验时间的延长,试验鱼的死亡率增加。由此可见,史氏鲟幼鱼的死亡率与氨氮浓度(或非离子氨浓度)、中毒时间呈正相关关系,而与幼鱼体质量呈负相关关系。
表2氨氮浓度对不同规格史氏鲟幼鱼死亡率的影响
Tab.2TheeffectofammonianitrogenconcentrationonthemortalityinAmursturgeonAcipenserschrenckijuvenileswithvarioussizes
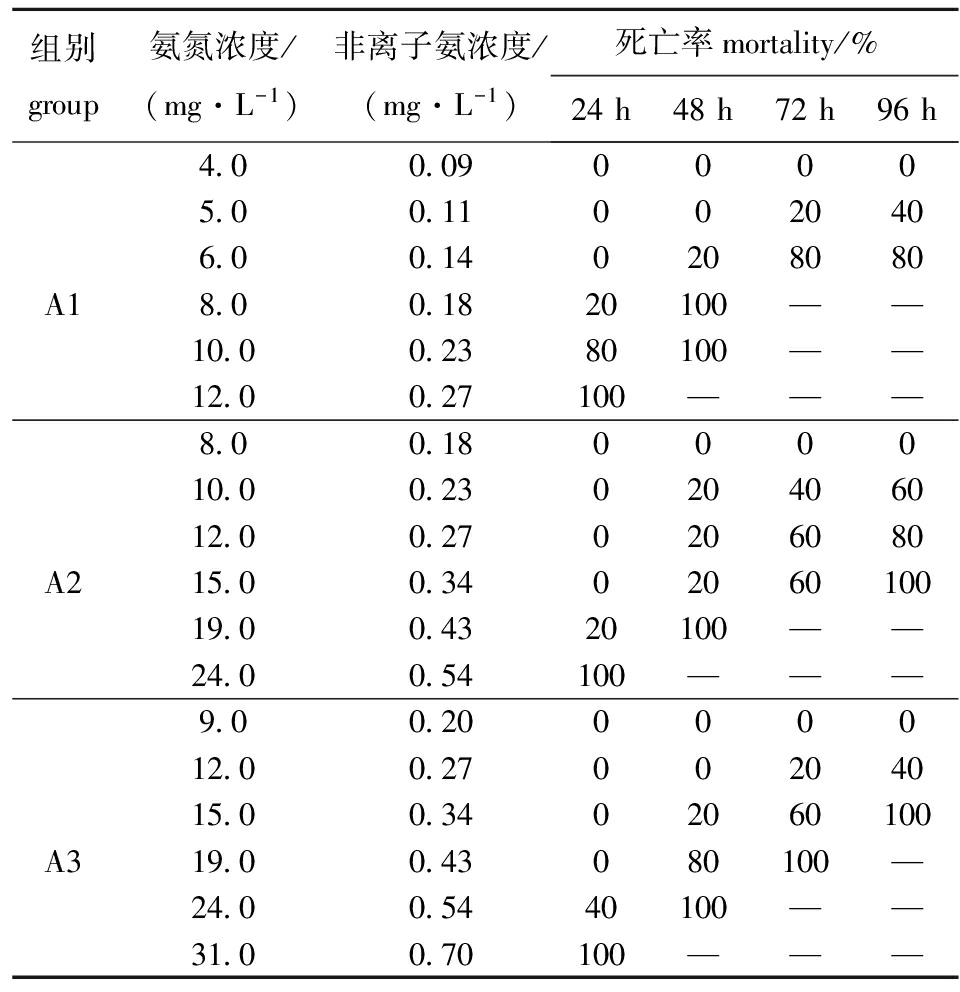
组别group氨氮浓度/(mg·L-1)非离子氨浓度/(mg·L-1)死亡率mortality/%24h48h72h96h4 00 0900005 00 110020406 00 140208080A18 00 1820100——10 00 2380100——12 00 27100———8 00 18000010 00 23020406012 00 270206080A215 00 340206010019 00 4320100——24 00 54100———9 00 20000012 00 2700204015 00 3402060100A319 00 43080100—24 00 5440100——31 00 70100———
2.2氨氮和非离子氨对不同规格史氏鲟幼鱼的LC50和安全浓度
从表3可见:氨氮和非离子氨对各种规格史氏鲟幼鱼的LC50和安全浓度均随试验鱼体质量的增加而增加,A1组24、48、72、96 h的LC50和安全浓度均显著低于A2、A3组(P<0.05)。
氨氮对A1、A2、A3组史氏鲟幼鱼的96 h LC50分别为5.30、10.20、12.30 mg/L,安全浓度分别为0.53、1.02、1.23 mg/L;非离子氨对A1、A2、A3组幼鱼的96 h LC50分别为0.13、0.26、0.28 mg/L,安全浓度分别为0.01、0.03、0.03 mg/L。
3.1非离子氨和氨氮的致毒机制
养殖水环境中的氨氮主要来源于残存的饲料与死亡动植物等含氮有机物经细菌分解、氨化作用的终产物,以及水生动物排泄的含氮产物。据研究表明,氨在水体中以离子铵![]() )和非离子氨(NH3)的形式存在,对水生动物产生毒害作用的主要是非离子氨:当水环境中的非离子氨浓度增大时,非离子氨能阻止水生动物体内的氨向体外排出,致使水生动物血液和组织中的氨含量升高,降低血液载氧能力,造成体内正常代谢的降级或停滞,进而对机体产生一系列的毒性影响;同时非离子氨因为不带电荷,具有较强的脂溶性,能够穿透细胞膜引起包括鳃组织在内的一些重要器官的损害,抑制其生长和发育,降低免疫力,甚至引起死亡;此外,非离子氨还能降低鱼类的能量代谢活动,损坏其鳃、肝、肾、脾和甲状腺组织,使其呼吸困难,体表分泌物增多,甚至衰竭死亡等[20-23]。本试验中,各组史氏鲟幼鱼死亡前均伏在容器底部,鳃盖张合速度加快,体表黏液增多,体色由深色逐渐变浅,直至死亡。最低氨氮浓度组,在延长试验时间后观察到部分个体小、体质弱的幼鱼逐渐死亡,现场解剖发现,其肝脏有损伤,肠内有出血点,而对照组无死亡,这与上述研究结果相吻合。
)和非离子氨(NH3)的形式存在,对水生动物产生毒害作用的主要是非离子氨:当水环境中的非离子氨浓度增大时,非离子氨能阻止水生动物体内的氨向体外排出,致使水生动物血液和组织中的氨含量升高,降低血液载氧能力,造成体内正常代谢的降级或停滞,进而对机体产生一系列的毒性影响;同时非离子氨因为不带电荷,具有较强的脂溶性,能够穿透细胞膜引起包括鳃组织在内的一些重要器官的损害,抑制其生长和发育,降低免疫力,甚至引起死亡;此外,非离子氨还能降低鱼类的能量代谢活动,损坏其鳃、肝、肾、脾和甲状腺组织,使其呼吸困难,体表分泌物增多,甚至衰竭死亡等[20-23]。本试验中,各组史氏鲟幼鱼死亡前均伏在容器底部,鳃盖张合速度加快,体表黏液增多,体色由深色逐渐变浅,直至死亡。最低氨氮浓度组,在延长试验时间后观察到部分个体小、体质弱的幼鱼逐渐死亡,现场解剖发现,其肝脏有损伤,肠内有出血点,而对照组无死亡,这与上述研究结果相吻合。
表3氨氮和非离子氨对不同规格史氏鲟幼鱼的半致死浓度和安全浓度
Tab.3Themedianlethalconcentrationandsafeconcentrationofammonianitrogenandnon-ionicammoniatoAmursturgeonAcipenserschrenckijuvenileswithvarioussizes
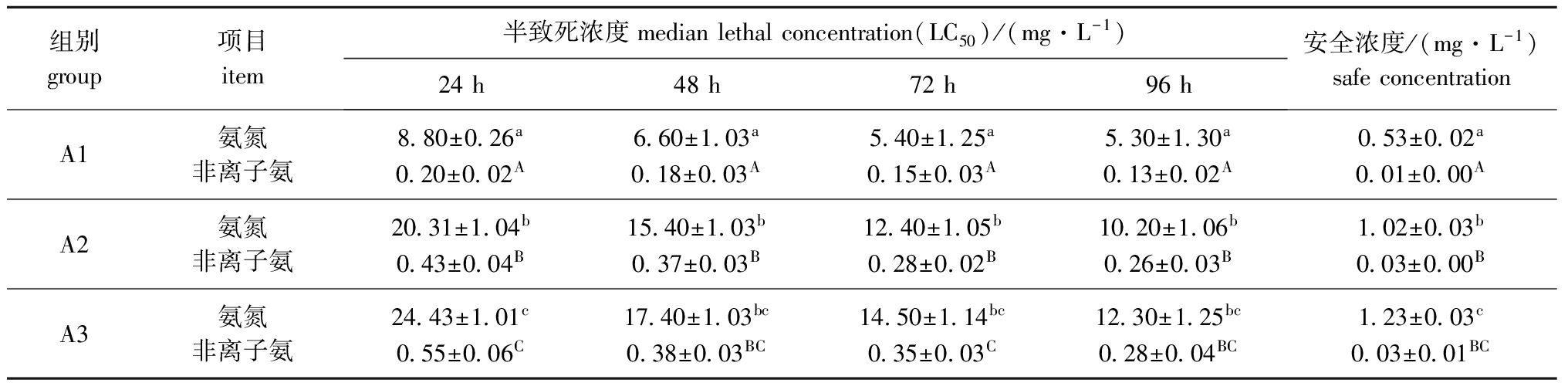
组别group项目item半致死浓度medianlethalconcentration(LC50)/(mg·L-1)24h48h72h96h安全浓度/(mg·L-1)safeconcentrationA1氨氮非离子氨8 80±0 26a0 20±0 02A6 60±1 03a0 18±0 03A5 40±1 25a0 15±0 03A5 30±1 30a0 13±0 02A0 53±0 02a0 01±0 00AA2氨氮非离子氨20 31±1 04b0 43±0 04B15 40±1 03b0 37±0 03B12 40±1 05b0 28±0 02B10 20±1 06b0 26±0 03B1 02±0 03b0 03±0 00BA3氨氮非离子氨24 43±1 01c0 55±0 06C17 40±1 03bc0 38±0 03BC14 50±1 14bc0 35±0 03C12 30±1 25bc0 28±0 04BC1 23±0 03c0 03±0 01BC
注:同列中标有不同小写字母者表示氨氮组间有显著性差异(P<0.05),标有不同大写字母者表示非离子氨组间有显著性差异(P<0.05)
Note:The means with different letters within the same column are significant differences in the ammonia nitrogen groups at the 0.05 probability level,and the means with the different capital letters within the same column are significant differences in the non-ionic ammonia groups
3.2氨氮和非离子氨浓度对幼鱼存活率的影响
本试验结果表明,在试验24、48、72、96 h时,氨氮对3组幼鱼LC50的变幅分别为8.80~24.43、6.60~17.40、5.40~14.50、5.30~12.30 mg/L,安全浓度为0.53~1.21 mg/L;非离子氨对其LC50变幅分别为0.20~0.55、0.18~0.38、0.15~0.35、0.13~0.28 mg/L,安全浓度为0.01~0.03 mg/L。由此表明:史氏鲟幼鱼存活率与氨氮浓度(或非离子氨浓度)、中毒延续时间呈负相关,即随着氨氮浓度(或非离子氨浓度)的升高,史氏鲟幼鱼在24、48、72 h和96 h的死亡率迅速升高,甚至全部死亡;幼鱼的存活率与体质量呈正相关,即在相同的氨氮浓度(或非离子氨浓度)和中毒时间下,规格越大的鱼对氨氮(或非离子氨)的耐受性越强,存活率就越高。
有研究表明[12,15,24],非离子氨对不同鱼类的安全浓度:白斑狗鱼Escoxlucius为0.08 mg/L,鳜Sinipercachuatsi为0.06 mg/L,加州鲈Micropterussalmonoides为0.09 mg/L,鲢Hypophthalmichthysmolitrix为0.16 mg/L,鲤Cyprinuscarpio为0.17 mg/L,岩原鲤Procyprisrabaudi为0.23 mg/L。由此可以看出,对于非离子氨,史氏鲟幼鱼的安全浓度低于白斑狗鱼、鳜和加州鲈,显著低于鲤、鲢等温水鱼类。
3.3非离子氨和氨氮的毒性影响因素
据研究表明,非离子氨的毒性与水中的pH、溶解氧、水温和盐度等非生物因素有关:分子氨和非离子氨在水体中的电离受水体pH的影响很大,在pH>11的水体中,几乎全部为非离子氨,在pH<7的水体中,大部分为离子铵;水温升高时,非离子氨浓度增大,毒性变大;高溶氧可以提高鱼体对非离子氨的代谢能力,从而降低对鱼体的毒性效应;盐度升高时,非离子氨浓度降低,毒性降低[25-26]。本试验中发现,在相同水环境条件下,规格大的鱼类表现出更高的成活率。氨氮浓度最低组试验期间幼鱼保持100%成活,但是继续延长试验时间,部分试验鱼出现肝胆、肠炎等疾病,并陆续死亡。这些症状与高密度养鱼池死亡鱼表现出的症状相同,作者分析认为,这可能是由于非离子氨的毒性引起的。因此,在史氏鲟幼鱼养殖过程中,挑选体质好的史氏鲟幼鱼,及时清理残饵和粪便,将非离子氨浓度根据幼鱼规格控制在0.01~0.03 mg/L,溶解氧应在5 mg/L以上,并注意水温和pH的变化,可明显降低史氏鲟幼鱼的死亡率。
参考文献:
[1] 张觉民.黑龙江省鱼类志[M].哈尔滨:黑龙江科学技术出版社,1995:25-30.
[2] 曲秋芝,孙大江,马国军,等.施氏鲟全人工繁殖研究初报[J].中国水产科学,2002,9(3):277-279.
[3] 王金,王洪波,周长海,等.施氏鲟苗种驯养试验[J].水产学杂志,2005,18(1):52-55.
[4] 李绍戎,王荻,卢彤岩,等.三种中药方剂对施氏鲟抗氧化能力的影响[J].水产学杂志,2012,25(3):47-50.
[5] 陈军,潘伟志,赵春刚,等.全人工配合饲料培育施氏鲟苗种试验[J].水产科学,2005,24(5):34-35.
[6] 庄平,章龙珍,田宏杰,等.盐度对施氏鲟幼鱼消化酶活力的影响[J].中国水产科学,2008,15(2):198-203.
[7] Green B W,Boyd C E.Chemical budgets for organically fertilized fish ponds in the dry tropics[J].Journal of the World Aquaculture Society,1995,26(3):284-296.
[8] Thakur D P,Lin C K.Water quality and nutrient budget in closed shrimp (Penaeusmonodon) culture systems[J].Aquacultural Engineering,2003,27(3):159-176.
[9] Christopher J,Nigel P,Peter J.Nitrogen budget and effluent nitrogen components at an intensive shrimp farm[J].Aquaculture,2003,218:397-411.
[10] Jown E.氮化物对鱼类的毒性[M].淡水渔业译丛,1983:58-62.
[11] 刘玲仪,金有坤.养殖鱼类细菌性败血症暴发期间鱼池水化学环境的初步调查[J].水产学报,1994,18(2):153-156.
[12] 陈瑞明.铵态氮和亚硝酸盐氮对鳜鱼苗的急性毒性试验[J].水利渔业,1998(1):17-20.
[13] 曲克明,徐勇,马绍赛,等.不同溶氧条件下亚硝酸盐和非离子氨对大菱鲆的急性毒性效应[J].海洋水产研究,2007,28(3):83-88.
[14] 王甜,杜劲松,高攀,等.氨氮对白斑狗鱼幼鱼的急性毒性研究[J].水产学杂志,2010,23(3):37-39.
[15] 余瑞兰,聂湘平,魏泰莉.分子氨和亚硝酸盐对鱼类的危害及其对策[J].中国水产科学,1999,6(3):73-77.
[16] 国家环境保护局科技司.地面水环境质量标准非离子氨换算方法[J].中国环境监测,1995,11(4):7-12.
[17] 国家环境保护局.中华人民共和国国家标准渔业水质标准 GB 11607—89[S].北京:中国国家环境保护局科技标准司,1990:1-8.
[18] 雷衍之.养殖水环境化学[M].北京:中国农业出版社,2008:191-202.
[19] 谢凤君,陈惠志,赵幼一.水质—物质对淡水鱼(斑马鱼)急性毒性测定方法 GB/T13267—1991[S].北京:中国国家环境保护局科技标准司,1991:521-526.
[20] Armstrong D A.Interaction of ionized and un-ionzed ammonia on short-term survival and growth of prawn larvae[J].Biobull,1978,154:15-31.
[21] 罗静波,曹志华,蔡太锐.氨氮对克氏原螯虾幼虾的急性毒性研究[J].长江大学学报:自然科学版,2006,3(4):183-185.
[22] 沈成刚,杨凤,刘长发,等.氨态氮在低温下对鱼的急性毒性研究[J].大连水产学院学报,1995,10(3):58-64.
[23] 陈炜,雷衍之,蒋双.离子铵和非离子氨对海蜇螅状幼体和碟状幼体的毒性研究[J].大连水产学院学报,1997,12(1):8-14.
[24] 龚全,赵刚,王婷,等.铵态氮和亚硝酸盐氮对岩原鲤的急性毒性试验[J].西南农业学报,2010,23(1):231-233.
[25] Thurston R V.Effect of pH on the toxicity of the unionized ammonia species[J].Environ Sci Technol,1981,15(7):837-840.
[26] 李建,蒋令绪,王文琪,等.氨氮和硫化氢对日本对虾幼体的毒性影响[J].上海水产大学学报,2007,16(1):22-27.
Abstract:The acute toxicity and safety concentration of non-ionic ammonia and ammonia-N to juvenile Amur sturgeonAcipenserschrenckiwith body weight of (1.7 ±0.2) g (A1),(3.6 ±0.6) g (A2), and (10.3 ±1.5) g(A3) were studied at water temperature of (22±1)℃, pH 7.6, and dissolved oxygen (DO) level of 7.0-8.0 mg/L. The results showed that there was a significant positive correlation between the median lethal concentration(LC50) and safety concentration of non-ionic ammonia and ammonia-N levels and body weight of the Amur sturgeon juveniles. Under the experimental conditions, the 96 h LC50of ammonia-N were found to be 5.30 mg/L in A1,10.20 mg/L in A2,and 12.30 mg/L in A3,with safety concentration of 0.53 mg/L in A1,1.02 mg/L in A2,and 1.23 mg/L in A3. The 96 h LC50of non-ionic ammonia-N were found to be 0.13 mg/L in A1,0.26 mg/L in A2, and 0.28 mg/L in A3, with safety concentration of 0.01 mg/L in A1,0.03 mg/L in A2, and 0.03 mg/L in A3.
Key words:non-ionic ammonia; ammonia nitrogen;Acipenserschrencki; safe concentration
DOI:10.3969/J.ISSN.2095-1388.2014.02.015
文章编号:2095-1388(2014)02-0175-04
收稿日期:2013-08-09
基金项目:国家海洋公益性行业项目(200905020-5);横向联合项目“达氏鳇养殖生态学基础研究”
中图分类号:S965.215
文献标志码::A