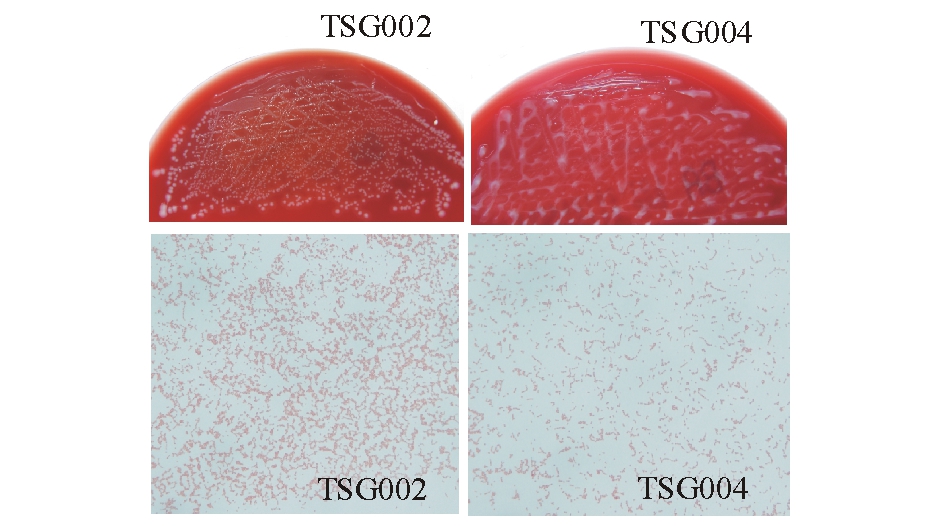
图1 TSG002和TSG004菌株革兰氏染色结果(100×)
Fig.1 Gram staining of TSG002 and TSG004 strains(100×)
摘要:于2011年8月对广西北海疑似链球菌感染的卵形鲳鲹Trachinotusovatus进行病原分离鉴定,经人工感染试验,确定分离的两株病原菌(编号为TSG002和TSG004)为卵形鲳鲹的致病菌,然后对两株病原菌进行形态学、生理生化特征、16S rRNA基因序列和二重PCR快速检测综合鉴定,构建系统进化树,最后对两株菌进行药敏分析。根据染色形态特征和二重PCR快速检测,初步鉴定菌株TSG002和TSG004分别为无乳链球菌和海豚链球菌,菌株TSG002和TSG004的16S rRNA基因序列(登录号分别为KF826095和KF826094)分别与无乳链球菌ATCC13813 strain JCM 5671基因(登录号NR040821.1)和海豚链球菌ATCC29178基因(登录号AF335572.1)的相似性最高,均达99%。药敏试验结果表明,两株菌对头孢曲松、头孢呋辛、头孢哌酮、恩诺沙星、氧氟沙星、阿莫西林、多粘菌素B、头孢噻吩和头孢他啶均敏感。研究表明,感染无乳链球菌和海豚链球菌的卵形鲳鲹可发病死亡,在病鱼中同时分离到两种链球菌尚属首例。
关键词:卵形鲳鲹;无乳链球菌;海豚链球菌;16S rRNA;药敏试验
卵形鲳鲹Trachinotusovatus属于暖水性鱼类,其肉质鲜美、生长速度快、营养价值高,已成为中国南方沿海网箱养殖的主要经济鱼类之一。但因养殖密度的不断增大、养殖海区环境的恶化等因素,导致卵形鲳鲹病害频发,并造成严重的经济损失。自2001年周永灿等[1]首次报道了嗜麦芽假单胞菌引起卵形鲳鲹幼鱼大规模死亡后,陆续又有卵形鲳鲹因感染细菌[2-5]、病毒[6]和寄生虫[7]等病原而引发大规模死亡的报道。
海豚链球菌和无乳链球菌广泛分布于世界各国,具有人畜共患特性,能引起人类败血症、蜂窝组织炎,甚至导致骨髓炎、心内膜炎和脑膜炎[8-9],还可感染包括鱼类在内的多种动物[10-13]。目前,日本、美国、以色列、澳大利亚、中国等很多国家均有鱼类链球菌病的相关报道[4,14-16],所危害的鱼类养殖品种也日趋增多,如罗非鱼、斑点叉尾鮰、大菱鲆、石斑鱼、卵形鲳鲹[4,15-16]等,并且海水和淡水鱼类均可被其感染,但尚未有从发病鱼群同时分离到无乳链球菌和海豚链球菌的报道。
作者对广西北海某网箱养殖的发病卵形鲳鲹进行了细菌的分离,对分离到的病原菌进行了致病性分析、生理生化鉴定、特异性PCR鉴定和药敏试验,旨在为养殖生产中选择合适的药物治疗和控制鱼病蔓延提供参考。
1.1材料
试验用患病卵形鲳鲹样品于2011年8月取自广西北海市铁山港网箱养殖户,体质量为(400±50)g。试验用健康卵形鲳鲹取自广西北海市某养殖场,体质量为(50±5)g,试验前暂养7 d。
主要试剂有:细菌分离用TSA培养基(北京奥博星生物技术有限公司产品)、细菌生化鉴定试剂条(法国梅里埃的API STREP 20)、基因鉴定用16S rRNA基因扩增通用引物及PCR扩增所用试剂(均为大连宝生物工程有限公司产品)、药敏纸片(购自杭州天和生物制剂公司)。
1.2方法
1.2.1 剖检与病原菌的分离 无菌条件下,将患病卵形鲳鲹从腹部剖开,分别取脑、肝脏、脾脏和肾脏组织接种于血平板上,于28 ℃下恒温培养24~48 h。挑取优势单菌落在血平板上再次划线分离纯化。将分离纯化到的细菌接种于胰蛋白胨大豆肉汤(TSB)中,扩大培养后于体积分数为20%的甘油中保种(-86 ℃)。
1.2.2 人工感染试验
(1)单独感染试验。感染试验在150 L水箱中进行,共设9组,其中一组为对照组,每组放20尾鱼。将分离到的两株菌液浓度分别设置为1.0×108、1.0×107、1.0×106、1.0×105CFU/mL,用不同浓度的菌液腹腔注射试验鱼,剂量为0.2 mL/尾,对照组腹腔注射相同剂量的生理盐水。每2天换水1/2,连续充气,水温为22~30 ℃,每天按试验鱼体质量的3%分两次投饵。每天观察并统计试验鱼的发病情况,同时用血平板对濒临死亡的卵形鲳鲹脑、肝脏、脾脏和肾脏进行细菌分离。
(2)混合感染试验。根据单独感染试验结果,取10倍半致死浓度的两菌株混合后,腹腔注射试验组的卵形鲳鲹,对照组注射生理盐水,每天观察并统计试验鱼的发病情况,共记录14 d,同时用血平板对濒死的卵形鲳鲹脑、肝脏、脾脏和肾脏进行细菌分离。
1.2.3 病原菌鉴定
(1)形态学观察。细菌纯化培养后,进行细菌革兰氏染色,油镜下观察细菌的形态特征。
(2)病原菌生理生化测定。按照API STREP 20试剂条说明书进行生理生化测定。
(3)二重PCR快速检测。将细菌置于TSB液中,于28 ℃下振荡培养24 h后,按照细菌DNA抽提试剂盒说明书操作,抽提两种菌株的基因组DNA,分装后于-20 ℃下保存备用。参照黎炯等[17]的方法设计引物和进行二重PCR扩增。无乳链球菌特异性扩增片段为474 bp,海豚链球菌特异性扩增片段为296 bp。
(4)细菌16S rRNA基因序列同源性分析及系统发育树的构建。16S rRNA所用引物为通用引物[18],引物27F/1492R序列为
27F:5′- AGAGTTTGATCCTGGCTCAG-3′;
1492R:5′-AAGGAGGTGATCCAGCC-3′。
反应在50 μL体系中进行,PCR产物纯化和测序由北京六合华大基因科技股份有限公司完成。将所得序列在GenBank中进行Blast搜索,利用Clustal X 1.83和Mega 3.1软件进行序列同源性分析和系统发育树的构建。
1.2.4 药物敏感性试验 采用纸片扩散法,将培养24 h的细菌培养物用灭菌生理盐水洗下后,将菌液浓度调整至1.0×108CFU/mL,取0.2 mL菌悬液涂布于TSA平板上。选择22种药敏纸片均匀贴于平板,每种药敏片设3个平行试验,于28 ℃下培养24 h后测量抑菌圈直径,根据说明书的标准确定两株菌对不同抗生素的敏感性。
2.1病原菌分离
从自然患病卵形鲳鲹的肾脏分离到两株菌,编号为TSG002和TSG004,两株菌在血平板上生长较好;于28 ℃下恒温培养24 h后,TSG002菌株的菌落直径均为1.0~3.0 mm,为乳白色,圆形,隆起,表面光滑,边缘整齐;而TSG004菌株则未见单个菌落,呈片状,乳白色,隆起。革兰氏染色观察发现,两菌体呈球形,链状排列,为革兰氏阴性(图1)。
2.2感染试验
对健康卵形鲳鲹腹腔注射TSG002和TSG004菌液后,各感染组试验鱼陆续出现死亡,人工感染试验结果见表1。最高浓度组注射后第2天开始出现大量死亡,7 d内全部死亡,死亡率与感染浓度呈正相关。8 d后所有试验组的鱼均不再死亡,整个试验过程中(14 d),对照组未发生死亡。在被感染死亡的卵形鲳鲹肾脏中也分离到TSG002和TSG004菌株,且毒性较强,用Reed-Muench法测得的LD50分别为4.70×104CFU/尾(TSG002)和1.48×105CFU/尾(TSG004)。被人工感染的病鱼症状(单独感染和混合感染)与自然发病鱼的症状相似,均表现为:鳍条基部出血,眼浑浊,空肠,腹水(图2),离群独游,少量于水面狂游。
2.3细菌分类学鉴定
2.3.1 细菌生理生化指标 两株细菌的生理生化指标见表2。TSG002和TSG004两菌株除了在丙酮酸、七叶灵、吡咯烷酮-β-萘胺、6-溴-2-萘-αD-半乳糖吡喃甙、萘酚ASB1-葡萄糖醛酸、2-萘-βD-半乳糖吡喃甙和D-甘露醇结果相反外,其余测试结果均相同。

图1 TSG002和TSG004菌株革兰氏染色结果(100×)
Fig.1 Gram staining of TSG002 and TSG004 strains(100×)
表1人工感染结果
Tab.1Resultsofbacterialchallengingtests
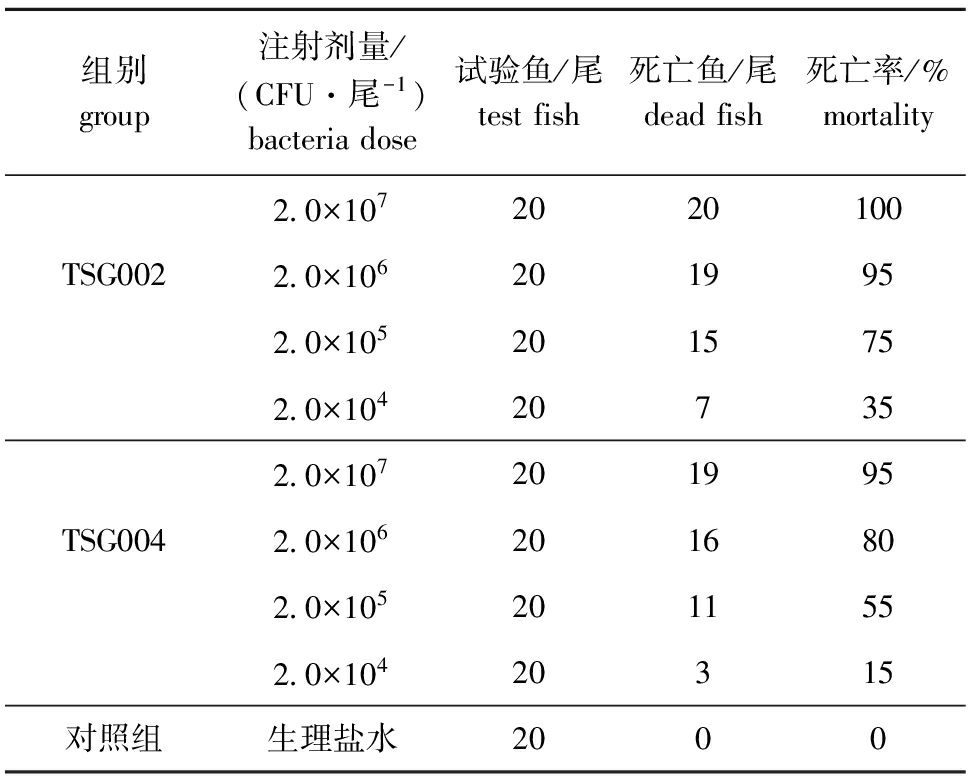
组别group注射剂量/(CFU·尾-1)bacteriadose试验鱼/尾testfish死亡鱼/尾deadfish死亡率/%mortality2 0×1072020100TSG0022 0×1062019952 0×1052015752 0×104207352 0×107201995TSG0042 0×1062016802 0×1052011552 0×10420315对照组生理盐水2000

图2 自然发病的卵形鲳鲹
Fig.2 The diseased ovate pompano Trachinotus ovatus naturally
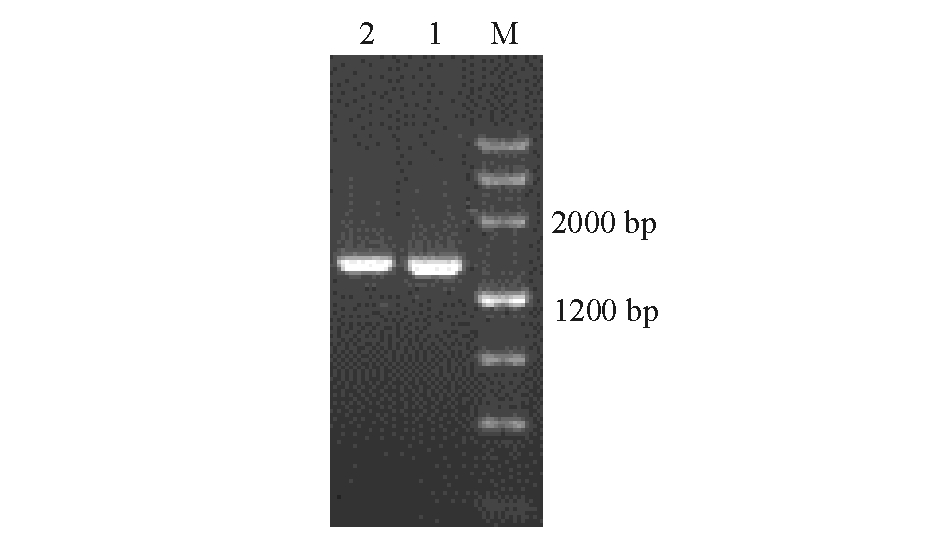
2.3.2 二重PCR快速检测 两株链球菌的二重PCR检测结果表明,TSG002 基因组DNA样品在470 bp出现特异性目的条带,而TSG004基因组DNA样品在296 bp出现特异性目的条带(图3)。
2.3.3 16S rRNA序列分析及系统发育树 两株链球菌的16S rRNA基因PCR扩增电泳结果如图4所示,其目的条带大小约为1500 bp。PCR产物经DNA双向测序,将测得的序列与GenBank数据库中的16S rRNA基因序列进行Blast搜索、比对分析、系统发育树分析。相似性分析表明,分离菌株TSG002与已报道的无乳链球菌S.agalactiae标准株(ATCC13813 strain JCM 5671)16S rRNA基因序列相似性最高(99%),而TSG004菌株与已报道的海豚链球菌S.iniae标准株(ATCC29178)16S rRNA基因序列相似性最高(99%)。进化树分析结果(图5、表3)显示,TSG002菌株与无乳链球菌聚成一群,而TSG004菌株与海豚链球菌聚成一群。因此,将TSG002菌株鉴定为无乳链球菌,TSG004菌株鉴定为海豚链球菌。
表2分离菌株的生化指标鉴定
Tab.2Physiologicalandbiochemicalcharacteristicsoftheisolatebacterialstrains
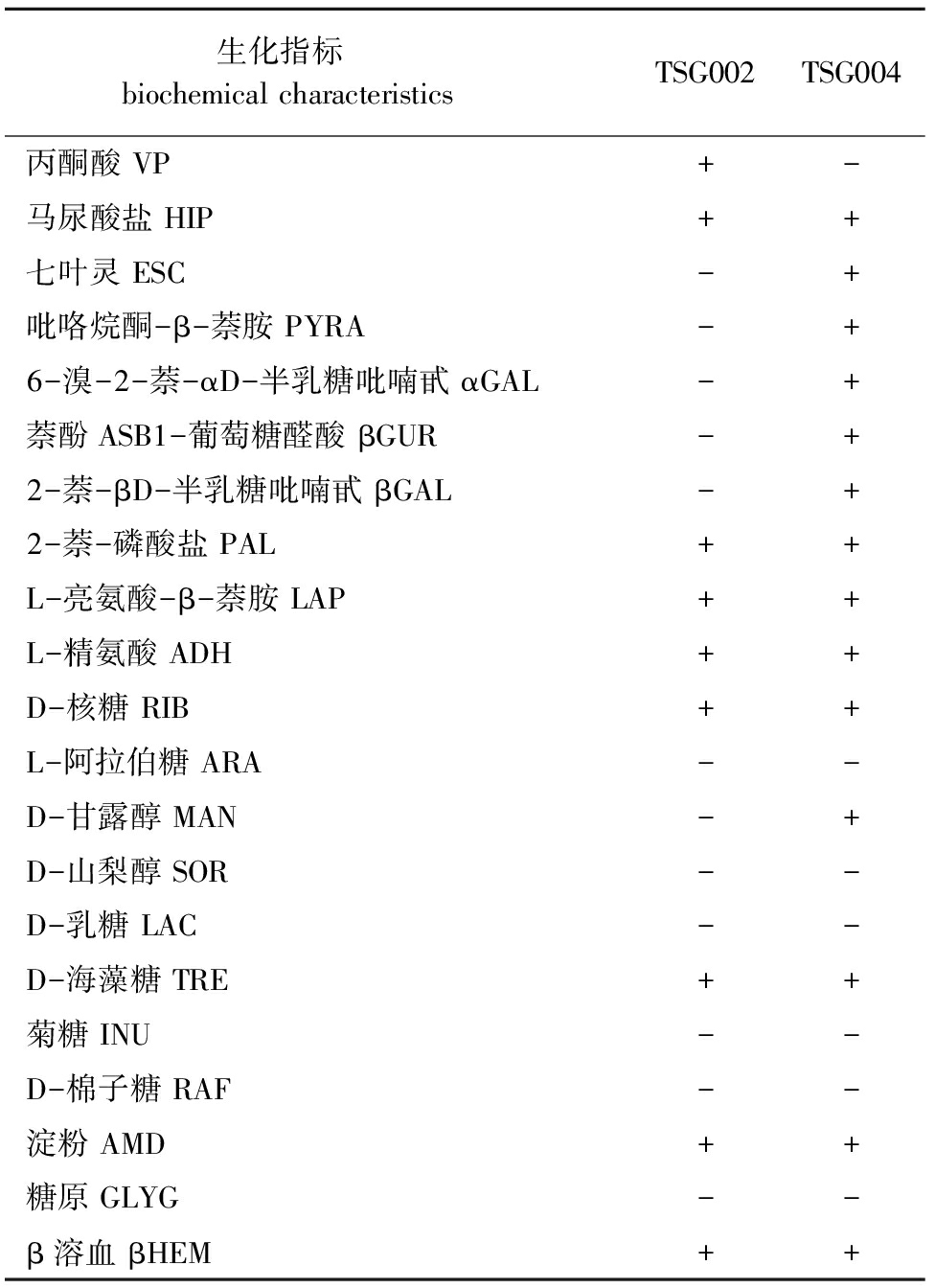
生化指标 biochemicalcharacteristicsTSG002TSG004丙酮酸VP+-马尿酸盐HIP++七叶灵ESC-+吡咯烷酮-β-萘胺PYRA-+6-溴-2-萘-αD-半乳糖吡喃甙αGAL-+萘酚ASB1-葡萄糖醛酸βGUR-+2-萘-βD-半乳糖吡喃甙βGAL-+2-萘-磷酸盐PAL++L-亮氨酸-β-萘胺LAP++L-精氨酸ADH++D-核糖RIB++L-阿拉伯糖ARA--D-甘露醇MAN-+D-山梨醇SOR--D-乳糖LAC--D-海藻糖TRE++菊糖INU--D-棉子糖RAF--淀粉AMD++糖原GLYG--β溶血βHEM++
注:+表示阳性;-表示阴性
Note:+ means positive reaction;-means negative reaction

注:M为4500 bp DNA标准;1为空白对照;2为TSG002 基因组DNA;3为TSG004 基因组DNA
Note:M,4500 bp DNA Marker;1,control;2,TSG002 DNA;3,TSG004 DNA
图3 两株链球菌的二重PCR扩增结果
Fig.3 Duplex PCR analysis of specificity for the two strains
注:M为4500 bp DNA标准;1为TSG002 基因组DNA;2为TSG004 基因组DNA
Note:M,4500 bp DNA Marker;1,TSG002 DNA;2,TSG004 DNA
图4 两株链球菌的16S rRNA基因PCR扩增结果
Fig.4 PCR amplification of 16S rRNA gene in the two strains
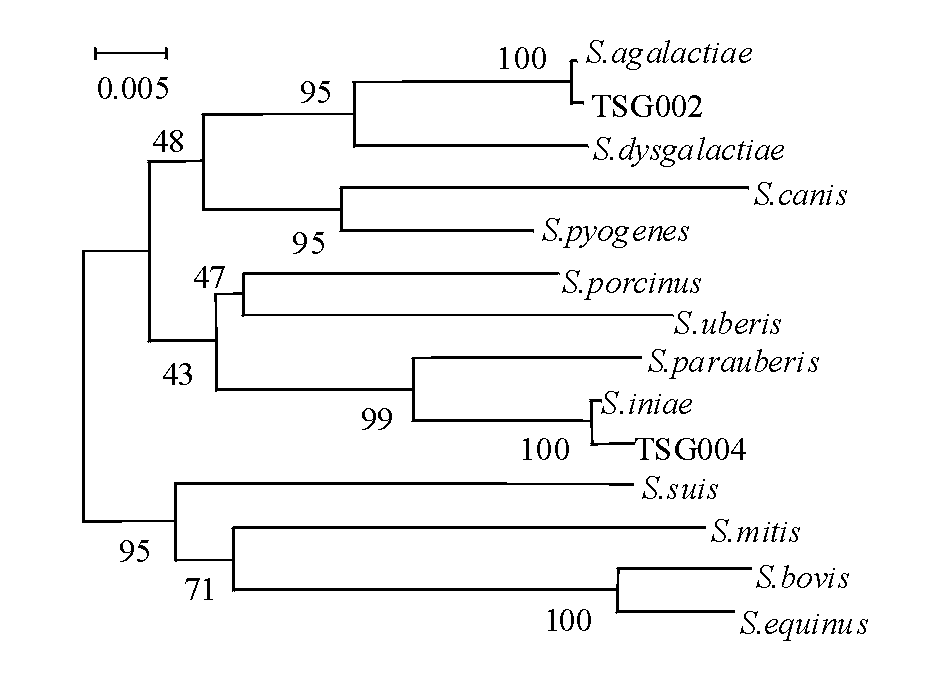
图5 临床分离链球菌株与相近病原的16S rRNA基因序列分析聚类结果
Fig.5 Phylogenetic tree of 16S rRNA gene sequences of the clinic isolated Streptococcus strains and the related organisms
2.4药敏试验
TSG002和TSG004菌株对22种抗生素的敏感性结果见表4。两菌株对头孢曲松、头孢呋辛、头孢哌酮、恩诺沙星、氧氟沙星、阿莫西林、多粘菌素B、头孢噻吩和头孢他啶均敏感,对新霉素、罗红霉素、阿米卡星、庆大霉素和林可霉素均耐药。
表3菌株信息表
Tab.3Theinformationofthestrains
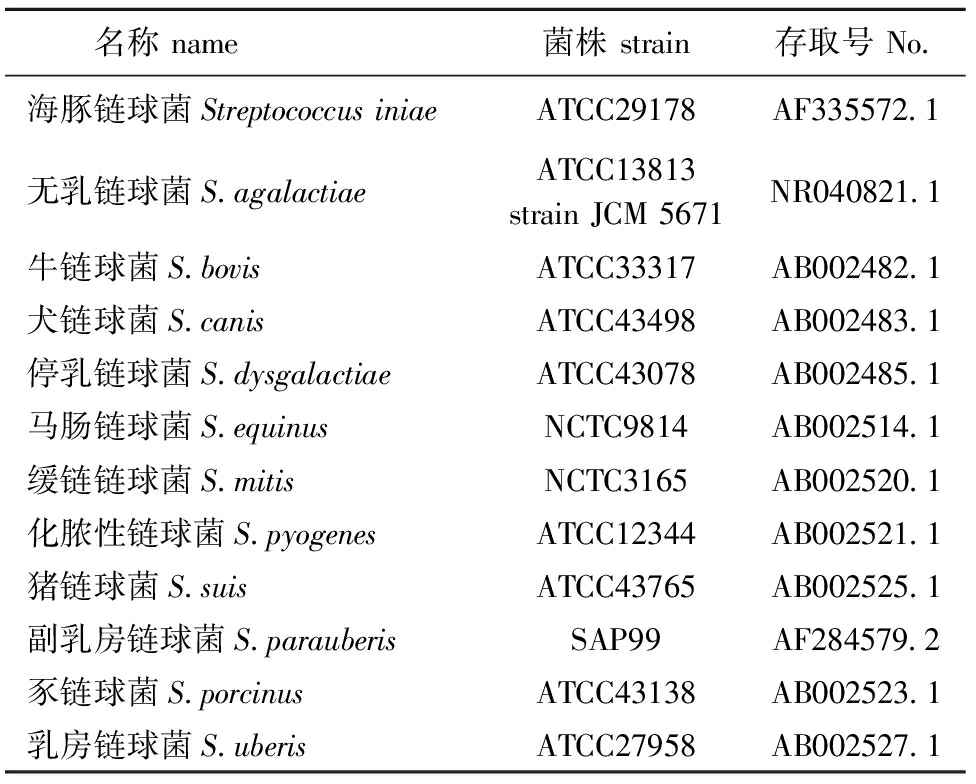
名称name菌株strain存取号No 海豚链球菌StreptococcusiniaeATCC29178AF335572 1无乳链球菌S agalactiaeATCC13813strainJCM5671NR040821 1牛链球菌S bovisATCC33317AB002482 1犬链球菌S canisATCC43498AB002483 1停乳链球菌S dysgalactiaeATCC43078AB002485 1马肠链球菌S equinusNCTC9814AB002514 1缓链链球菌S mitisNCTC3165AB002520 1化脓性链球菌S pyogenesATCC12344AB002521 1猪链球菌S suisATCC43765AB002525 1副乳房链球菌S parauberisSAP99AF284579 2豕链球菌S porcinusATCC43138AB002523 1乳房链球菌S uberisATCC27958AB002527 1
鱼类感染链球菌病一般可分为急性、亚急性和慢性。亚急性和慢性感染的鱼发病特征比较明显:病鱼在水面异常转圈游泳,身体弯曲,体色暗黑,鳃盖、鳍条等部位出血,眼球突出、浑浊,解剖后内脏出血,腹腔积水或积血等,一段时间内持续死亡。而急性感染的鱼则呈现暴发性死亡,除败血症、狂游外,其他症状不明显[8,14-16]。本次调查发现,患病卵形鲳鲹的鳍条基部出血,眼浑浊,空肠,腹水,离群独游,少量在水面狂游,与链球菌引起的鱼类链球菌病的发病症状相似。对分离到的两种优势菌,从菌落形态、染色特征、二重PCR快速诊断结果可初步鉴定为无乳链球菌(TSG002)和海豚链球菌(TSG004);通过生理生化、16S rRNA等鉴定,最终鉴定为无乳链球菌和海豚链球菌。
人工感染试验表明,TSG002和TSG004菌株均为卵形鲳鲹的致病菌,被人工感染病鱼的症状与自然发病鱼基本相似,笔者认为,此次发病为无乳链球菌和海豚链球菌共同感染所致。目前已报道的卵形鲳鲹细菌性病原菌主要有诺卡氏菌、美人鱼发光杆菌、海豚链球菌和停乳链球菌等[2-5],其中均为单一病原感染,未见共同感染的报道,本研究中无乳链球菌和海豚链球菌共同感染同一鱼群的卵形鲳鲹发病的报道尚属首次。
近年来,鱼类感染无乳链球菌和海豚链球菌的报道越来越多,但要关注的是这两种菌还可感染人和与人密切相关的哺乳动物。海豚链球菌可感染人,引起败血性蜂窝组织炎和膝部败血性关节炎[19]。无乳链球菌比海豚链球菌感染的宿主范围更广,造成的后果也更为严重。例如,无乳链球菌可感染孕妇和新生胎儿,引起孕妇流产、胎膜早破和宫内感染,致新生胎儿肺炎、败血症和脑膜炎[9-10]; 可感染奶牛,引发奶牛乳房炎,导致牛奶产量和质量下降,间接影响人类健康[11-12]。对于可能引起人类公共卫生安全威胁的无乳链球菌,国外学者对其跨种感染进行了大量探索和研究。Bisharat等[20]研究发现,对人新生胎儿具有超强感染能力的ST-17菌株来源于奶牛的ST67菌株,暗示奶牛源无乳链球菌可能感染人。Manning等[21]研究发现,一对夫妻携带有与他们饲养的奶牛粪便中含有相同基因型的无乳链球菌菌株,暗示部分人源无乳链球菌可能来源于奶牛。Pereira等[22]用9株奶牛源无乳链球菌感染罗非鱼,其中3株感染成功。这些研究结果显示,人、罗非鱼和其他动物源无乳链球菌在一定条件下可交叉感染。鱼类链球菌不仅给水产养殖业造成了很大的损失,也给人类的食品安全和健康构成了威胁,鱼类链球菌作为人兽共患病原,对该病原引起的水生动物疾病的防控亟待引起人们的高度重视。
表4药敏试验结果
Tab.4Theresultsofthedrugsensitivitytest
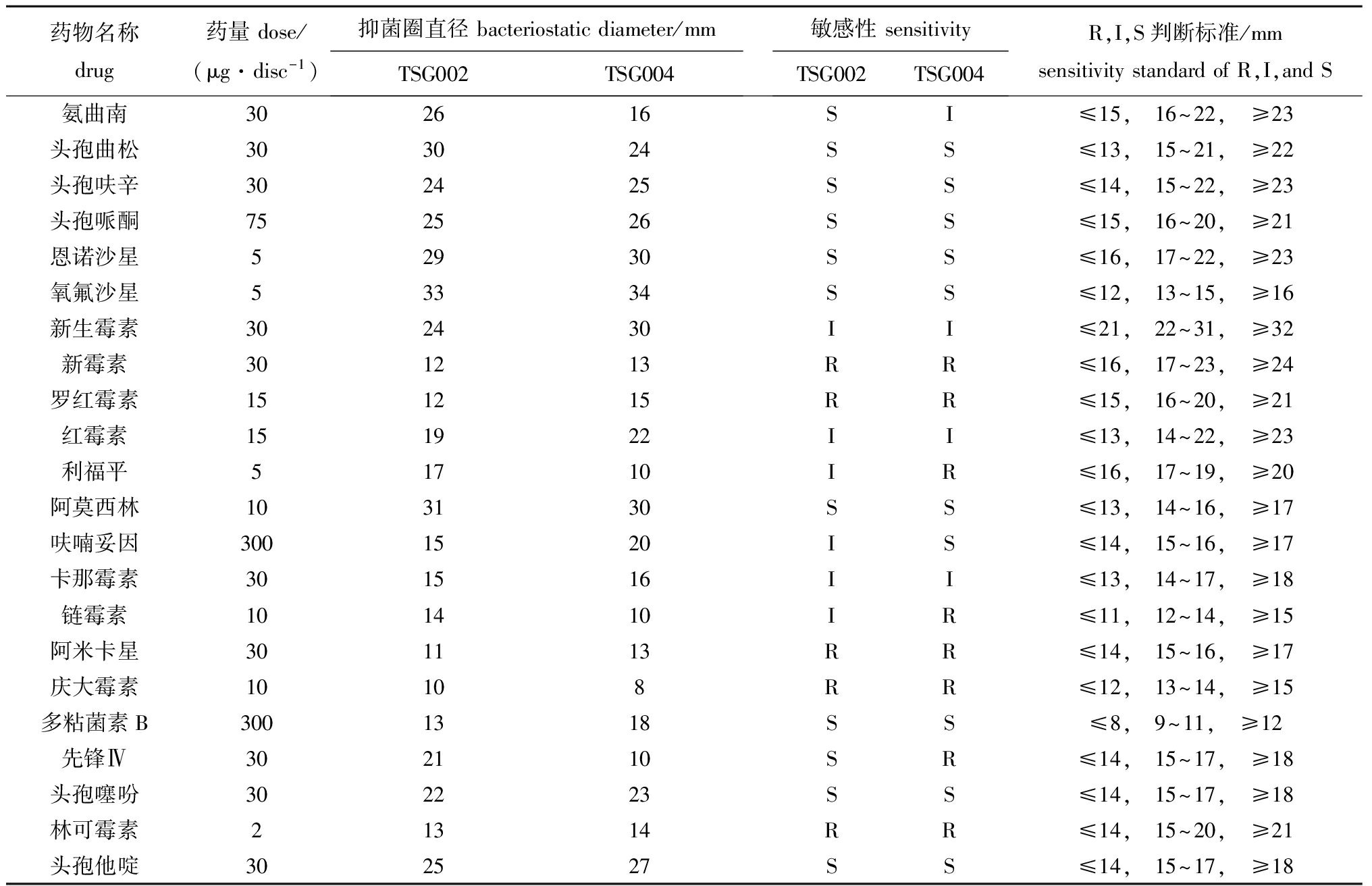
药物名称drug药量dose/(μg·disc-1)抑菌圈直径bacteriostaticdiameter/mmTSG002TSG004敏感性sensitivityTSG002TSG004R,I,S判断标准/mmsensitivitystandardofR,I,andS氨曲南302616SI≤15, 16~22, ≥23头孢曲松303024SS≤13, 15~21, ≥22头孢呋辛302425SS≤14, 15~22, ≥23头孢哌酮752526SS≤15, 16~20, ≥21恩诺沙星52930SS≤16, 17~22, ≥23氧氟沙星53334SS≤12, 13~15, ≥16新生霉素302430II≤21, 22~31, ≥32新霉素301213RR≤16, 17~23, ≥24罗红霉素151215RR≤15, 16~20, ≥21红霉素151922II≤13, 14~22, ≥23利福平51710IR≤16, 17~19, ≥20阿莫西林103130SS≤13, 14~16, ≥17呋喃妥因3001520IS≤14, 15~16, ≥17卡那霉素301516II≤13, 14~17, ≥18链霉素101410IR≤11, 12~14, ≥15阿米卡星301113RR≤14, 15~16, ≥17庆大霉素10108RR≤12, 13~14, ≥15多粘菌素B3001318SS≤8, 9~11, ≥12先锋Ⅳ302110SR≤14, 15~17, ≥18头孢噻吩302223SS≤14, 15~17, ≥18林可霉素21314RR≤14, 15~20, ≥21头孢他啶302527SS≤14, 15~17, ≥18
注:R表示耐药,I表示中介,S表示敏感
Note:R,drug resistance;I,median sensitivity;S,high sensitivity
药物敏感试验结果表明,TSG002和TSG004病原菌对22种抗生素的敏感性有所不同,两株菌对头孢曲松、头孢呋辛、头孢哌酮、恩诺沙星、氧氟沙星、阿莫西林、多粘菌素B、头孢噻吩和头孢他啶均表现为敏感,对新霉素、罗红霉素、阿米卡星、庆大霉素和林可霉素均表现为耐药,但对氨曲南、利福平、呋喃妥因、链霉素和先锋Ⅳ的敏感性有一定差异,药敏结果可为生产上选择合适的治疗或控制药物提供理论参考。
参考文献:
[1] 周永灿,朱传化,张本,等.卵形鲳鲹大规模死亡的病原及其防治[J].海洋科学,2001,25(4):40-43.
[2] 黄郁葱,简纪常,吴灶和,等.卵形鲳鲹结节病病原的分离与鉴定[J].广东海洋大学学报,2008,28(4):49-53.
[3] 王瑞旋,冯娟,苏友禄,等.卵形鲳鲹美人鱼发光杆菌杀鱼亚种的分离鉴定[J].中国水产科学,2010,17(5):1020-1027.
[4] 周素明,李安兴,马跃,等.养殖鱼类链球菌病病原的分离鉴定及其16S rDNA分析[J].中山大学学报:自然科学版,2007,46(2):69-71.
[5] 周素明.鱼类海豚链球菌流行病学及诊断技术的研究[D].广州:中山大学,2010.
[6] 王江勇,郭志勋,黄剑南,等.一起卵形鲳鲹幼鱼死亡原因的调查[J].南方水产,2006,2(3):54-57.
[7] 王玉群,彭劲松,杨土金.金鲳感染刺激隐核虫(海水小瓜虫)的诊断和防治[J].科学养鱼,2010(12):79.
[8] Weinstein M,Low D,McGeer A,et al.Invasive infections due to a fish pathogen,Streptococcusiniae[J].N Engl J Med,1997, 337:589-594.
[9] Dermer P,Lee C,Eggert J,et al.A history of neonatal group BStreptococcuswith its related morbidity and mortality rates in the United States[J].J Pediatr Nurs,2004,19:357-363.
[10] Edwards M S,Baker C J.Group B streptococcal infections in elderly adults[J].Clin Infect Dis,2005,41:839-847.
[11] Akerstedt M,Wredle E,Lam V,et al.Protein degradation in bovine milk caused byStreptococcusagalactiae[J].J Dairy Res,2012,79(3):297-303.
[12] Gao J,Yu F Q,Luo L P,et al.Antibiotic resistance ofStreptococcusagalactiaefrom cows with mastitis[J].Veterinary Journal,2012,194:423-424.
[13] Hoshina T,Sano t,Morimoto Y A.Streptococcuspathogenic to fish[J].J Tokyo Univ Fish,1958,44:57-58.
[14] Eldar A,Bejerano Y,Livoff A,et al.Experimental streptococcal meningoencephalitis in cultured fish[J].Veterinary Microbiology,1995,43:33-40.
[15] Domenech A,Femandez-Garayzabal J E,Pascual C,et al.Streptococcusis in cultured turbot,Scophthalmusmaximus(L.),associated withStreptococcusparauberis[J].J Fish Dis,1996,19:33-38.
[16] Shoemaker C A,Klesius P H,Evans J J.Prevalence ofStreptococcusiniaein tilapia,hybrid striped bass,and channel catfish on commercial fish farms in the United States[J].Am J Vet Res, 2001,62:174-177.
[17] 黎炯,叶星,卢迈新,等.双重PCR快速鉴别无乳链球菌和海豚链球菌[J].湖南农业大学学报:自然科学版,2010,36(4):449-452.
[18] Messick J B,Berent L M,Cooper S K.Development and evaluation of a PCR—based assay for detection ofHaemobartonellafelisin cat and differentiation ofH.felisfrom related bacteria by restriction fragment length polymorohism analysis[J].J Clin Microbiol,1998,36(2):462-466.
[19] Weinstein M,Low D,McGeer A,et al.Invasive infections due to a fish pathogen,Streptococcusiniae[J].N Engl J Med, 1997,337:589-594.
[20] Bisharat N,Crook D W,Leigh J,et al.Hyperinvasive neonatal group Bstreptococcushas arisen from a bovine ancestor[J].J Clin Microbiol,2004,42(5):2161-2167.
[21] Manning S D,Springman A C,Million A D,et al.Association of Group BStreptococcuscolonization and bovine exposure:a prospective cross-sectional cohort study[J].PLoS One,2010,5(1):e8795.
[22] Pereira U P,Mian G F,Oliveira I C,et al.Genotyping ofStreptococcusagalactiaestrains isolated from fish,human and cattle and their virulence potential in Nile tilapia[J].Veterinary Microbiology,2010,140(1/2):186-192.
Abstract:Two bacterial strains TSG002 and TSG004 were isolated from the diseased ovate pompanoTrachinotusovatuscollected in Beihai,Guangxi Province,China in August of 2011,and were confirmed to be the pathogens of the diseased ovate pompano by animal challenge test, and by morphology, physiological and biochemical examination and 16S rRNA genetic analysis. In addition,the sensitivity of both strains to twenty-two antibiotics were studied. The results showed that strains TSG002 and TSG004 were similar to bacteriaStreptococcusagalactiaeandS.iniae, based on the morphology, physiology and biochemistry examinations. The phylogenetic analysis revealed that the l6S rRNA sequence of strains TSG002 (KF826095) and TSG004 (KF826094) has high similarity (99%) toS.agalactiae(NR040821.1) andS.iniae(AF335572.1) in GenBank. Phylogenetic tree ofStreptococcusspp. built according to 16S rRNA genes also showed that strains TSG002 and TSG004 are classified intoS.agalactiaeandS.iniaegroup, respectively.Both strains were found to be highly sensitive to nine drugs, including ceftriaxone,enrofloxacin, ofloxacin, amoxicillin and cephalothin. It is concluded that ovate pompano can be infected byS.agalactiaeandS.iniae, which were firstly and simultaneously found in one diseased ovate pompano.
Key words:Trachinotusovatus;Streptococcusagalactiae;S.iniae; 16S rRNA; drug sensitivity test
DOI:10.3969/J.ISSN.2095-1388.2014.02.012
文章编号:2095-1388(2014)02-0161-06
收稿日期:2013-11-27
基金项目:广西区直属公益性科研院所基本科研业务费专项资金资助项目(GXIF-2012-02);广西重点实验室计划项目(12-A-03-01);广西科技创新推广扶持项目(桂渔牧科1204905,桂渔牧科1304527,桂渔牧科1304534);广西面上基金资助项目(2012GXNSFAA053065)
中图分类号:S941.42
文献标志码::A