表1正交试验因素水平表
Tab.1Factorsandlevelsofaorthogonaltest
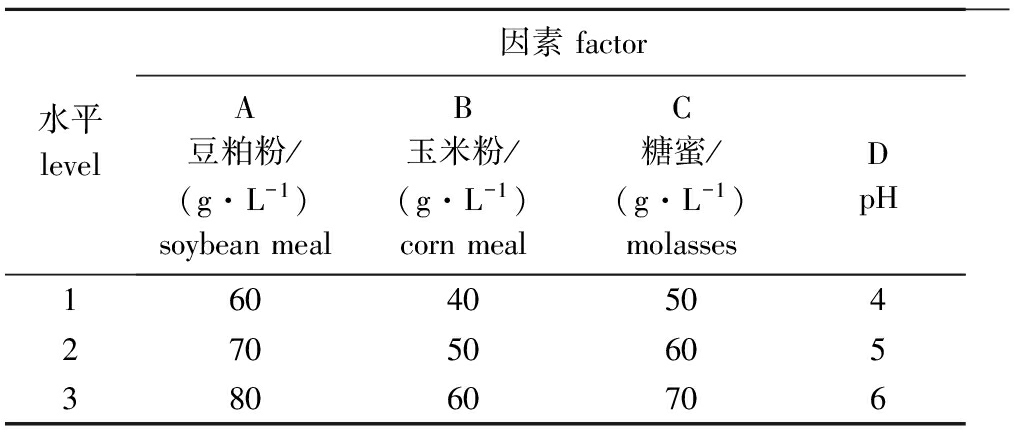
水平level因素factorA豆粕粉/(g·L-1)soybeanmealB玉米粉/(g·L-1)cornmealC糖蜜/(g·L-1)molassesDpH160405042705060538060706
摘要:以廉价原料豆粕粉、玉米粉和糖蜜为营养要素,采用单因素试验优化了梅奇酵母Metschnikowiasp.C14的培养基成分,再通过豆粕粉、玉米粉、糖蜜和初始pH值4因素3水平的正交试验,确定培养基的最佳组合为:70 g/L豆粕粉、40 g/L玉米粉、60 g/L糖蜜、初始pH为6,在此基础上进一步优化梅奇酵母C14菌株的培养条件。结果显示,该菌株的最佳摇瓶发酵条件为:培养温度25 ℃,转速180 r/min,接种量3%,250 mL三角瓶中培养基的装液量为25 mL,经28 h培养,C14菌密度可达1.26×109cells/mL,比优化前提高了72.91%。
关键词:梅奇酵母C14;培养基;发酵条件;优化
酵母通常被认为是蛋白质、核酸、维生素和多糖的良好来源[1-2]。海洋红酵母Rhodotorulasp.可以替代单胞藻进行刺参浮游幼体的培育[3];德巴利酵母Debaryomycessp. MY3、克鲁维酵母Kluyveromycessp. MY32、虫道酵母Ambrosiozymasp. MY33以不超过50%的比例替代球等鞭金藻Isochrysisgalbana,对海湾扇贝Argopectenirradians幼贝的生长和存活影响不大[4];汉逊德巴利酵母DebaryomyceshanseniiHF1可提高鲈Dicentrarchuslabrax幼体的存活率[5];沼泽生红冬孢酵母Rhodosporidiumpaludigenum能够促进凡纳滨对虾Litopenaeusvannamei的生长[6];清酒假丝酵母CandidasakeS165、汉逊德巴利酵母S8和热带假丝酵母CandidatropicalisS186是印度明对虾Fenneropenaeusindicus有效的免疫增强剂[2,7]。
刺参Apostichopusjaponicus是中国北方地区重要的海珍品养殖种类。由于养殖密度的迅速增加和不规范养殖,使刺参病害频发,严重制约了刺参养殖业的可持续发展[8-12]。使用益生菌防止刺参疾病发生是替代抗生素的有效方法之一。薛德林等[13]研究表明,当海洋胶红酵母Rhodotorulamucilaginosa(浓度为1×1010CFU/mL)日投喂量为10 mL/m3(水体)时,试验组刺参幼体烂胃病的发病率显著低于对照组。从天然海域健康刺参肠道分离的梅奇酵母Metschnikowiasp.C14体外可抑制刺参病原菌黄海希瓦氏菌ShewanellamarisflaviAP629和灿烂弧菌VibriosplendidusNB13 的生长[14]。Liu等[15]将梅奇酵母C14添加到刺参基础饵料中进行投喂试验,结果表明,C14菌株可刺激幼参的免疫反应,提高其抗病力。有益酵母菌的传统培养大多使用价格较高的葡萄糖、酵母膏和蛋白胨等培养基。本试验中,以成本低廉且适用于工业生产的糖蜜、豆粕粉和玉米粉为营养要素,优化梅奇酵母C14的培养基与培养条件,旨在为该菌株的工业化发酵生产提供参考依据。
1.1材料
供试菌株梅奇酵母C14从健康刺参肠道分离获得[14-15]。
培养基为种子培养基(YPD),其包含蛋白胨20 g、酵母粉10 g、葡萄糖20 g、陈海水1000 mL,自然pH。
发酵培养基包含豆粕粉70 g、玉米粉50 g、糖蜜50 g、陈海水1000 mL,pH为5。豆粕粉和玉米粉与一定量的海水搅拌均匀后于60 ℃水浴中静置1 h[16]。糖蜜的处理参考文献[17]中的方法。
1.2方法
1.2.1 培养基的优化 将梅奇酵母C14于YPD斜面活化后,接入5 mL液体种子培养基中,于25 ℃下摇床培养(150 r/min)20 h,再将其以4%的接种量接入盛有25 mL发酵培养基的三角瓶(250 mL,下同)中,25 ℃下摇床培养(150 r/min)24 h,用血球计数板计数酵母菌总数[18]。
(1)单因素试验。在发酵培养基中添加50、60、70、80、90 g/L共5个浓度的豆粕粉(每一浓度设3个平行,下同),选择其最优质量浓度;在豆粕粉最优质量浓度基础上改变玉米粉含量为30、40、50、60、70 g/L共5个浓度,选择其最优质量浓度;在豆粕粉和玉米粉最优质量浓度基础上改变糖蜜含量为30、40、50、60、70 g/L共5个浓度,选择其最优质量浓度。
(2)正交试验。根据单因素试验结果,选择豆粕粉、玉米粉、糖蜜和pH进行4因素3水平L9(34)的正交试验(表1),共9个处理组,每组设3个平行,测定不同处理组酵母菌的生长情况。
表1正交试验因素水平表
Tab.1Factorsandlevelsofaorthogonaltest

水平level因素factorA豆粕粉/(g·L-1)soybeanmealB玉米粉/(g·L-1)cornmealC糖蜜/(g·L-1)molassesDpH160405042705060538060706
1.2.2 发酵条件的优化 在正交试验优化后的培养基基础上,进行梅奇酵母C14发酵条件的优化。种子液制备同“1.2.1”。
(1)温度对C14菌株生长的影响。将液体种子以4%接种量接入25 mL发酵培养基中,分别于20、25、30 ℃(每一温度设3个平行)下摇床培养 (150 r/min) 24 h,计数酵母菌总数,确定该菌株的最适生长温度。
(2)摇瓶转速对C14菌株生长的影响。将液体种子以4%接种量接入25 mL发酵培养基中,在最适温度下分别以120、150、180、210 r/min (每一转速设3个平行)摇床培养 24 h,计数酵母菌总数,确定最适摇瓶转速。
(3)接种量对C14菌株生长的影响。将液体种子以2%、3%、4%、5%和6%的接种量(每一接种量设3个平行)接入25 mL发酵培养基中,于最适温度和摇瓶转速条件下摇床培养24 h,计数酵母菌总数,确定最适接种量。
(4)装液量对C14菌株生长的影响。将液体种子以最适接种量接入15、25、35 mL发酵培养基(每一装液量设3个平行)中,于最适温度和摇瓶转速条件下摇床培养24 h,计数酵母菌总数,确定最适装液量。
1.2.3 梅奇酵母C14生长曲线的测定 将液体种子以最适接种量接入装有最适装液量的优化发酵培养基中,在最适摇瓶转速和温度条件下培养,每隔4 h计数酵母菌总数。
1.3数据处理
试验数据采用SPSS 16.0 软件进行单因素方差分析和Duncan多重比较,显著性水平设为0.05。描述性统计值用平均值±标准差表示。
2.1发酵培养基的优化
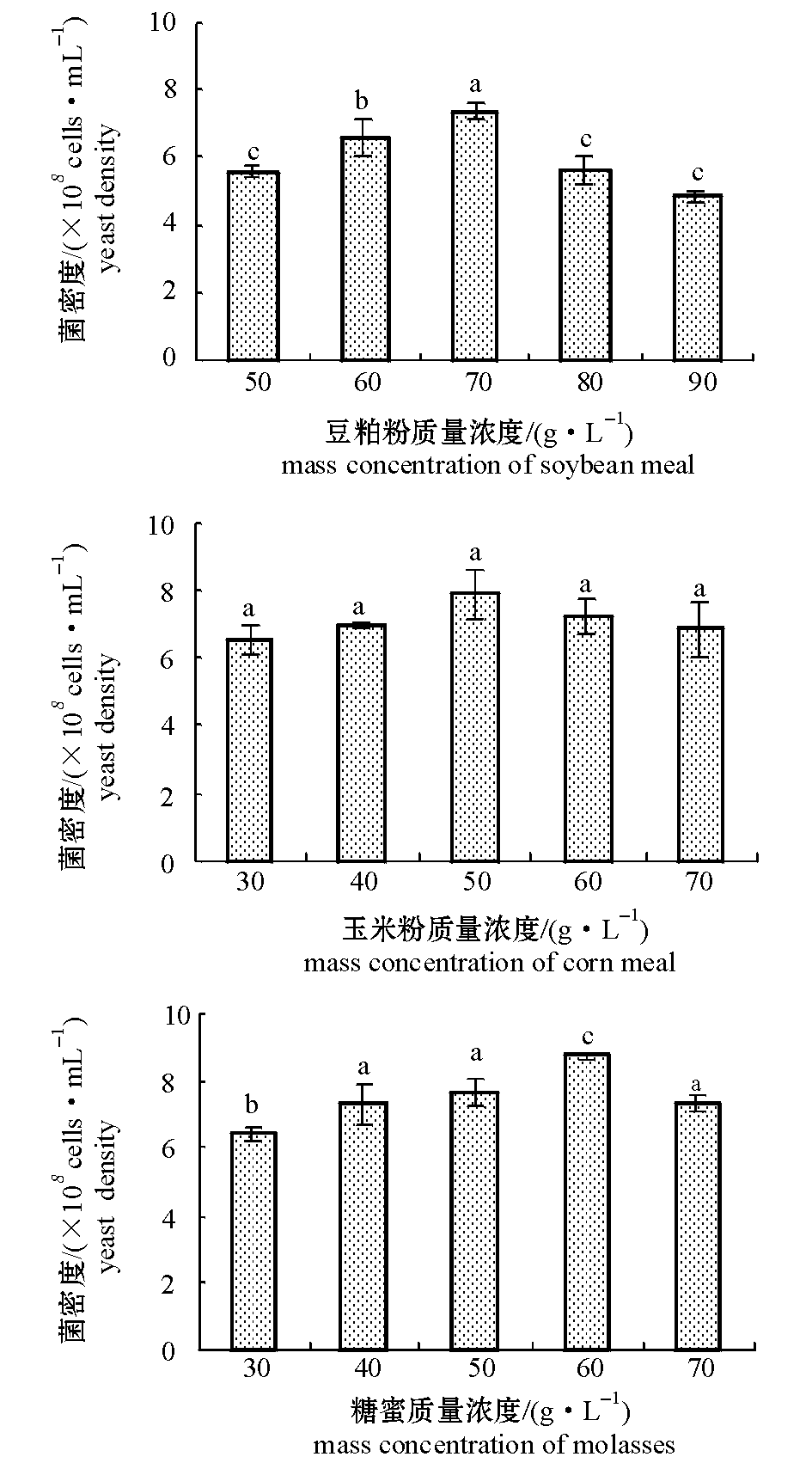
2.1.1 单因素试验 不同质量浓度的豆粕粉、玉米粉和糖蜜对C14菌株生长的影响如图1所示。发酵液中C14菌密度随着豆粕粉、玉米粉和糖蜜质量浓度的升高均呈先上升后下降的趋势。从图1可见:当豆粕粉质量浓度为70 g/L时,C14菌密度最高,且显著高于其他浓度组(P<0.05);不同玉米粉质量浓度对C14菌株生长没有显著影响(P>0.05),当玉米粉质量浓度为50 g/L时,C14菌密度稍高;当糖蜜质量浓度为60 g/L时,C14菌密度最高(8.75×108cells/mL),且显著高于其他浓度组(P<0.05)。
2.1.2 正交试验 在单因素试验结果的基础上设计豆粕粉质量浓度、玉米粉质量浓度、糖蜜质量浓度和pH值4因素3水平的正交试验(表2)。从表2可见,影响C14菌株生长的主次因素顺序为豆粕粉>糖蜜>pH>玉米粉。方差分析结果表明(表3),A、D因素对C14菌株生长的影响均达到极显著水平,C因素对C14菌株生长的影响达到显著水平。因此,C14菌株生长的最优培养基配方组合为A2B1C2D3,即70 g/L豆粕粉,40 g/L玉米粉,60 g/L糖蜜,pH为6,培养24 h时的C14菌密度达1.09×109cells/mL。
2.2发酵条件的优化
2.2.1 温度对C14菌株生长的影响 温度对C14菌株生长有显著影响,当温度为25 ℃时,C14菌密度最高,且显著高于其他温度组(P<0.05)(图2)。因此,在本试验条件下,确定最佳发酵温度为25 ℃。
注:标有不同字母表示组间有显著性差异(P<0.05),下同
Note: The means with different letters are significant differences (P<0.05), et sequentia
图1 豆粕粉、玉米粉、糖蜜对C14菌株生长的影响
Fig.1 Effect of soybean meal,corn mealon,and molasses on growth of strain C14
表2C14菌株生长的正交试验设计方案及试验结果
Tab.2ThegrowthofstrainC14anddesignintheorthogonalexperiments
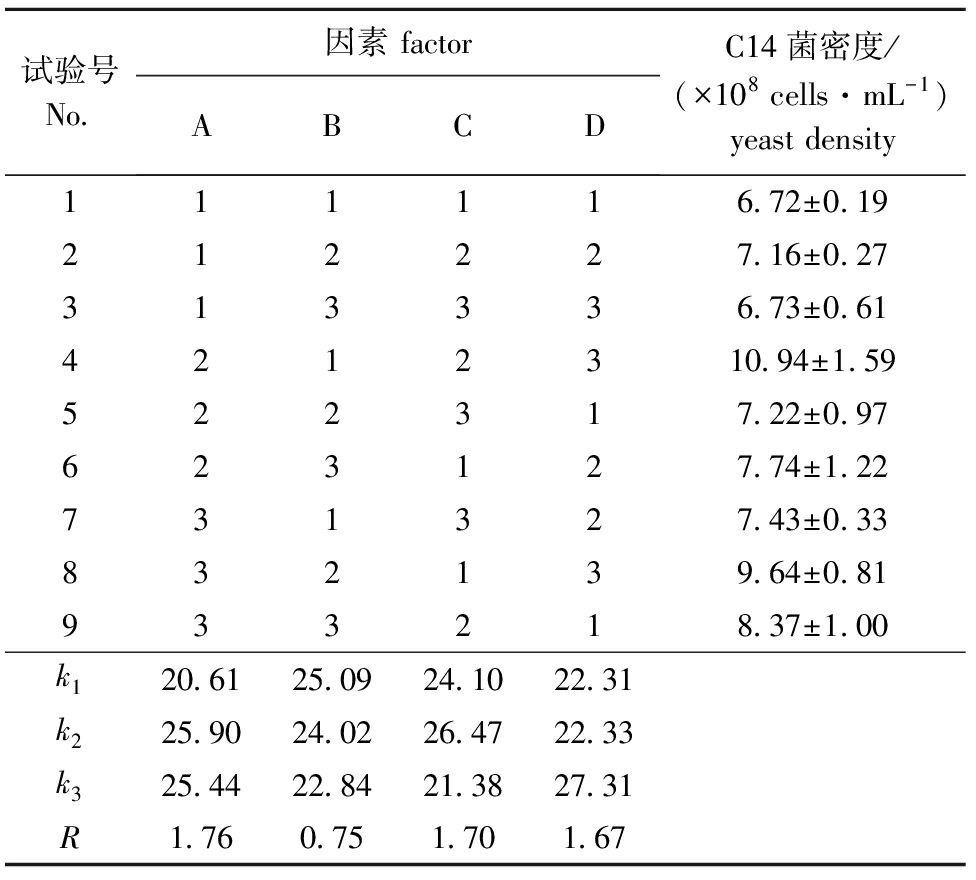
试验号No 因素factorABCDC14菌密度/(×108cells·mL-1)yeastdensity111116 72±0 19212227 16±0 27313336 73±0 614212310 94±1 59522317 22±0 97623127 74±1 22731327 43±0 33832139 64±0 81933218 37±1 00k120 6125 0924 1022 31k225 9024 0226 4722 33k325 4422 8421 3827 31R1 760 751 701 67
2.2.2 转速对C14菌株生长的影响 随着摇瓶转速的增大,C14菌密度显著提高,但进一步提高摇床转速,C14菌密度则开始逐渐下降,当摇瓶转速为180 r/min时,C14菌密度达到最高,且显著高于其他摇瓶转速组(P<0.05)(图2)。因此,在本试验条件下,确定最佳摇瓶转速为180 r/min。
2.2.3 接种量对C14菌株生长的影响 接种量对C14菌株生长有显著影响,当接种量为3%、4%时,C14菌密度均较高,且显著高于其他接种量组(P<0.05),当接种量超过5%时,菌株的生长受到抑制(图2)。因此,在本试验条件下,从经济效益考虑,确定最佳接种量为3%。
表3试验方差分析结果
Tab.3TheresultsofANOVA
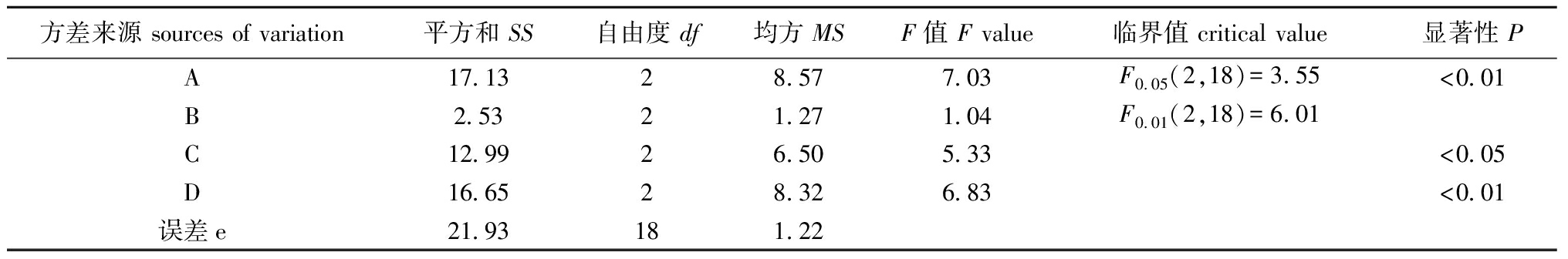
方差来源sourcesofvariation平方和SS自由度df均方MSF值Fvalue临界值criticalvalue显著性PA17 1328 577 03F0 05(2,18)=3 55<0 01B2 5321 271 04F0 01(2,18)=6 01C12 9926 505 33<0 05D16 6528 326 83<0 01误差e21 93181 22
2.2.4 装液量对C14菌株生长的影响 C14菌株的生长随装液量的增加而增加,当装液量为25 mL时,C14菌密度最高,且显著高于其他装液量组(P<0.05),当装液量超过25 mL时,菌株的生长反而受到抑制(图2)。因此,在本试验条件下,确定最佳装液量为25 mL。
2.3C14菌株的生长曲线
由图3可知,当培养时间为0~8 h时C14菌体生长缓慢,8~24 h时菌体密度呈指数增加,28 h时菌体密度最高(1.26×109cells/mL)。因此,在本试验条件下,确定最佳培养时间为28 h。
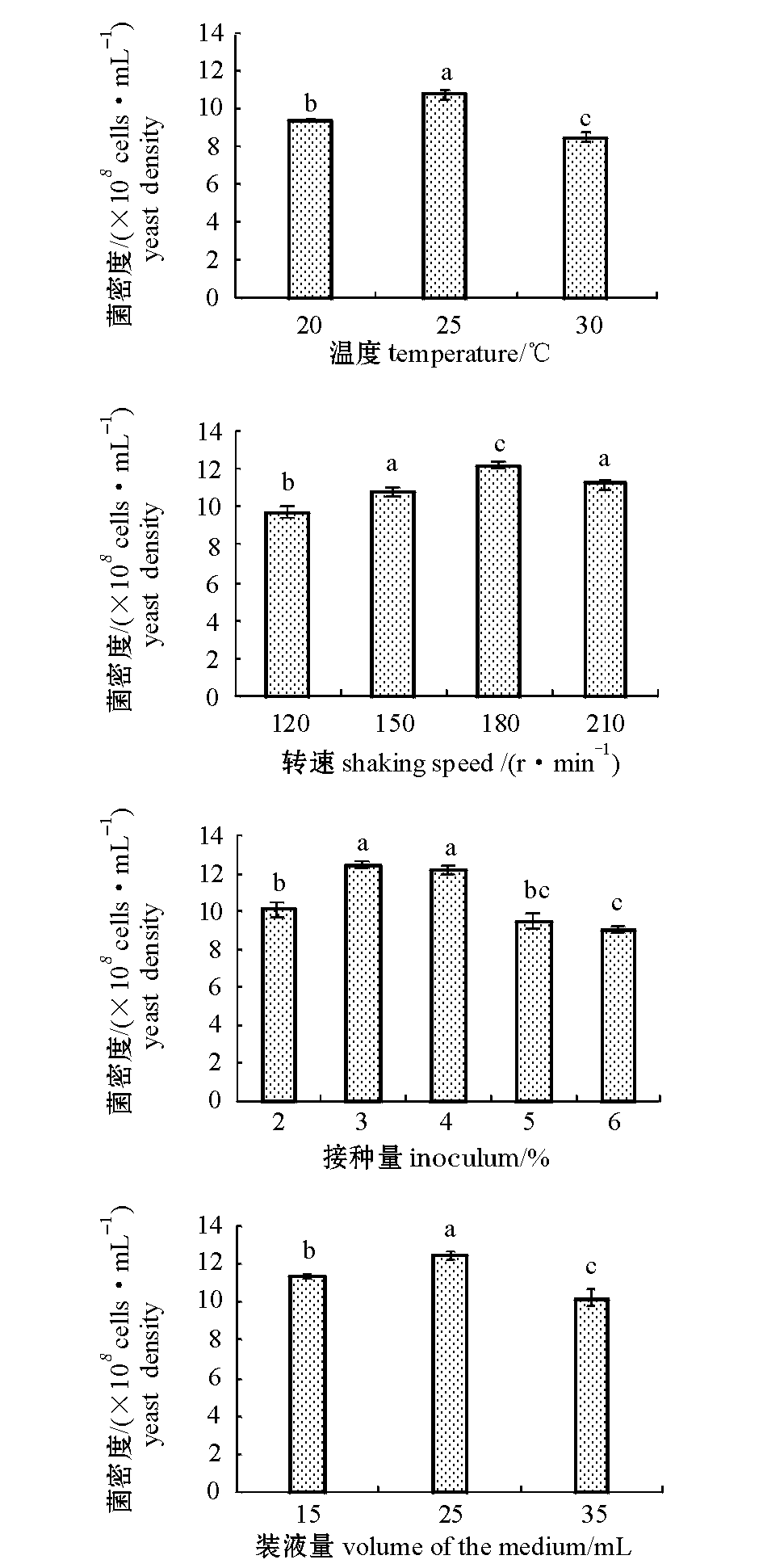
图2 培养温度、转速、接种量、装液量对C14菌株生长的影响
Fig.2 Effect of temperature, shaking speed, inoculum ratio, and medium volume on growth of strain C14

图3 C14菌株的生长曲线
Fig.3 Growth curve of strain C14
豆粕粉中蛋白质含量超过40%,且富含多种氨基酸。豆粕为工业生产枯草芽孢杆菌Bacillussubtilis发酵培养基配方中的最佳氮源[19]。玉米浆含有丰富的氨基酸、还原糖、磷、微量元素和生长素,很容易被微生物吸收利用。玉米浆对水产用益生菌地衣芽孢杆菌BacilluslicheniformisD1的生长有促进作用,适宜添加量为1.5%[20]。糖蜜是制糖工业的主要副产品,含丰富的糖类、氨基酸、有机酸、维生素、无机盐和色素等,是发酵工业中常用的廉价原料。海洋红酵母可利用糖蜜作为其生长较适宜的碳源[21]。本试验中,培养基中含豆粕粉70 g/L、玉米粉40 g/L、糖蜜60 g/L,有利于C14菌株的生长,培养24 h后获得的菌密度(1.09×109cells/mL)远高于胶红酵母 HN-3在葡萄糖、蛋白胨和酵母膏组成的优化培养基中生长48 h的菌密度(4.80×107cells/mL)[22]。
本试验中,C14菌株生长的最适温度为25 ℃,温度偏低可能与菌株来源有关。刺参通常生活在低温环境中,其体内的酵母菌为适应其生存环境而形成与陆地酵母菌不同的生活习性。当摇瓶转速为180 r/min时,C14菌株的生物量最高,可能是低转速使三角瓶内溶解氧含量减少,而高转速又导致瓶中的剪切应力增大,转速过高或过低时均使菌体生长缓慢。接种量与菌株的生长周期有关,接种量低,延滞期长,发酵周期延长;接种量高,菌体对营养成分的竞争力过大,菌体因营养不足而死亡,C14菌株生长的最适接种量为3%。装液量可反映摇瓶内溶解氧含量的多少,装液量少,瓶内溶解氧含量多;装液量多时可导致供氧不足,影响菌体的生长,C14菌株生长的最适装液量为25 mL。梁晓华等[23]研究表明,250 mL三角瓶中培养基的装液量为10 mL时最有利于海洋红酵母Y2的生长。本试验中,在优化的培养基和发酵条件下培养,C14菌株的最大菌密度为1.26×109cells/mL,高于海洋红酵母Rhodotorulabenthica和Rhodotorulasp.RH1在优化的培养基(蔗糖/葡萄糖、蛋白胨、酵母膏等)和发酵条件下培养获得的最大菌密度(9.70×108cells/mL、1.05×109cells/mL)[24-25]。因此,以豆粕粉、玉米粉和糖蜜廉价原料组成的培养基有利于C14菌株的生长。本试验结果可为刺参内源益生菌的工业化生产提供参考依据。
参考文献:
[1] Brown M R,Barrett S M,Volkman J K,et al.Biochemical composition of new yeasts and bacteria evaluated as food for bivalve aquaculture[J].Aquaculture,1996,143:341-360.
[2] Sajeevan T P,Philip R,Singh I S B.Immunostimulatory effect of a marine yeastCandidasakeS165 inFenneropenaeusindicus[J].Aquaculture,2006,257:150-155.
[3] 赵玉明,毛玉泽.海洋酵母培育仿刺参Apostichopusjaponicus浮游幼体研究[J].中国农业科技导报,2009,11(3):71-75.
[4] 蔡诗庆,孙世春.三株海洋酵母投喂海湾扇贝幼贝效果的研究[J].中国海洋大学学报:自然科学版,2005,35(6):955-960.
[5] Tovar D,Zambonino J,Cahu C,et al.Effect of live yeast incorporation in compound diet on digestive enzyme activity in sea bass(Dicentrarchuslabrax) larvae[J].Aquaculture,2002,204:113-123.
[6] Yang S P,Wu Z H,Jian J C,et al.Effect of marine red yeastRhodosporidiumpaludigenumon growth and antioxidant competence ofLitopenaeusvannamei[J].Aquaculture,2010,309:62-65.
[7] Sarlin P J,Philip R.Efficacy of marine yeasts and baker’s yeast as immunostimulants inFenneropenaeusindicus: a comparative study[J].Aquaculture,2011,321:173-178.
[8] 马悦欣,徐高蓉,常亚青,等.大连地区刺参幼参溃烂病细菌性病原的初步研究[J].大连水产学院学报,2006,21(1):13-17.
[9] 马悦欣,徐高蓉,张恩鹏,等.仿刺参幼参急性口围肿胀症的细菌性病原[J].水产学报,2006,30(3):378-382.
[10] 王印庚,荣小军,张春云,等.养殖海参主要疾病及防治技术[J].海洋科学,2005,29(3):1-7.
[11] Deng H,He C B,Zhou Z C,et al.Isolation and pathogenicity of pathogens from skin ulceration disease and viscera ejection syndrome of the sea cucumberApostichopusjaponicus[J].Aquaculture,2009,287:18-27.
[12] Li H,Qiao G,Li Q,et al.Biological characteristics and pathogenicity of a highly pathogenicShewanellamarisflaviinfected sea cucumber (Apostichopusjaponicus)[J].Journal of Fish Disease,2010,33:865-877.
[13] 薛德林,胡江春,王国安,等.海洋胶红酵母、光合细菌、生化黄腐酸在海参育苗和养成中的应用效果[J].腐殖酸,2009,22(4):19-24.
[14] 李明,马悦欣,刘志明,等.刺参体内外酵母菌组成及其拮抗活性的研究[J].大连海洋大学学报,2012,27(5):436-440.
[15] Liu Z M,Ma Y X,Yang Z P,et al.Immune responses and disease resistance of the juvenile sea cucumberApostichopusjaponicusinduced byMetschnikowiasp.C14[J].Aquaculture,2012,368:10-18.
[16] 巴尼特 J A,佩恩 R W,亚罗D.酵母菌的特征与鉴定手册[M].胡瑞卿,译.青岛:青岛海洋大学出版社,1991:29.
[17] 朱晓立,裘晖,邓毛程,等.红发夫酵母生产虾青素的培养基优化[J].食品与发酵工业,2008,32(2):61-64.
[18] 沈萍,陈向东.微生物学实验[M].北京:高等教育出版社,2007:51-55.
[19] 元福杰,王印庚,廖梅杰,等.一株刺参益生菌的发酵配方及其发酵条件优化[J].渔业现代化,2012,39(3):40-45.
[20] 杨莺莺,李卓佳,陈永青,等.益生菌D-1液体发酵工艺的研究[J].南方水产,2005(6):44-49.
[21] 张超.补料分批培养海洋红酵母的研究[J].四川轻化工学院学报,2000,13(2):26-30.
[22] 周鲜娇,田丽,梁如璞,等.一株海洋红酵母的鉴定及其培养基的优化[J].水产科学,2012,31(2):107-110.
[23] 梁晓华,杨莺莺,杨铿,等.海洋红酵母Y2发酵产类胡萝卜素条件的研究[J].中国微生态学杂志,2011,23(12):1068-1073.
[24] 童应凯,韦东胜,刘婷,等.海洋红酵母培养条件的研究[J].食品研究与开发,2006,27(8):75-79.
[25] 杨莺莺,陈永青,杨铿,等.海洋红酵母RH1菌株发酵培养条件的研究[J].南方水产科学,2012,8(1):67-74.
Abstract:A single factor experiment was carried out to optimize the culture medium containing soybean meal, corn flour and molasses for a probiotic strainMetschnikowiasp. C14,and then the fermentation conditions were optimized by orthogonal testL9(34) of four factors and three levels. The optimal culture medium was found to be consisted of soybean meal 70 g/L, corn flour 40 g/L, molasses 60 g/L, and pH 6.0. The optimum fermentation was observed under conditions of culture temperature of 25 ℃, shaking speed 180 r/min, inoculum volume 3%, and 25 mL medium in 250 mL Erlenmeyer flask, withMetschnikowiasp. C14 cell counts of 1.26×109cells/mL 28 h after culture, which was increased by 72.91%.
Key words:Metschnikowiasp. C14; medium; fermentation condition; optimization
DOI:10.3969/J.ISSN.2095-1388.2014.02.010
文章编号:2095-1388(2014)02-0151-05
收稿日期:2013-07-19
基金项目:国家“863”计划重大项目(2012AA10A412);大连海洋大学校级项目(017264)
中图分类号:Q939.5
文献标志码::A