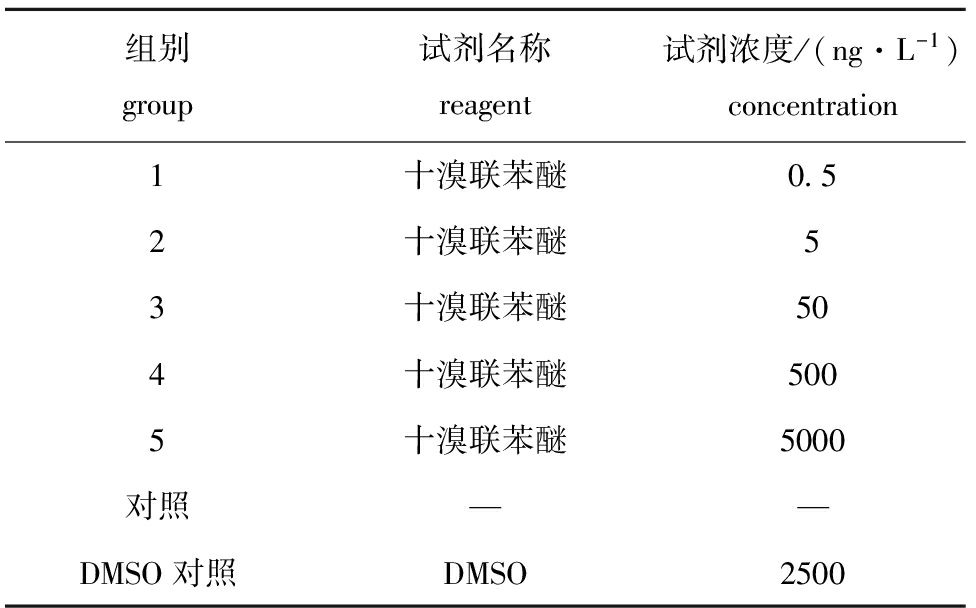
组别group试剂名称reagent试剂浓度/(ng·L-1)concentration1十溴联苯醚0 52十溴联苯醚53十溴联苯醚504十溴联苯醚5005十溴联苯醚5000对照——DMSO对照DMSO2500
摘要:通过扫描电镜和透射电镜观察,研究了不同浓度的十溴联苯醚对太平洋鳕Gadusmacrocephalus精子超微结构的影响。结果表明:与对照组相比,浓度为0.5、5、50、500 ng/L的十溴联苯醚对太平洋鳕精子的超微结构无显著影响,而浓度为5000 ng/L的十溴联苯醚对太平洋鳕精子的超微结构影响显著。扫描电镜下观察,在浓度为5000 ng/L 十溴联苯醚中暴露2 h和4 h时,太平洋鳕精子的形态与对照组相比无显著变化,8 h时精子细胞核表面出现白色结晶状变化,12 h时精子细胞核破裂。透射电镜下观察,在浓度为5000 ng/L十溴联苯醚中暴露2 h时,太平洋鳕精子的形态与对照组相比无显著变化,4 h时精子出现质膜膨胀,线粒体移位,8 h时出现质膜破裂,线粒体内嵴断裂,甚至溶解,基质变浅,呈空泡样改变,12 h时鞭毛大量脱落堆积,部分微管结构解体甚至消失,线粒体内嵴结构基本消失。研究表明,十溴联苯醚主要作用于精子细胞的质膜、线粒体和鞭毛上,其毒性主要表现为质膜破裂,线粒体空泡样改变,鞭毛大量脱落,轴丝微管结构解体等。
关键词:十溴联苯醚;太平洋鳕;精子;超微结构;扫描电镜;透射电镜
太平洋鳕GadusmacrocephalusTilesius俗名大头鳕,隶属于硬骨鱼纲Osteichthves、鳕形目Gadiformes、鳕科Gadidae、鳕属Gadus,是典型的冷水性鱼类,分布于太平洋北部沿岸海域,多栖息于大陆架和大陆斜坡上部水深10~550 m的海域中。中国的太平洋鳕主要产于黄海,一般栖息于水深为50~80 m的泥沙或软泥底质海区[1]。太平洋鳕是经济价值较高的鱼类之一,其肉质白细鲜嫩、清口不腻,呈蒜瓣状,是鳕科鱼类中的主要捕捞对象[1]。目前,国外已经形成了一套完整的大西洋鳕人工繁殖和养殖模式,太平洋鳕已成为北欧、北美等诸多国家新的重要养殖品种,养殖产量逐年增加[2-3]。太平洋鳕的人工育苗技术虽然在国外已经获得成功,但在中国尚未获得突破。国内对太平洋鳕的系统研究甚少[1,4-6],仅有少量关于其生物学的初步研究[7]。
多溴联苯醚(polybrominated diphenyl ethers,PBDEs)属于溴系阻燃剂的一种,被广泛应用于电子、电器、化工等领域中[8]。PBDEs具有一定的挥发性,可随大气长距离迁移,且亲脂性强、化学性质稳定,可随食物链生物富集和放大,是一种持久性有机污染物[9]。十溴联苯醚(BDE-209)是国内产量最大、最具代表性的高分子含溴阻燃剂[10-12]。目前,PBDEs对海洋环境的影响已成为环境科学领域的热点问题之一。中国对PBDEs的研究起步较晚,对PBDEs在环境中迁移转化的研究虽取得了一些成果,但对PBDEs的生物毒理研究才刚刚起步。
国内关于环境持久性有机污染物对鱼类毒性的研究主要集中在其对生物体本身的毒性作用以及对生物体遗传毒性方面,而有关其对鱼类精子影响方面的研究尚属空白。生物的精子活力、精子运动能力对受精率具有重要的影响[13-14]。而对于体外受精种类而言,研究持久性有机污染物对其精子形态、存活率等的影响,显得尤为重要。目前,对于PBDEs毒性研究的相关试验大多是单一的针对PBDEs在短周期、高剂量暴露下的生物效应的研究,而根据环境中存在的多溴联苯醚浓度设置试验浓度的相关研究却鲜有报道[15]。本试验中,根据环境中多溴联苯醚的含量进行不同试验浓度的设置,采用扫描电镜和透射电镜观察太平洋鳕精子的超微结构,研究不同浓度的十溴联苯醚对其结构产生的影响,旨在丰富太平洋鳕的相关生物学研究内容,为海水中十溴联苯醚安全含量的监测以及探究十溴联苯醚的毒性机制提供参考依据。
1.1材料
1.1.1 试验试剂 十溴联苯醚购自百灵威试剂公司,二甲基亚砜(DMSO)购自上海生工有限公司,其余试剂均购自沈联试剂公司。所有化学试剂均为分析纯。
1.1.2 精液来源 雄性太平洋鳕购自大连市黑石礁市场,2~4龄,体长为30~60 cm。选择体质健壮、无伤病的太平洋鳕作为试验对象,试验前暂养于大连海洋大学农业部北方海水增养殖重点实验室。取样时先用蒸馏水冲洗太平洋鳕泄殖腔,再用干毛巾将泄殖腔周围擦干,轻压腹部,收集精子。
1.2方法
1.2.1 试验设计 试验分为7组,即对照组、DMSO对照组和5个十溴联苯醚试验组,每组设3个平行,各组试剂浓度见表1。对照组采用自然海水。取适量太平洋鳕精子放于100 mL烧杯中(镜检精子密度为105个/mL,存活率>90%),进行暴露,并分别在暴露后2、4、8、12 h时取样,每次取1 mL精液,以2000 r/min离心10 min,去除上清液,然后沿管壁小心加入等体积2.5%(体积分数)的戊二醛固定,于冰箱(4 ℃)中保存备用。
表1试验各组十溴联苯醚和DMSO暴露浓度的设置
Tab.1TheconcentrationsofdecabromodiphenylethersandDMSOintheexperiment

组别group试剂名称reagent试剂浓度/(ng·L-1)concentration1十溴联苯醚0 52十溴联苯醚53十溴联苯醚504十溴联苯醚5005十溴联苯醚5000对照——DMSO对照DMSO2500
1.2.2 扫描电镜(SEM)样品的制备 用0.1 mol/L PBS洗涤精子3次,每次浸洗10~15 min,用梯度叔丁醇脱水处理,分两个阶段进行,第一阶段的叔丁醇分别为50%、70%、80%、90%、95%(体积分数),各级脱水处理10 min;第二阶段用纯叔丁醇脱水3次,每次10 min。将经脱水处理后的精子连带叔丁醇置于冰箱(4 ℃)中,待叔丁醇变为固态时,再将其转至真空抽滤瓶中进行真空干燥。将干燥的精子粘贴于有导电胶的金属样品台上,用离子喷涂仪在精子样品表面均匀镀一层能够导电的金膜,并置于扫描电镜下观察并拍照。
1.2.3 透射电镜(TEM)样品的制备 用体积分数为1%的锇酸双重固定,用梯度乙醇脱水、树脂包埋、AO超薄切片机切片,经醋酸铀和柠檬酸铅双染色,在JEOL 1200EX电镜下观察并拍照。
2.1太平洋鳕正常精子的形态
在电子显微镜下观察,对照组、DMSO对照组、0.5 ng/L浓度组、5 ng/L浓度组、50 ng/L浓度组和 500 ng/L浓度组的太平洋鳕精子超微结构大部分形态正常,结构基本完整(图1)。在扫描电镜下观察,正常精子细胞表面比较均匀、光滑,主要由头部、中段和尾部3部分组成(图1-A、B);在透射电镜下观察,精子质膜完整,细胞核连续,核染色质致密而均匀。
在扫描电镜下观察,精子头部呈卵圆形,长径为(2.334±0.044)μm,短径为(1.422±0.285)μm,主要结构是细胞核(图1-C)。在透射电镜下观察,细胞核染色质致密,由核膜包被,核前方无顶体,核后方有一植入窝,植入窝较深,为细胞核的1/2~3/4(图1-I)。
在透射电镜下观察,精子中段由中心粒复合体和袖套组成(图1-H)。中心粒复合体位于植入窝内,包括近端中心粒和远端中心粒(基体),近端中心粒位于植入窝的前端,由9组三联微管组成,基体位于植入窝后端,与近端中心粒呈“T”字形(图1-I、J)。袖套呈筒状,中央的腔即为袖套腔,袖套腔较狭窄(图1-E、I)。袖套中包括4~6个线粒体,呈不规则排列,线粒体的双膜层和内嵴均清晰可见,基质较疏松(图1-K、G)。
在透射电镜下观察,由基体发出的轴丝向后延伸并连同少量的细胞质构成精子的鞭毛, 此为精子的尾部。鞭毛长度为(28.078±3.573)μm,直径为(0.206±0.250)μm,鞭毛横切面略呈圆形,外由一层膜包围,内由轴丝和微管系统组成,微管结构为典型的“9+2”双联微管结构(图1-F)。尾部外表面有由质膜向两侧突出而形成的侧鳍(图1-D)。
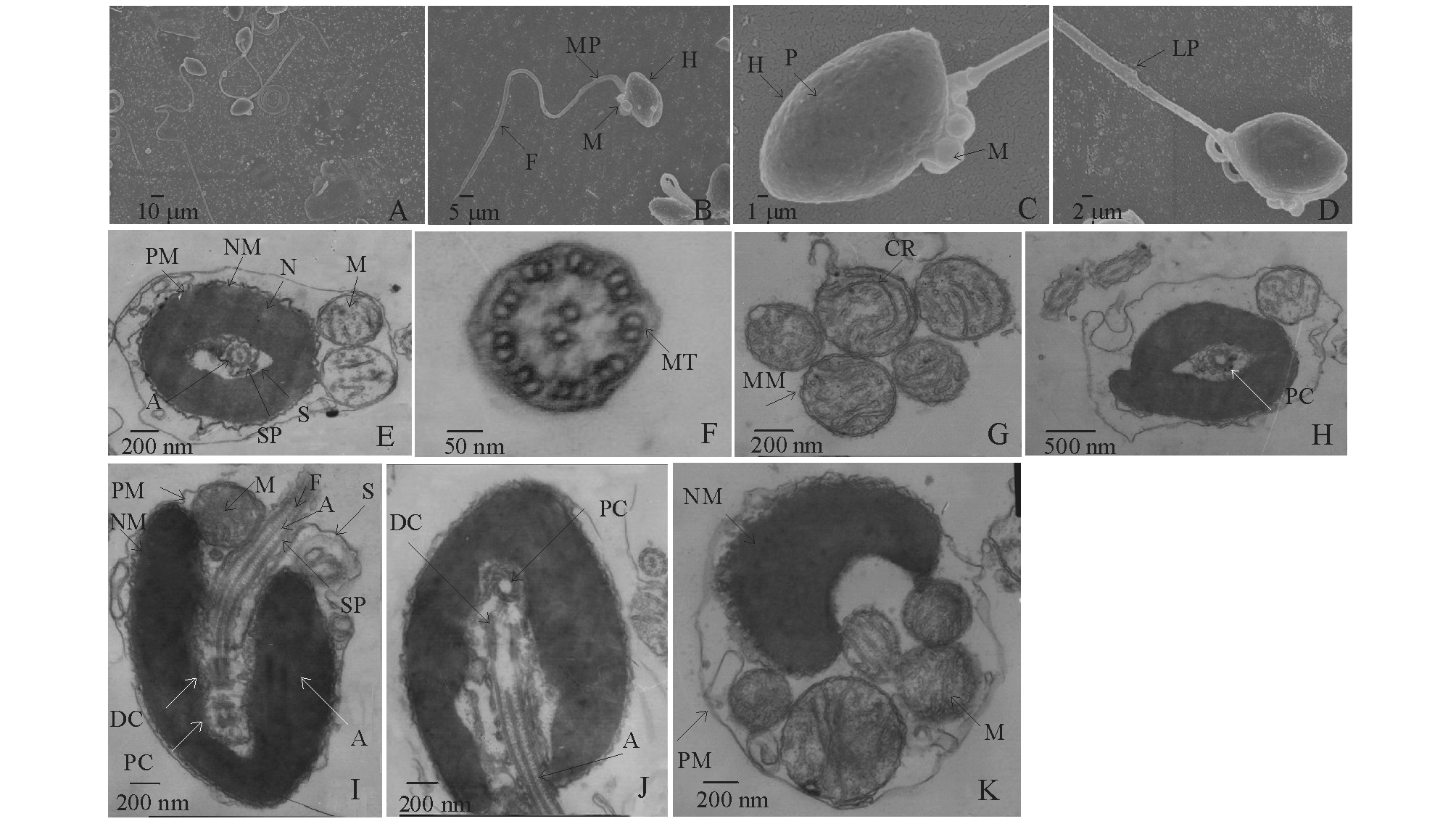
注:A 扫描电镜下精子全貌(×4000);B 扫描电镜下精子全貌,示头部、中段和尾部(×10 000);C 扫描电镜下精子头部和中段,示突起、线粒体(×40 000);D 扫描电镜下精子全貌,示侧鳍(×20 000);E 透射电镜下精子横切(×20 000);F 透射电镜下精子尾部横切,示轴丝“9+2”双联微管结构(×100 000);G 透射电镜下线粒体横切,示线粒体的双膜层和内嵴(×30 000); H 透射电镜下精子中段横切,示近端中心粒(×12 000); I 透射电镜下精子纵切(×25 000);J 透射电镜下精子头部和中段纵切,示近端中心粒9组三联微管、远端中心粒、轴丝(×20 000);K 透射电镜下精子横切,示质膜、核膜、线粒体(×30 000)
H示头部;MP示中段;F示鞭毛;LP示侧鳍;P示突起;M示线粒体;PM示质膜;NM示核膜;N示细胞核;PC示近端中心粒;DC示远端中心粒;S示袖套;SP示袖套腔;A示轴丝;MT示微管;MM示线粒体膜;CR示嵴;下同
Note:A,the appearance of spermtozoa under SEM(×4000);B,the appearance of spermtozoon under SEM, showing the head, mid-piece and tail(×10 000);C,the sperm head and the mid-piece under SEM,showing protuberance mitochondrion(×40 000);D,the appearance of spermtozoa under SEM,showing the lateral fin(×20 000);E,a cross section of spermatozoon under TEM(×20 000);F,a cross section of sperm tail under TEM,showing the “9+2” double microtubules of axoneme(×100 000);G,a cross section of mitochondrion under TEM,showing the double layer and the inner mitochondrial cristae(×30 000);H,a cross section of sperm mid-piece under TEM,showing proximal centriole(×12 000);I,longitudinal section of spermtozoon under TEM(×25 000);J,longitudinal section of sperm head and the mid-piece under TEM,showing nine triplet microtubules of proximal centriole, distal centriole and axoneme(×20 000);K, a cross section of spermtozoon under TEM,showing plasma membrane,nuclear membrane and mitochondrion(×30 000)
H,head;MP,mid-piece;F,flagellum;LP,lateral fin;P,protuberance;M,mitochondrion;PM,plasma membrane;NM,nuclear membrane;N,nucleus;PC,proximal centriole;DC,distal centriole;S,sleeve;SP,central space of sleeve;A,axonemule;MT,microtubule;MM,mitochondrial membrane; CR,cristae;et sequentia
图1 太平洋鳕正常精子的超微结构
Fig.1 Ultrastructure of nomal spermtozoa in Pacific cod Gadus macrocephalus Tilesius
2.2太平洋鳕异常精子的形态
暴露于高浓度十溴联苯醚(5000 ng/L)的太平洋鳕精子结构出现一些不同程度的异常,主要体现在精子质膜、细胞核、线粒体和鞭毛的变化上,其中暴露2 h时试验组的精子形态基本完整,4、8、12 h时试验组精子的形态发生不同程度的改变(图2)。
在扫描电镜下观察,暴露于高浓度十溴联苯醚(5000 ng/L)2 h和4 h时的精子形态基本完整,与对照组相比无显著变化;8 h时精子细胞核表面出现白色结晶状病变(图2-A);12 h时精子细胞核破裂、变形,线粒体减少,可见鞭毛断裂痕迹(图2-B)。在透射电镜下观察,暴露2 h时大多数精子形态与对照组相比无显著变化;4 h时偶有质膜膨胀表现,线粒体移位,其他结构均完整 (图2-C);8 h时出现精子质膜破裂,线粒体部分膜结构受损,内嵴断裂,甚至溶解,基质变浅,呈空泡样(图2-D、E),鞭毛偶有断裂;12 h时大多数精子质膜消失,鞭毛大量脱落、堆积(图2-F),部分微管结构解体,甚至消失(图2-H),线粒体内嵴结构基本消失(图2-G)。
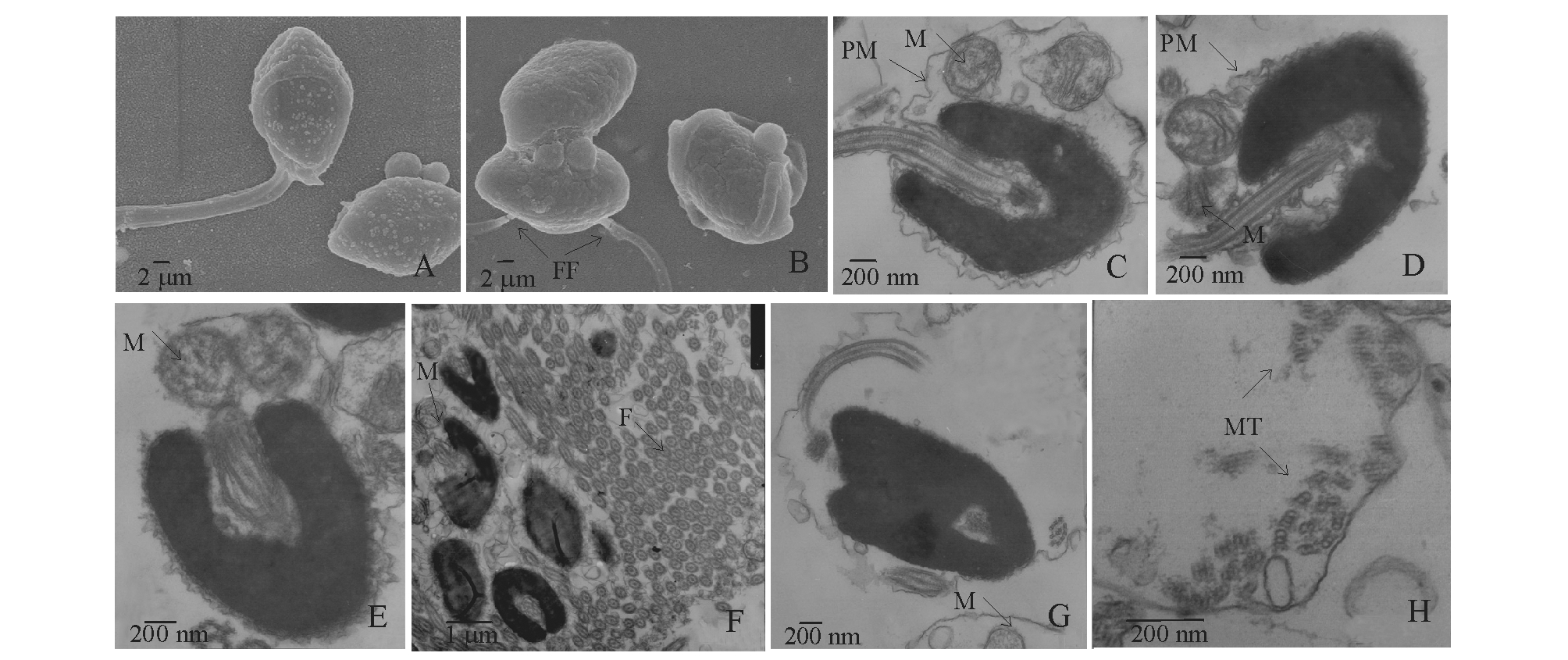
注:A 扫描电镜下,示暴露8 h时异常精子细胞核表面白色结晶状病变(×20 000);B 扫描电镜下,示12 h时异常精子细胞核断裂,亦可见鞭毛断裂处(FF)(×20 000);C 透射电镜下,示4 h时异常精子质膜膨大、线粒体移位(×20 000);D 透射电镜下,示8 h时异常精子质膜破裂,部分线粒体膜结构受损(×20 000);E 透射电镜下,示8 h时异常精子质膜破裂,线粒体内嵴断裂,甚至溶解,呈空泡样(×20 000);F 透射电镜下,示12 h时精子鞭毛大量脱落、堆积,线粒体内嵴结构基本消失(×7500);G 透射电镜下,示12 h时线粒体内嵴结构消失,呈空泡样(×20 000);H 透射电镜下,示12 h时轴丝的微管结构解体,甚至消失(×25 000)
Note:A,white crystalline lesions of abnormal sperm nucleus surface 8 hour after exposure under SEM(×20 000);B, broken nucleus and the fracture of flagellum(FF) of abnormal sperm 12 hour after exposure under SEM(×20 000);C,enlargement of the abnormal sperm plasma membrane and displacement of mitochondrion 4 hour after exposure under TEM(×20 000);D,the rupture of abnormal sperm plasma membrane and the structural damage to some mitochondrial membrane 8 hour after exposure under TEM(×20 000); E,the rupture of abnormal sperm plasma membrane and the fracture of mitochondrial cristae,even dissolved, showed vacuolar 8 hour after exposure under TEM(×20 000);F,shedding and accumulation of a large number of sperm flagellum and disappearance of structure of mitochondrial cristae 12 hour after exposure under TEM(×7500);G,complete disappearance of mitochondrial cristae,showing vacuolar 12 hour after exposure under TEM(×20 000);H,microtubules of axoneme being disintegration or even disappeared 12 hour after exposure under TEM(×25 000)
图2 高浓度组(5000 ng/L)太平洋鳕异常精子的超微结构
Fig.2 Ultrastructure of spermtozoa of Pacific cod Gadus macrocephalus exposed to 5000 ng/L decabromodiphenyl
3.1太平洋鳕精子超微结构的变化与功能的关系
本研究发现,高浓度(5000 ng/L)十溴联苯醚对太平洋鳕的质膜、细胞核、线粒体和鞭毛均有不同程度的损伤作用。暴露4 h时,高浓度组精子开始出现超微结构的改变,随着时间的延长,变化更为明显,如细胞质膜破裂,甚至消失,细胞核变形,线粒体空泡状等。
精子细胞膜的组成与一般细胞膜相似,由糖蛋白和磷脂组成,其中磷脂是精子细胞膜的稳定剂,磷脂的改变,对精子的代谢、获能、受精,以及药物毒性的渗入有重要意义[16-17]。本试验中,高浓度(5000 ng/L)十溴联苯醚即可损坏精子的细胞膜,破坏膜的完整性和稳定性,使毒物进入细胞内,从而破坏精子的内部结构,抑制精子的活动能力,甚至杀死精子,影响受精率。
线粒体是氧化磷酸化的主要部位,其中含有脱氢酶和三磷酸腺苷酶(ATP)[18]。精子运动的能量主要来自于线粒体,可见线粒体的完整性对于精子的活力至关重要。高浓度十溴联苯醚可使精子中段线粒体变形,嵴溶解,呈空泡样,从而使ATP酶的产生受阻,能源枯竭,进而严重影响精子的活力。本试验结果证明,有机污染物对精子活力影响的一个重要方面是来自于对线粒体的损害,影响供能,进而影响精子活力,这是研究持久性有机污染物对精子影响的一个重要突破。
鞭毛为精子的主要运动器官,精子尾部的摆动能使精子运动,而与尾部运动直接相关的是中央轴丝,即中央2对和外周9对微管结构。尾部的摆动是由每对二联微管之间的相对滑动引起的,二联微管上的纤毛蛋白臂中含有大量的ATP酶,可以水解ATP以供给能量[18]。本试验中,暴露于高浓度(5000 ng/L)十溴联苯醚中8 h和12 h时,太平洋鳕精子均出现鞭毛异常现象,12 h时鞭毛大量脱落,轴丝微管结构解体,甚至消失,从而使精子失去了运动能力。而12 h时精子的线粒体也基本萎缩,内嵴消失,失去了供能的能力。由此可认为,太平洋鳕精子在浓度为5000 ng/L的十溴联苯醚中暴露12 h时基本可以被完全杀死。
通过本试验结果可以推出十溴联苯醚对太平洋鳕精子的主要影响:(1)破坏精子质膜;(2)破坏线粒体内嵴结构;(3)破坏精子的鞭毛,损伤轴丝微管系统。
3.2十溴联苯醚的毒性及生态风险评价
多溴联苯醚是一类重要的溴代阻燃剂,含量从5%到30%不等[19],其中十溴联苯醚(PBDE-209)是中国国内产量最大的含溴阻燃剂[10-12]。目前,六溴联苯醚、七溴联苯醚、四溴联苯醚、五溴联苯醚已被列入禁用名单,其中四溴联苯醚的毒性最大。虽然十溴联苯醚毒性不如四溴联苯醚剧烈,但随着近些年来电子电器产业突飞猛进,十溴联苯醚作为高效的含溴阻燃剂在国内大量生产使用,电子废弃物等的大量排放造成环境污染日趋严重,因此,其在环境中的毒性累积作用也不容忽视。
研究表明,海洋、河口地区水中PBDE-209的质量浓度范围一般在0.05~65.20 ng/L[20-23]。本试验中根据此浓度范围设置5个浓度,即0.5、5、50、 500、5000 ng/L。试验结果表明,浓度为0.5、5、50、500 ng/L的十溴联苯醚对太平洋鳕精子超微结构无显著性影响,而浓度为5000 ng/L十溴联苯醚对太平洋鳕精子超微结构影响显著。由此可得出,当海洋中十溴联苯醚含量达到5000 ng/L时,即可以杀死大部分精子,影响海洋生物的受精,进而引起海洋中生物的减少,极有可能导致该物种的消亡。尽管目前环境中的十溴联苯醚浓度达不到5000 ng/L,但是在现实环境中,不仅只有一种污染物独立存在,而是几种污染物同时存在,同时起作用[22],众多的污染物势必会在达到某一个界限时引发精子的致畸和死亡。另一方面,人和动物暴露于PBDEs的主要途径是通过食物链的传递作用[24-25]。PBDEs属于非离子型化合物,其持久性强、水溶性低,与颗粒物具有很强的亲和性,易在沉积物和生物体内累积[26-27]。因此,PBDEs的累积作用也不容忽视,PBDEs在生物体内长久累积,当其达到一定的浓度值时,势必会引起对生物体的毒性作用,对于此方面的深入研究应给予足够的重视。而本试验中所研究的十溴联苯醚,也可与其他多溴联苯醚同系物之间,包括与其他污染物(如多氯联苯、多氯化萘等)之间形成多种环境污染物,其是否具有协同效应,目前还没有确切的报道。因此,上述环境持久性有机污染物的联合作用方式、作用部位,以及剂量-效应之间的关系等还有待进一步研究。
参考文献:
[1] 朱元鼎,成庆泰,郑葆珊.东海鱼类志[M].北京:科学出版社,1961:169-170.
[2] 高天翔,张肖荣,王丹,等.几种鳕鱼的生物学初步研究[J].海洋湖沼通报,2003(1):35-42.
[3] Cohen D M,Inada T,Iwamoto T,et al.Gadiform fishes of the world (Order Gadiformes).An annotated and illustrated catalogue of cods,hakes,grenadiers and other gadiform fishes known to data[J].FAO Fisheries Synopsis,1990,125(10):452.
[4] 远洋渔业技术经济信息研究课题组.远洋渔业技术经济手册[M].北京:海洋出版社,2002:24-39.
[5] 张春霖,成庆泰,郑葆珊,等.黄渤海鱼类调查报告[M].北京:科学出版社,1955:78-80.
[6] 沈汉祥,李善勋,唐小曼,等.远洋渔业[M].北京:海洋出版社,1987:285-295.
[7] 姜志强,张志明,赵翀,等.太平洋鳕性腺发育及营养来源的初步研究[J].大连海洋大学学报,2012,27(4):315-320.
[8] 刘汉霞,张庆华,江桂斌,等.多溴联苯醚及其环境问题[J].化学进展,2005,17(3):554-562.
[9] 魏爱雪,王学彤,徐晓白.环境中多溴联苯醚PDBEs类化合物污染研究[J].化学进展,2006,18(9):1227-1233.
[10] Patricia A F,Gregory M,Thomas C H,et al.Polybrominated diphenyl ethers(PBDES) in blubber of free-ranging bottlenose dolphins (Tursiopstruncatus) from two southeast Atlantic estuarine areas[J].Arch Environ Contam Toxicol,2007,53(3):483-494.
[11] Michele M S,Jennifer M K,Stefan L,et al.Certification of SRM 1589a PCBs,pesticides,PBDEs,and dioxins/furans in human serum[J].Analytical and Bioanalycal Chemistry,2007,389(4):1201-1208.
[12] Hu Xiao-zhong,Xu Ying,Hu De-cong,et al.Apoptosis induction on human hepatoma cells Hep G2 of decabrominated diphenyl ether(BDE-209)[J].Toxicology Letters,2007,171(1/2):19-28.
[13] Gage M J G,Macfarlane C P.Spermatozoal traits and sperm,competition in Atlantic salmon:relative sperm velocity is the primary determinant of fertilization success[J].Current Biology,2004,14:44-47.
[14] Bode M,Marshall D J.The quick and the dead? Sperm competition and sexual conflict in the sea[J].Evolution,2007,61:2693-2700.
[15] 齐彭德,陆光华,梁艳,等.多溴联苯醚的生物效应研究[J].环境科学与技术,2011,34(11):11-17.
[16] 张英姿,韩向阳,朱淑英,等.中药蛇床子对人类精子超微结构影响的研究[J].哈尔滨医科大学学报,1995,29(1):22-24.
[17] 张蕴晖,汪玉宝,李卫华,等.苯扎溴铵对人精子细胞超微结构的影响[J].环境与职业医学,2002,19(2):71-73.
[18] 王兰,堵南山,赖伟.长江华溪蟹精子发生过程中线粒体的超微结构研究[J].动物学报,1997,43(2):113-118.
[19] De Wit C A.An overview of brominated flame retardants in the environment[J].Chemosphere,2002,46(5):583-624.
[20] 管玉峰,涂秀云,吴宏梅.珠海入海口水体中多溴联苯醚及其来源分析[J].生态环境学报,2011,20(3):474-479.
[21] 唐学玺,柯可,王悠.多溴联苯醚在海洋环境中的分布及其对海洋生物的影响研究[J].海洋湖沼通报,2010(1):37-46.
[22] Wurl O,Lam P K S,Obbard J P.Occurrence and distribution of polybrominated diphenyl ethers (PBDEs) in the dissolved and suspended phases of the sea-surface microlayer and seawater in Hong Kong,China[J].Chemosphere,2006,65(9):1660-1666.
[23] 罗贤丽,刘丽华,晋艺聪.多溴联苯醚动物毒性综述[J].化学工程与装备,2010(1):131-134.
[24] Darnerud P O,Eriksen G S.Polybrominated diphenyl ethers:occurrence,dietary exposure,and toxicology[J].Environ Health Persp,2001,109:49-68.
[25] Bergman ,Nybom R,Carlsson H,et al.Flame retardants and plasticizers on particulate in the modern computerized indoor environment[J].Organohal Comp,1997,33:4l4-419.
,Nybom R,Carlsson H,et al.Flame retardants and plasticizers on particulate in the modern computerized indoor environment[J].Organohal Comp,1997,33:4l4-419.
[26] Meerts I A,Leteher R J,Hoving S,et al.In vitro estregenicity of polybrominated diphenyl ethers,hydroxylated PBDEs,and polybrominated bisphenol compounds[J].Environ Health Persp,2001,109(4):399-407.
[27] Sjödin A,Jones R S,Focant J F,et al.Retrospective time trend study of polybrominated diphenyl ether and polybrominated and polyehlorinated biphenyl levels in human serum from the United States[J].Environ Health Persp,2004,112(6):654-658.
Abstract:The effects of different concentrations of decabromodiphenyl ether on ultrastucture of sperm in Pacific codGadusmacrocephaluswere studied by scanning electron microscopy (SEM) and transmission electron microscopy (TEM).The results showed that there was no significant difference in ultrastructure of sperm between the Pacific cod in the control group and the Pacific cod exposed to 0.5, 5, 50, and 500 ng/L decabromodiphenyl ethers. However, the Pacific cod exposed to 5000 ng/L had the sperm with significant changes in the ultrastructure compared with the fish in the control group. The SEM revealed that white crystalline lesions on the sperm nucleus surface and ruptured nuclei were observed in sperm of the cod exposed to 5000 ng/L for 8 h and 12 h, even though there was no significant change in the ultrastructure of sperm in the Pacific cod exposed for 2 h and 4 h. Under the TEM, no significant change in the sperm morphology was found in the cod exposed to 5000 ng/L for 2 h compared with the fish in the control group. In 5000 ng/L 4 h exposure, however, the expansion of sperm plasma membrane and shifting of mitochondria were observed, and the ruptured plasma membrane, broken, even dissolved, mitochondrial cristae, and vacuolar shallow changes in the matrix were found in the cod exposed to 5000 ng/L for 8 h. The cod exposed to 5000 ng/L for 12 h had deciduous and accumulated flagella in abundance, some disintegrated microtubules and mitochondrial cristae, even disappearance. The findings indicated that the decabromodiphenyl ether led to damages in the plasma membrane, mitochondria and flagella of the sperm, including plasma membrane rupture, mitochondrial-vacuole like change, deciduous and accumulated flagella and disintegrated axoneme microtubules.
Key words:decabromodiphenyl ether;Gadusmacrocephalus; sperm; ultrastructure; scanning electron microscopy; transmission electron microscopy
DOI:10.3969/J.ISSN.2095-1388.2014.02.008
文章编号:2095-1388(2014)02-0141-06
收稿日期:2013-08-11
基金项目:国家自然科学基金资助项目(41101481);大连市科学技术基金资助项目(2011J21DW011);辽宁省大学生创新训练计划项目(201210158010)
中图分类号:S965.321
文献标志码::A