图1 试验海域及试验网箱示意图
Fig.1 The schematic diagram of sea area and net cages in the experimenta
摘要:研究了投喂不同饵料(微绿球藻Nannochloropsissp.、海洋红酵母Rhodomanasbenthica、孔石莼Ulvapertusa碎屑和海蒿子Sargassumpallidium碎屑)对刺参海上网箱育苗中各阶段浮游幼虫、稚参的存活率及其生长的影响,幼虫培育历时30 d,稚参培育试验共进行21 d。结果表明:在浮游幼体中后期,投喂微绿球藻的组幼虫存活率均显著高于投喂海洋红酵母的组和不投饵的对照组(P<0.05);在稚参培育21 d时,投喂海蒿子的组稚参存活率最高,为20.4%±0.2%,投喂孔石莼的组次之,存活率为19.9%±1.7%,但二者差异不显著(P>0.05),投喂微绿球藻与投喂海洋红酵母的组存活率无明显差异(P>0.05),存活率分别为13.6%±0.9%和13.9%±0.7%,而不投饵料的对照组存活率最低,仅为8.9%±0.8%;试验结束时,投喂海蒿子、孔石莼和海洋红酵母的组稚参的体长增长均较快,分别为(7.79±0.47)、(7.35±0.13)、(7.08±0.63)mm,显著高于微绿球藻组(5.08 mm±0.40 mm)和对照组(4.94 mm±0.23 mm)(P<0.05)。研究表明:相对于不投喂饵料,投喂适量饵料能够显著提高刺参海上网箱育苗幼体的存活率和生长率;浮游幼虫阶段,投喂微绿球藻较为适宜;附着变态后的稚参期,投喂海蒿子或孔石莼碎屑最佳。
关键词:刺参;网箱育苗;饵料;生长;存活率
随着刺参Apostichopusjaponicus养殖业的大规模发展,刺参海上网箱生态育苗在近几年取得了一定成果,初步探索出了从亲体促熟到幼体培养的养殖工艺流程[1-2]。刺参室内苗种生产阶段,海洋微藻(如盐藻Dunaleillasalina、湛江等鞭金藻Isochrysiszhanjiangensis、小新月菱形藻Nitzschiaclosterium、牟式角毛藻Chaetocerosmuelleri等)和酵母(如海洋红酵母Rhodotorulabenthica)是浮游幼体期的主要饵料,而底栖硅藻和人工配合饲料是稚参阶段的常用饵料[3]。然而,与刺参室内苗种生产相比,海上育苗的相关技术尚未成熟,特别是关于海上网箱育苗幼体培育过程中饵料选择的研究尚未见报道。
目前,刺参海上网箱育苗期间,浮游幼虫和稚参的摄食主要依靠海水中的天然饵料[4]。然而,天然海水中的饵料数量相对较少,从而限制了海上网箱育苗的苗种产量和质量。本研究中针对这一生产问题,主要探讨了微绿球藻Nannochloropsissp.、海洋红酵母Rhodomanasbenthica、孔石莼Ulvapertusa碎屑和海蒿子Sargassumpallidium碎屑4种饵料对刺参海上网箱育苗过程中浮游幼虫和稚参的投喂效果,旨在为刺参网箱生态育苗技术和相关产业的完善提供基础数据。
1.1材料
于刺参的自然繁殖季节(7月中旬,水温为18~20 ℃),在多落母海湾刺参养殖区采集性腺发育较好的种参用于试验。
试验海域为大连市长海县广鹿岛乡多落母海湾(北纬39°20′、东经122°39′),试验网箱为方形木质浮筏(规格为5 m×5 m),配合使用200目尼龙质网衣(规格为5 m×5 m×4 m)(图1);附着基为40目尼龙质网片(规格为0.5 m×0.3 m),用聚乙烯绳相互连接成一吊40个的网袋链,幼体附着期间,每个试验网箱放置100吊附着基。

图1 试验海域及试验网箱示意图
Fig.1 The schematic diagram of sea area and net cages in the experimenta
1.2方法
1.2.1 刺参的产卵与孵化 将采集的种参阴干处理30 min后,每个网箱放入90头种参。在随后的两日内,每隔8~12 h,用水生80-型采水器采集各网箱内的水样,观察刺参的产卵情况,将产卵后的种参及时从网箱移出。产卵后约48 h,卵发育为小耳状幼体,此时对各网箱内的幼体进行定量(用水生80-型采水器从4个样点进行采集,取其平均值为最终密度),根据定量结果,用200目拖网对各网箱的小耳状幼体进行分苗处理,使各网箱内小耳状幼体的密度达到约0.1 ind./mL。
1.2.2 幼体培育的饵料 本研究中的幼体(浮游幼虫和稚参)培育饵料为微绿球藻、海洋红酵母、孔石莼碎屑和海蒿子碎屑。微绿球藻在室温(17 ℃±3 ℃)下培养于海水中,营养盐使用Conway培养基[5],于指数增长期以4000 r/min下离心15 min,制成微绿球藻藻膏(密度约为2×1011cells/g)。大型海藻孔石莼和海蒿子于当地海域退潮时进行采集,在淡水中浸泡清洗10 min,以去除砂石、软体动物、甲壳动物和原生动物等,清洗后将海藻在100 ℃的自来水中煮1 min,以进一步杀灭微生物,同时有助于降解海藻细胞内的有毒代谢产物;将前处理后的海藻切成碎条,用超微粉碎机(FFL-400FJ)反复粉碎处理2~3次,以获得孔石莼和海蒿子的海藻碎屑悬浮液。微绿球藻藻膏、孔石莼碎屑悬浮液、海蒿子碎屑悬浮液和海洋红酵母悬浮液(购于蓬莱水产饲料公司)均于-20 ℃下保存,使用前置室温下解冻备用。
1.2.3 不同饵料对刺参浮游幼虫和稚参的投喂效果 刺参浮游幼体期,幼虫的饵料为微绿球藻和海洋红酵母,同时设定不投饵料的对照组;附着变态后,稚参的饵料选用微绿球藻、海洋红酵母、孔石莼碎屑和海蒿子碎屑,同样设定不投饵料的对照组。各饵料试验组均设置4个平行。
试验一:浮游幼体期,每天早晚各投饵1次,试验网箱内的微绿球藻和海洋红酵母的投喂量为10~12 μg/mL(湿质量,测定方法参照文献[6]);每天对各网箱内幼体的密度进行测定,以计算各主要幼体发育期(小耳幼体、中耳幼体、大耳幼体、樽形幼体和五触手幼体)幼虫的存活率,饵料投喂及取样观察持续至浮游幼体完全附着变态后停止,在自然海域此阶段约历时30 d。
试验二:在试验一进行阶段,同时期另设20个网箱,其中16个网箱早晚只投喂微绿球藻,投喂量为10~12 μg/mL;剩余4个网箱作为不投饵料的对照组。当各网箱内幼虫附着变态成稚参后,即刻增加饵料种类,开始喂食微绿球藻、海洋红酵母、孔石莼碎屑和海蒿子碎屑,早晚各投喂一次,饵料投喂量均为20~24 μg/mL。每隔7天对各网箱内的稚参存活率及生长率进行取样计算,取样时在每个网箱的不同位置随机抽取4~5个网片,将网片上附着的稚参用细毛刷轻轻刷入解剖盘内,进行定量分析,同时在定量样品中随机选取20~30只稚参,置于显微镜下(100 ×)测定体长。试验进行21 d后停止,此时受气候及水温的影响,网箱内的稚参均需要转移到海底进行避风及越冬。
1.3数据处理
不同饵料对刺参各时期浮游幼虫的存活率以及稚参的存活率和生长率的试验结果用SPSS 12.0软件进行单因素方差分析(One-way ANOVA),当差异显著时用Bonferroni法进行多重比较。统计分析时,以百分数形式表示的数据进行反正弦(arcsin)转换。
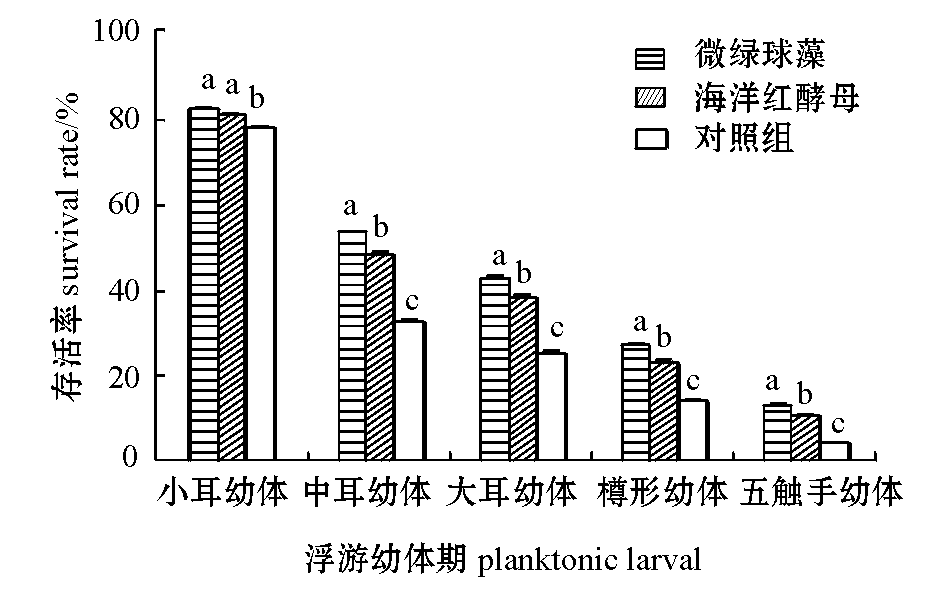
2.1不同饵料对浮游幼虫存活率的影响
投喂不同饵料对刺参各阶段浮游幼虫的存活率有显著影响(P<0.05)。从图2可见:小耳幼体期,投喂微绿球藻和海洋红酵母的组幼虫的存活率均最高,分别为82.6%±0.5%、81.0%±0.5%,两组间无显著性差异(P>0.05),但均显著高于不投饵的对照组(P<0.05);中耳幼体期、大耳幼体期、樽行幼体期和五触手幼体期,幼虫的存活率均为微绿球藻组>海洋红酵母组>对照组,且两两之间存在显著性差异(P<0.05)。
注:标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters are significant differences at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
图2 不同饵料对浮游幼虫存活率的影响
Fig.2 Survival of planktonic larvae of sea cucumber Apostichopus japonicus fed different diets
2.2不同饵料对稚参存活率的影响
投喂不同饵料对稚参存活率有显著影响(P<0.05)。从图3可见:稚参附着7 d和14 d后,投喂海蒿子的组存活率均最高,分别为80.1%±0.8%、62.7%±1.1%,显著高于其他各组(P<0.05),投喂孔石莼、微绿球藻的组稚参存活率次之,不投饵的对照组最低(P<0.05);稚参附着21 d后,投喂海蒿子的组稚参存活率最高,为20.4%±0.2%,投喂孔石莼的组次之,存活率为19.9%±1.7%,二者无显著性差异(P>0.05),但均显著高于其他各组(P<0.05),投喂微绿球藻和海洋红酵母的组存活率无明显差异(P>0.05),存活率分别为13.6%±0.9%和13.9%±0.7%,而不投饵的对照组存活率最低,仅为8.9%±0.8%。
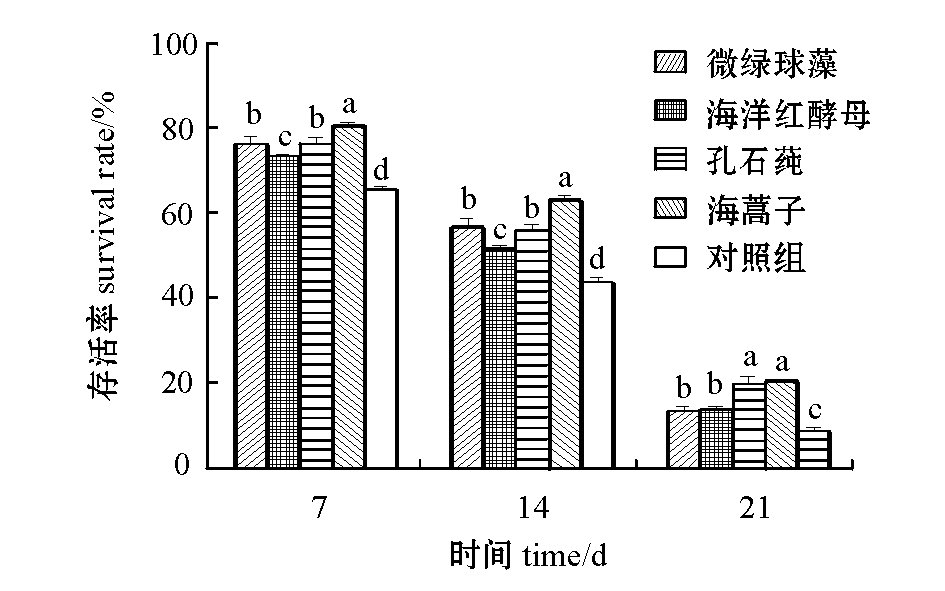
图3 不同饵料对稚参存活率的影响
Fig.3 Survival of juvenile sea cucumber Apostichopus japonicus fed different diets
2.3不同饵料对稚参生长的影响
投喂不同饵料对稚参生长有显著影响(P<0.05)。从图4可见:稚参在培育7、14、21 d 时,投喂海蒿子、孔石莼和海洋红酵母的组稚参的体长均为最大,3组间无显著性差异(P>0.05),但均显著高于投喂微绿球藻的组和对照组(P<0.05);试验结束时,投喂海蒿子、孔石莼、海洋红酵母、微绿球藻的各组和对照组稚参的体长分别为(7.79±0.47)、(7.35±0.13)、(7.08±0.63)、(5.08±0.40)、(4.94±0.23)mm。

图4 不同饵料对稚参体长的影响
Fig.4 Body length of juvenile sea cucumber Apostichopus japonicus fed different diets
与刺参室内人工育苗相比,由于刺参海上网箱育苗人为干预因素少,不用药,具有育苗成本低、苗体健壮、对环境适应能力强、苗种成活率高等特点[2]。无论刺参室内人工育苗还是海上网箱育苗,饵料投喂都是影响刺参苗种培育的关键[7]。关于不同饵料对稚参生长和存活的影响已有大量研究[7-8],王吉桥等[9]研究表明,相对于舟形藻和双肋藻,圆筛藻能够更有效地提高刺参的附着率,投喂混合硅藻的刺参,其附着率也显著高于投喂单一硅藻的刺参。此外,利用鼠尾藻、酵母和配合饵料混合投喂稚参和幼参时发现,稚参、幼参的成活率与配合饲料的添加量呈正相关,培育期稚参的生长速度随投喂量的增加而加快[10]。朱建新等[11]的研究结果同样支持以上观点,即投喂用蛋白酶处理的浒苔能显著提高刺参幼体的生长率。此外,将单胞藻与海洋红酵母以适当比例混合投喂,同样能显著提高刺参幼虫的体长日增长率,单独投喂海洋红酵母的刺参,其变态率和成活率也显著高于单独投喂单胞藻[12]。
目前,刺参网箱育苗阶段通常不进行饵料投喂,仅依靠海水中的天然饵料供给浮游幼虫和稚参的摄食,这可能是导致幼体发育慢、单位水体产量低的主要原因。Sun等[13]的研究结果表明,在低密度饵料条件下,刺参浮游幼虫生长延迟且存活率降低。本研究结果与该结果相似,投喂微绿球藻时刺参浮游幼虫存活率最高,投喂海洋红酵母时次之,而不投饵的对照组存活率最低。微绿球藻细胞内富含蛋白质和高不饱和脂肪酸,为刺参浮游幼虫的发育提供了稳定的营养供给,具有较好的饵料效果(图2)。目前,微绿球藻已广泛应用于蟹、虾等的育苗及轮虫的高密度培养中[14-19]。与微绿球藻相比较,海洋红酵母含有一定量的粗蛋白质,但缺少水产动物生长所必需的多不饱和脂肪酸(EPA和DHA)[20]。因此,相对于海洋红酵母,微绿球藻更适宜作为刺参浮游幼虫培育的饵料。
本研究中,稚参培育阶段,投喂大型海藻海蒿子和孔石莼碎屑时稚参的存活率最高,投喂微绿球藻和海洋红酵母时存活率次之,不投饵时存活率最差;同样,投喂海蒿子和孔石莼时,稚参体长的增长显著快于投喂微绿球藻的组和对照组。尽管微绿球藻和海洋红酵母是刺参浮游幼虫期生长的合适饵料,但两者并不是稚参生长的最适合饵料,这是由于不同发育时期的刺参个体对饵料选择和营养需求不同而造成的[21-23]。首先,与微绿球藻与海洋红酵母相比,海藻碎屑在水体中悬浮性较弱,容易在短时间内散落到附着基(网片)的表面,这就增加了稚参对食物的利用效率。其次,与海蒿子和孔石莼相比较,海洋红酵母缺少高不饱和脂肪酸(EPA和DHA)[24],而微绿球藻虽然有很高含量的EPA,但缺乏DHA[6,25];与前两者相比,海蒿子和孔石莼的蛋白质和高度不饱和脂肪酸含量更高一些[26],这就保证了稚参生长和发育阶段营养物质的供给。目前,大型海藻在水产动物饵料上的应用已取得了很好的效果,其中尤以石莼的饵料效果最佳。Yin等[6]利用孔石莼、裙带菜、角叉菜和微绿球藻投喂褶皱臂尾轮虫Brachionusplicatilis,结果发现,用孔石莼投喂的轮虫营养价值显著高于用微绿球藻投喂的,用孔石莼投喂时,轮虫的DHA/EPA是用微绿球藻投喂的6.9倍。此外,Xia等[27]和Liu等[28]根据刺参饵料现状,采用不同大型海藻(鼠尾藻、匍枝马尾藻、大叶藻、石莼、海带和煮熟的海带)投喂刺参,结果表明,用石莼投喂的刺参增长率和摄食率均优于用鼠尾藻和匍枝马尾藻投喂的。这些研究结果与本试验研究结果较一致。
综上所述,在刺参海上网箱育苗期间,适量投喂饵料可以显著提高苗种的产量和质量。本研究中,投喂饵料组的刺参浮游幼虫和幼体的变态、发育、生长都优于不投喂饵料组,其中微绿球藻是刺参浮游幼虫阶段的最适宜饵料,孔石莼和海蒿子是稚参的最适宜饵料。有关刺参海上网箱育苗相关技术的完善及混合饵料投喂效果将是笔者进一步研究的重点。
参考文献:
[1] 李明.刺参海上网箱人工育苗在山东威海首获成功[J].河北渔业,2005(6):53.
[2] 马跃华.刺参海上网箱生态育苗生产研究[J].河北渔业,2006(6):32-33.
[3] 袁成玉.海参饲料研究的现状与发展方向[J].水产科学,2005,12:54-56.
[4] 迟庆红,丛莉.刺参自然海域生态育苗技术[J].中国水产,2012(4):74.
[5] Louren O S O,Marquez U M L,Mancini-Filho J,et al.Changes in biochemical profile ofTetraselmisgracilis:I.Comparison of two culture media[J].Aquaculture,1997,148:153-168.
[6] Yin X W,Min W W,Lin H J,et al.Population dynamics,protein content,and lipid composition ofBrachionusplicatilisfed artificial macroalgal detritus andNannochloropsissp.diets[J].Aquaculture,2013,380/383:62-69.
[7] 常亚青,于金海,孙丕海,等.刺参育苗及养殖技术(上)[J].科学养鱼,2006(11):16-18.
[8] 王吉桥,樊莹莹,徐振祥,等.饲料中β-胡萝卜素和虾青素添加量对仿刺参幼参生长及抗氧化能力的影响[J].大连海洋大学学报,2012,27(3):215-220.
[9] 王吉桥,丛文虎,姜玉声,等.底栖硅藻种类和密度对刺参幼体和稚参生长与成活的影响[J].大连海洋大学学报,2010,25(3):203-209.
[10] 王吉桥,隋晓楠,顾公明,等.不同饲料搭配及投喂量对刺参稚、幼参生长和成活的影响[J].水产科学,2008,27(2):55-58.
[11] 朱建新,曲克明,李健,等.不同处理方法对浒苔饲喂稚幼参效果的影响[J].渔业科学进展,2009,30(5):108-112.
[12] 张萍萍,李琪,孔令锋,等.四种单胞藻和海洋红酵母对刺参浮游幼虫生长与变态成活的影响[J].中国海洋大学学报:自然科学版,2011,41(10):30-34.
[13] Sun X J,Li Q.The effect of food availability on development and phenotypic plasticity in larvae of the sea cucumber (Apostichopusjaponicus)[J/OL].Invertebrate Reproduction and Development,2013(Published Online).
[14] 沈和定,黄旭雄.三种藻类对中华绒螯蟹Ι期溞状幼体培育效果的比较[J].上海水产大学学报,1999,8(3):202-209.
[15] 成文靖,蔡春芳.微绿球藻在罗氏沼虾育苗中的应用研究[J].水利渔业,2002,22(1):15-16.
[16] 刘新富,雷霁霖,刘忠强,等.真鲷饵料生物褶皱臂尾轮虫和眼点拟微绿球藻的大量培养[J].海洋科学,2002,24(5):47-51.
[17] Lubzens E,Gibson O,Zmora O,et al.Potential advantages of frozen algae (Nannochloropsissp.) for rotifer (Brachionusplicatilis) culture [J].Aquaculture,1995,133:295-309.
[18] Chebil L,Yamasaki S.Improvement of a rotifer ecosystem culture to promote recycling marine microalga,Nannochloropsissp.[J].Aquacultural Engineering,1998,17:1-10.
[19] Rebolloso-Fuentes M M,Navarro-Pérez A,García-Camacho F,et al.Biomass nutrient profiles of the microalgaNannochloropsis[J].Journal of Agriculture and Food Chemistry,2001,49(6):2966-2972.
[20] 杨世平,吴灶和,简纪常.一株海洋红酵母的营养组分分析[J].饲料工业,2011,32(10):52-54.
[21] Yanagisawa T.Aspects of the biology and culture of the sea cucumber[J].Tropical Mariculture,1998,45:291-308.
[22] Seo J Y,Shin I S,Lee S M.Effect of dietary inclusion of various plant ingredients as an alternative forSargassumthunbergiion growth and body composition of juvenile sea cucumberApostichopusjaponicus[J].Aquaculture Nutrition,2011,17:549-556.
[23] 朱建新,刘慧,冷凯良,等.几种常用饵料对稚幼参生长影响的初步研究[J].海洋水产研究,2007,28(5):48-53.
[24] Seo J Y,Lee S M.Optimum dietary protein and lipid levels for growth of juvenile sea cucumberApostichopusjaponicus[J].Aquaculture Nutrition,2011,17:56-61.
[25] 蒋霞敏,郑亦周.14种微藻总脂含量和脂肪酸组成研究[J].水生生物学报,2003,27(3):243-247.
[26] 纪明候.海藻化学[M].北京:科学出版社,1997.
[27] Xia S D,Yang H S,Li Y,et al.Effects of different seaweed diets on growth,digestibility,and ammonia-nitrogen production of the sea cucumberApostichopusjaponicus(Selenka)[J].Aquaculture,2012,338/341:304-308.
[28] Liu Y,Dong S L,Tian X L,et al.The effect of different macroalgae on the growth of sea cucumber (ApostichopusjaponicusSelenka)[J].Aquaculture Research,2010,41:881-885.
Abstract:The effects of different diets (algaNannochloropsissp., yeastRhodotorulabenthica, sea lettuceUlvapertusadetritusand sea weedSargassumpallidiumdetritus) on survival and growth of larval and juvenile sea cucumberApostichopusjaponicuswere studied in marine net cages for 30 d for the larvae and 21 d for the juveniles. The results showed that the later larvae fed the alga had significantly higher survival and growth than those fed the yeast (P<0.05), both being significantly higher than the larvae in the control group(unfeeding) (P<0.05). In 21 day rearing period, the maximal survival rate (20.4%±0.2%) was observed in the juveniles fed the sea weed, followed by the juveniles fed the sea lettuce(19.9%±1.7%),without significant difference (P>0.05). There were no significant differences in the juveniles fed the yeast (13.9%±0.7%) and the alga (13.6%±0.9%), with the minimal survival in the control group(8.9%±0.8%). At the end of the experiment, the juveniles fed the sea weed(7.79±0.47) mm, sea lettuce(7.35±0.13) mm, and yeast (7.08±0.63) mm showed higher growth in body length than those fed the alga (5.08±0.40) mm and in the control group(4.94±0.23)mm, without significant difference (P>0.05). Compared with the unfeeding traditional culture methods in the marine net cage, the growth and survival of larval and juvenile sea cucumber were improved greatly by feeding at an optimal rate and types, including the larvae fedNannochloropsissp., and the metamorphosed juveniles fed sea weed detritus.
Key words:Apostichopusjaponicus; net cage seedling; diet; growth; survival rate
DOI:10.3969/J.ISSN.2095-1388.2014.02.005
文章编号:2095-1388(2014)02-0126-05
收稿日期:2013-06-23
基金项目:科技部“十二五”支撑计划(2011BAD13B03);辽宁省高等学校优秀人才支持计划项目(LJQ2011079);大连市科学技术基金资助项目(2012J21DW013)
中图分类号:S968.9
文献标志码::A