表1亲蟹交配设计表
Tab.1Matingdesignofbroodstockcrab

家系类别category交配组合matingcombination子一代标记firstfilialgenerationdesign自交家系inbredlinesA(1♂)×A(3♀)B(1♂)×B(3♀)F66F33杂交家系hybridizationA(1♂)×B(3♀)B(1♂)×A(3♀)F63F36
摘要:为培育三疣梭子蟹Portunustrituberculatus新品系,选择差异较大的两代自交家系进行家系内自繁和家系间杂交的试验,建立了三疣梭子蟹近交系和杂交系,并比较了其繁殖性能和子一代早期生长与存活的情况。三疣梭子蟹A家系为自交F6,B家系为自交F3,均为基因纯化程度不同的两个家系,试验设计自交组F66(A♀×A♂)、F33(B♀×B♂)和杂交组F63(A♀×B♂)、F36(B♀×A♂)4个试验组。繁殖试验结果表明,两个自交组亲蟹的抱卵量、排幼量和单位体质量抱卵量均比两个杂交组大,且均显著高于F63组(P<0.05),而自交组的单位体质量排幼量和孵化率也均比杂交组大,但无显著性差异(P>0.05),表明在繁殖性能上,杂交组并未表现出杂种优势。幼蟹的早期生长和存活试验结果表明,杂交使Ⅱ期幼蟹至Ⅴ期幼蟹的生长和存活两个表型性状都得到了改良,杂交组(F63和F36)在早期生长阶段相对于自交组(F66和F33),体质量的总体杂种优势率为14.38%~25.05%,全甲宽的总体杂种优势率为5.57%~10.27%,体质量和全甲宽的增长速度各组均为F63>F66>F36>F33,其中F36组相对于F33组各表型性状的杂种优势均明显大于F63组相对于F66组的杂种优势;杂交组存活的总体杂种优势率为22.49%~36.67%,其中F63组相对于F66组存活的杂种优势明显大于F36相对于F33组的杂种优势。研究表明,三疣梭子蟹杂交组在繁殖性能方面虽未表现出杂种优势,但在早期生长和存活方面表现出了显著的杂种优势,这可为进一步开展三疣梭子蟹选育工作提供参考依据。
关键词:三疣梭子蟹;杂交;自交;繁殖;生长
三疣梭子蟹Portunustrituberculatus是中国重要的渔业资源,主要分布于中国、朝鲜、日本等海域[1-2],1981年以来已被列为中国主要的海洋水产养殖品种之一[3]。近年来,随着梭子蟹养殖规模的不断扩大,各种病害给产业和区域经济的发展造成了重大损失[4],为满足水产养殖的需要,越来越多的苗种将由人工蓄养的亲本群体提供,在苗种生产过程中,由于捕获的亲本数量有限,群体内近交不可避免[5],加之累代养殖所造成的种质退化、遗传多样性降低的可能性大大增加。因此,对三疣梭子蟹进行遗传改良,培育出优质新品系,可为三疣梭子蟹养殖业健康、可持续发展提供重要的保证。杂交是水产生物育种的重要途径之一,已经在水产生物的品种改良和生产中发挥了重要的作用[6]。
杂交是通过利用杂种优势或为育种制备中间材料而改良动植物的遗传特性[7],杂交产生的杂种优势或杂种活力能迅速和显著地提高杂种的产量和生活力[8-10]。目前,对水产动物杂交育种的研究较多[11-20]。本研究中,以黄海水产研究所种质资源与工程育种实验室2005年收集的莱州湾海区、鸭绿江口海区、海州湾海区和舟山海区4个不同的三疣梭子蟹地理群体作为基础群体,利用人工定向交尾技术,建立了全同胞自交家系,选择差异较大的两代自交家系进行家系内自交和家系间杂交,以研究自交家系和杂交家系的繁殖性能及其子代早期生长与存活等方面的杂种优势,为其种质改良、培育新品种提供科学依据。
1.1材料
试验于2012年3月—6月在山东省潍坊市昌邑海丰水产养殖有限责任公司进行。根据2011年自交家系研究结果,选择差异较大的自交家系A家系(F6)和B家系(F3),于2011年9月建立A家系与B家系的双列杂交组合,分别为自交组F66(A♀×A♂)、F33(B♀×B♂)和杂交组F63(A♀×B♂)、F36(B♀×A♂)4个试验组。
1.2方法
1.2.1 亲蟹的交配设计 亲蟹的交配设计如表1所示,每种交配组合均设4个平行。
表1亲蟹交配设计表
Tab.1Matingdesignofbroodstockcrab

家系类别category交配组合matingcombination子一代标记firstfilialgenerationdesign自交家系inbredlinesA(1♂)×A(3♀)B(1♂)×B(3♀)F66F33杂交家系hybridizationA(1♂)×B(3♀)B(1♂)×A(3♀)F63F36
1.2.2 试验设计与养殖管理
(1)亲蟹越冬阶段。亲蟹于2011年9月在室内设计定向交尾后,于底面积为30~40 m2水深为0.8~1.2 m的室内水泥池中越冬,池底铺10~15 cm细沙,亲蟹入池前用二溴海因进行体表消毒,越冬温度控制在8~10 ℃。越冬期间,亲蟹密度控制在每5~8只/m2,池水的溶氧不低于5 mg/L, pH为7.8~8.6,盐度为28~32,光照强度控制在500 lx以下。
(2)育苗阶段。亲蟹排幼前转至底面积为8 m2水深为1.5 m的室内单独育苗池中,幼体投喂褶皱臂尾轮虫Brachinonusplicatilis、卤虫Brineshrimp,每天换水10%,连续充气培养。
(3)早期生长阶段。当各家系的幼体达到Ⅱ期幼蟹出苗时,从每个家系随机挑选出150尾幼蟹,平均放入3个150 L的育苗桶中(即3个平行),以卤虫为饵料,每天换水20%,连续充气培养。
1.2.3 亲蟹形态学指标的测量 观察越冬亲蟹的卵块发育情况,选定亲蟹,用游标卡尺测定其全甲宽、甲宽、甲长、体高(精确到0.1 mm)等形态学指标,根据观测到的卵块发育颜色和镜检卵膜内幼体每分钟的心跳次数,确定亲蟹放入单独育苗池的时间和预估亲蟹的排幼时间。
1.2.4 杂种优势 杂交子代在生长、成活、繁殖能力或生产性能等方面可能优于亲本的一方或者优于双亲的均值。
杂交子代杂种优势率的计算参照文献[9,18]中的方法,计算公式为
![]() ,
,
(1)
![]() ,
,
(2)
![]() 。
。
(3)
其中:H为A、B两个自交家系总的杂种优势;H(A)、H(B)分别为A自交家系和B自交家系各自的杂种优势;F66、F33、F63、F36分别为4个试验组的不同表型值。
1.2.5 繁殖力
(1)抱卵量。用电子天平称量产卵前和产卵后亲蟹的质量,记为m1和m2(精确到0.1 g);称量刚产出的卵0.1 g,置于解剖镜下计数,平行测量两次,取其平均值即为卵密度(粒/g)。抱卵量按下式进行估计:
抱卵量=(m1-m2)×卵密度。
(2)排幼量。用显微镜观察亲蟹卵膜内幼体的心跳次数,在其排幼前10 h左右将亲蟹用箱笼放入底面积为8 m2水深为1.5 m的单独育苗池中,排幼后6 h,在育苗池均匀设置6个采样点,分别用500 mL烧杯取400 mL水样,统计每个点的Z1幼体个数,取6点的平均值,再根据育苗池水体的体积计算亲蟹的排幼量。
(3)孵化率。亲蟹在育苗池中排出的Z1幼体数占总抱卵量的百分比即为亲蟹的孵化率。
(4)变态率。使用电子显微镜实时监测幼体的发育状态,参考三疣梭子蟹各发育阶段的时间设置数据采集时间点,以各阶段首次观测到幼体变态后6 h为测量时间点,于变态发育的每个阶段在育苗池中均匀设6个采样点,用500 mL烧杯取400 mL水样,统计Z1、Z4幼体数量,取6点的平均值,记为SZ1和SZ4;在每个家系试验组出苗时,从各家系取100只Ⅱ期幼蟹,称量质量记为m,每个家系所出全部蟹苗的质量记为N,根据N/(m/100)计算出苗的Ⅱ期幼蟹总的个体数,记为SⅡ期,并计算各个阶段的变态率:
Z1至Z4阶段的变态率=SZ4/SZ1×100%;
Z4至Ⅱ期幼蟹的变态率=SⅡ期/SZ4×100%。
1.2.6 子代的早期生长与存活 在每个家系试验组出苗时,各取150尾Ⅱ期幼蟹,分3个平行组(每个平行放50只)饲养于150 L的白色塑料桶中,培育同常规方法,每个家系每个阶段的培育条件一致。入桶前每个家系用游标卡尺测量其全甲宽,用电子天平称量其体质量;以后每天观察,分别在Ⅲ期、Ⅳ期、Ⅴ期时测量幼体的全甲宽和体质量,记录存活数。
在幼体生长阶段,每天观察每个试验组幼体的生长情况,捞取死亡幼体,每两天从各试验组的每个平行中随机取样10只,每个家系共取样30只,测量其体质量和全甲宽,观察变态发育情况,利用回归方程求出日增长量,同时记录各个试验组的存活数,计算各组的存活率。
1.3数据处理
采用SPSS 17.0软件对获得的各个家系各形态性状表型参数的平均值、标准差和变异系数进行统计分析,利用单因素方差分析(One-Way ANOVA)进行显著性检验,用LSD法进行多重比较。
2.1试验亲蟹的形态学指标
4组试验亲蟹的形态学指标测量结果见表2。
表2试验亲蟹的形态学指标
Tab.2Themorphologicalparametersofbroodstockcrabduringtheexperiment
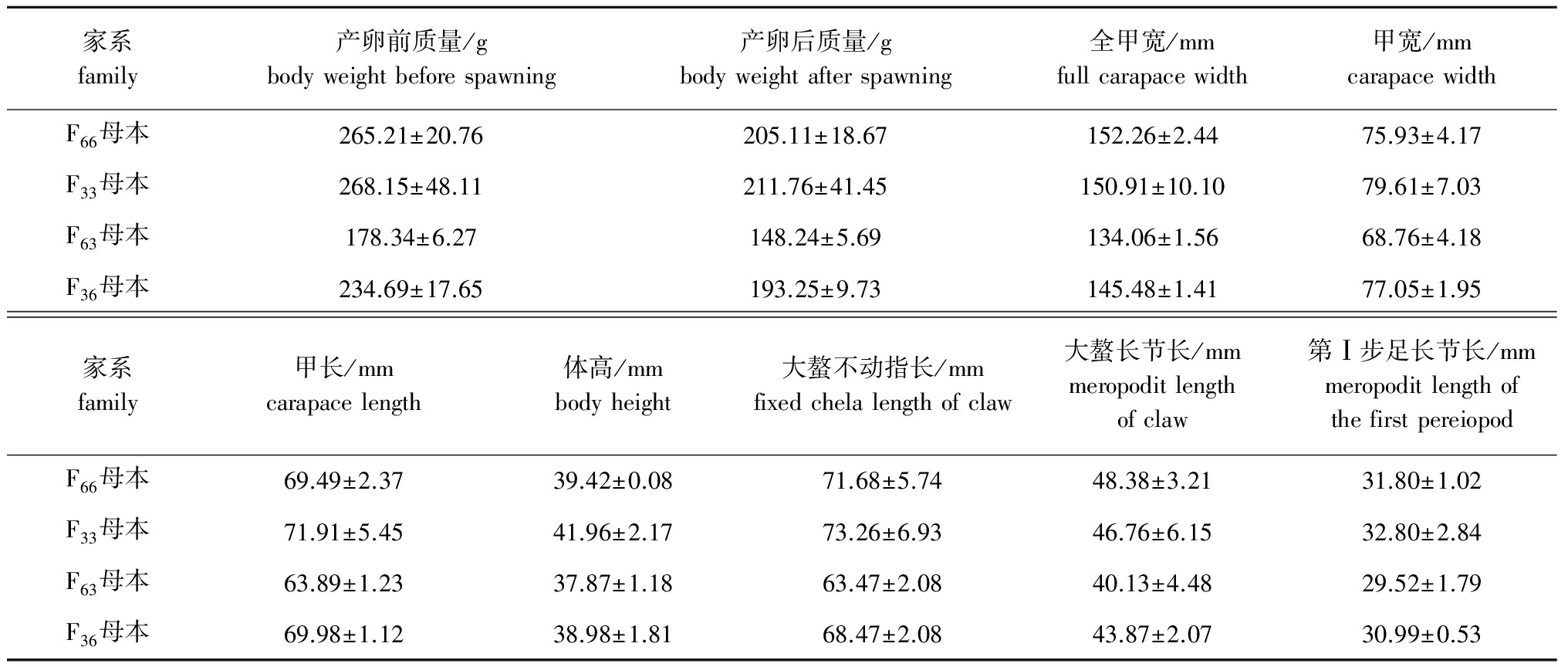
家系family产卵前质量/gbodyweightbeforespawning产卵后质量/gbodyweightafterspawning全甲宽/mmfullcarapacewidth甲宽/mmcarapacewidthF66母本265.21±20.76205.11±18.67152.26±2.4475.93±4.17F33母本268.15±48.11211.76±41.45150.91±10.1079.61±7.03F63母本178.34±6.27148.24±5.69134.06±1.5668.76±4.18F36母本234.69±17.65193.25±9.73145.48±1.4177.05±1.95家系family甲长/mmcarapacelength体高/mmbodyheight大螯不动指长/mmfixedchelalengthofclaw大螯长节长/mmmeropoditlengthofclaw第Ⅰ步足长节长/mmmeropoditlengthofthefirstpereiopodF66母本69.49±2.3739.42±0.0871.68±5.7448.38±3.2131.80±1.02F33母本71.91±5.4541.96±2.1773.26±6.9346.76±6.1532.80±2.84F63母本63.89±1.2337.87±1.1863.47±2.0840.13±4.4829.52±1.79F36母本69.98±1.1238.98±1.8168.47±2.0843.87±2.0730.99±0.53
2.2试验亲蟹抱卵量、排幼量和孵化率的数据分析
为检验本试验中挑选的4组亲蟹的规格大小对试验测量数据是否有影响,以试验组类别为分组依据,分别以亲蟹的全甲宽和体质量为协变量,对所测得的抱卵量、排幼量、孵化率等繁殖性能进行协方差分析。从表3可见,无论是以试验所选亲蟹的全甲宽还是体质量作为协变量,各个因变量的F统计量的相伴概率值都大于显著性水平0.05,说明本试验所选亲蟹的规格大小对各测量数据的大小并没有显著性影响(P>0.05)。
2.3室内培育期间各组亲蟹的繁殖力
从表4可见:4组亲蟹的抱卵量和单位体质量抱卵量均为F66>F33>F36>F63,排幼量和单位体质量排幼量均为F33>F66>F36>F63,孵化率为F33>F66>F63>F36,自交组的抱卵量、排幼量和单位体质量抱卵量均比杂交组大,且显著大于F63组(P<0.05);自交组的单位体质量排幼量和孵化率虽然也比杂交组大,但差异并不显著(P>0.05)。表明在繁殖性能上,杂交组并未表现出杂种优势。
表3试验亲蟹抱卵量、排幼量、孵化率的协方差分析
Tab.3Covarianceanalysis(ANCOVA)ofovigerousnumber,larvaereleasedandhatchingratebroodstockcrabduringtheexperiment
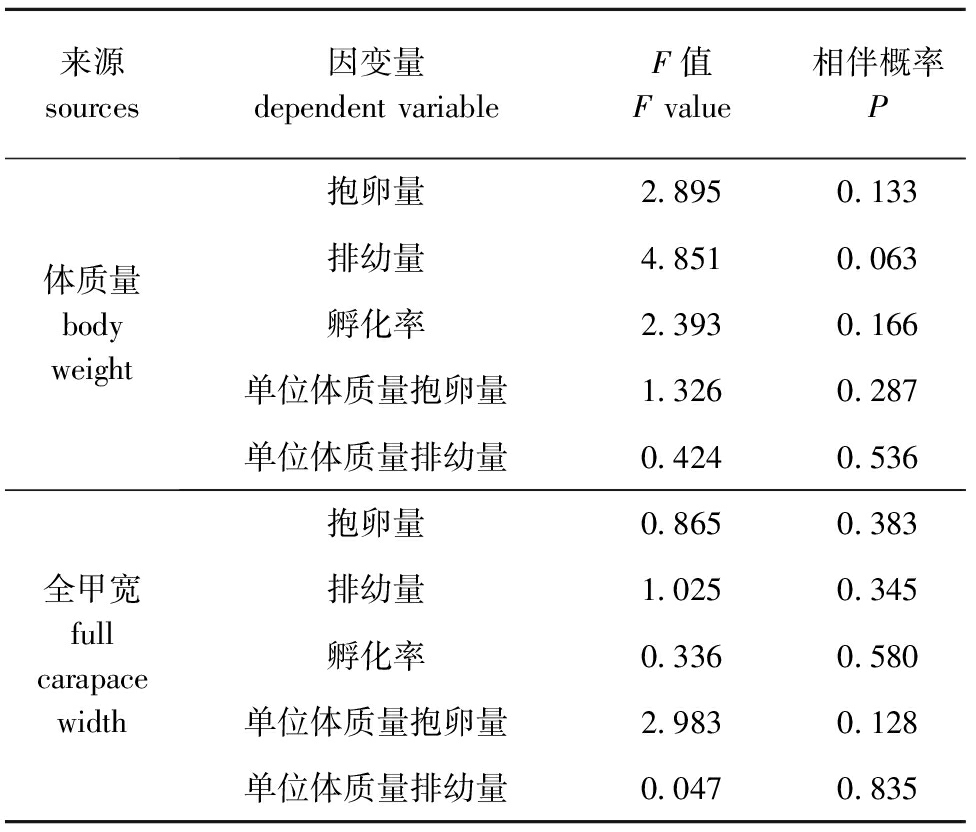
来源sources因变量dependentvariableF值Fvalue相伴概率P体质量bodyweight抱卵量2 8950 133排幼量4 8510 063孵化率2 3930 166单位体质量抱卵量1 3260 287单位体质量排幼量0 4240 536全甲宽fullcarapacewidth抱卵量0 8650 383排幼量1 0250 345孵化率0 3360 580单位体质量抱卵量2 9830 128单位体质量排幼量0 0470 835
表4各组亲蟹繁殖力的分析结果
Tab.4Thereproductionperformanceofbroodstochcrabineachgroup

家系family单位体质量抱卵量/(万粒·g-1)fecundityperunitbodyweight单位体质量排幼量/(万粒·g-1)larvanumberperunitbodyweight抱卵量/万粒fecundity排幼量/万粒larvaereleased孵化率/%hatchingrateF66母本0 39±0 06bc0 26±0 07a79 75±10 47Bb53 69±16 95b66 53±13 69aF33母本0 36±0 04c0 27±0 02a74 83±9 85Bb57 43±13 32b76 11±8 45aF63母本0 27±0 04a0 17±0 03a39 94±4 84Aa25 45±3 78a64 17±11 33aF36母本0 28±0 04ab0 18±0 08a55 15±10 74ABa35 17±17 47ab61 33±21 48a
注:同列中标有不同大写字母者表示组间有极显著性差异(P<0.01),标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different capital letters within the same column are very significantly different at the 0.01 probability level,with different letters being significantly different at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
2.4各阶段三疣梭子蟹的变态率
从表5可见:在Z1至Z4阶段,各组幼蟹的变态率依次为F33>F66>F36>F63,只有F33组和F63组间有显著性差异(P<0.05),其他组间均无显著性差异(P>0.05),即不存在杂种优势;在Z4至Ⅱ期阶段,各组的变态率依次为F63>F36>F66>F33,只有F33组和F63组间有显著性差异(P<0.05),F63组的变态率比F66组高16.09%,F36组的变态率比F33组高3.71%;在Z1至Ⅱ期阶段,F66组幼蟹的变态率大于F63组,F33组和F36组的变态率相近,各试验组间均无显著性差异(P>0.05)。
表5室内培育期间各试验组各阶段的变态率
Tab.5ThemetamorphosisateachstagefromzoeaⅠtojuvenilecrabⅡintheexperimentgroupsduringtheindoorrearingperiod
%

组别groupZ1至Z4zoeaⅠtozoeaⅣZ4至Ⅱ期zoeaⅣtojuvenilecrabⅡZ1至Ⅱ期zoeaⅠtojuvenilecrabⅡF6659 58±6 50ab8 46±1 49ab4 92±0 99aF3374 90±3.54b5 79±1 62a4 19±0 41aF6327 34±1 97a25 55±5 91b4 85±0 14aF3645 09±9 57ab9 50±2 22ab4 19±0 66a
2.5早期生长阶段各组的生长、存活和杂种优势
对F66、F33、F63、F364个试验组从Ⅱ期幼蟹至Ⅴ期幼蟹4个时期的生长、存活进行分析,各组幼体在Ⅱ期、Ⅲ期、Ⅳ期、Ⅴ期的平均体质量、体质量生长速度和杂种优势如表6所示,各期平均全甲宽、全甲宽生长速度和杂种优势如表7所示,各期存活率及其杂种优势如表8所示。
从表6可见:杂交组F63和F36在早期生长阶段相对于自交组F66和F33,体质量的总体杂种优势率为14.38%~25.05%,体质量生长速度的总体杂种优势率为8.47%;F63组相对于F66组的体质量生长的杂种优势率为-7.48%~12.37%,体质量生长速度的杂种优势率为2.94%;F36组相对于F33组的体质量生长的杂种优势率为21.37%~50.15%,体质量生长速度的杂种优势率为16.00%。各组体质量的生长速度依次为F63>F66>F36>F33;F36组相对于F33组体质量及其生长速度的杂种优势均明显大于F63组相对于F66组的杂种优势。
从表7可见:杂交组F63和F36在早期生长阶段相对于自交组F66和F33,全甲宽的总体杂种优势率为5.57%~10.27%,全甲宽生长速度的总体杂种优势率为0.57%;F63组相对于F66组,全甲宽生长的杂种优势率为-0.51%~5.00%,全甲宽生长速度的杂种优势率为0.36%;F36组相对于F33组,全甲宽生长杂种优势率为9.27%~12.41%,全甲宽生长速度的杂种优势率为0.81%。各组全甲宽的生长速度依次为F63>F66>F36>F33;F36组相对于F33组全甲宽及其生长速度的杂种优势均明显大于F63组相对于F66组的杂种优势。
从表8可见:杂交组F63和F36在早期生长阶段相对于自交组F66和F33存活的总体杂种优势率为22.49%~36.67%;F63组相对于F66组存活的杂种优势率为32.70%~83.61%;F36组相对于F33组存活的杂种优势率为4.83%~21.79%。从Ⅲ期到Ⅳ期,各组的存活率依次为F63>F36>F66>F33,但到试验结束Ⅴ期幼蟹阶段时,F33组的存活率大于F66组,其中F63组相对于F66组存活的杂种优势明显大于F36相对于F33组的杂种优势。
表6早期生长阶段各试验组幼蟹的体质量和杂种优势
Tab.6Averagebodyweightanddailyincrement,andheterosisinearlydevelopmentindifferentexperimentalgroups
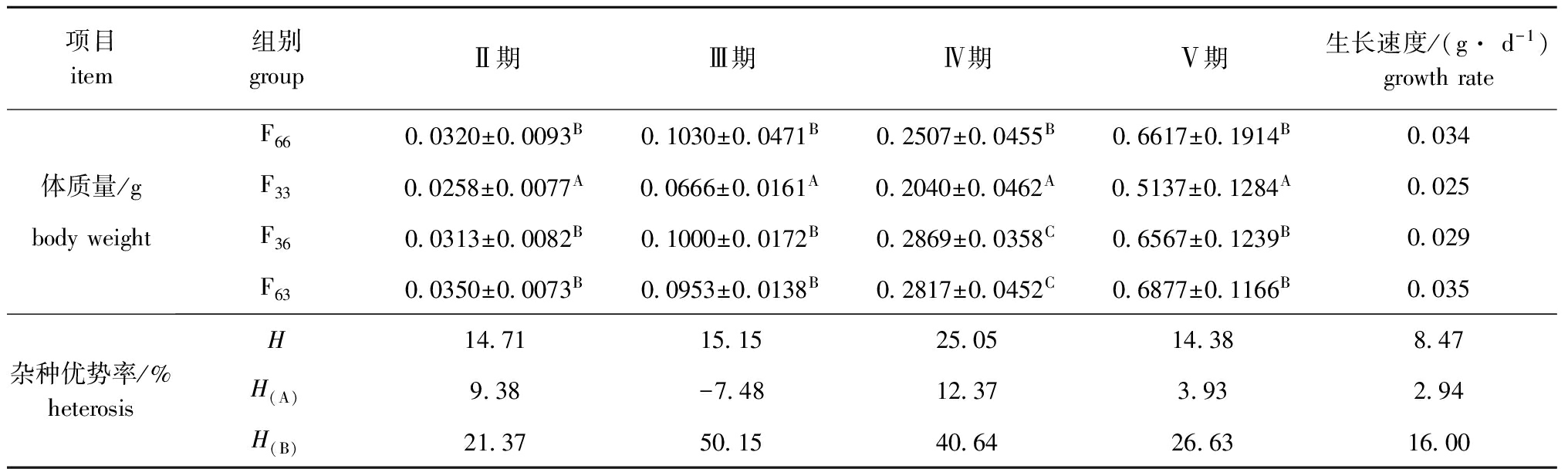
项目item组别groupⅡ期Ⅲ期Ⅳ期Ⅴ期生长速度/(g·d-1)growthrateF660 0320±0 0093B0 1030±0 0471B0 2507±0 0455B0 6617±0 1914B0 034体质量/gF330 0258±0 0077A0 0666±0 0161A0 2040±0 0462A0 5137±0 1284A0 025bodyweightF360 0313±0 0082B0 1000±0 0172B0 2869±0 0358C0 6567±0 1239B0 029F630 0350±0 0073B0 0953±0 0138B0 2817±0 0452C0 6877±0 1166B0 035杂种优势率/%heterosisH14 7115 1525 0514 388 47H(A)9 38-7 4812 373 932 94H(B)21 3750 1540 6426 6316 00
表7早期生长阶段各试验组幼蟹的全甲宽和杂种优势
Tab.7Averagefullcarapacewidthanddailyincrement,andheterosisinearlydevelopmentindifferentexperimentalgroups
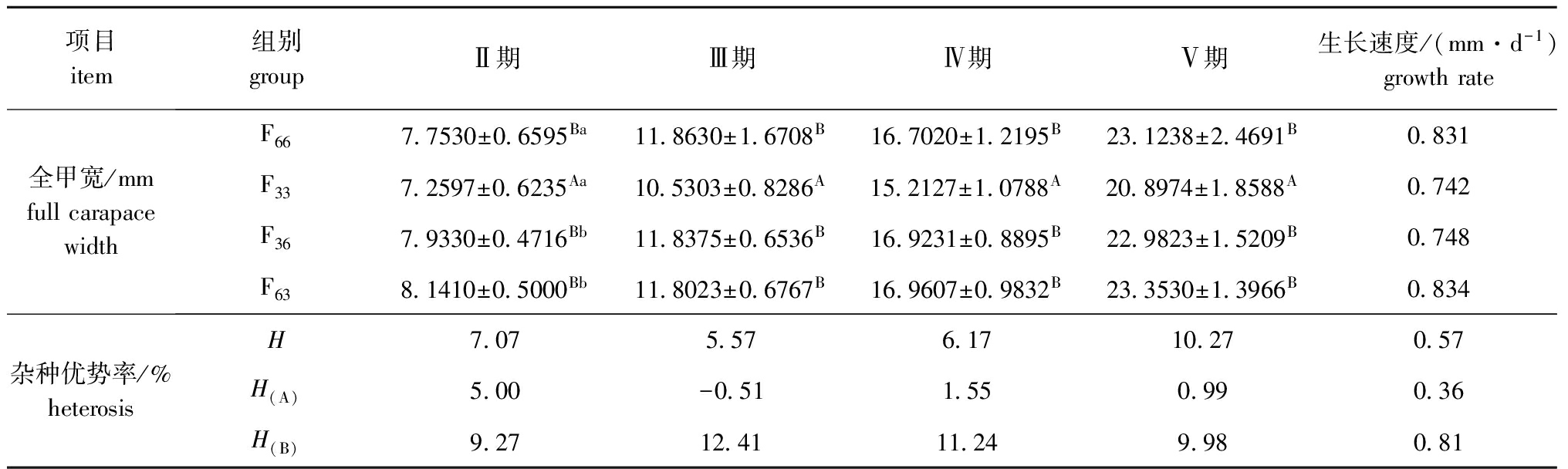
项目item组别groupⅡ期Ⅲ期Ⅳ期Ⅴ期生长速度/(mm·d-1)growthrate全甲宽/mmfullcarapacewidthF667 7530±0 6595Ba11 8630±1 6708B16 7020±1 2195B23 1238±2 4691B0 831F337 2597±0 6235Aa10 5303±0 8286A15 2127±1 0788A20 8974±1 8588A0 742F367 9330±0 4716Bb11 8375±0 6536B16 9231±0 8895B22 9823±1 5209B0 748F638 1410±0 5000Bb11 8023±0 6767B16 9607±0 9832B23 3530±1 3966B0 834杂种优势率/%heterosisH7 075 576 1710 270 57H(A)5 00-0 511 550 990 36H(B)9 2712 4111 249 980 81
表8早期生长阶段各试验组幼蟹的存活率和杂种优势
Tab.8Averagesurvivalrate,andheterosisinearlydevelopmentindifferentexperimentalgroups
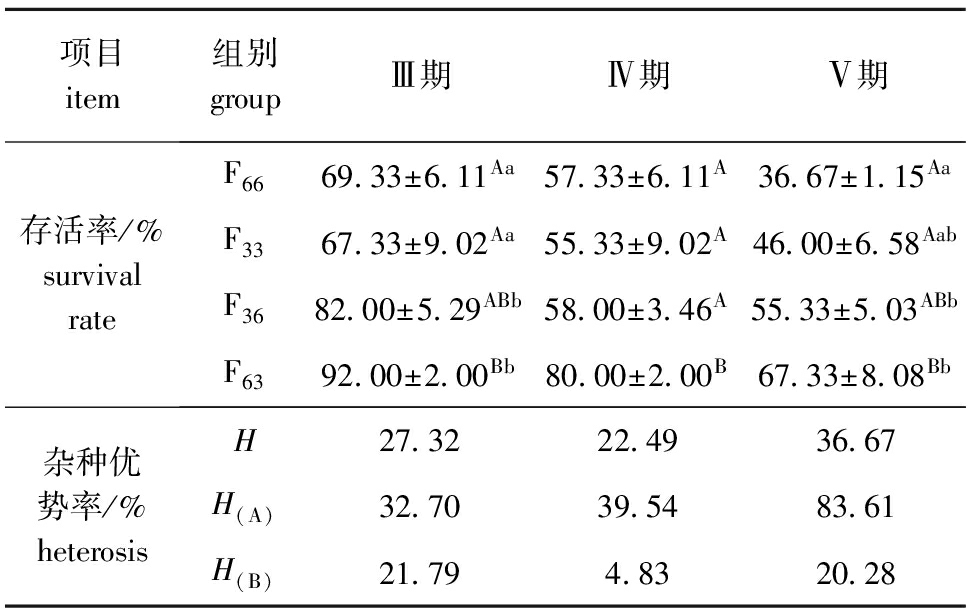
项目item组别groupⅢ期Ⅳ期Ⅴ期存活率/%survivalrateF6669 33±6 11Aa57 33±6 11A36 67±1 15AaF3367 33±9 02Aa55 33±9 02A46 00±6 58AabF3682 00±5 29ABb58 00±3 46A55 33±5 03ABbF6392 00±2 00Bb80 00±2 00B67 33±8 08Bb杂种优势率/%heterosisH27 3222 4936 67H(A)32 7039 5483 61H(B)21 794 8320 28
3.1杂交亲本的遗传差异分析
无论是植物还是动物,杂种优势都十分普遍。为了获得杂种优势,一般会对亲本间的遗传差异首先进行评估,只有两个基础群体的基因频率不同,它们的杂交后代才有表现出杂种优势的可能[21],无论两个不同纯种群等位基因的差异如何,经过中间杂交和种内杂交的杂交后代都会表现出不同程度的杂种优势[22]。杂种优势来源与杂交亲本之间遗传类型的差异有关,差异越大后代的杂种优势就可能越明显[14]。非加性效应改善养殖品种的理论认为,增加非加性效应是提高杂种优势的基础,可以通过加大两个群体间的基因频率、提高群体的纯合程度来增加杂种优势[9]。也就是说,就同一物种而言,群体内的基因纯合程度越高,群体间的基因频率差异就会越大,遗传距离也会越远,从而使其杂交后代产生较大杂种优势的可能性增大[10,23]。形态学参数的比较是鉴别杂种的传统方法[24]。杨章武等[14]研究表明,凡纳滨对虾杂交子代的抗逆性较自交子代强,在低温、低盐条件下,杂交组较自交组生长快,认为凡纳滨对虾的杂种优势与亲本的提纯、选优紧密相关。蟹类的杂交育种目前还仅限于种内杂交,本试验中,材料A家系为F6,B家系为F3,均为基因纯化程度不同的两个家系,相比利用不同地理种群野生种进行种内杂交的种群,基因纯合程度较高,可能有更大的杂种优势。
3.2自交组和杂交组繁殖性能的比较
对鱼类的研究认为,鱼的初始规格会对鱼类生长性能试验终值的研究产生很大影响[25]。本试验中选择的待产亲蟹均为2011年越冬亲蟹,从各个试验组中挑选初始规格相近的亲蟹,经过协方差分析差异不显著,比较杂交组与自交组的繁殖力可知,自交组的抱卵量、排幼量和单位体质量抱卵量均比杂交组大,且均与F63组有显著性差异(P<0.05);虽然自交组的单位体质量排幼量和孵化率也比杂交组大,但差异并不显著(P>0.05),表明在繁殖性能上,杂交组并未表现出杂种优势。孙灵毅等[19]对中国刺参与韩国红刺参正反杂交子一代发育特征的研究表明,正反杂交组合的受精率都比自交组低,同时正反杂交组合的受精卵发育时间也比自交组延长,也未表现出杂种优势。丘洋洋等[18]对金鱼红白虎头和红白碟尾的双列杂交组合的研究表明,正反杂交组的受精率与孵化率都比自交组低很多,同样在繁殖性能上也未表现出杂种优势。
3.3自交组和杂交组子代早期生长和存活的比较
生长和存活在育种方面是十分重要的数量性状,同时也是与经济效益密切相关的指标。从早期生长试验数据可以看出,F66组幼蟹体质量和全甲宽的生长速度均大于F33组,试验终止时F33组的存活率大于F66组,各组的存活率依次为F63>F36>F33>F66,而F36组相对于F33组的存活杂种优势大于F63组相对于F66组的存活杂种优势。
通过对4个试验组幼蟹的早期生长研究发现,杂交组F63和F36在早期生长阶段相对于自交组F66和F33,体质量的总体杂种优势率为14.38%~25.05%,全甲宽的总体杂种优势率为5.57%~10.27%,各组体质量和全甲宽的生长速度依次均为F63>F66>F36>F33,其中F36组相对于F33组的杂种优势大于F63相对于F66组的杂种优势;存活的总体杂种优势率为22.49%~36.67%,各组的存活率依次为F63>F36>F33>F66,其中F63组相对于F66组的存活杂种优势大于F36相对于F33组的杂种优势。杂交后代表型性状上的差异,一般认为是母本效应或父母本的交互作用引起的[26]。
3.4提高杂种优势的措施
近交造成物种内群体的基因越来越纯合,遗传差异增大,固定了优良性状,保持优秀个体的血统,提高育种群体的一致性和整齐度,但同时也暴露有害基因,使群体对环境的敏感性增加,极易造成近交衰退。从近交使隐性有害等位基因暴露的因素考虑,杂种优势只是一种对近交衰退的补偿[27-28]。通过不同近交程度亲本间的杂交,原本因为近交而暴露的隐性有害等位基因被掩盖,将使后代遗传到两个亲本各自的某些优良性状,用取长补短的方式培育出一个优良品种[12]。
本试验中,通过包含两个亲本所有可能配成的杂交组合的双列杂交设计,进行不同近交程度家系间的杂交组合试验,比较分析了各试验组的繁殖性能和生长、存活的差异,虽然本试验中自交家系间的杂交并没有显著提高杂交组合的繁殖性能,但该杂交方式能有效地增加遗传变异,可为三疣梭子蟹优良品系培育提供更丰富的选择材料,为三疣梭子蟹的种质改良和新品种培育奠定了重要的基础,同时也为后期杂交育种和选择育种工作提供了十分重要的基础数据支持,有利于后期育种时对杂交优势的利用。
参考文献:
[1] 戴爱云,冯钟琪,宋玉枝,等.三疣梭子蟹渔业生物资源的初步调查[J].动物学杂志,1977,12(2):30-33.
[2] 戴爱云,杨思谅,宋玉枝,等.中国海洋蟹类[M].北京:海洋出版社,1986:213-214.
[3] 孙颖民,闫愚,孙进杰,等.三疣梭子蟹的幼体发育[J].水产学报,1984,8(3):219-226.
[4] 王国良,金珊,李政,等.三疣梭子蟹(Portunustrituberculatus)乳化病的组织病理和超微结构病理研究[J].海洋与湖沼,2006,37(4):297-303.
[5] 张洪玉,罗坤,孔杰,等.近交对中国明对虾生长、存活及抗逆性的影响[J].中国水产科学,2009,16(5):744-750.
[6] 吴仲庆.水产生物遗传育种学[M].3版.厦门:厦门大学出版社,2000.
[7] 高保全,刘萍,李健.三疣梭子蟹3个地理种群杂交子一代生长和存活率的比较[J].大连水产学院学报,2008,23(5):325-329.
[8] Newkirk G F.Review of the genetics and the potential for selective breeding of commercially important bivalves[J].Aquaculture,1980,19:209-228.
[9] 高保全,刘萍,李健,等.三疣梭子蟹(Portunustrituberculatus)不同地理种群内自繁和种群间杂交子一代生长性状的比较[J].海洋与湖沼,2008,39(3):291-296.
[10] 刘小林,常亚青,相建海,等.栉孔扇贝不同种群杂交效果的初步研究[J].海洋学报,2003,25(1):93-99.
[11] 范兆廷.水产动物育种学[M].北京:中国农业出版社,2005:87-117.
[12] 姚雪梅,黄渤,张继涛,等.SPF凡纳滨对虾F1、F2及杂交子代生长和存活比较研究[J].中国水产科学,2007,14(2):327-330.
[13] 于飞,张庆文,孔杰,等.大菱鲆不同进口群体杂交后代的早期生长差异[J].水产科学,2008,32(1):58-64.
[14] 杨章武,郑雅友,李正良,等.凡纳滨对虾群体自交与杂交子代幼体对低温、低盐抗逆性与生长比较[J].水产学报,2012,36(2):284-289.
[15] 林红军,沈琪,张吕平,等.凡纳滨对虾生长性状的双列杂交分析[J].热带海洋学报,2010,29(6):51-56.
[16] Cruz P,Ibarra M.Larval growth and survival of two catarina scallop(ArgopectencircularisSowerby,1835) populations and their reciprocal crosses[J].J Exp Mar Bio Ecol,1997,212:95-110.
[17] 江曙光,常亚青,田燚,等.仿刺参多种杂交方式下杂交效果的初步研究[J].大连水产学院学报,2009,24(6):247-250.
[18] 邱洋洋,陆海燕,宓华明,等.金鱼红白虎头和红白蝶尾及其杂交F1代的体色和体型的分析[J].大连海洋大学学报,2011,26(3):209-214.
[19] 孙灵毅,赵强,任利华,等.中国刺参与韩国红刺参杂交及子代发育特征的研究[J].大连海洋大学学报,2013,28(3):281-286.
[20] 刘振,闫喜武,霍忠明,等.蛤仔白斑马品系的家系选择及近交效应研究[J].大连海洋大学学报,2013,28(4):355-360.
[21] 郑怀平,张国范,刘晓,等.海湾扇贝杂交家系与自交家系生长和存活的比较[J].水产学报,2004,28(3):267-272.
[22] Misamore M,Browdy C L.Evaluating hybridization potential betweenPenaeussetiferusandPenaeusvannameithrough natural mating, artificial insemination andinvitrofertilization[J].Aquaculture,1997,150:1-10.
[23] 楼允东.鱼类育种学[M].北京:中国农业出版社,1998:23.
[24] Scribner K T,Page K S,Bartron M L.Hybridization in freshwater fishes:a review of case studies and cytonuclear methods of biological inference[J].Review in Fish Biology and Fisheries,2001,10:293-323.
[25] 文春根.俄罗斯鲟和杂交鲟鱼种的生长对比试验[J].水利渔业,2004,24(6):27-29.
[26] 秦艳杰,刘晓,张海滨,等.海湾扇贝正反交两个家系形态学指标比较分析[J].海洋科学,2007,31(3):22-27.
[27] 王亚馥,戴灼华.遗传学[M].北京:高等教育出版社,1999:528-536.
[28] 马大勇,胡红浪,孔杰.近交及其对水产养殖的影响[J].水产学报,2005,29(6):849-856.
Abstract:The growth and survival at early stage between inbred lines and hybrid systems were compared between full-sib inbreeding families and hybridization of two full-sib inbreeding in two families, A pedigree (F6)and B (F3), of swimming crabPortunustrituberculatuswith different genetic purification in order to breed new families. There were four test groups, including two inbreeding groups F66(A♀×A♂) and F33(B♀×B♂) and two hybrid groups F63(A♀×B♂ ),and F36(B♀×A♂).In terms of reproductive performance, there were significantly higher fecundity, relative egg carrying production and relative larvae releasing production in the inbreeding groups than those in the hybrid groups, especially the fecundity (P<0.05). Within the inbreeding groups, however, there was higher relative egg carrying production and relative larvae releasing production, without significant difference, indicating that the hybrid group showed no advantage in reproductive performance. The growth and survival of juveniles from stage Ⅱ to stage Ⅴrevealed that the hybrid groups F63and F36had general heterosis of 14.38%-25.05% in body weight, and 5.57%-10.27% in full carapace width, higher than the inbreeding groups of F66and F33. The overall growth rate was ranged as the following: F63>F66>F36>F33. There was higher heterosis in F36group than F66and F63group than F66group. The overall survival heterosis of 22.49%-36.67% was found in the hybrid groups, higher in F63group than in F66group, and higher in F36group than in F66group. The findings indicated that the hybrid groups did not show the heterosis in reproductive performance, instead in growth and survival at the early growth stage, which provides foundation for further breeding of swimming crab.
Key words:Portunustrituberculatus; hybrid; inbred; reproduction; growth
DOI:10.3969/J.ISSN.2095-1388.2014.02.003
文章编号:2095-1388(2014)02-0114-07
收稿日期:2013-07-12
基金项目:国家“863”高技术研究发展计划项目(2012AA10A409);农业科技成果转化资金资助项目(2013GB23260589);中央级公益性科研院所基本科研业务费专项资金资助项目(20603022012015)
中图分类号:Q321
文献标志码::A