注:图序号注释见表1,下同
Note: The annotation of figure serial No. are shown in Tab.1,et sequentia
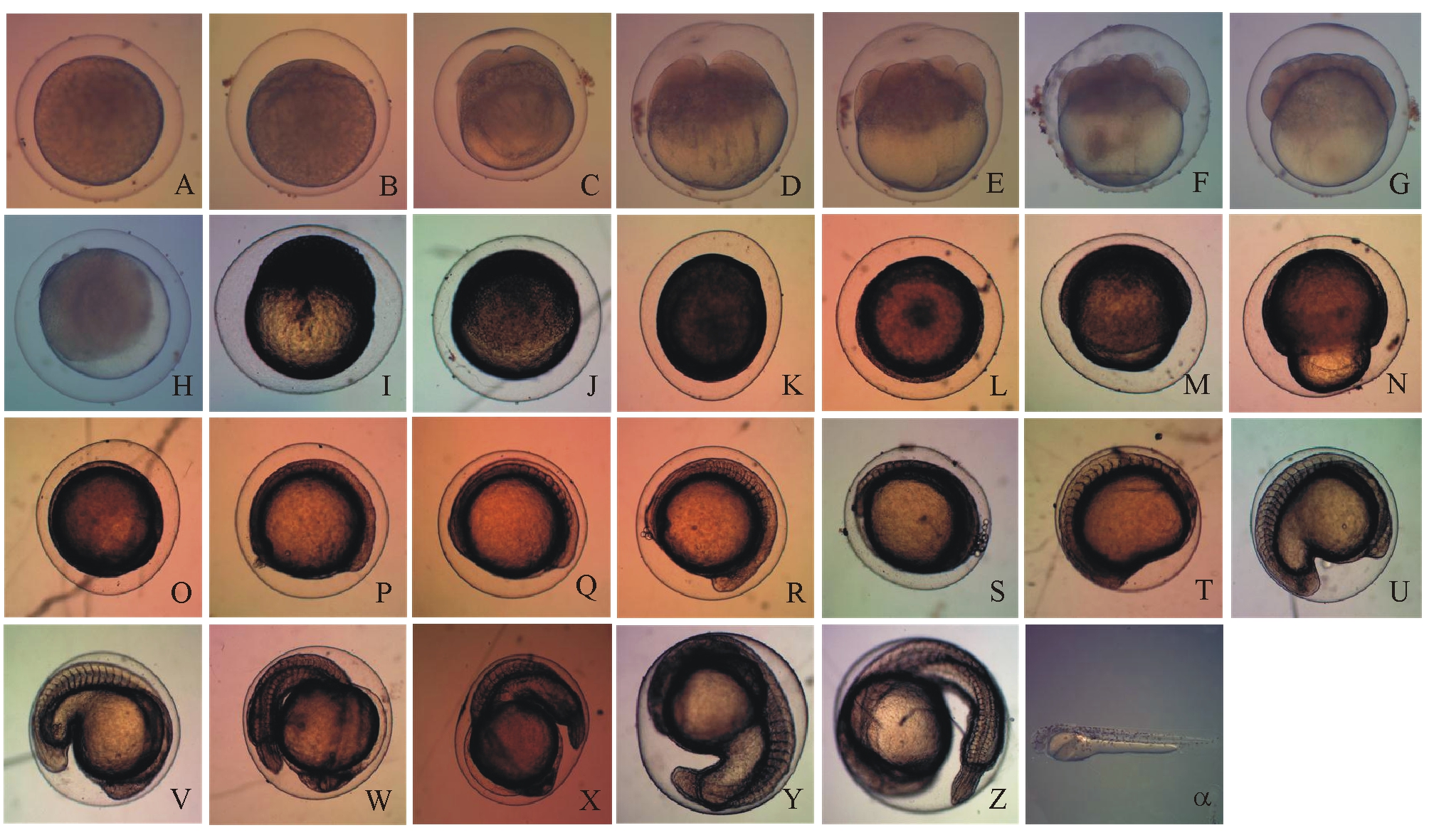
图1 2n♀×4n♂后代的胚胎发育观察
Fig.1 Embryonic development in hybrid triploid loach 2n♀×4n♂
摘要:对杂交三倍体泥鳅Misgurnusanguillicaudatus(2n♀×4n♂, DT)和二倍体泥鳅(2n♀×2n♂, DD)的胚胎发育进行观察,详细记录了其胚胎发育的形态特征和发育特点。结果表明:DT受精卵在水温(25±1)℃的条件下,整个胚胎发育过程约需36 h 19 min;对照组DD受精卵在水温(25±1)℃的条件下,整个胚胎发育过程约需35 h 57 min;DT(DD)的胚胎发育包括卵裂期、囊胚期、原肠期、神经胚期、器官形成期和孵化出膜期6个时期,DT(DD)受精卵约40 min(40 min)后进入卵裂期,3 h 45 min(3 h 40 min)后进入囊胚期,6 h 30 min(6 h 24 min)后进入原肠期,9 h 32 min(9 h 20 min)后进入神经胚期,15 h 45 min(15 h 30 min)后进入器官形成期,36 h 19 min(35 h 57 min)后出膜。研究表明,DT的胚胎发育时序及形态特征与DD基本相似,说明DT具有正常的胚胎发育过程,本研究可为杂交三倍体泥鳅苗种培育提供生物学依据。
关键词:泥鳅;杂交三倍体;二倍体;胚胎发育
三倍体鱼类具有生长速度快、肉质好、抗病力强、不干扰鱼类资源、不育等优良性状特点,在养殖上具有重要意义。自20世纪50年代以来,多倍体诱导技术在鱼类遗传育种领域已得到广泛应用,国内外先后在三棘刺鱼Gasterosteusaculeatus[1]、鲤Cyprinuscarpio[2]、水晶彩鲫Carassiusauratustransparentcoloredvariety[3]等30多种鱼类育种中成功获得三倍体,其中三倍体的异育银鲫Carassiusauratusgibelio[4]、湘云鲫Carassiusauratus[5-6]、湘云鲤Cyprinuscarpio[7]已进行了商品化生产,达到了产业化水平,多倍体技术在生产上发挥着越来越重要的作用。因此,培育三倍体泥鳅Misgurnusanguillicaudatus品种,对促进泥鳅养殖生产的发展将具有重要意义。
泥鳅是中国重要的出口水产品,随着泥鳅养殖业的迅速发展,良种泥鳅的选育显得十分重要,对泥鳅的研究工作也逐渐深入。已有的细胞学研究资料表明,中国长江流域存在大量的天然四倍体泥鳅[8-11]。这些四倍体泥鳅是中国特有的、非常珍贵的种质资源,是鱼类遗传育种研究的理想原材料。笔者利用天然四倍体与二倍体泥鳅正、反交成功制备了一种新型的杂交三倍体泥鳅[12],并对其子代的染色体数目组成进行了研究[13-14]。但关于杂交三倍体泥鳅的胚胎发育时序目前尚未见报道,本研究中对杂交三倍体泥鳅胚胎发育进行了观察,并与普通二倍体泥鳅的胚胎发育时序及形态进行比较,旨在为杂交三倍体泥鳅苗种的培育提供生物学依据。
1.1材料
试验用天然四倍体泥鳅取自湖北省洪湖市,二倍体泥鳅取自大连市农贸市场。暂养在实验室水族箱中,水温为(25±1)℃。
1.2方法
1.2.1 人工催产及授精 试验于2012年6月在大连海洋大学农业部北方海水增养殖重点实验室进行。挑选性腺发育良好的天然四倍体泥鳅和二倍体泥鳅,对其注射绒毛膜促性腺激素(HCG),雌性注射剂量为20~25 IU/g(体质量),雄性注射剂量减半,12 h后轻压二倍体雌泥鳅腹部即有卵排出,将卵收集于直径为9 cm的培养皿中,二倍体和天然四倍体雄鱼按生殖孔下边两侧,用毛细管收集精液于塑料离心管中,用淡水生理盐水稀释100倍,采用干法授精。试验分为2组,即杂交三倍体泥鳅组(2n♀×4n♂, DT)和二倍体泥鳅组(2n♀×2n♂, DD),每组设3个平行。
1.2.2 幼鱼培育 孵化和幼鱼培育在塑料水槽中进行,温度为(25±1)℃。经常用经曝气的水更换培育用水,保持室内空气新鲜和流通,及时用吸管吸出死亡的胚胎。
1.2.3 胚胎发育观察 在Olympus生物解剖镜下观察胚胎的发育过程。孵化期间按照其发育的各个时期定期取样,各时期测定样品30个,发育时序以50%的胚胎发育至某期的时间计算,同时用LY-WN-HPCCD进行显微拍照。
1.3数据处理
鱼卵发育至原肠晚期时统计受精率,即受精卵数占总卵数的百分比。鱼卵发育至孵出前期时统计孵化率,即孵化苗数占受精卵数的百分比。
用SPSS 17.0软件对试验数据进行单因素方差分析和多重比较,显著性水平设为0.05。
2.1不同时期的发育特征
DT与DD的胚胎发育时序及形态特征基本相似。
2.1.1 受精及胚盘的形成 DT(DD)卵受精后几分钟,卵膜吸水膨胀,微黏性,透明( 图1-A,图2-A);受精后30 min(30 min)时,原生质在卵的动物极集中,形成略带淡红色的胚盘,约占卵球高度的1/3( 图1-B,图2-B)。
2.1.2 卵裂期 DT(DD)卵受精后40 min(40 min)时,开始第一次卵裂,形成大小相等、形状相似的2个细胞,为2细胞期(图1-C, 图2-C);受精后56 min(56 min)时,出现第二次卵裂,分裂沟与第一次的相垂直,将细胞等分成4个细胞,进入4细胞期(图1-D,图2-D);受精后1 h 10 min(1 h 12 min)时,进行第三次卵裂,形成8个大小基本相等的细胞(图1-E, 图2-E);受精后1 h 30 min(1 h 28 min)时,在第二次分裂面的两侧分别产生与之平行的分裂沟,形成4排细胞,每排4个,共16个大小基本相等的细胞(图1-F,图2-F);受精后1 h 55 min(1 h 56 min)时,进入32细胞期,形成32个大小不等的细胞,细胞排列不规则,边缘的细胞略大(图1-G, 图2-G);受精后2 h 40 min(2 h 40 min)时,细胞数量不断增多,细胞界限开始模糊不清,分裂球越分越小,进入多细胞期(图1-H,图2-H)。
2.1.3 囊胚期 DT(DD)卵受精后 3 h 45 min(3 h 40 min)时,分裂环界限不清,高耸于卵黄上方,占卵的1/2,进入高囊胚期(图1-I,图2-I);受精后5 h 30 min(5 h 25 min)时,囊胚高度逐渐下降,并有下包趋势,进入低囊胚期(图1-J, 图2-J)。
2.1.4 原肠期 DT(DD)卵受精后6 h 30 min(6 h 24 min)时,囊胚下包卵黄的1/3,内卷形成胚环,胚胎发育进入原肠早期(图1-K,图2-K);受精后7 h 25 min(7 h 15 min)时,囊胚下包卵黄的1/2,胚胎发育进入原肠中期(图1-L, 图2-L);受精后8 h 3 min(7 h 56 min)时,囊胚下包卵黄的2/3,进入原肠晚期(图1-M,图2-M)。
2.1.5 神经胚期 DT(DD)卵受精后 9 h 32 min(9 h 20 min)时,胚层下包约4/5,胚环一端膨大为头部,另一端为尾部,出现原基,进入神经胚期(图1-N,图2-N);受精后 11 h 13 min(11 h)时,胚盘完全包裹卵黄,胚体开始形成,进入胚孔封闭期(图1-O, 图2-O)。
2.1.6 肌节出现及尾泡形成期 DT(DD)卵受精后14 h 2 min(13 h 48 min)时, 躯干中段出现2对肌节,进入肌节出现期(图1-P,图2-P);受精后 15 h(14 h 45 min)时, 出现4对肌节,尾部出现圆形亮点,即尾泡,进入尾泡形成期(图1-Q, 图2-Q)。
2.1.7 器官形成期 DT(DD)卵受精后 15 h 45 min(15 h 30 min)时,脑分为前中后3部分,前段透明的囊泡为眼囊,进入眼囊出现期(图1-R,图2-R);DT(DD)受精后 16 h 40 min(16 h 25 min)时,眼囊前倾,下方出现暗色斑块,即嗅囊,进入嗅囊出现期(图1-S, 图2-S);受精后 17 h 53 min(17 h 37 min)时, 尾部变圆,出现锥形尾芽,进入尾芽出现期(图1-T,图2-T);受精后 18 h 38 min(18 h 19 min)时,出现透明的泡状耳囊,进入耳囊形成期(图1-U,图2-U);受精后 19 h 54 min(19 h 41 min)时, 肌节为22对,胚体中段出现间歇性肌肉收缩,进入肌肉效应期(图1-V,图2-V);受精后 21 h 53 min(21 h 35 min)时,尾部边缘出现薄而透明的褶状鳍,尾泡消失,进入尾鳍褶出现期(图1-W,图2-W);受精后 23 h 3 min(22 h 47 min)时, 胚囊内出现晶体,肌节为24对,进入晶体出现期(图1-X,图2-X);受精后 28 h 12 min(27 h 50 min)时, 耳囊内出现2粒黑色耳石,进入耳石期(图1-Y, 图2-Y);受精后 28 h 57 min(28 h 38 min)时, 心脏原基开始有节律的跳动,心率为48次/min,进入心跳期(图1-Z,图2-Z)。

注:图序号注释见表1,下同
Note: The annotation of figure serial No. are shown in Tab.1,et sequentia
图1 2n♀×4n♂后代的胚胎发育观察
Fig.1 Embryonic development in hybrid triploid loach 2n♀×4n♂

图2 2n♀×2n♂后代的胚胎发育观察
Fig.2 Embryonic development in diploid loach 2n♀×2n♂
2.1.8 出膜阶段 DT(DD)卵受精后36 h 19 min(35 h 57 min)时,尾部出现,与体轴形成一条直线,头部仍在卵膜内,进入出膜期(图1-α,图2-α)。
2.2发育时序及分期标志
在水温(25±1)℃的条件下,从受精开始,DT(DD)的胚胎发育可分为6大阶段共27个时期(表1)。
表1二倍体和杂交三倍体泥鳅的胚胎发育阶段与时序
Tab.1Embryonicdevelopmentstageandtimesequencein2n♀×2n♂(DD)loachand2n♀×4n♂(DT)loach
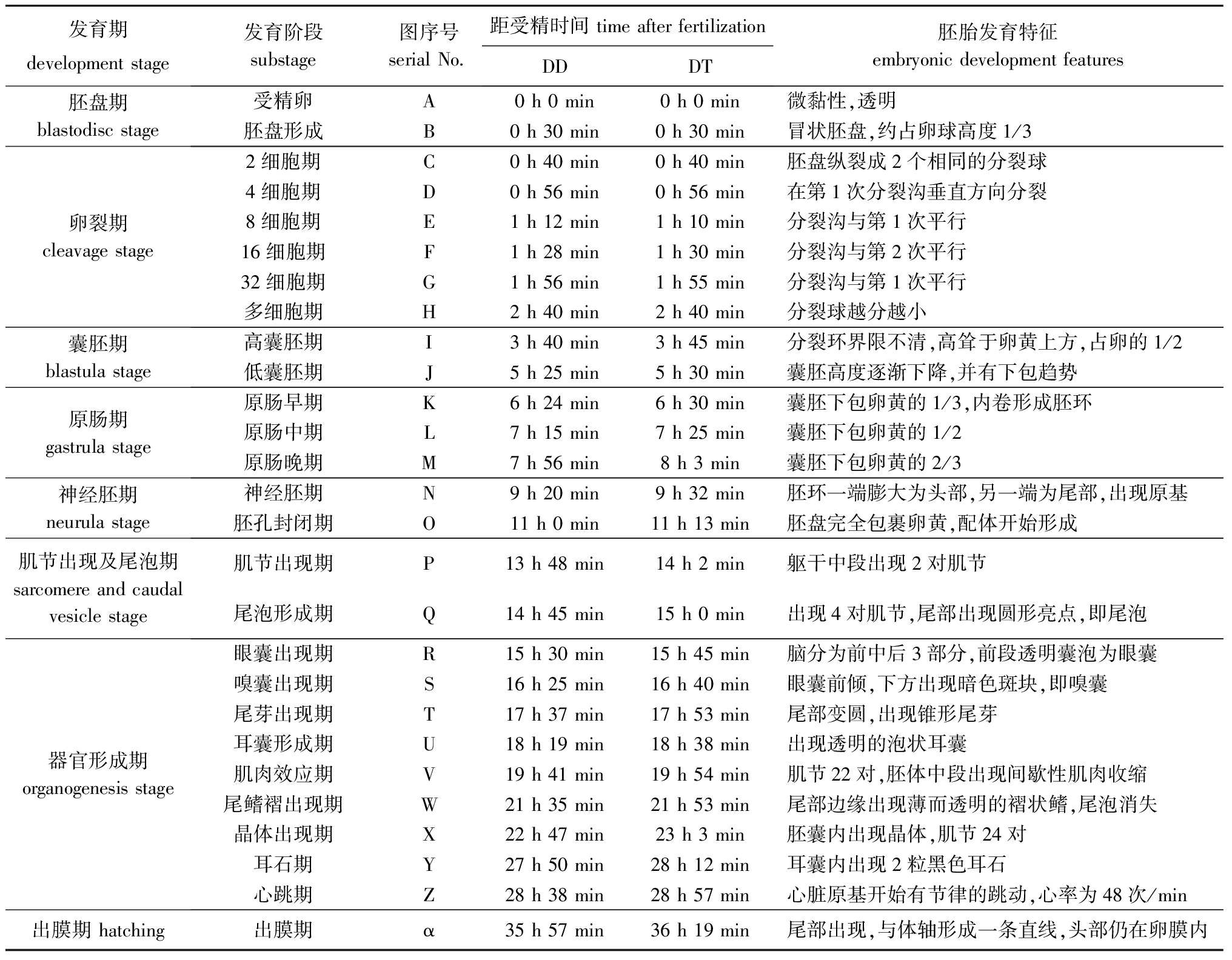
发育期developmentstage发育阶段substage图序号serialNo 距受精时间timeafterfertilizationDDDT胚胎发育特征embryonicdevelopmentfeatures胚盘期blastodiscstage受精卵A0h0min0h0min微黏性,透明胚盘形成B0h30min0h30min冒状胚盘,约占卵球高度1/3卵裂期cleavagestage2细胞期C0h40min0h40min胚盘纵裂成2个相同的分裂球4细胞期D0h56min0h56min在第1次分裂沟垂直方向分裂8细胞期E1h12min1h10min分裂沟与第1次平行16细胞期F1h28min1h30min分裂沟与第2次平行32细胞期G1h56min1h55min分裂沟与第1次平行多细胞期H2h40min2h40min分裂球越分越小囊胚期blastulastage高囊胚期I3h40min3h45min分裂环界限不清,高耸于卵黄上方,占卵的1/2低囊胚期J5h25min5h30min囊胚高度逐渐下降,并有下包趋势原肠期gastrulastage原肠早期K6h24min6h30min囊胚下包卵黄的1/3,内卷形成胚环原肠中期L7h15min7h25min囊胚下包卵黄的1/2原肠晚期M7h56min8h3min囊胚下包卵黄的2/3神经胚期neurulastage神经胚期N9h20min9h32min胚环一端膨大为头部,另一端为尾部,出现原基胚孔封闭期O11h0min11h13min胚盘完全包裹卵黄,配体开始形成肌节出现及尾泡期sarcomereandcaudalvesiclestage肌节出现期P13h48min14h2min躯干中段出现2对肌节尾泡形成期Q14h45min15h0min出现4对肌节,尾部出现圆形亮点,即尾泡器官形成期organogenesisstage眼囊出现期R15h30min15h45min脑分为前中后3部分,前段透明囊泡为眼囊嗅囊出现期S16h25min16h40min眼囊前倾,下方出现暗色斑块,即嗅囊尾芽出现期T17h37min17h53min尾部变圆,出现锥形尾芽耳囊形成期U18h19min18h38min出现透明的泡状耳囊肌肉效应期V19h41min19h54min肌节22对,胚体中段出现间歇性肌肉收缩尾鳍褶出现期W21h35min21h53min尾部边缘出现薄而透明的褶状鳍,尾泡消失晶体出现期X22h47min23h3min胚囊内出现晶体,肌节24对耳石期Y27h50min28h12min耳囊内出现2粒黑色耳石心跳期Z28h38min28h57min心脏原基开始有节律的跳动,心率为48次/min出膜期hatching出膜期α35h57min36h19min尾部出现,与体轴形成一条直线,头部仍在卵膜内
2.3受精率及孵化率
从表2可见:DT组的平均受精率为89.29%,平均孵化率为63.26%;DD组的平均受精率为92.75%,平均孵化率为82.57%;两组的受精率和孵化率之间均无显著性差异(P>0.05)。
表2二倍体和杂交三倍体泥鳅杂交的受精率和孵化率
Tab.2Tertilizaitonrate,andhatchingrateinDDloachandDTloach

组别group用卵量/枚amountofeggs受精率/%fertilizationrate孵化率/%hatchingrateDD33592.75±0.7282.57±8.91DT92089.29±3.4663.26±14.81
近年来,关于鱼类胚胎发育的研究曾有一些报道,但关于多倍体鱼类胚胎发育的研究鲜有报道。刘少军等[15]对异源四倍体鱼胚胎的早期发育进行了研究,结果表明,异源四倍体鲫鲤有正常的胚胎发育过程。刘海金等[16]对不同倍性牙鲆的胚胎发育进行了研究,结果表明,雌核发育二倍体、三倍体与普通二倍体牙鲆的胚胎发育在外观上没有明显差异,胚胎发育正常,除发育速度较慢外,发育时序基本相同,并认为冷休克可能是导致雌核发育二倍体和三倍体牙鲆发育延迟的原因。赵振山等[17]对大鳞副泥鳅雄核发育单倍体胚胎发育的观察结果显示,大鳞副单倍体的胚胎发育延迟,并认为单套染色体组不能完全行使胚胎发育过程所需要的正常遗传功能是导致单倍体胚胎发育延迟的原因。易念等[18]对三倍体鲫(二倍体金鱼♀× 异源四倍体鲫鲤♂)早期胚胎发育的研究结果显示,三倍体鲫的早期胚胎发育正常,初步证明了该三倍体鱼的三倍性没有影响到个体的正常发育。本研究中,杂交三倍体泥鳅的胚胎发育时序及形态特征与二倍体泥鳅基本相似,从受精率及孵化率来看,DT组略低于DD组,但二者无显著性差异。说明杂交三倍体泥鳅具有正常的胚胎发育过程。本研究结果表明,染色体组数的增加并不影响胚胎的早期发育,这与上述研究结果相一致。
温度是影响鱼类胚胎发育速度的重要环境因素之一。谢仰杰等[19]研究了温度对花尾胡椒鲷胚胎发育的影响,结果表明:在适温范围内,花尾胡椒鲷胚胎发育的速度随着水温的升高而加快,水温越高,胚胎发育所需时间越短,但孵化率低,畸形率高;而水温越低,胚胎发育所需的时间越长,但孵化率高,畸形率低。夏连军等[20]、陈来钊等[21]研究温度对不同种鱼类及贝类早期胚胎发育的影响时也得出了相同的结果。关于泥鳅胚胎发育所处温度的报道[22-23]大都集中在19~23 ℃,从表3可见,在水温为19.5~23.0 ℃条件下,泥鳅从受精到孵化出膜最短的只有24 h 20 min[24]。本研究中,在水温为(25±1)℃条件下,DT(DD)整个胚胎发育过程约需36 h 19 min(35 h 57 min),虽然发育总时序延长了,但器官形成期之前发育速度较快,体现出温度升高,胚胎发育所需时间变短,但器官形成期之后到出膜期发育速度较慢。此外,在温度范围基本一致的情况下,亲本来源不同的后代发育的总时序差别较大,所以不同地理分布的群体可能会存在一定的差异,这可能是本研究中器官形成期之后胚胎发育迟缓的原因。因此,仍需对同一地理位置的泥鳅在不同温度下的胚胎发育进行研究,以期为泥鳅的人工繁育提供最佳的温度条件。
表3泥鳅发育时序研究结果的比较
Tab.3Summaryoftheembryonicdevelopmentsequenceinloach
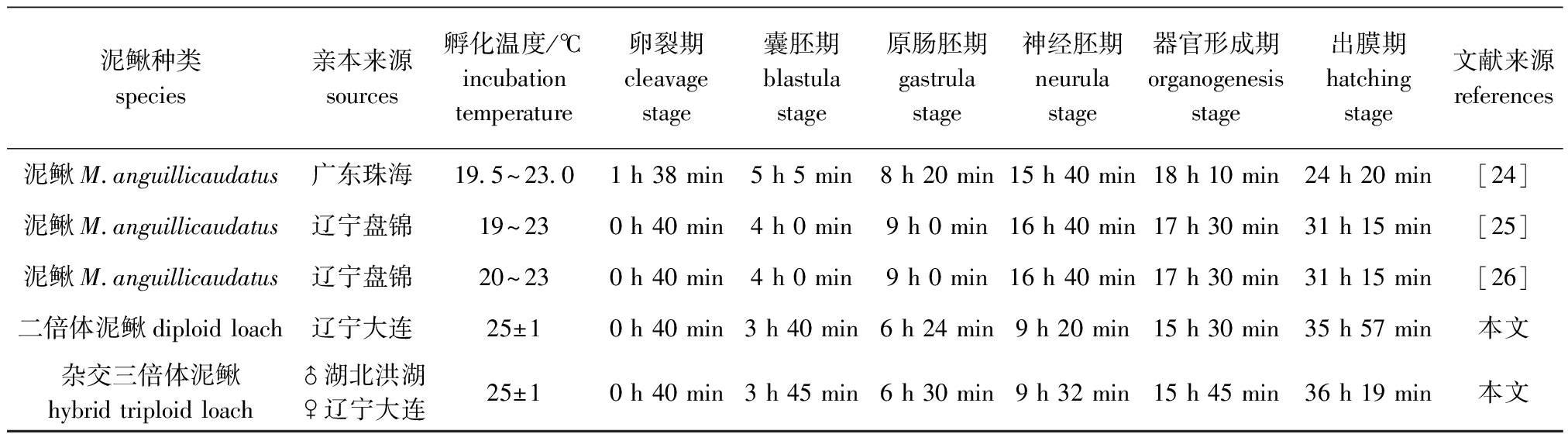
泥鳅种类species亲本来源sources孵化温度/℃incubationtemperature卵裂期cleavagestage囊胚期blastulastage原肠胚期gastrulastage神经胚期neurulastage器官形成期organogenesisstage出膜期hatchingstage文献来源references泥鳅M anguillicaudatus广东珠海19 5~23 01h38min5h5min8h20min15h40min18h10min24h20min[24]泥鳅M anguillicaudatus辽宁盘锦19~230h40min4h0min9h0min16h40min17h30min31h15min[25]泥鳅M anguillicaudatus辽宁盘锦20~230h40min4h0min9h0min16h40min17h30min31h15min[26]二倍体泥鳅diploidloach辽宁大连25±10h40min3h40min6h24min9h20min15h30min35h57min本文杂交三倍体泥鳅hybridtriploidloach♂湖北洪湖♀辽宁大连25±10h40min3h45min6h30min9h32min15h45min36h19min本文
杂交鱼类的亲本对后代胚胎的发育也会产生一定的影响,刘毅辉等[24]对翘嘴鳜Sinipercachuatsi(♀)、斑鳜sinipercaschezeri(♂)及其杂交后代的胚胎和胚后发育进行了比较研究,结果表明,卵细胞在胚胎发育过程中对胚胎发育时序、胚胎大小起到了决定性的作用,即“母本效应”。研究表明,在许多鱼类中“母本效应”非常普遍,翘嘴鳜和斑鳜杂交后代在形态方面[25],三角鲂Megalobramaterminalis和团头鲂M.Amblycephala正反交后代在形态方面[26],牙鲆Paralichthysolivaceus(♀)×圆斑星鲽Veraspervariegatus(♂)杂交后代在胚胎发育方面[27],虹鳟Oncorhynchusmykiss(♀)×山女鳟Oncorhynchusmasou(♂)杂交后代在胚胎发育积温方面[28],均具有“母本效应”。本研究中,杂交三倍体泥鳅是以大连二倍体泥鳅为母本,而且杂交三倍体泥鳅的胚胎发育特征及时序与二倍体泥鳅相似,是否也具有“母本效应”,今后有必要进一步对杂交三倍体泥鳅及四倍体泥鳅的胚胎发育时序进行比较研究。
参考文献:
[1] Swarup H.Production of triploidy inGasterosteusaculeatus[J].Genetics,1959,44:129-142.
[2] Gervai J,Peter S,Nagy A,et al.Induced triploidy in carp,Cyprinuscarpio[J].J Fish Biol,1980,17(6):667-671.
[3] 桂建芳,肖武汉,梁绍昌,等.静水压休克诱导水晶彩鲫三倍体和四倍体的细胞学机理初探[J].水生生物学报,1995,28(2):49-55.
[4] 桂建芳,梁绍昌,朱蓝菲,等.异育银鲫人工繁育群体中复合四倍体的发现及其育种潜力[J].科学通报,1992,37(7):646-648.
[5] Liu Shao-jun,Liu Yun,Zhou Gong-jian,et al.The formation of tetraploid stocks of red crucian carp×common carp hybrids as an effect of interspecific hybridization[J].Aquaculture,2001,192:171-186.
[6] 刘少军,胡芳,周工建,等.三倍体湘云鲫繁殖季节的性腺结构观察[J].水生生物学报,2000,24(4):301-306.
[7] 周工建.三倍体新型鱼类——湘云鲫、湘云鲤[J].农村实用技术与信息,2006(6):12.
[8] 李康,李渝成,周暾.两种泥鳅染色体组型的比较研究[J].动物学研究,1983,4(1):75-80.
[9] 李渝成,李康.马口鱼和泥鳅的核型研究兼论鱼类染色体数目多态与分类的关系[J].武汉大学学报,1987(1):107-112.
[10] 印杰,赵振山,陈小奇,等.二倍体和四倍体泥鳅染色体组型比较[J].水生生物学报,2005,29(4):469-472.
[11] 李雅娟,印杰,王嘉博,等.中国におけるドジョウ倍数体の分布に関する研究[J].日本水産学会誌,2008,74(2):177-182.
[12] 李雅娟,庞义猛,于卓,等.利用天然四倍体泥鳅生产全三倍体泥鳅的初步研究[J].东北农业大学学报,2010,41(11):92-95.
[13] 李雅娟,钱聪,印杰,等.不同倍性泥鳅杂交后代染色体数目组成的研究[J].大连海洋大学学报,2012,27(4):326-332.
[14] Li Ya-juan,Zhang Ming-zhao,Qian Cong,et al.Fertility and ploidy of gametes of diploid,triploid and tetraploid loaches,Misgurnusanguillicaudatus,in China[J].Journal of Applied Ichthyology,2012,28:900-905.
[15] 刘少军,黎双飞,刘筠.异源四倍体鱼早期胚胎发育观察[J].湖南师范大学学报:自然科学版,2001,24(1):55-57.
[16] 刘海金,王常安,朱晓琛,等.牙鲆单倍体、三倍体、雌核发育二倍体和普通二倍体胚胎发育的比较[J].大连水产学院学报,2008,23(3):162-167.
[17] 赵振山,吴清江,高贵琴,等.大鳞副泥鳅雄核发育单倍体胚胎发育的研究[J].动物学研究,1999,20(3):230-234.
[18] 易念,张纯,王云,等.三倍体鲫鱼早期胚胎发育观察[J].湖南师范大学学报:自然科学版,2006,29(1):87-91.
[19] 谢仰杰,翁朝红,管延华,等.温度对花尾胡椒鲷胚胎发育的影响[J].集美大学学报:自然科学版,2001,6(2):138-143.
[20] 夏连军,施兆鸿,王建钢.温度对黄鲷胚胎发育的影响[J].上海水产大学学报,2002,15(2):163-168.
[21] 陈来钊,王子臣. 温度对海湾扇贝与虾夷扇贝及其杂交受精、胚胎和早期幼虫发育的影响[J].大连水产学院学报,1994,9(4):1-9.
[22] 郑文彪.泥鳅胚胎和幼鱼发育的研究[J].水产学报,1985,9(1):37-47.
[23] 张明宇.泥鳅的胚胎发育与生长[J].生物学通报,1999,34(3):20-22.
[24] 刘毅辉,陈永乐,朱新平,等.翘嘴鳜、斑鳜及其杂交后代的胚胎和胚后发育比较[J].大连海洋大学学报,2012,27(1):6-11.
[25] 宓国强,赵金良,贾永义,等.鳜(♀)×斑鳜(♂)杂种 F1的形态特征与微卫星分析[J].上海海洋大学学报,2010,19(2):145-150.
[26] 杨怀字,李思发,邹曙明.三角鲂和团头鲂正反交F1的遗传性状[J].上海水产大学学报,2002,11(4):305-309.
[27] 李竹,张全启,齐洁,等.牙鲆(♀)×圆斑星鲽(♂)杂交子代的胚胎及仔鱼发育[J].中国水产科学,2006,13(5):732-739.
[28] 陈术强,张玉勇,贾智英,等.虹鳟(♀)×山女鳟(♂)杂交种胚胎及仔鱼发育的研究[J].上海海洋大学学报,2010,19(6):757-762.
Abstract:The embryonic development was morphologically observed in hybrid triploid(DT,2n ♀×4n♂) and diploid loach (DD,2n ♀×2n♂)Misgurnusanguillicaudatus. The embryonic development in DD took 35 h 57 min at water temperature of(25±1)℃, while the embryonic development in DT was completed in 36 h 19 min at the same conditions. The embryonic development included six phases cleavage, blastula, gastrula, neurula, organogenesis, and hatching stages. Fertilized eggs in DT(DD) developed into cleavage stage in 40 min (40 min)after fertilization, blastula stage in 3 h 45 min(3 h 40 min) after fertilization, gastrula stage in 6 h 30 min(6 h 24 min) after fertilization, neurula stage in 9 h 32 min(9 h 20 min) after fertilization, organogenesis stage in 15 h 45 min(15 h 30 min) after fertilization, and hatching in 36 h 19 min(35 h 57 min) after fertilization. The sequence of embryonic development in DT was similar to that in DD, though blastula stage in DT was observed later than that in DD. The findings indicate that the hybrid triploid loach have normal embryonic development, providing biological evidences of embryonic development for breeding of triploid loach in aquaculture.
Key words:Misgurnusanguillicaudatus; hybrid triploid; diploid; embryonic development
DOI:10.3969/J.ISSN.2095-1388.2014.02.001
文章编号:2095-1388(2014)02-0103-06
收稿日期:2013-12-28
基金项目:国家自然科学基金资助项目(31272650);辽宁省科学技术基金资助项目(201102019);大连海洋大学博士启动基金资助项目(017208)
中图分类号:S966.4
文献标志码::A