
图1 摩洛哥专属经济区沙丁鱼采样站点示意图
Fig.1 Sampling stations of sardine Sardina pilchardus at EEZ waters of Morocco
摘要:根据2011年6—8月中国资源探捕渔船在摩洛哥专属经济区海域(21°00′~26°00′N、15°30′~20°00′W)采集的沙丁鱼Sardinapilchardus样本,对其生物学进行初步分析。结果表明:渔获物的雌雄性比为0.93∶1,叉长小于170 mm和大于230 mm的样本中雌雄性比均较大,分别为2.67∶1和3.3∶1,其余叉长范围的雌雄性比为(0.66~1.12)∶1;雌性个体的叉长范围为150~270 mm,优势叉长为190~230 mm,占雌性总数的81.51%,雄性个体的叉长范围为150~250 mm,优势叉长为190~230 mm,占雄性总数的84.47%;雌性个体的体质量范围为60~210 g,优势体质量为90~150 g,占雌性总数的85.46%,雄性个体的体质量范围为60~210 g,优势体质量为90~150 g,占雄性总数的93.44%;沙丁鱼体质量与叉长的关系方程为W雌性=7×10-6L3.1076(R2=0.8483,P<0.001),W雄性=9×10-6L3.0653(R2=0.8140,P<0.001);雌性个体中未成熟个体、成熟个体、繁殖后个体分别占76.47%、19.64%、3.89%,雄性个体中未成熟个体、成熟个体、繁殖后个体分别占69.04%、30.08%、0.88%;经拟合,半数雌性个体达初次性成熟时的叉长为228.14 mm,半数雄性个体达初次性成熟时的叉长为219.78 mm;对所取样本进行摄食情况分析,发现胃级为0级和1级的样本最多且所占比例相近,但未出现胃数为4级的样本。
关键词:摩洛哥南部沿岸;沙丁鱼;生物学特性
沙丁鱼Sardinapilchardus为鲱形目的典型物种,是重要的洄游性经济鱼类,广泛分布于西大西洋各海域及地中海[1-2]。作为近海暖水性鱼类,沙丁鱼一般不出现在外海和大洋。它们游速快,栖息于近海中上层,但秋冬季由于水温较低会移动到较深海域[3]。根据沙丁鱼在夜间易被亮光吸引的特性,捕捞者一般采用灯光诱捕法进行捕捞。摩洛哥地处非洲西北部,西临大西洋,海岸线长达2446 km。由于该海域受加那利寒流和涌升的影响,营养物质丰富,饵料充足,因此鱼类种类繁多,其中以中上层的沙丁鱼闻名于世[4]。据统计,2007年世界沙丁鱼渔获量为99万t,而摩洛哥沿岸的渔获量为57万t,占全世界沙丁鱼总渔获量的57%,近几年基本稳定在60万t左右,沙丁鱼产量位居世界第一[5]。本研究中,依据2011年6—8月中国资源探捕渔船在摩洛哥专属经济区海域采集的沙丁鱼样本,对其基础生物学进行初步分析,旨在为今后更好地利用沙丁鱼资源奠定基础。
1.1调查船和调查站位
调查船为上海蒂尔远洋渔业有限公司的“HUYU855号”渔船,该船属冷海水拖网渔船,总长为39.20 m,型宽为7.38 m,设计吃水为3.5 m,总吨位为413 t,主机功率为1491 kW。所使用的网具为四片式中层拖网,为荷兰MARITIEM公司设计的Pelagic trawl 650 MTR型渔具,网板采用6 m2立式V型网板,总重约1300 kg,采用双手纲连接。囊网最后部分采用PES聚乙烯网线,其他部分采用不同粗度的尼龙编绳或编线,囊网由单层网衣组成,前部网衣网目内径为44 mm,末端网目尺寸为55 mm。
沙丁鱼样本的采集海域为摩洛哥专属经济区海域(21°00′~26°00′N、15°30′~20°00′W),调查站位的设置如图1所示。

图1 摩洛哥专属经济区沙丁鱼采样站点示意图
Fig.1 Sampling stations of sardine Sardina pilchardus at EEZ waters of Morocco
1.2调查方法
作业渔法为单拖作业,拖曳时间根据渔场鱼群和渔获物数量而定,时间不定,可从几十分钟至6~7 h不等,拖速基本维持在4 kn以上。探捕时间为2011年6—8月,随机取样后共获得2036尾样本,冷冻后带回实验室进行测量与分析。
对沙丁鱼生物学的测定内容包括叉长、体质量、性别、性腺成熟度等。叉长用量鱼板测量,精确至1 mm。性别的确定主要基于对性腺的形状、外观和结构的分析。根据黄海水产研究所改编的《海洋水产资源调资手册》(1981年),将性腺成熟度划分为Ⅰ~Ⅵ期,并分为性未成熟(Ⅰ~Ⅲ期)、性成熟(Ⅳ~Ⅴ期)和繁殖后(雄性为排精后,雌性为产卵后)(Ⅵ期)3个等级。根据陈新军[6]对鱼类食性研究中所用的直接观察法进行描述,将沙丁鱼的胃级分为0~4五个等级,其中0级为空胃,1级为胃含物不足1/2,2级为胃含物占胃的1/2,3级为胃含物超过胃的1/2,4级为满胃。
1.3数据处理
(1)利用频度分析法分析沙丁鱼样品的叉长和体质量组成,组间距分别为20 mm和30 g。
(2)采用线性回归法,求得雌雄叉长与体质量之间的关系:
W=aLb。
其中:W为体质量(g);L为叉长(mm);a、b为估算参数。
(3)利用方差检验(ANOVA),对不同性腺成熟度个体的叉长和体质量进行比较,差异特别显著的,用最小显著性差异法(LSD)进行组间多重比较,显著性水平设为0.05。
(4)采用Logistic曲线,推算不同性别的沙丁鱼个体达初次性成熟时的叉长方程为
![]() 。
。
其中:Pi为成熟个体占组内样本的比例;Li为各组叉长(mm);c、d为估算参数。
沙丁鱼个体初次性成熟时的叉长L50%=-c/d。
2.1叉长和体质量的组成
对叉长分析的结果表明:摩洛哥海域沙丁鱼样本中,雌性个体的叉长范围为150~270mm,优势叉长为190~230mm,占雌性总数的81.51%;雄性个体的叉长范围为150~250mm,优势叉长为190~230mm,占雄性总数的84.47%(图2)。雌性个体叉长在较小个体(<190mm)和较大个体(>230mm)范围均有一定量的分布,而雄性个体叉长较为集中(190~230mm)。雌性的叉长较雄性大,不同性别间存在显著性差异(t=4.856,P=0.000<0.01)。
对体质量分析的结果表明:沙丁鱼雌性个体的体质量范围为60~210g,优势体质量为90~150g,占雌性总数的85.46%;雄性个体的体质量范围为60~210g,优势体质量为90~150g,占雄性总数的93.44%(图2)。雌、雄个体的优势体质量相差不大,但雄性优势体质量的比例相对较高。
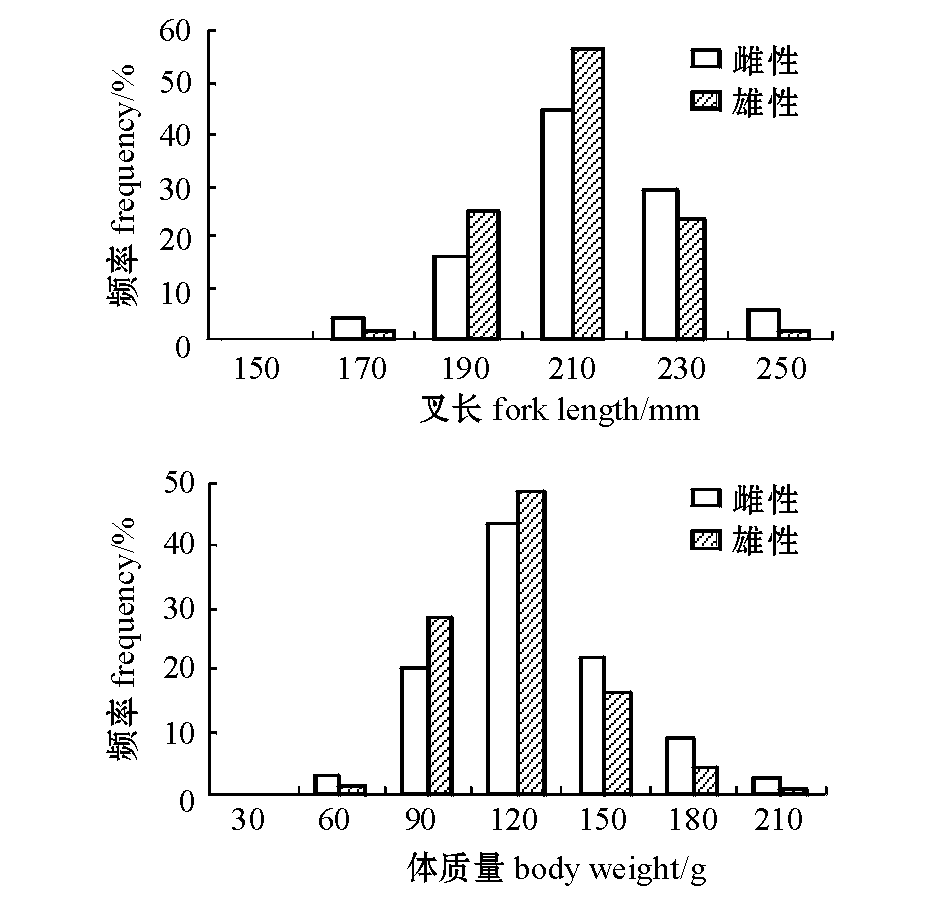
图2 沙丁鱼叉长和体质量的频率分布
Fig.2 Distribution histogram of fork length and body weight in sardine Sardina pilchardus
2.2叉长与体质量的关系
通过对体质量与叉长的对应值进行分析,得到二者之间的相关性。由于雌、雄个体的叉长和体质量均存在显著性差异,为此,本研究中将雌、雄分开进行讨论,结果如图3所示。雌、雄沙丁鱼的体质量(W)与叉长(L)的关系方程分别为
W雌性=7×10-6L3.1076,R2=0.8483,P<0.001,
W雄性=9×10-6L3.0653,R2=0.8140,P<0.001。
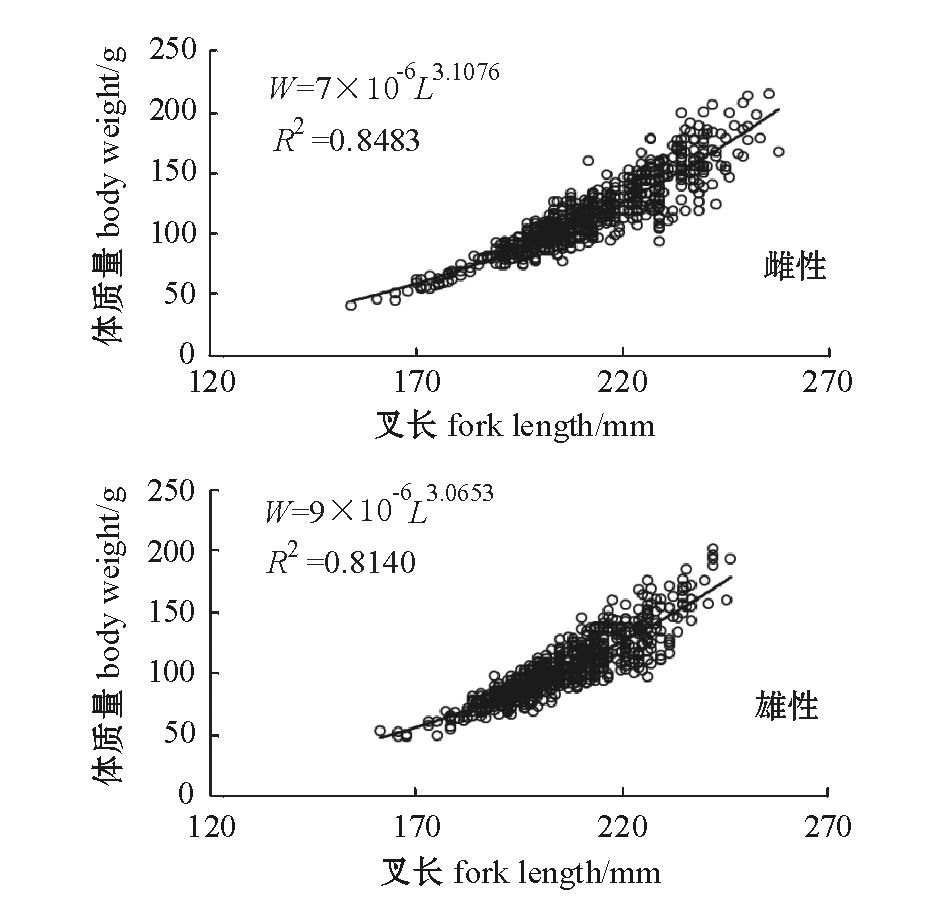
图3 沙丁鱼体质量与叉长的关系
Fig.3 Relationship between fork length and body weight in sardine Sardina pilchardus
2.3性比分析
经过对2036尾沙丁鱼样本进行鉴别,样本中雌性958尾(占47.05%),雄性1026尾(占50.39%),性别未定52尾(占2.56%),雌雄性比为0.93∶1。从图4可见:叉长≤170 mm和叉长>230 mm的样本中,雌雄性比均较大,分别为2.67∶1和3.3∶1,叉长为171~230 mm的样本中雌雄性比为(0.66~1.12)∶1。
2.4性成熟度组成分析
统计分析发现:雌性沙丁鱼个体中未成熟个体、成熟个体、繁殖后个体分别占76.47%、19.64%、3.89%,其中,Ⅰ~Ⅵ期个体分别占2.21%、38.13%、36.13%、8.40%、11.24%和3.89%,大部分样本都处在Ⅱ期和Ⅲ期,未成熟个体占样本的大多数;对于雄性个体,未成熟个体、成熟个体、繁殖后个体分别占69.04%、30.08%、0.88%,其中,Ⅱ~Ⅵ期个体分别占47.46%、21.58%、18.26%、11.82%和0.88%,繁殖后的个体非常少,未成熟个体所占比例比雌性大。无论雌性还是雄性,沙丁鱼的叉长和体质量均随性腺成熟度的增大而增大(表1)。由于雌性Ⅰ期样本较少,而雄性Ⅰ期没有样本以及Ⅵ期个体的样本较少,因此,本研究中未对这些发育期的数据进行分析讨论。
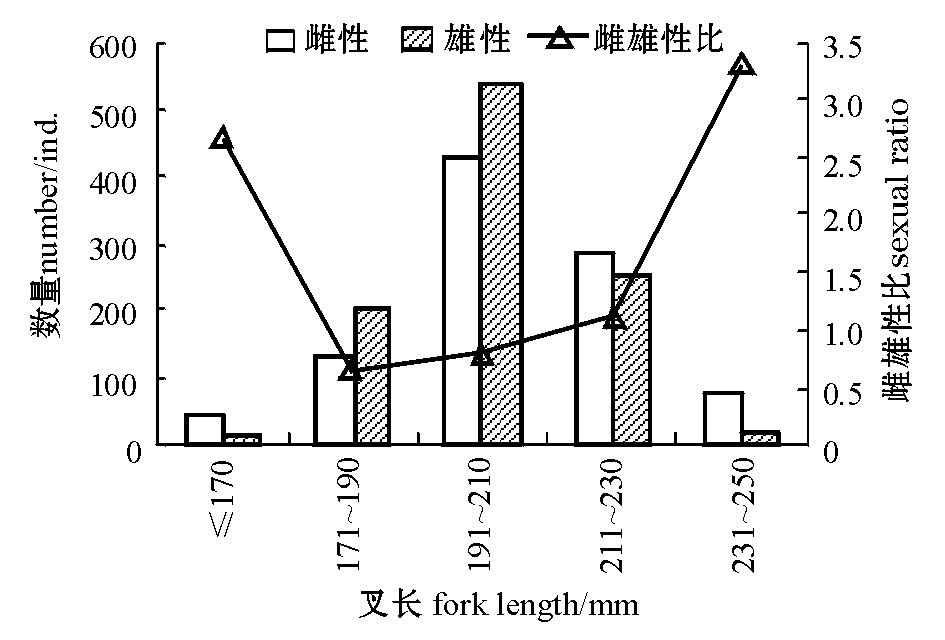
图4 不同叉长范围沙丁鱼的雌雄性比组成变化
Fig.4 Variation in sexual ratio in sardine Sardina pilchardus in different fork length groups
经ANOVA分析发现,雌性沙丁鱼不同性腺成熟度期的叉长(F=70.39,P=0.000<0.01)和体质量(F=33.782,P=0.000<0.01)均存在极显著性差异。经LSD分析表明,雌性Ⅱ期和Ⅲ期之间以及与其他等级的叉长和体质量均存在极显著性差异(P=0.000<0.01),Ⅳ期、Ⅴ期和Ⅵ期之间的叉长和体质量均无显著性差异(P>0.05)(表1)。
雄性沙丁鱼不同性腺成熟度期的叉长(F=28.428,P=0.000<0.01)和体质量(F=12.084,P=0.000<0.01)均存在极显著性差异。经LSD分析表明,雄性Ⅱ期的叉长与其他等级均存在极显著性差异(P=0.000<0.01),Ⅲ期与Ⅴ期的叉长存在极显著性差异(P=0.000<0.01),而Ⅲ期与Ⅳ期以及Ⅳ期与Ⅴ期的叉长均无显著性差异(P>0.05);雄性Ⅱ期的体质量与Ⅳ期和Ⅴ期以及Ⅲ期与Ⅴ期的体质量均存在极显著性差异(P=0.001<0.01),Ⅱ期与Ⅲ期的体质量存在显著性差异(P=0.049<0.05),而Ⅲ期与Ⅳ期以及Ⅳ期与Ⅴ期的体质量均无显著性差异(P>0.05)(表1)。
对同一叉长组的雌性个体比较发现(图5),在叉长≤170 mm的样本中,未出现Ⅳ期和Ⅵ期性腺,出现最多的是Ⅱ期性腺,Ⅰ期性腺次之;在叉长范围为171~190 mm的样本中,各期性腺均有出现,最多的是Ⅱ期性腺,Ⅲ期性腺次之;在叉长范围为191~210 mm的样本中,Ⅰ期性腺仅有1尾,出现最多的是Ⅱ期性腺,Ⅲ期性腺次之;在叉长范围为211~230 mm的样本中,未出现Ⅰ期性腺,出现最多的是Ⅲ期性腺,Ⅱ期性腺次之;在叉长范围为231~250 mm的样本中,未出现Ⅰ期性腺,出现最多的是Ⅴ期性腺,Ⅳ期性腺次之。对同一叉长组的雄性个体比较发现(图5),在叉长≤170 mm的样本中只出现了Ⅱ期性腺;在叉长范围为171~190 mm的样本中,也未出现Ⅵ期性腺,出现最多的是Ⅱ期性腺,其他各期分布较均匀;在叉长范围为191~210 mm的样本中,各期性腺都有出现,最多的是Ⅱ期性腺,Ⅲ期性腺次之;在叉长范围为211~230 mm的样本中,Ⅵ期性腺个体仅为6尾,其他各期性腺数量基本一致;在叉长范围为231~250 mm的样本中,Ⅱ、Ⅲ、Ⅳ、Ⅴ期性腺均有出现,出现最多的是Ⅴ期性腺。
表1不同性腺成熟度期叉长和体质量的分布
Tab.1DistributionofforklengthandbodyweightinsardineSardinapilcharduswithdifferentmaturity
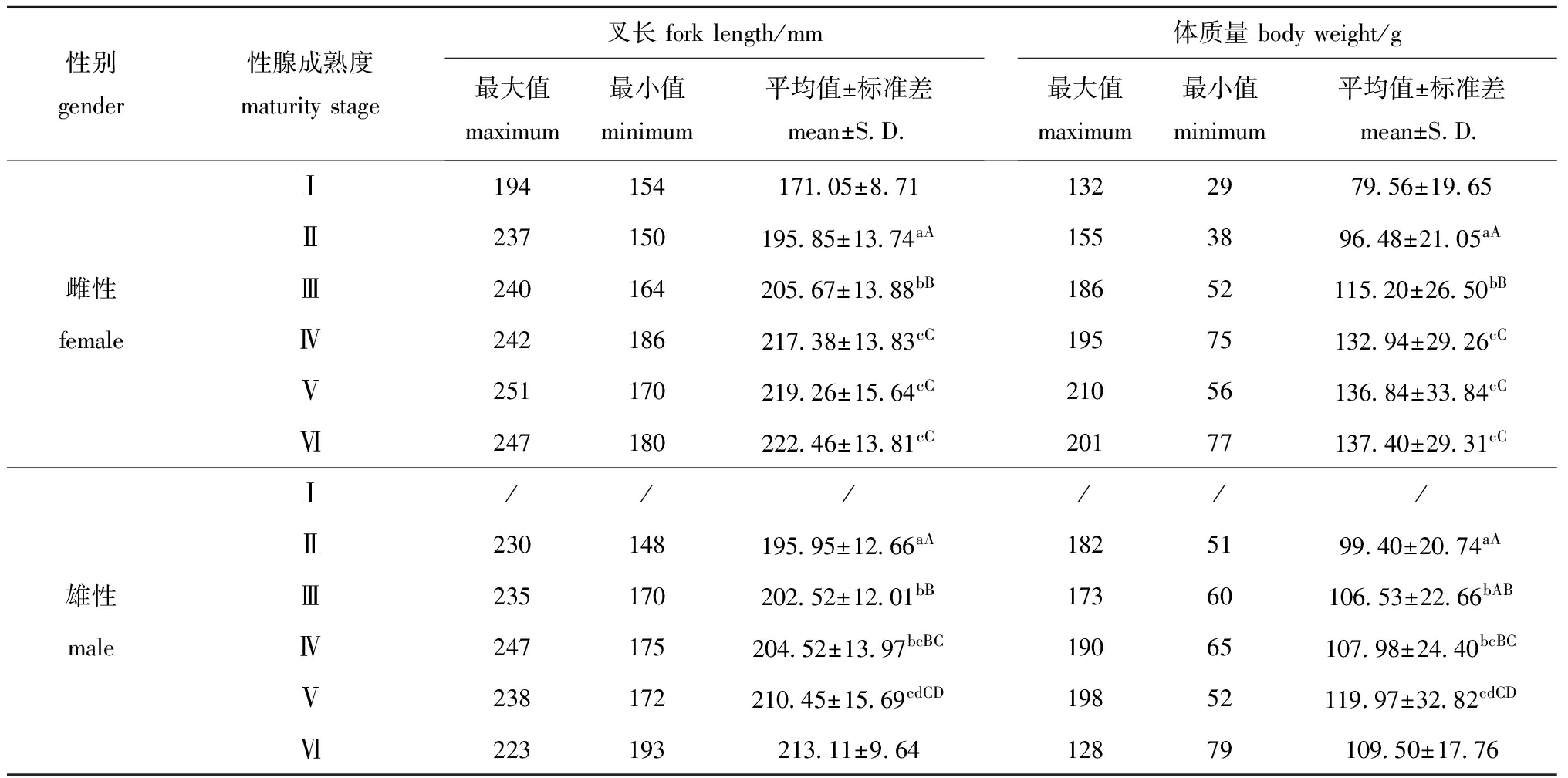
性别gender性腺成熟度maturitystage叉长forklength/mm最大值maximum最小值minimum平均值±标准差mean±S D 体质量bodyweight/g最大值maximum最小值minimum平均值±标准差mean±S D Ⅰ194154171 05±8 711322979 56±19 65Ⅱ237150195 85±13 74aA1553896 48±21 05aA雌性Ⅲ240164205 67±13 88bB18652115 20±26 50bBfemaleⅣ242186217 38±13 83cC19575132 94±29 26cCⅤ251170219 26±15 64cC21056136 84±33 84cCⅥ247180222 46±13 81cC20177137 40±29 31cCⅠ//////Ⅱ230148195 95±12 66aA1825199 40±20 74aA雄性Ⅲ235170202 52±12 01bB17360106 53±22 66bABmaleⅣ247175204 52±13 97bcBC19065107 98±24 40bcBCⅤ238172210 45±15 69cdCD19852119 97±32 82cdCDⅥ223193213 11±9 6412879109 50±17 76
注:同列中标有不同大写字母者表示组间有极显著性差异(P<0.01),标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different capital letters within the same column are very significantly different at the 0.01 probability level,means with different letters being significantly different at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
利用Mann-Whitney U检验发现,雌雄之间性腺成熟度的分布存在显著性差异(Z=2.594,P=0.000<0.05)。用列联表法(contingency tables)对不同叉长组的雌雄个体性成熟度进行分析,结果表明:叉长≤170 mm(χ2=11.691,df=3,P=0.009<0.05)、叉长为171~190 mm(χ2=31.275,df=4,P=0.000<0.05)和叉长为211~230 mm(χ2=25.521,df=5,P=0.000<0.05)3个叉长组雌雄个体性腺成熟度的分布均存在显著性差异,而叉长为191~210 mm(χ2=7.77, df=5,P=0.169>0.05)和231~250 mm(χ2=5.863,df=4,P=0.210>0.05)两个组则不存在显著性差异。

图5 不同叉长组沙丁鱼性成熟度的组成
Fig.5 The profile of maturity stage of sardine Sardina pilchardus in different fork length groups
2.5半数个体达初次性成熟时的叉长
经过Logistic曲线的拟合,雌性和雄性的半数个体达初次性成熟时的叉长曲线如图6所示,方程分别为
雌性![]() ,
,
R2=0.9981,n=952,P<0.001,
雄性![]() ,
,
R2=0.9821,n=1024,P<0.001。
半数个体达初次性成熟时的叉长为L50%:雌性个体L50%=228.14 mm,雄性个体L50%=219.78 mm。
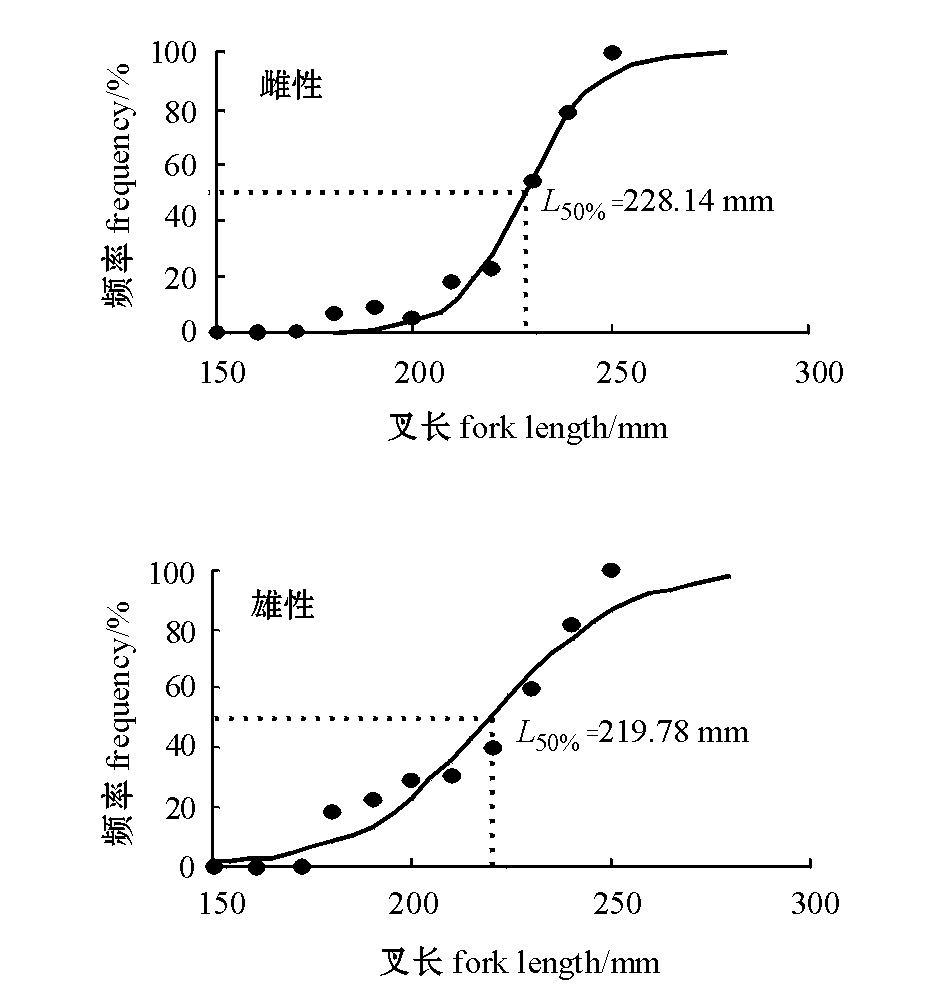
图6 不同性别沙丁鱼初次性成熟时的叉长(L50%)
Fig.6 The fork length(L50%) at first maturity in females and males of sardine Sardina pilchardus
2.6摄食等级和比例组成
对所取样本进行摄食等级分析,发现胃级为0级和1级的样本最多,且所占比例相近(不分雌雄),而并未出现胃级为4级的样本。对雌雄个体分别进行分析(图7),发现雌性个体中,胃级为0级、1级、2级、3级的样本分别占44.50%、42.03%、11.53%、1.94%,未出现胃级为4级的样本;雄性个体中,胃级为0级、1级、2级、3级的样本分别占46.76%、43.02%、9.21%、1.01%,也未出现胃级为4级的样本。
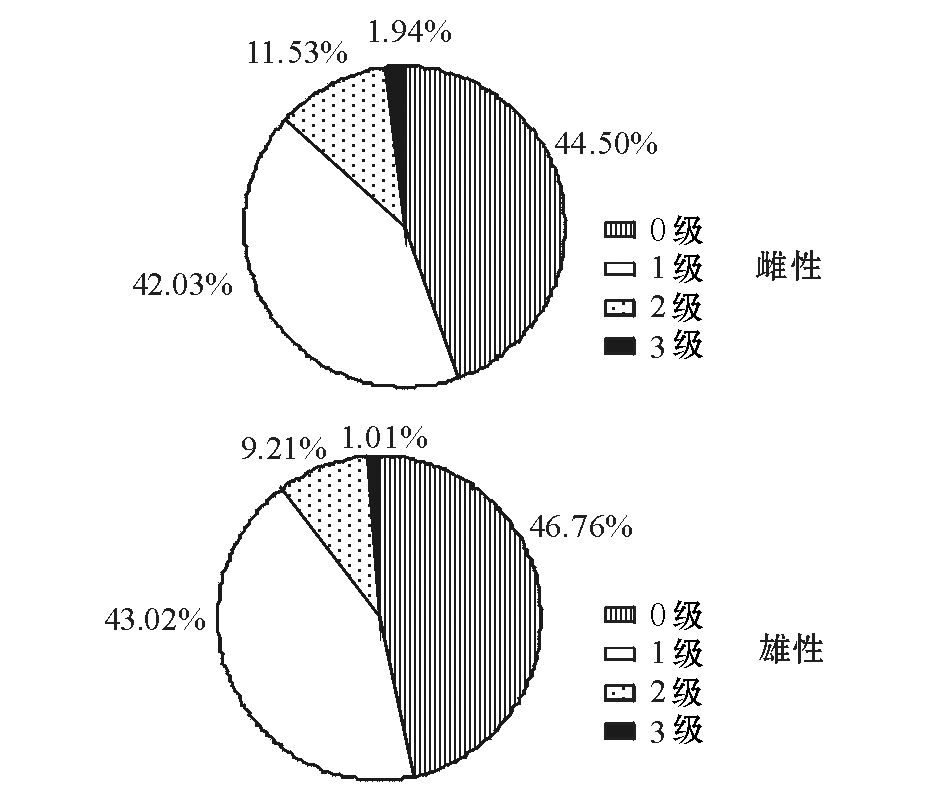
图7 沙丁鱼摄食等级分析
Fig.7 Analysis of food item proportion in sardine Sardina pilchardus
沙丁鱼属于较小个体的上层鱼类,生长迅速,年龄最高可达到9龄[7-8]。本研究中发现,雌雄个体的优势叉长均在190~230 mm范围内,雌性个体的叉长大于雄性个体,不同性别之间的叉长分布和体质量分布均存在显著性差异。摩洛哥海域沙丁鱼的生长在不同性别中存在着差异[9],这在对其他临近海域不同群体沙丁鱼的研究中也有所报道[10-12]。从叉长与体质量的关系中也可以发现,雌性个体的生长较快,这就更有利于沙丁鱼的繁殖,对物种本身也是一种保护策略[5]。
摩洛哥海域沙丁鱼的性别比例在不同的叉长范围内有着不同的变化。在较小的叉长范围(<170 mm)和较大的叉长范围(>231 mm)内,雌性比例明显高于雄性,在其他叉长范围内雄性略多于雌性。Amenzoui等[5]对摩洛哥海域沙丁鱼的繁殖生物学进行研究时也发现,在较小的叉长范围内,雌性个体较多,这可能是因为该地区为沙丁鱼的繁殖场,该地聚集了大量性成熟的雌性沙丁鱼所致。这种现象在摩洛哥北岸的大西洋海域[10]和阿尔沃兰海海域[13]也有发现。Parrish等[14]根据地理分布和生物学特征,将北大西洋的沙丁鱼分为4个种群:分布于北海 (57°N) 至西班牙北岸(43°N)的北欧大西洋种群(Septentrional Atlantic stock),分布于葡萄牙沿岸至直布罗陀海峡(43°N~36°N)的南欧大西洋种群(Meridional Atlantic group),分布于摩洛哥沿岸(36°N~28°N)的摩洛哥种群(Moroccan stock),以及分布于毛里塔尼亚沿岸(西撒哈拉地区沿岸)(28°N~21°N)的撒哈拉种群(Saharian stock)。从地理分布上看,本研究中的样本属于撒哈拉种群,属于大个体。不同种群在不同时期的性别比例上也有一定的差异。
本研究中发现,未成熟的雌雄个体均超过样本的65%以上。沙丁鱼全年都产卵,但是产卵的高峰期主要在每年的10月至翌年2月[5,15],本研究中的采样时间并不在产卵高峰期内,因此也是样本中未成熟个体较多的主要原因。叉长和体质量都随着性腺成熟度的上升而增加,从叉长和体质量的增加趋势来看,都可以发现未成熟个体(Ⅰ期、Ⅱ期和Ⅲ期)与成熟个体(Ⅳ期、Ⅴ期和Ⅵ期)之间存在显著性差异,同时Ⅰ期、Ⅱ期和Ⅲ期之间也存在显著性差异。这说明沙丁鱼在未成熟时,生长迅速,各个时期均有一定的差异;而到性成熟阶段,生长速度减缓,各个时期的差异不大。鱼类在生长过程中,在初期生长很快,大量的能量仅供给鱼体的生长;而在后期,由于大量的能量还要供给性腺的发育,因此个体生长的速度就相对变慢[16]。在对不同叉长的个体进行分析时发现,雌雄之间的性成熟度分布存在显著性差异,这与不同性别沙丁鱼的性腺成熟时间不同有关。而在较小个体时(<190 mm),雌性需要迅速生长以便早于雄性,在叉长为211~230 mm阶段,雌性需要大量的能力供给卵巢生长,所以这两个阶段雌性的性腺成熟度分布与雄性有很大的不同。叉长为191~210 mm时沙丁鱼处在生长的中间期,叉长为231~250 mm时大部分沙丁鱼已经达到性成熟期,因此,这两个阶段的雌雄差异并不大。另外,一些生态原因,如可利用的食物和温度等都会对沙丁鱼的性成熟产生影响[17-18]。
本研究中,对沙丁鱼达到初次性成熟时的叉长进行分析,结果发现,雌性和雄性的初次性成熟时的叉长比较接近,但是与其他学者的研究结果有所差异[5,11,19-20]。撒哈拉种群属于较大群体,因此,初次性成熟时的叉长会较其他地区的种群大。而样本中没有发现满胃个体,基本上都处于0~1级,这可能与未成熟个体较多和捕捞的时间有关。
沙丁鱼主要是欧洲沿岸国家和北非国家的捕捞对象,中国首次派船队对该海域进行探捕。本研究基于2011年6—8月中国探捕船采集的样本,对沙丁鱼的生物学特征进行了初步分析。中国学者之前也对中国近岸的沙丁鱼类进行过研究[21-23],但目前尚未对其他海域不同种类的沙丁鱼进行过调查研究,因此,在今后的研究中应该更科学地确定样本采集时间,并结合相关的海洋环境数据,如温度[24]、叶绿素a[25]等,尽量认定沙丁鱼的年龄[26],以便对沙丁鱼的年龄生长和生活史有更深入地了解。
参考文献:
[1] Furnestin J,Furnestin M L.La reproduction de la sardine et de l’anchois des c tes atlantiques du Maroc (saisons et aires de ponte)[J].Rev Trav Inst Pêches Marit,1959,23(1):79-104.
tes atlantiques du Maroc (saisons et aires de ponte)[J].Rev Trav Inst Pêches Marit,1959,23(1):79-104.
[2] Ettahiri O.Étude de la phase planctonique de la sardine,Sardinapilchardus(Walb.),et de l’anchois,Engraulisencrasicolus(L.)des c tes atlantiques marocaines,thése[D].Brest:Universitéde Bretagne Occidentale,1996:262.
tes atlantiques marocaines,thése[D].Brest:Universitéde Bretagne Occidentale,1996:262.
[3] Muzinic R.Migrations of adult sardines in the central Adriatic[J].Netherland Journal of Sea Research,1973,7:19-30.
[4] Sinovcic G.Stock size assessment of sardine,Sardinapilchardus(Walb.) population from the cenatral eastern Adriatic on the basis of VPA method[J].Acta Adriatica,1991,32(2):869-884.
[5] Amenzoui K,Ferhan-Tachinante F,Yahyaoui A,et al.Analysis of the cycle of reproduction ofSardinapilchardus(Walbaum,1792) off the Moroccan Atlantic coast[J].C R Biologies,2006,329(10):892-901.
[6] 陈新军.渔业资源与渔场学[M].北京:海洋出版社,2004:27-32.
[7] Sinovcic G.Estimation of growth,mortality,production and stock size of sardine,Sardinapilchardus(Walb.),from the middle Adriatic[J].Acta Adriatica,1986,27(1/2):67-74.
[8] Sinovcic G.Responsible exploitation of the sardineSardinapilchardus(Walb.),population in the coastal region of the Adriatic Sea[J].Periodicum Biologorum,2000,102(Suppl.1):47-54.
[9] Turner S C,Grimes C B,Able K W.Growth,mortality,and age/size structure of the fisheries for the tilefish,Lopholatiluschaemaelonticeps,in the middle Atlantic-Southern New England region[J].Fisheries Bulletin,1983,81:751-763.
[10] Belvèze H.Biologie et dynamique des populations de sardine(Sardinapilchardus) peuplant les c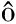 tes atlantiques et proposition pour un aménagement des pêcheries,thèse d’état[D].Bretagne:Universitéde Brest Occidentale,1984:531.
tes atlantiques et proposition pour un aménagement des pêcheries,thèse d’état[D].Bretagne:Universitéde Brest Occidentale,1984:531.
[11] Abad R,Giraldez A.Reproduccion,factor de condicion y talla de primer madurez de la sardina,Sardinapilchardus(Walb.),del litoral de Malaga,mar de Alboran (1989-1992)[J].Bol Inst Esp Oceanogr,1993,9(1):145-155.
[12] Boely T.Étude du cycle sexuel de la sardinelle ronde (SardinellaauritaVal.1847) au Sénégal,Cah.ORSTOM[J].Ser Oceanogr,1982,17(1):3-13.
[13] Garcia A,Franco C,Sold A,et al.Sardina (Sardinapilchardus,Walb.) daily egg production of the Galicia,Cantabrian and Bay of Biscay Waters[J].ICES C M,1991,H(37):15.
[14] Parrish R H,Serra R,Grant W S.The monotypic sardines,SardinaandSardinops:their taxonomy,distribution,stock structure,and zoogeography[J].Can J Fish Aquat Sci,1989,46(11):2019-2036.
[15] Muzinic R.Contributonà l’ étude de l’oecologie de la sardina (SardinapilchardusWalb.) dans l’Adriatique orientale[J].Acta Adriatica,1954,5(10):1-219.
[16] Sinovcic G,Kec V C,Zorica B.Population structure,size at maturity and condition of sardine,Sardinapilchardus(Walb.,1792),in the nursery ground of the eastern Adriatic Sea (Krka River Estuary,Croatia)[J].Estuarine,Coastal and Shelf Science,2008,76(4):739-744.
[17] Nikolsky G V.The Ecology of Fishes[M].London and New York:Academic Press,1963:352.
[18] Hempel G.On the importance of larval survival for the population dynamics of marine food fish[J].California Cooperative Oceanic Fisheries Investigations,1965,10:13-23.
[19] Villamil M M, Nespereira J M L,Pajuelo J M G,et al.Periodo reproductory madurez sexual de la sardinaSardinapilchardus(Walbaum,1792) en aguas de Gran Canaria (islas Canarias)[J].Bol Inst Esp Oceanogr,1997,13(1/2):47-55.
[20] Perez N,Porteiro C,Alvarez F.Contribucion al conocimiento de la biologia de la sardina de Galicia[J].Bol Inst Esp Oceanogr,1985,2(3):27-37.
[21] 王启华,姚善成,邱兆星.黄海区远东拟沙丁鱼的年龄与生长[J].海洋通报,1988,7(1):56-62.
[22] 杨圣云,丘书院.台湾海峡南部金色小沙丁鱼的年龄和生长[J].台湾海峡,1984,3(1):100-111.
[23] 高天翔,杨天燕.中、日青鳞小沙丁鱼形态学比较分析[J].中国海洋大学学报:自然科学版,2008,38(2):201-206.
[24] Ramzi A,Hbid M L,Ettahiri O.Larval dynamics and recruitment modeling of the Moroccan Atlantic coast sardine (Sardinapilchardus)[J].Ecological Modelling,2006,197(3/4):296-302.
[25] Ganias K.Linking sardine spawning dynamics to environmental variability[J].Estuarine,Coastal and Shelf Science,2009,84:402-408.
[26] Dulcic J.Estimation of age and growth of sardine,Sardinapilchardus(Walbaum,1792),larvae by reading daily otolith increments[J].Fisheries Research,1995,22(3):265-277.
Abstract:The biological characteristics of sardineSardinapilcharduswere evaluated by the samples collected from the Chinese resource agent capture fishing boat working in the Morocco coastal waters(21°00′-26°00′N, 15°30′-20°00′W)from June to August in 2011. The results showed that the sex ratio (female versus male) was found 0.93∶1 in the samples; larger sex ratio in the individuals with fork length less than 170 mm (2.67∶1) and more than 230 mm (3.3∶1), others were 0.66∶1 to 1.12∶1, than the others. The female sardine had fork length from 150 mm to 270 mm, the dominant size between 190 mm and 230 mm, accounting for 81.51%, and the male sardine showed fork length from 150 mm to 250 mm, the dominant size between 190 mm to 230 mm, accounting for 84.47%; the body weight of the female sardine was ranged from 60 g to 210 g, the dominant body weight between 90 g to 150 g, accounting for 85.46%, the body weight of male sardine ranged from 60 g to 210 g, the dominant between 90 g to 150 g, representing for 93.44%. The length-weight relationship of the sardine was expressed asW=7×10-6L3.1076(R2=0.8483,P<0.001) (female)andW=9×10-6L3.0653(R2=0.8140,P<0.001) (male). There were 76.47% of immature individuals, 19.64% mature individuals, and 3.89% recovery individuals in the female samples, while 69.04% of immature individuals, 30.08% mature individuals, and 0.88% recovery individuals were observed in the male samples. The female sardines were found to have fork length of 228.14 mm and the male ones 219.78 mm when 50% of the sardines were first mature. The food item analysis revealed that most of the individuals showed 0 and 1 stomach fullness, no 4 stomach fullness.
Key words:south of Morocco coastal;Sardinapilchardus; biological characteristics
DOI:10.3969/J.ISSN.2095-1388.2014.01.018
文章编号:2095-1388(2014)01-0086-07
收稿日期:2013-06-07
基金项目:农业部远洋渔业资源调查和探捕项目(2130135);国家“863”计划项目(2012AA092303)
中图分类号:S932.4
文献标志码::A