摘要:在水温为14~17 ℃条件下,将大规格施氏鲟Acipenserschrenckii幼鱼(225.69 g±32.28 g)随机放入9个四边形水泥池(池底面积为18.23 m2)中流水饲养,分别设置5.5、8.0、11.0 kg/m33个放养密度组,每组设3个平行,养殖试验共进行70 d, 观察并研究放养密度对施氏鲟幼鱼生长、摄食和肌肉组分的影响。结果表明:施氏鲟幼鱼的终末体质量、特定生长率、日增重和摄食率等均随养殖密度的增大而显著降低(P<0.05),饲料系数随养殖密度的增大而显著升高(P<0.05),密度为8.0 kg/m3的组生长效率最高;肌肉中的粗蛋白质和粗脂肪含量随养殖密度的增大而显著降低(P<0.05),而水分和灰分含量的变化不明显(P>0.05);试验期间,水体中的溶解氧浓度随养殖密度的增大显著降低(P<0.05),而氨氮和化学耗氧量浓度则随养殖密度的增大而显著升高(P<0.05)。研究表明,8.0 kg/m3的放养密度更适合大规格施氏鲟幼鱼的养殖,过高的放养密度会对施氏鲟幼鱼生长及其肌肉品质产生不利影响。
关键词:施氏鲟;放养密度;生长;摄食;肌肉组分;水质
鲟鱼是一种古老而珍稀的鱼类,素有“水中活化石”之称,由鲟鱼卵加工成的鱼子酱,有着“黑色黄金”的美誉,深受国内外消费者的青睐[1]。施氏鲟Acipenserschrenckii隶属于鲟形目、鲟科、鲟属,俗称七粒浮子,具有个体大、生长快、成活率高、病害少、肉味鲜美、营养丰富等特点,是中国现存鲟鱼中最具经济价值的优质珍稀种类之一[2]。目前,施氏鲟已经成为一种优良的淡水养殖新品种,并且可以在海水中驯养,其开发利用前景十分广阔。
随着人工繁育和用配合饲料对施氏鲟驯养的成功, 其人工养殖规模逐年增加。施氏鲟的养殖方式主要有网箱养殖、池塘养殖、工厂化养殖和大面积放养[3],其中具有节能、高产和产品安全可控等优点的工厂化流水养殖已成为其主要的养殖方式。而在工厂化养殖中,养殖密度是直接影响养殖对象的生长性能、健康状况、肌肉品质、摄食情况和养殖产量等的关键因素之一[4]。研究表明,不适宜的养殖密度可导致鱼类生长减慢、死亡率升高、免疫力降低和行为发生改变等[5-6]。而确定每个养殖品种和生长阶段最适宜的养殖密度不仅有利于提高产品质量,而且可以增加产量,提高养殖效益[7]。国内外关于鲟鱼养殖密度的研究多集中在稚鱼或小规格幼鱼阶段[8-9],对大规格施氏鲟幼鱼养殖密度的研究目前尚未见报道。本研究中,结合生产实际,在流水池塘养殖模式下进行大规格施氏鲟幼鱼养殖试验,研究了不同养殖密度对池塘水质指标和施氏鲟幼鱼生长、摄食和肌肉组分的影响,探讨流水池塘养殖模式下大规格施氏鲟幼鱼适宜的放养密度,以期为实际生产中施氏鲟幼鱼的合理放养和健康养殖提供参考依据。
1.1材料
试验在山东鲟龙科技发展有限公司(山东省济宁市泗水县)进行,试验鱼为同一批卵孵化而成,体质健康,规格基本一致,施氏鲟初始体质量为(225.69±32.28)g,体长为(30.82±2.96)cm。
试验池为9个四边形水泥池,池底面积为18.23 m2,水深约45 cm,每个水泥池设有一个由水阀控制的进水口和一个位于中央的出水口。试验用水为经曝气、沙滤、沉淀后的地下井水,水温为14~17 ℃,溶解氧大于8.0 mg/L,pH为7.5~8.5,出水口流速控制在15.41 L/min左右。
1.2方法
1.2.1 试验设计 试验共设置3个养殖密度:LSD组(低密度组,每池200尾)、MSD组(中密度组,每池300尾)和HSD组(高密度组,每池400尾),相应的养殖密度分别为5.5、8.0、11.0 kg/m3,每个密度组均设3个平行。试验于2012年4月6日开始放鱼,暂养待适应新环境后,开始正常投喂和测定各项指标,试验共进行70 d。
1.2.2 投喂和采样 试验期间投喂宁波天邦公司生产的鲟鱼配合饲料,根据鱼体质量的变化使用对应规格的饲料。每天投喂3次,投喂量为鱼体质量的1.0%~1.5%,观察并记录投料、剩料和摄食情况。每隔10 d采样1次,从每个池中随机取4尾鱼,立即将鱼放入200 mg/L的MS-222中快速麻醉,称量体质量,测量体长,然后取其肝脏、肌肉等组织用于后续分析。从每个池中随机捞取50尾鱼,称量湿重(重复3次)估算平均体质量,试验期间根据抽样估算的体质量变化计算投喂量。
1.2.3 水质指标的测定 试验期间,每天用HACH水质测定仪(HQ40d,美国)测定水体中的温度、溶解氧(DO)和pH;每隔10 d,用纳氏试剂法和酸性高锰酸钾法分别测定一次养殖水体中的氨氮![]() -N)浓度和化学耗氧量(COD)。
-N)浓度和化学耗氧量(COD)。
1.2.4 肌肉组分的测定 试验结束时,从每个池中随机捞取12尾鱼,称量体质量,测量体长,并在冰上解剖,取其肌肉,称量肌肉鲜重。然后将肌肉样品放在105 ℃烘箱中烘至恒重,通过计算前后差值获得水分含量。采用马福炉550 ℃灼烧法(GB/T5009.4—1985)、索氏抽提法(GB/T5009.6—1985,瑞士BUCHI公司36680型脂肪抽提仪)、凯氏定氮法(GB/T5009.5—1985,丹麦FOSS公司2300型自动定氮仪)分别测定灰分、粗脂肪和粗蛋白质含量,每个测定均重复3次。
1.2.5 生长率与摄食率的测定与计算
特定生长率=(lnW2-lnW1)/(t2-t1)×100%,
日增重=(W2-W1)/(t2-t1),
增重率=(W2-W1)/W1×100%,
净增重=(W2/S-W1/S)/(t2-t1),
生长效率=[(W2-W1)n/F]×100%,
日摄食量=F/[n(t2-t1)],
日摄食率=F/[(t2-t1)n(W2+W1)/2]×100%, 饲料系数=F/[n(W2-W1)],
肥满度=W/L3×100。
其中:t1、t2为试验时间(d);W1、L1分别为时间t1时的体质量(g)和体长(cm);W2、L2分别为时间t2时的体质量(g)和体长(cm);S为池塘面积(m2);n为鱼尾数;F为总投饵量(g)。
1.3数据处理
试验结果用SPSS 17.0 软件进行统计分析, 采用单因子方差分析法进行方差分析,用Duncan法进行组间多重比较,显著性水平设为0.05。试验数据均用平均值±标准差表示。
2.1池塘水质的变化
从表1可见:试验开始时,不同养殖密度组各水质指标之间均无显著性差异(P>0.05)。试验结束时,各密度组水温基本保持一致,均在15.4 ℃左右;随养殖密度的增大,水质逐渐变差,![]() -N和COD浓度均显著升高(P<0.05);DO随养殖密度的增大逐渐降低(P<0.05),但仍能维持在6.40 mg/L以上;pH也随养殖密度的增大而降低,但各密度组间无显著性差异(P>0.05)。
-N和COD浓度均显著升高(P<0.05);DO随养殖密度的增大逐渐降低(P<0.05),但仍能维持在6.40 mg/L以上;pH也随养殖密度的增大而降低,但各密度组间无显著性差异(P>0.05)。
2.2养殖密度对施氏鲟幼鱼生长性能的影响
试验期间,观察到LSD组施氏鲟幼鱼可以完全分布在池塘底部,而HSD组中由于幼鱼数量多且池底面积有限,一部分幼鱼只能在中上层游动。从图1可见:随着养殖时间的延长,各密度组幼鱼的体质量逐渐增大,且养殖密度越低,幼鱼生长越快;试验开始及养殖前期,各密度组幼鱼的体质量均无显著性差异(P>0.05);在试验的第50天时,LSD组幼鱼的体质量显著高于HSD组(P<0.05);随着养殖时间的延长,各密度组幼鱼的体质量差异越来越大。
从表2可见:试验开始时,各密度组幼鱼的平均初始体质量、体长均无显著性差异(P>0.05),而在试验结束时,各密度组幼鱼的生长均表现出不同程度的差异。其中终末体质量随着养殖密度的增大而显著降低(P<0.05);HSD组幼鱼的终末体长、SGR、GBW、DWG均显著低于LSD组和MSD组(P<0.05);净增重随养殖密度的增加而逐渐升高,在不同密度组表现出显著性差异(P<0.05);MSD组的生长效率最高,显著高于其他组(P<0.05);鱼体肥满度随养殖密度的增大而降低,HSD组的肥满度显著低于其他两组(P<0.05)。
表1试验期间不同养殖密度组水质理化指标的变化
Tab.1Physicochemicalparametersinthetesttankwaterduringtheexperimentalperiodmg/L
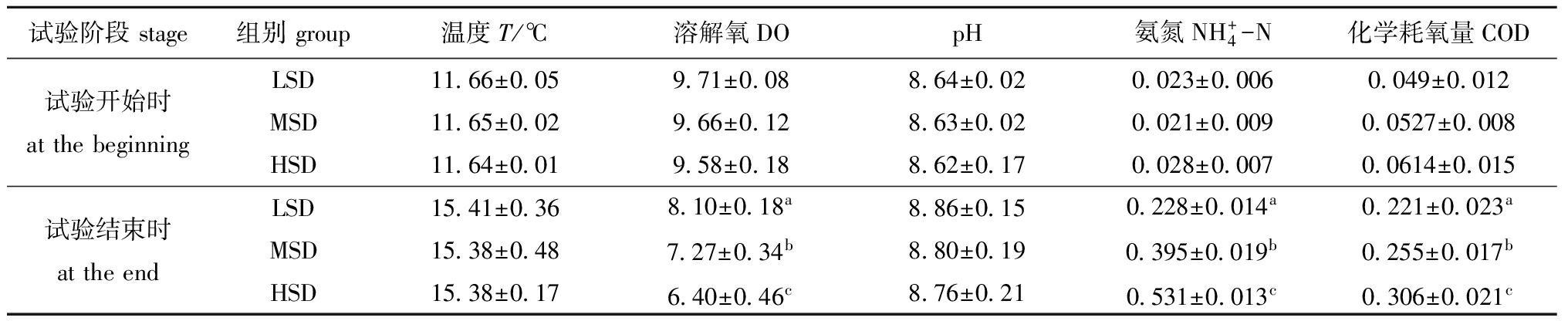
试验阶段stage组别group温度T/℃溶解氧DOpH氨氮NH+4-N化学耗氧量COD试验开始时atthebeginningLSDMSDHSD11 66±0 0511 65±0 0211 64±0 019 71±0 089 66±0 129 58±0 188 64±0 028 63±0 028 62±0 170 023±0 0060 021±0 0090 028±0 0070 049±0 0120 0527±0 0080 0614±0 015试验结束时attheendLSDMSDHSD15 41±0 3615 38±0 4815 38±0 178 10±0 18a7 27±0 34b6 40±0 46c8 86±0 158 80±0 198 76±0 210 228±0 014a0 395±0 019b0 531±0 013c0 221±0 023a0 255±0 017b0 306±0 021c
注:同列中标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significant differences at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
2.3养殖密度对施氏鲟幼鱼摄食的影响
试验前期,各密度组幼鱼摄食良好,无剩料出现;随着养殖时间的延长,HSD组开始出现剩料。从表3可见:试验结束时,随着养殖密度的增加各组总摄食量增大,但每条鱼的日摄食量显著降低(P<0.05),表明养殖密度过大会对施氏鲟幼鱼的摄食产生消极影响;饲料系数随养殖密度的增加而增大,HSD组的饲料系数显著高于其他两组(P<0.05);HSD组的摄食率显著低于其他两组(P<0.05),但其他两组间无显著性差异(P>0.05)。
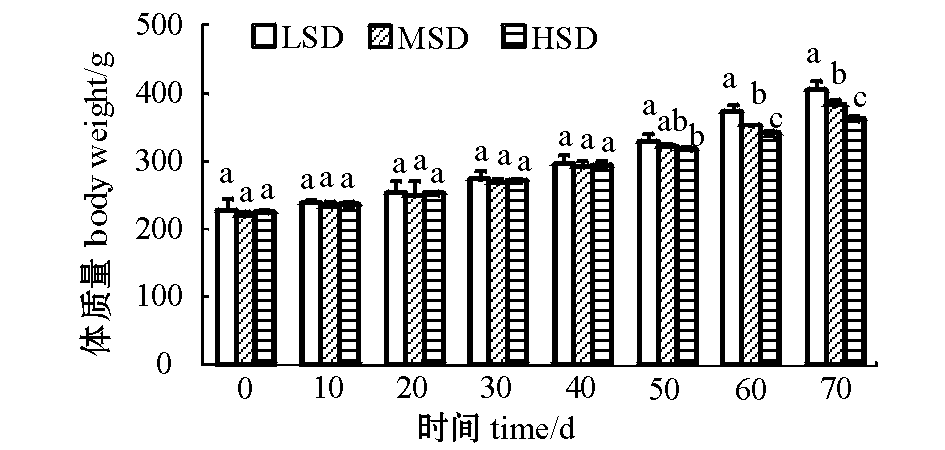
图1 各养殖密度组中施氏鲟幼鱼体质量的变化
Fig.1 Changes in body weight of Amur sturgeon at various stocking densities
表2不同养殖密度组施氏鲟幼鱼的生长参数
Tab.2GrowthparametersofAmursturgeonatdifferentrearingdensities
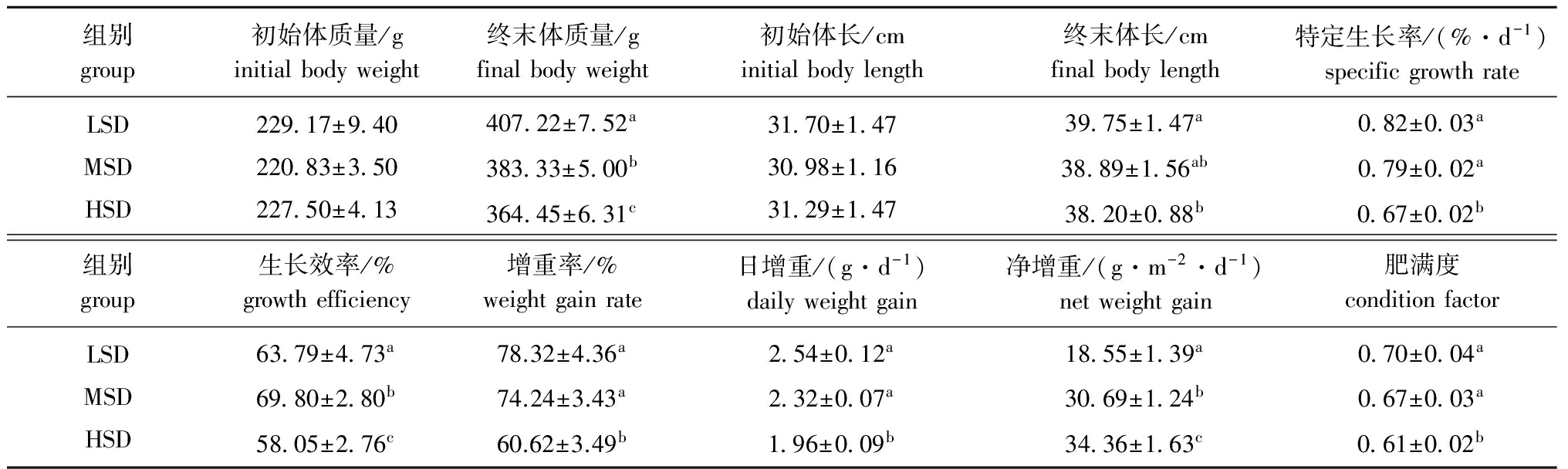
组别group初始体质量/ginitialbodyweight终末体质量/gfinalbodyweight初始体长/cminitialbodylength终末体长/cmfinalbodylength特定生长率/(%·d-1)specificgrowthrateLSDMSDHSD229 17±9 40220 83±3 50227 50±4 13407 22±7 52a383 33±5 00b364 45±6 31c31 70±1 4730 98±1 1631 29±1 4739 75±1 47a38 89±1 56ab38 20±0 88b0 82±0 03a0 79±0 02a0 67±0 02b组别group生长效率/%growthefficiency增重率/%weightgainrate日增重/(g·d-1)dailyweightgain净增重/(g·m-2·d-1)netweightgain肥满度conditionfactorLSDMSDHSD63 79±4 73a69 80±2 80b58 05±2 76c78.32±4.36a74.24±3.43a60.62±3.49b2 54±0 12a2 32±0 07a1 96±0 09b18 55±1 39a30 69±1 24b34 36±1 63c0 70±0 04a0 67±0 03a0 61±0 02b
表3不同养殖密度组施氏鲟幼鱼的总摄食量、日摄食量、饲料系数和摄食率
Tab.3Thetatalfoodconsumption,dailyfoodconsumption,foodconversionratioandfoodintakeinAmursturgeonatdifferentrearingdensities

组别group总摄食量totalfoodintake/g日摄食量dailyfoodintake/g饲料系数foodconversionratio摄食率foodintakerate/(%·d-1)LSD37342±8 48a3 10±0 001a1 05±0 05a0 97±0 01aMSD56115±58 50b2 94±0 002b1 15±0 03a0 97±0 01aHSD75519±149 46c2 90±0 005c1 38±0 07b0 91±0 01b
2.4养殖密度对施氏鲟幼鱼肌肉组分的影响
从表4可见:施氏鲟肌肉中的水分、灰分含量与养殖密度在一定程度上呈正相关关系,即养殖密度越大,肌肉中水分、灰分含量就越高,但各密度组间无显著性差异(P>0.05);肌肉中的粗蛋白质、粗脂肪含量随养殖密度的增大而降低,且LSD组的粗蛋白质、粗脂肪含量均显著高于HSD组(P<0.05)。
表4试验结束时不同养殖密度组施氏鲟幼鱼肌肉中的营养成分
Tab.4NutritionalcompositioninmuscleofAmursturgeonatdifferentrearingdensitiesattheendoftheexperiment%

组别group水分moisture灰分ashcontent粗蛋白质crudeprotein粗脂肪crudelipidLSDMSDHSD71 83±1 1773 24±0 4474 27±1 730 89±0 130 99±0 101 04±0 0721 24±0 76a19 98±0 46ab19 31±0 39b5 99±0 10a5 87±0 17ab5 18±0 11b
3.1放养密度对施氏鲟幼鱼生长性能的影响
高密度养殖作为一种慢性胁迫因子,会对鱼类的生长产生不利的影响[10]。本研究结果表明,随着养殖密度的增加, 施氏鲟幼鱼的终末体质量、终末体长、特定生长率、日增重、肥满度等指标均降低, 且HSD组降低显著,这与对白点鲑Salvelinusleucomaenis[11]、青石斑鱼Epinephelusawoara[12]和欧洲鲈Dicentrarchuslabrax[13]等的研究结果一致,表明慢性拥挤胁迫对施氏鲟幼鱼的生长产生了负面影响。生长上的抑制在一定程度上反映了鱼类慢性应激的状况[14],因此,可推测本研究中HSD组幼鱼处于被慢性拥挤胁迫状态。 肥满度是衡量养殖鱼类经济价值的重要指标之一,本研究中,HSD组幼鱼的肥满度显著减小,说明高密度养殖会降低鱼类的经济价值。生长效率反映鱼类把所摄食的饵料转化成自身有机物的情况,本研究中,生长效率在MSD组中最高,表明养殖密度过低或过高均不利于鱼类饵料的转化。试验鱼的净增重随养殖密度的增大而升高,这与庄平等[8]关于养殖密度对施氏鲟稚鱼净增重影响的研究结果一致,即养殖密度越大,净增重越高。高密度养殖可以产生高的经济产量,但这种高产量是由于较大的养殖个体基数造成的,并不代表高密度下生产效率也高。本研究中,HSD组生长效率较其他两组低,也证实了上述观点。因此:从生长效率的角度出发,本研究中MSD组的效果更适合养殖需要;从经济角度考虑,只要鱼净产量的经济产出相对于饲料消耗等经济投入有较高的经济收益即可,HSD组短期养殖可获得较高的产量,但饲料等消耗也较大。综上所述,最适合大规格施氏鲟幼鱼的养殖密度为8.0 kg/m3。
3.2放养密度对施氏鲟幼鱼肌肉组分的影响
本研究中对施氏鲟幼鱼肌肉营养成分进行了测定,一方面可为该种鱼的营养需要量的制定提供参考依据,另一方面也为不同养殖密度下该鱼的营养价值作出评判。结果表明,放养密度对大规格施氏鲟幼鱼肌肉的一般营养成分造成了影响,其中水分和灰分含量随着养殖密度的增大而升高,而粗蛋白质和粗脂肪含量则相反,均下降显著(P<0.05)。鱼类的营养价值主要决定于鱼肉蛋白质和脂肪含量的多少[15],蛋白质和脂肪含量的降低表明高密度养殖会降低施氏鲟的营养价值,影响鱼的品质,从而降低经济效益。同时,肌肉中营养成分的积累在一定程度上也反映了鱼体内的代谢情况。高密度养殖使鱼类处于被慢性胁迫状态,为了适应这种胁迫和种内竞争,鱼类的机体耗能必然增加,如果长时间持续下去,鱼体内能量便会枯竭[16]。脂肪、糖类和蛋白质是鱼类主要的储能物质,高露姣等[17]研究发现,施氏鲟耗能时最早动用的是糖原,其次是脂肪,最后是蛋白质。在高密度养殖条件下,施氏鲟为了适应胁迫而保持高耗能,脂肪和蛋白质等营养物质被分解产能,所以鱼体肌肉的有机物质含量减少,而水分和灰分含量相对增加。
3.3放养密度对施氏鲟幼鱼摄食的影响
养殖密度过大会加剧种内对水域空间和食物资源的竞争,引起胁迫,从而影响鱼类生长[8]。本试验期间,观察到HSD组鲟鱼相互竞争空间,作为底栖鱼类, HSD组一部分鲟鱼由于空间限制只能在中上层游动,投喂时游动迅速且有明显抢食现象,这就增加了游动所需能耗;另外底层摄食饱的鱼仍然占据池塘底层,而中上层鲟鱼无法成功连续摄食,导致摄食速度变慢,未被摄取的饵料随水流被冲走,造成资源浪费。可见在高养殖密度条件下,施氏鲟为了获得更多的底层空间及食物,需要更多的能量应对竞争压力,这也使得体内能量的消耗增加,用于生长的能量减少,导致生长变慢。
养殖密度可直接或间接影响鱼类的摄食行为,从而影响鱼类的生长, 改变机体能量的收支平衡,增加或减少用于生长的能量分配[18]。高养殖密度条件下,鱼类生长减慢与摄食率、食物转化率降低密切相关[19]。本试验中观察了试验鱼的摄食行为,试验前50 d,各密度组幼鱼保持良好的食欲;随着养殖时间的延长,HSD组摄食能力降低,且摄食率随养殖密度的增大呈逐渐下降的趋势,这与对中华鲟Acipensersinensis的研究结果[20]一致。有研究表明,高养殖密度条件下,鱼类的摄食率降低是由于拥挤限制了鱼类的摄食成功率[21],但也有学者认为,这是鱼类对拥挤胁迫的适应造成的[22]。本研究中,HSD组幼鱼明显受到空间限制而使摄食不能连续,导致部分鲟鱼不能饱腹。因此,高密度组摄食率降低可能是因拥挤限制了摄食成功率造成的,而慢性拥挤胁迫的作用机制尚需进一步研究。
3.4放养密度与水质的关系
“养鱼先养水”,良好的水质是水产养殖的首要条件,水质的好坏能直接影响养殖鱼类的生存、生长和发育。而衡量水质好坏的指标主要有![]() -N等[23]。本试验中,DO水平随养殖密度的增大而显著降低,而
-N等[23]。本试验中,DO水平随养殖密度的增大而显著降低,而![]() -N和COD浓度随养殖密度的增大显著升高。DO作为池塘养殖最重要的水质指标之一,对鱼类的生长和摄食均有很大的影响[24];提高养殖水体DO水平可减少养殖密度对大西洋鲑Salmosalar生长的影响[25]。本试验中,HSD组的DO水平显著降低,但由于采用流水养殖,其仍能维持在较高的水平,推测在工厂化流水养殖中DO水平对鲟鱼生长有一定影响,但并不是限制鲟鱼生长的主要因素。COD浓度的大小与养殖水体中有机营养成分的含量密切相关,水产动物的排泄物和残饵会造成N、P大量积累,进而引起水体富营养化,导致藻类大量生长,使水质恶化[23]。本试验后期,HSD组池塘底部藻类生长明显多于LSD组,且水质较低密度组更加浑浊,COD浓度也显著增大。
-N和COD浓度随养殖密度的增大显著升高。DO作为池塘养殖最重要的水质指标之一,对鱼类的生长和摄食均有很大的影响[24];提高养殖水体DO水平可减少养殖密度对大西洋鲑Salmosalar生长的影响[25]。本试验中,HSD组的DO水平显著降低,但由于采用流水养殖,其仍能维持在较高的水平,推测在工厂化流水养殖中DO水平对鲟鱼生长有一定影响,但并不是限制鲟鱼生长的主要因素。COD浓度的大小与养殖水体中有机营养成分的含量密切相关,水产动物的排泄物和残饵会造成N、P大量积累,进而引起水体富营养化,导致藻类大量生长,使水质恶化[23]。本试验后期,HSD组池塘底部藻类生长明显多于LSD组,且水质较低密度组更加浑浊,COD浓度也显著增大。![]() -N对水生生物有较强的毒性,它通过鳃和皮膜进入鱼体内,能降低血液载氧能力,引起鱼体内多种酶活的改变,降低鱼体免疫力,从而影响鱼类的生长[26]。Paust等[27]研究发现,较高的
-N对水生生物有较强的毒性,它通过鳃和皮膜进入鱼体内,能降低血液载氧能力,引起鱼体内多种酶活的改变,降低鱼体免疫力,从而影响鱼类的生长[26]。Paust等[27]研究发现,较高的![]() -N浓度(0.17 mg/L)会导致大比目鱼Hippoglossushippoglossus生长速度减慢、食欲下降和血液指标发生明显变化。本研究中,HSD组
-N浓度(0.17 mg/L)会导致大比目鱼Hippoglossushippoglossus生长速度减慢、食欲下降和血液指标发生明显变化。本研究中,HSD组![]() -N浓度显著高于其他两组,超过了中国渔业水质标准规定的
-N浓度显著高于其他两组,超过了中国渔业水质标准规定的![]() -N浓度(<0.5 mg/L),这对施氏鲟幼鱼的生长会产生一定影响。集约化养殖过程中,放养密度过大引起水质恶化是由于鱼类过量的排泄物增加了有机负载量和
-N浓度(<0.5 mg/L),这对施氏鲟幼鱼的生长会产生一定影响。集约化养殖过程中,放养密度过大引起水质恶化是由于鱼类过量的排泄物增加了有机负载量和![]() -N浓度以及减少了水体中DO水平造成的[28];水质恶化加剧了胁迫程度,使鱼类的生理调节和行为模式发生改变,影响鱼体生长[29]。Kebus等[30]也认为,拥挤胁迫抑制虹鳟生长可能是由高负载造成的水质恶化引起的。
-N浓度以及减少了水体中DO水平造成的[28];水质恶化加剧了胁迫程度,使鱼类的生理调节和行为模式发生改变,影响鱼体生长[29]。Kebus等[30]也认为,拥挤胁迫抑制虹鳟生长可能是由高负载造成的水质恶化引起的。
综上所述,高养殖密度不仅对大规格施氏鲟幼鱼的生长产生不利的影响,而且还会降低施氏鲟幼鱼的营养价值,这些影响主要是通过增加空间竞争、恶化水质和影响摄食等多方面的综合作用实现的。在工厂化流水养殖鲟鱼过程中,可在达到最适生长效率的基础上适当增大养殖密度来提高生产效益,但要注意定期刷池,保持水质良好,及时调整养殖水体负载率,根据实际情况进行分级和分池,从而达到健康养殖和生产效益最大化的目标。
参考文献:
[1] Bemis W E,Findeis E K,Grande L.An overview of Acipenseriformes[J].Environ Biol Fish,1997,48(14):25-71.
[2] 刘健,赵德树.史氏鲟的生物学特性及其人工繁殖技术[J].水利渔业,2006,28(1):26-27.
[3] 冯广朋,庄平,章龙珍,等.我国鲟鱼类养殖现状及发展前景[J].海洋渔业,2004,26(4):317-320.
[4] Tolussi C E,Hilsdorf A W S,Caneppele D,et al.The effect of stocking density in physiological parameters and growth of the endangered teleost species piabanba,Bryconinsignis(Steindachner,1877)[J].Aquaculture,2010,310:221-228.
[5] Ellis T,North B,Scott A P,et al.The relationships between stocking density and welfare in farmed rainbow trout[J].J Fish Biol,2002,61:493-531.
[6] Kristiansen T S,Ferno A,Holm J C,et al.Swimming behaviour as an indicator of low growth rate and impaired welfare in Atlantic halibut(HippoglossushippoglossusL.) reared at three stocking densities[J].Aquaculture,2004,230:137-151.
[7] Rowland S J,Mifsud C,Nixon M,et al.Effects of stocking density on the performance of the Australian freshwater silver perch(Bidyanusbidyanus) in cages[J].Aquaculture,2006,53:301-308.
[8] 庄平,李大鹏,王明学,等.养殖密度对史氏鲟稚鱼生长的影响[J].应用生态学报,2002,13(6):735-738.
[9] Li D P,Liu Z D,Xie C X.Effect of stocking density on growth and serum concentrations of thyroid hormones and cortisol in Amur sturgeon,Acipenserschrenckii[J].Fish Physiol Biochem,2012,38:511-520.
[10] Vijayan M M,Leatherland J F.Effect of stocking density on the growth and stress response in brook charr,Salvelinusfontinalis[J].Aquaculture,1988,75:159-170.
[11] 张永泉,尹家胜,王丙乾,等.养殖密度对白点鲑幼鱼生长、存活以及行为的影响[J].大连水产学院学报,2009,24(6):520-524.
[12] 张曦文,吴垠,贺茹靖,等.循环水养殖模式下养殖密度对青石斑鱼生长及生理指标的影响[J].大连海洋大学学报,2012,27(6):465-469.
[13] Lupatsch I,Santos G A,Schrama J W,et al.Effect of stocking density and feeding level on energy expenditure and stress responsiveness in European sea bassDicentrarchuslabrax[J].Aquaculture,2010,298:245-250.
[14] Pickering A D.Stress and the suppression of somatic growth in teleost fish[J].Prog Clin Biol Res,1990,342:473-479.
[15] 邴旭文,张宪中.斑驳尖塘鳢肌肉营养成分与品质的评价[J].中国海洋大学学报:自然科学版,2006,36(1):107-111.
[16] Tort L,Balasch J C,MacKenzie S.Fish health challenge after stress.Indicators of immune competence[J].Contributions to Science,2004,2(4):443-454.
[17] 高露姣,陈立侨,宋兵.饥饿和补偿生长对史氏鲟幼鱼摄食、生长和体成分的影响[J].水产学报,2004,28(3):279-284.
[18] Schreck C B.Stress and rearing of salmonid[J].Aquaculture,1982,28:241-249.
[19] Papoutsoglou S E,Karakatsouli N,Pizzonia G,et al.Effects of rearing density on growth,brain neurotransmitters and liver fatty acid composition of juvenile white sea breamDiplodussargusL.[J].Aquac Res,2006,37:87-95.
[20] 张建明,郭柏福,高勇.中华鲟幼鱼对慢性拥挤胁迫的生长、摄食及行为反应[J].中国水产科学,2013,20(3):592-598.
[21] Refstie T,Kittelsen A.Effect of density on growth and survival of artificially reared Atlantic salmon[J].Aquaculture,1976,8:319-326.
[22] Vijayan M M,Ballantyne J S,Leatherland J F.High stocking density alters the energy metabolism of brook charr,Salvelinusfontinalis[J].Aquaculture,1990,88:371-381.
[23] 陈在新,王文一.影响鱼类生长的水质因子机理与控制[J].畜牧与饲料科学,2009,30(1):15-16.
[24] 王克行,金洪生,杨利民.温度对对虾PenaeusorientalisKishinouye生长的影响[J].海洋湖沼通报,1984(4):42-46.
[25] Poston H A,Williams R C.Interrelations of oxygen concentration,fish density,and performance of Atlantic salmon in an ozonated water reuse system[J].Prog Fish Cult,1988,50:69-76.
[26] 赵燕超,王蓉,魏俊力.当前养殖水体中氨氮和亚硝酸氮对鱼类的危害及防治措施[J].天津水产,2003(2):30-33.
[27] Paust L O,Foss A,Imsland A K.Effects of chronic and periodic exposure to ammonia on growth,food conversion efficiency and blood physiology in juvenile Atlantic halibut(HippoglossushippoglossusL.)[J].Aquaculture,2011,315:400-406.
[28] Sharma J G,Chakrabarti R.Role of stocking density on growth and survival of catla,Catlacatla,and rohu,Labeorohita,larvae and water quality in a recirculating system[J].J Appl Aquac,2004,14:171-178.
[29] Ellis T,Scott A P,Bromage N,et al.What is stocking density?[J].Trout News,2001,32:35-37.
[30] Kebus M J,Collinsm M T,Brownfieldm J A.Effects of rearing density on the stress response and growth of rainbow trout[J].J Aquat Anim Health,1992(4):1-6.
Abstract:The juvenile Amur sturgeonAcipenserschrenckiiwith body weight of (225.69±32.28)g was reared in nine 18.23 m2concrete tanks at water temperature of 14-17 ℃ at an initial density of 5.5, 8.0 and 11.0 kg/m3for 70 days to investigate the effects and physiological mechanism of stocking density on growth and feeding. The results showed that there were significant decrease in weight increment, specific growth rate, daily weight gain and food consumption rate and increase in the food conversion ratio in the juveniles with increasing stocking density (P<0.05), with the best growth at socking density of 8.0 kg/m3. At the end of the experiment, the crude protein content and crude lipid content were found to be significant decreases(P<0.05) in muscles, without significant difference in moisture content and ash content (P>0.05). During the experiment, a significant decrease in dissolved oxygen level (DO) was observed as the stocking density was increased(P<0.05), while the ammonia-nitrogen content and COD were decreased with increasing stocking density (P<0.05), indicating that the poor growth derived from high stocking density is contributed to both crowding stress and water deterioration, as well as associated with reductions in food consumption. It is suggested that 8.0 kg/m3be of suitable stocking density for Amur sturgeon at the size in the experiment.
Key words:Acipenserschrenckii; stocking density; growth; feeding; muscle composition; water quality
DOI:10.3969/J.ISSN.2095-1388.2014.01.010
文章编号:2095-1388(2014)01-0045-06
收稿日期:2013-10-08
基金项目:国家公益性行业 (农业) 科研专项经费项目(201003055)
中图分类号:S917.4
文献标志码::A