海带粉对克氏原螯虾生长、非特异性免疫和肝胰脏抗氧化能力的影响
杨维维1、2,刘文斌1,沈美芳2,唐建清2,朱杰1,钱妤1
(1.南京农业大学 动物科学技术学院 江苏省水产动物营养重点实验室,江苏 南京 210095;2.江苏省淡水水产研究所,江苏 南京 210017)
摘要:为了探讨海带粉对克氏原螯虾Procambarusclarkii生长、非特异性免疫和肝胰脏抗氧化能力的影响,选取体质量为(7.25±0.24 )g的克氏原螯虾随机分成5组,每组设3个平行,每个平行放20只虾。其中一组为对照组,投喂基础饲料;另外4组为试验组,投喂基础饲料中分别添加质量分数为0.5%、1.0%、2.0%、4.0%海带粉的饲料。饲养8周后,测定克氏原螯虾的生长性能及血液和肝胰脏生化指标。结果表明:海带粉对克氏原螯虾死亡率和增重率均有显著性影响(P<0.05),当添加量为2.0%时增重率最高,成活率则随着添加量的增加而提高;随着饲料中海带粉添加量的增加,试验组虾血清中的溶菌酶活性、总蛋白浓度均呈先上升后降低的趋势,当添加量为2.0%时均达到最大值,碱性磷酸酶活性在海带粉添加量为1.0%时达到最大值;随着海带粉添加量的增加,肝胰腺中的超氧化物歧化酶、过氧化氢酶和谷胱甘肽活性均呈先升高后降低的趋势,超氧化歧化酶活性在添加量为2.0%时达到最大值,过氧化氢酶和谷胱甘肽活性在添加量为1.0%时均达到最大值,丙二醛含量则呈相反的变化趋势。研究表明,饲料中添加1.0%~2.0%的海带粉可以显著提高虾的生长性能、免疫功能和肝胰脏抗氧化能力,建议克氏原螯虾饲料中添加1.0%~2.0%的海带粉。
关键词:克氏原螯虾; 海带粉;生长性能;免疫功能
海带属于褐藻纲、海带科植物,是一种营养价值较高的海洋性蔬菜,含有丰富的海藻多糖、膳食纤维、矿物质元素、多种维生素[1]、氨基酸、酶类和促生长活性因子,为典型碘化合物富集体。根据测定,每克海带中含碘量高达24 mg,且所含的矿物质和绝大多数微量元素均以有机态形式存在,不易发生氧化,吸收利用率高。海带中的海藻胶、褐藻糖胶是天然优质黏合剂, 可以增强鱼虾类饲料的稳定性, 提高饲料利用率,防止水质污染[2]。海带蛋白对动物体内的大肠杆菌Escherichiacoli、产气杆菌Anthraci、金色葡萄球菌Staphylococcusaureus具有抑制作用[3]。海带粉作为一种良好的饲料添加剂,国内已在畜禽生产中广泛使用,但在对虾商品饲料中也有部分生产厂家使用了海带粉。在矿物质和微量元素贫乏的水体中,投喂添加海带粉的饲料对鱼虾的生长和病害防治都有明显的效果[4]。
克氏原螯虾Procambarusclarkii隶属于甲壳纲、十足目、螯虾科、原螯虾属[5],是中国目前重要的经济水产养殖对象,养殖规模逐年扩大。目前,国内外对螯虾的野外食性以及环境对螯虾进食的 影响等食性特征进行了研究, 但对海带粉在克氏原螯虾饲料的应用尚未见报道。本研究中,探讨了饲料中添加不同水平的海带粉对克氏原螯虾生长性能、非特异性免疫指标和肝胰脏抗氧化功能的影响,以期为克氏原螯虾人工配合饲料中合理添加海带粉提供科学依据。
1材料与方法
1.1材料
试验用克氏原螯虾取自江苏盱眙满江红养殖基地。选择体质健壮、规格基本一致,体质量为(7.25±0.24)g的克氏原螯虾用于试验。
海带粉购自西安小草植物科技有限公司,其营养成分(均为质量分数):粗蛋白质为8.2%,粗脂肪为0.3%,甘露醇为10%~15%,粗纤维为5%~6%,矿物质为25%~27%,褐藻胶为20%~24%。
1.2方法
1.2.1 试验设计 试验设5组,每组设3个平行,试验在15个网箱(规格为0.5 m×0.5 m×0.5 m)中进行,每个网箱放养20只克氏原螯虾。其中一组为对照组,投喂基础饲料;另外4组为试验组,投喂基础饲料中分别添加质量分数为0.5%、1.0%、2.0%、4.0%海带粉的饲料。
试验饲料的基础配方(均为质量分数):鱼粉(5.00%)、豆粕(31.25%)、菜籽粕(16.00%)、虾糠粉(3.00%)、面粉(31.29%)、α-淀粉(4.00%)、豆油(3.21%)、棒土(1.00%)、沸石粉(1.50%)、磷酸二氢钙(2.20%)、食盐(0.40%)、复合预混料(1.00%)和脱壳素(0.15%)。其中复合预混料(每kg饲料)包含:维生素E 150 mg, 维生素K 50 mg, 维生素B180 mg, 维生素B250 mg,烟酸 150 mg, 泛酸150 mg, 维生素B650 mg, 生物素1 mg, 维生素B120.02 mg, 叶酸10 mg, 维生素C 300 IU, 维生素A 10 000 IU, 维生素D 2000 IU, 硫酸铜2.0 g, 硫酸铁25 g, 硫酸锌22 g, 硫酸锰7 g, 亚硒酸钠0.04 g, 碘化钾0.026 g, 氯化钴0.1 g。各试验组饲料中分别加入0、0.5%、1.0%、2.0%、4.0 %的海带粉代替部分面粉。基础饲料的营养成分:粗蛋白质为26%,粗脂肪为6%。饲料原料经粉碎过60 目筛, 逐级混匀后加水搅拌,用小型绞肉机制成粒径为2 mm的颗粒, 自然晾干后在冰箱(4 ℃)中保存备用。
1.2.2 试验管理 克氏原螯虾在试验网箱中驯化15 d后投喂试验饲料,每天8:00、16:00、22:00投喂。日投饵量为虾体质量的4%~6%,上午和下午的投饵量均为日投饵量的30%,晚上为40%。并根据摄食和生长情况作适当调整,以每次投饲2 h后无残饵为宜,饲养试验共进行8周。饲养期间,水温为(25±3)℃,溶氧为7~8 mg/L,pH保持在7.0~8.0。
1.2.3 生长性能的测定 饲养试验结束后,禁食24 h,将各网箱中克氏原螯虾计数、称重,统计投喂所用饲料重,并计算成活率、增重率、特定生长率、饵料系数。计算公式如下:
成活率(%)=100×(Nt/N0),
增重率(%)=100×[(Wt-W0)/W0],
特定生长率(%/d)=100×(lnWt-lnW0)/t,
饵料系数=F/(Wt-W0)。
其中:N0、Nt分别为试验初始和试验结束时虾的存活数;W0、Wt分别为试验初始和试验结束时虾体质量(g);t为试验时间(d);F为饲料摄入量(g)。
1.2.4 血液生化指标的测定 试验结束后,从各网箱中随机取5只虾,用无菌注射器从虾体围心腔中取血,将血液置于无菌离心管中,于冰箱(4 ℃)中过夜后离心,得到的血清用于溶菌酶(LSZ)、碱性磷酸酶(AKP)、总蛋白(TP)、谷丙转氨酶(GPT)和谷草转氨酶(GOT)的测定。采用考马斯亮蓝染色法测定血浆中的TP浓度,采用磷酸苯二钠比色法测定AKP的活力,其他指标均按照南京建成生物公司研究所提供的试剂盒方法进行测定。
1.2.5 组织营养成分的测定 从抽取过血液的每只虾中取肝胰腺、肌肉和肠道,用生理盐水冲洗后用滤纸吸去组织样品表面的水分,放入冻存管中置于液氮中速冻,并置于冰箱(-20 ℃)中保存,用于营养成分和相关酶活性的测定分析。肝胰脏样品解冻后称重,肝胰脏与生理盐水按质量比为1∶9混合,冰浴匀浆,然后于4 ℃下以4000 r/min离心10 min,取上清液用于超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)、谷胱甘肽(GSH)的测定,各项指标均按照南京建成生物公司研究所提供的试剂盒方法进行测定。
1.3数据处理
试验数据均用平均数±标准误(mean±S.E.)表示,用SPSS 16.0统计软件进行方差分析,采用Duncan氏法进行多重比较,显著性水平设为0.05。
2结果
2.1海带粉对克氏原螯虾生长性能的影响
从表1可见:海带粉添加组的增重率均较对照组高,随着海带粉添加量的增加虾的增重率呈先升高后降低的趋势,其中仅2.0%添加组与对照组有显著性差异(P<0.05);饲料中添加海带粉,可以提高虾的成活率,虾的成活率随着添加量的增加而提高,当添加量为2.0%和4.0%时与对照组有显著性差异(P<0.05);饵料系数随着海带粉的添加显著下降(P<0.05)(除4.0%组外),但各添加组间无显著性差异(P>0.05)。
表1海带粉对克氏原螯虾生长性能的影响
Tab.1EffectsofkelppowderongrowthofredswampcrawfishProcambarusclarkia
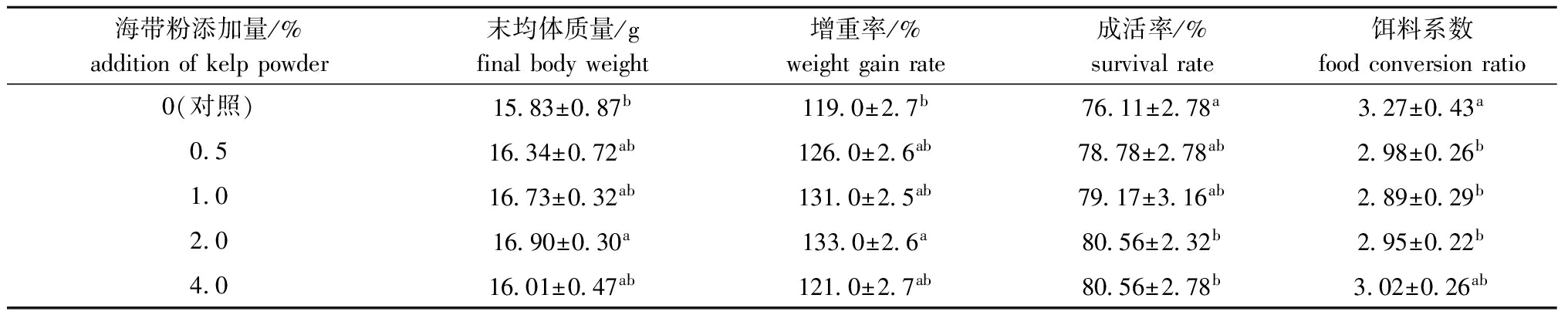
海带粉添加量/%additionofkelppowder末均体质量/gfinalbodyweight增重率/%weightgainrate成活率/%survivalrate饵料系数foodconversionratio0(对照)15 83±0 87b119 0±2 7b76 11±2 78a3 27±0 43a0 516 34±0 72ab126 0±2 6ab78 78±2 78ab2 98±0 26b1 016 73±0 32ab131 0±2 5ab79 17±3 16ab2 89±0 29b2 016 90±0 30a133 0±2 6a80 56±2 32b2 95±0 22b4 016 01±0 47ab121 0±2 7ab80 56±2 78b3 02±0 26ab
注:同列中标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significant differences at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
2.2海带粉对克氏原螯虾血清生化指标的影响
从表2可见:海带粉添加组虾血清中的LSZ活性均较对照组显著升高(P<0.05),当添加量达到1.0%和2.0%时LSZ活性最强;海带粉添加组虾血清中的TP浓度较对照组均有所上升,当添加量为2.0%时TP浓度最高(P<0.05);AKP活性则随着海带粉添加量的增加显著升高(P<0.05),当添加量为1.0%和2.0%时AKP活性最强;GPT和GOT活性随着海带粉添加量的增加没有显著变化(P>0.05)。
表2海带粉对克氏原螯虾血清生化指标的影响
Tab.2EffectsofkelppowderonserumbiochemicalparametersofredswampcrawfishProcambarusclarkia
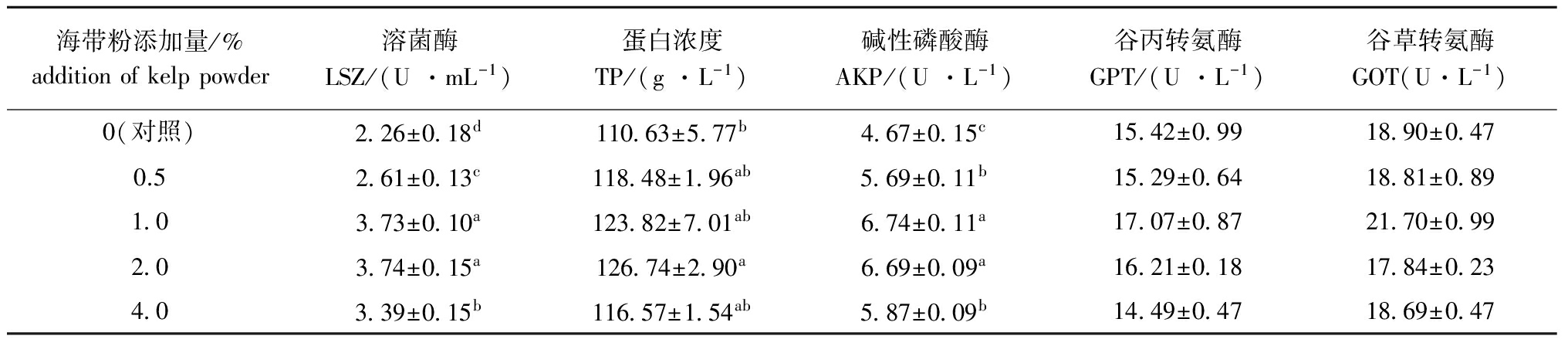
海带粉添加量/%additionofkelppowder溶菌酶LSZ/(U·mL-1)蛋白浓度TP/(g·L-1)碱性磷酸酶AKP/(U·L-1)谷丙转氨酶GPT/(U·L-1)谷草转氨酶GOT(U·L-1)0(对照)2 26±0 18d110 63±5 77b4 67±0 15c15 42±0 9918 90±0 470.52 61±0 13c118 48±1 96ab5 69±0 11b15 29±0 6418 81±0 891 03 73±0 10a123 82±7 01ab6 74±0 11a17 07±0 8721 70±0 992 03 74±0 15a126 74±2 90a6 69±0 09a16 21±0 1817 84±0 234 03 39±0 15b116 57±1 54ab5 87±0 09b14 49±0 4718 69±0 47
2.3海带粉对克氏原螯虾肝胰脏抗氧化能力的影响
从表3可见:克氏原螯虾肝胰脏中的SOD、CAT和GSH活性均随着饲料中海带粉添加量的增加呈先升高后降低的趋势,而MDA含量的变化趋势正好相反。海带粉添加量为1.0%~4.0%时,肝胰脏中的SOD活性与对照组有显著性差异(P<0.05),当添加量为2.0%时SOD活性最强;海带粉添加组的CAT、GSH活性均较对照组显著升高(P<0.05),当海带粉添加量为1.0%时CAT、GSH活性最强;海带粉添加组的MDA含量与对照组无显著性差异(P>0.05),当添加量为2.0%时MDA含量最低。
表3海带粉对克氏原螯虾肝胰脏抗氧化功能的影响
Tab.3EffectsofkelppowderonhepatopancreaticantioxidantcapacityofredswampcrawfishProcambarusclarkiaU/mg
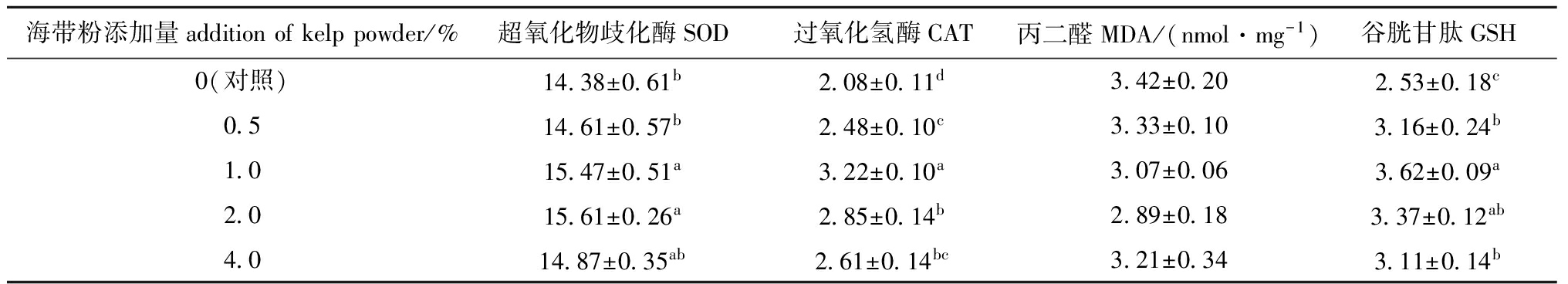
海带粉添加量additionofkelppowder/%超氧化物歧化酶SOD过氧化氢酶CAT丙二醛MDA/(nmol·mg-1)谷胱甘肽GSH0(对照)14 38±0 61b2 08±0 11d3 42±0 202 53±0 18c0 514 61±0 57b2 48±0 10c3 33±0 103 16±0 24b1 015 47±0 51a3 22±0 10a3 07±0 063 62±0 09a2 015 61±0 26a2 85±0 14b2 89±0 183 37±0 12ab4 014 87±0 35ab2 61±0 14bc3 21±0 343 11±0 14b
3讨论
海带是一种典型的碘富集体,可以提高动物的生长性能和免疫功能。本研究结果显示:饲料中添加海带粉对克氏原螯虾的增重率有一定的提升作用,但只有当添加量达到2.0%时显著上升;虾的死亡率随着海带粉添加量的增加呈直线下降的趋势;而饵料系数则呈先降低后升高的趋势,在添加量为1.0%时达到最低值。刘立鹤等[6]研究表明, 饲料中海带粉添加量为0.4%时,凡纳滨对虾对饲料粗蛋白的表观消化率最高, 当添加量为3.2%、6.4%时,增重率最高。周歧存等[7-8 ]用添加不同水平的海藻(3%、6%、9%、12%)饲料投喂凡纳滨对虾和南美白对虾,结果3%海藻添加组的增重率最高,且凡纳滨对虾的饲料利用率最高,这与本试验结果相似。因此,在本试验设置的添加量范围内,添加1.0%~2.0%的海带粉对克氏原螯虾的促生长和节约饲料效果最为显著,这与海带粉中含有丰富的多糖和甘露醇(寡糖)等有关。甘露醇是一种很好的化学益生素,可以提供碳源被多数动物肠道分解,促进双歧杆菌等有益微生物增殖,进而抑制有害菌的生长、繁殖,促进动物健康生长。
血液成分的变化被广泛用来评价虾类的健康和营养状况,血液成分是重要的生理、病理和毒理学指标[9]。虾体受到外界影响发生生理或病理变化时,必然会在血液指标中反映出来。溶菌酶是动物体内重要的非特异性免疫因子之一,对革兰氏阳性菌有较强的杀灭作用[10],动物体内溶菌酶的活性和抗菌活力直接关系到鱼类的免疫功能和健康,研究表明,水生动物机体的免疫力随着溶菌酶活性的上升而提高[11]。碱性磷酸酶是生物体内一种重要的代谢调控酶,可以直接参与磷酸基团的转移和钙磷代谢,在鱼虾类对营养物质的吸收与利用过程中发挥着重要作用,有助于提高鱼虾的抗病力[12]。本试验结果表明,添加海带粉后均可提高克氏原螯虾血清的TP浓度,增加虾体蛋白质的合成,促进其生长,其中2.0%海带粉添加组虾血清的TP浓度较对照组显著上升(P<0.05),但与其他试验组无显著性差异;各添加组虾血清的LSZ和APK酶活性较对照组显著上升(P<0.05),且随着添加量的增加呈先升高后降低的趋势,分别在添加量为1.0%和2.0%时达到最大值。由此可见,饲料中添加海带粉可以提高克氏原螯虾的免疫功能,添加量为1.0%和2.0%时效果最为显著。EI-Boshy等[13]研究表明, 在尼罗罗非鱼Oreochromisniloticus饲料中添加海带提取物褐藻淀粉能提高鱼体的巨噬细胞呼吸爆发指数、噬菌细胞活性和血清溶菌酶活性,这说明海带中的多糖可以通过提高溶菌酶的活性来增强虾体的免疫能力。
GPT、GOT是重要的氨基酸转氨酶, 在机体蛋白质代谢中起着重要作用, 其活性变化也是反映肝细胞生理状态的主要敏感指标。血清中转氨酶活性值正常情况下较小,当肝细胞受到损伤时, 细胞膜通透性加大, 大量GPT、GOT渗入血液,肝脏中的GPT、GOT活性明显下降[14]。本试验结果表明, 饲料中添加海带粉对克氏原螯虾肝胰脏中的GPT、GOT没有显著影响(P>0.05),说明海带对其肝功能不会造成损伤。董学兴等[1]研究表明,在饲料中添加海带粉对异育银鲫血清GPT、GOT活性没有显著影响,与本试验结果一致。海带对肝脏的保护作用与其含有丰富的多糖有关,海带多糖具有清除自由基及抗脂质过氧化的作用[ 15-16]。
抗氧化系统能清除体内多余的活性氧,保护自身免受氧化损伤,防止各种病理变化。SOD、CAT、MDA、GSH均是用于衡量动物机体内抗氧化功能的代表性指标[17-18]。SOD、CAT能够清除自由基,减少脂质过氧化损伤。GSH能帮助机体保持正常的免疫系统功能,并具有抗氧化作用和整合解毒作用。应激会造成机体内自由基产生增多,过多的自由基等活性氧可造成脂质过氧化,增加了体内脂质过氧化物。MDA是脂质过氧化物进一步分解产生的具有很强生物毒性的物质,MDA会对机体造成伤害,反映了细胞的受损伤程度和脂质过氧化程度[19]。本研究中,饲料中添加海带粉对虾体肝胰脏中的SOD、CAT和GSH活性均有显著的提升作用,当添加量达到1.0%时,CAT、GSH的抗氧化效果最为显著;添加量为2.0%时,SOD的抗氧化效果最为显著;MDA则随着海带粉添加量的增加呈先降低后升高的趋势,在添加量为2.0%时MDA含量最低。由此可知,饲料中添加海带粉可以提高克氏原螯虾肝胰脏的抗氧化能力,当添加量为1.0%~2.0%时抗氧化效果最为显著。
综上所述,在基础饲料中添加海带粉可以促进克氏原螯虾的生长,提高虾体的非特异性免疫力和抗氧化能力,对抗病防病有一定的效果。当海带粉添加量为1.0%~2.0%时效果最佳,故建议克氏原螯虾饲料中海带粉的添加量为1.0%~2.0%。
参考文献:
[1] 董学兴,吕林兰,王爱民.海带对异育银鲫生长性能、表观消化率、体成分及非特异性免疫的影响[J].水产科学,2011,30(9):543-546.
[2] 靳玲品,李双群,李秀花.海藻饲料的营养及其在养殖业中的应用[J].畜牧与兽医,2008,40(1):55-56.
[3] 李伟,邬丽君,肖妍君,等.海带蛋白的提取和活性研究[J].水产科学,2008,27(10):530-532.
[4] 常巧玲,孙建义.海藻饲料资源及其在水产养殖中的应用研究[J].饲料工业,2006,27(2):62-64.
[5] 肖鸣鹤,肖英平,吴志强.养殖密度对克氏原螯虾幼虾生长、消化酶活力和生理生化指标的影响[J].水产学报,2012,36(7):1088-1093.
[6] 刘立鹤, 董爱华, 周永奎.饲料中不同水平海带粉对凡纳对虾生长及饲料表观消化率的影响[J].广东农业科学,2006(2):72-74.
[7] 周歧存,赵华超.海藻在罗氏沼虾饲料中的应用研究[J].饲料研究,2001,24(8):5-6.
[8] 周歧存,肖风波.海藻在南美白对虾饲料中的应用研究[J].海洋科学,2003,27(3):66-69.
[9] 周玉,郭文场,杨振国,等.鱼类血液指标的研究进展[J].上海水产大学学报,2001,10(2):163-165.
[10] Mck A,Peters G.Lysozyme activity in rainbow trout,Oncorhynchusmykiss(Walbaum),stressed by handling,transport and water pollution[J].J Fish Biol,1990,37(6):873-885.
[11] 李华,张太娥,李强.复方中草药对大菱鲆非特异性免疫力的影响[J].大连海洋大学学报,2013,28(2):115-120.
[12] 张华军,李卓佳,张家松.凡纳滨对虾免疫指标变化与其养殖环境理化因子的关系[J].大连海洋大学学报,2011,26(4):356-361.
[13] EI-Boshy M E,EI-Ashramb A M,AbdeI Hamid F M,et al.Immunomodulatory effect of dietarySaccharomycescerevisiae,glucan and laminaran in mercuricchloride treated Nile tilapia (Oreochromisniloticus) and experimentally infected withAeromonashydrophila[J].Fish & Shellfish Immunology,2010,28(5/6):802-808.
[14] 惠天朝,施明华,朱荫湄.硒对罗非鱼慢性镉中毒肝抗氧化酶及转氨酶的影响[J].中国兽医学报,2000,20(3):264-266.
[15] 李兆杰,薛长湖,陈磊,等.低分子量海带岩藻聚糖硫酸酯的清除活性氧自由基和体内抗氧化作用[J].水产学报,2001,25(1):64- 68.
[16] Xue C H,Fang Y,Lin H,et al.Chemical character sand antioxidative properties of sulfated polysaccharides fromLaminariajaponica[J].J Appl Phycol,2000(1):1-4.
[17] 刘波,明俊超,谢骏,等.大黄蒽醌提取物对罗氏沼虾高温下抗氧化能力与热应激蛋白70基因表达的影响[J].水产学报,2010,34(6):792-800.
[18] Rahman M M,Escobedo-Bonilla C M,Corteel M,et al.Effect of high water temperature(33 ℃) on the clinical and virological outcome of experimental infections with white spot syndrome virus(WSSV) in specific pathogenfree (SPF)Litopenaeusvannamei[J].Aquaculture,2006,261(3):842 -849.
[19] Munoz M,Cedenq R.Measurement of reactive oxygen intermediate production in haemocytes of the penaeid shrimp,Penaeusvannamei[J].Aquaculture,2000,191(1/3):89-107.
Effectsofkelppowderongrowth,non-specificimmunityandheptaopancreaticantioxidantinredswampcrayfishProcambarusclarkii
YANG Wei-wei1,2,LIU Wen-bin1,SHEN Mei-fang2,TANG Jian-qing2,ZHU Jie1,QIAN Yu1
(1.Key Laboratory of Aquatic Animal Nutrition and Feed Science of Jiangsu Province, College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210095, China;2.Freshwater Fisheries Research Institute of Jiangsu Province,Nanjing 210017, China)
Abstract:Juvenile red swamp crayfishProcambarusclarkiiwith body weight of (7.25±0.24)g was randomly divided into five groups and fed basal diet (control group) and the basal diets supplemented with 0.5%, 1.0%, 2.0%, and 4.0% of kelp powder(treatment groups) at water temperature of (25±3)℃ with triplication for 8 weeks to evaluate the effects of kelp powder on the growth,non-specific immunity and heptaopancreatic antioxidant capacity in red swamp crayfish. The results showed that the survival rate and weight gain rate of the crayfish were significantly affected by the kelp powder (P<0.05), the best growth in the crawfish fed the diet containing 2.0% of kelp powder, and increase in survival with increase in dietary kelp powder. The serum lysozyme activity, and total protein level were found to be increased and then decreased with increase in dietary kelp powder level, the maximum at 2.0% dietary kelp powder group, and the maximal serum alkaline phosphatase activity at 1.0% dietary kelp powder group. The activities of hepatopancreatic superoxide dismutase, catalase and glutathione showed a trend of increase and then decrease with the increase in the addition of kelp powder,the maximal superoxide dismutase activity at 2.0% dietary kelp powder group, the maximal catalase and glutathione activities and the minimal malondialdehyde level at 1.0% dietary kelp powder group. In conclusion, 1.0% to 2.0% dietary kelp powder led to significant improvement of growth performance, immunity and hepatopancreatic antioxidant capacity in the crawfish, and was recommended to be used in the crawfish feed.
Key words:Procambarusclarkii; kelp powder; growth performance; immune function
DOI:10.3969/J.ISSN.2095-1388.2014.01.009
文章编号:2095-1388(2014)01-0040-05
收稿日期:2013-06-02
基金项目:公益性行业(农业)科研专项(201003070);江苏省科技支撑计划(农业)(BE2013446)
作者简介:杨维维(1988—), 男, 硕士研究生。E-mail:2011113017@njau.edu.cn
通信作者:沈美芳(1968—), 女, 研究员。E-mail:mfshen2005@aliyun.com
中图分类号:S917.4
文献标志码::A


