摘要:利用实时定量PCR技术,分析了Z9~Z11期口虾蛄OratosquillaoratoriaMn-SOD基因在不同盐度胁迫下的表达情况。试验共设置8组,盐度分别为12.8、16.3、19.8、23.3、26.8(对照组)、30.3、33.8、37.3,各组均在盐度胁迫后的1.5、3、6、9、12、24、36、48、72 h取样。结果表明:在盐度胁迫时间为6、9、12、48、72 h时,各盐度组口虾蛄Mn-SOD基因的表达量总体上极显著或显著低于对照组(P<0.01或P<0.05),且与对照组盐度差值小的23.3、30.3两个盐度组,Mn-SOD基因表达量总体上均高于极高盐度(37.3)和极底盐度(12.8)组,在胁迫时间为24、36 h时,除12.8、16.3两个低盐度组外,其余盐度组Mn-SOD基因的表达量总体上极显著高于对照组(P<0.01);除极高和极低盐度组外,其余盐度组Mn-SOD基因的表达量均随着胁迫时间的延长总体上呈先降低再升高再逐步降低的变化趋势,盐度为12.8、16.3、19.8、23.3、30.3、33.8、37.3的各试验组,Mn-SOD基因最大表达量的时间点分别为6、12、24、24、24、24、24 h。研究表明,各试验盐度组口虾蛄在72 h内对盐度胁迫的适应总趋势为不适应—最不适应—逐步适应—不适应。
关键词:口虾蛄;Mn-SOD基因;盐度胁迫;基因表达
超氧化物歧化酶(SOD)是McCord等[1]从牛红细胞中发现并正式命名的,是各种生物体内重要的抗氧化酶类。根据与其结合的金属离子不同,SOD可分为Fe-SOD、Mn-SOD、Cu/Zn-SOD和Ni-SOD。SOD能消除体内的氧自由基,可对抗和阻断氧自由基对细胞造成的损害,并及时修复受损细胞[2]。水生生物在逆境胁迫(如重金属、污染、强光、离子辐射、极端温度、水分胁迫、盐度胁迫等)下,生物体内的SOD酶在防御外来压力、消除过量的![]() ·、维持生物体内活性氧分子的代谢平衡和保护机体免受活性氧损伤等方面起着重要的作用[3-5]。因此,研究水生生物体内SOD酶的表达量对水产动物养殖、疾病防治、生态环境保护等方面具有重要意义。李华等[6]、叶建生等[7]研究表明,盐度对凡纳滨对虾血清中SOD酶活力影响显著。
·、维持生物体内活性氧分子的代谢平衡和保护机体免受活性氧损伤等方面起着重要的作用[3-5]。因此,研究水生生物体内SOD酶的表达量对水产动物养殖、疾病防治、生态环境保护等方面具有重要意义。李华等[6]、叶建生等[7]研究表明,盐度对凡纳滨对虾血清中SOD酶活力影响显著。
口虾蛄Oratosquillaoratoria隶属于节肢动物门、甲壳纲、口足目、虾蛄科、口虾蛄属,常栖息于泥沙底质,在中国沿海均有分布。口虾蛄味道鲜美、营养丰富,是一种经济价值较高的水产品。目前,对口虾蛄的研究主要集中在生物学基础特征、群体结构、提取物的医药作用等方面[8-13]。刘海映等[14]研究了盐度对口虾蛄生长和存活的影响,指出大连沿海口虾蛄的生存盐度为20~40,最适盐度为24~36。培育口虾蛄Z9~Z11期假溞状幼体的适宜盐度为27~33[15]。目前,有关在盐度胁迫下,口虾蛄功能基因表达的研究尚未见报道。本研究中,采用实时定量PCR技术检测了口虾蛄在不同盐度胁迫和不同胁迫时间下,Mn-SOD基因的表达情况,旨在为口虾蛄的育苗工作提供参考,同时也为研究口虾蛄对盐度的调节适应机制提供基础资料。
1.1材料
试验用口虾蛄取自辽宁盘锦光合蟹业水产有限公司,为土池育苗的Z9~Z11期口虾蛄。
试剂和引物主要有:动物总RNA提取试剂盒(天根生物科技有限公司)、反转录和实时定量相关试剂(宝生物公司);PCR引物(大连万泽贸易有限公司)、DL2000Marker(生工生物公司)、dNTP、Hotstart DNA Polymerase(生工生物公司)。
1.2方法
1.2.1 试验设计 试验共设置8组,盐度分别为12.8、16.3、19.8、23.3、26.8、30.3、33.8、37.3(26.8为海水盐度,设为对照组),每个盐度组约放100只口虾蛄。于盐度胁迫后的1.5、3、6、9、12、24、36、48、72 h,分别从每个盐度组取8只口虾蛄,浸泡于RNA液中,于-80 ℃下保存备用。
1.2.2 总RNA的提取与反转录 从每个胁迫盐度组的各个胁迫时间点采集的样品中随机取两只口虾蛄,按试剂盒说明书步骤提取总RNA。用10 g/L琼脂糖凝胶电泳检测RNA的质量,用紫外分光光度计测定RNA的浓度。使用PrimeScript RT reagent Kit(Perfect Real Time)反转录cDNA。反转录体系:1 μL总RNA、2 μL 5×PrimeScript buffer (for Real Time)、0.5 μL PrimeScript RT Enzyme MixⅠ、0.5 μL 1×OligodT Primer(50 μmol/L)、0.5 μL 1×Random 6 mers(100 μmol/L),用RNase-free水定容至10 μL。反应在PCR仪上进行,先于37 ℃下反应15 min,再于85 ℃下反应5 s。
1.2.3 PCR扩增 根据大连海洋大学辽宁省海洋生物资源恢复与生境修复重点实验室克隆得到的Mn-SOD基因全长,用Primer 5.0软件设计定量表达引物(表1),用β-actin作为定量表达内参基因[16]。将引物进行PCR检测,筛选出条带单一、无二聚体的引物,用于下一步的试验。
表1引物序列
Tab.1Sequencesoftheprimers
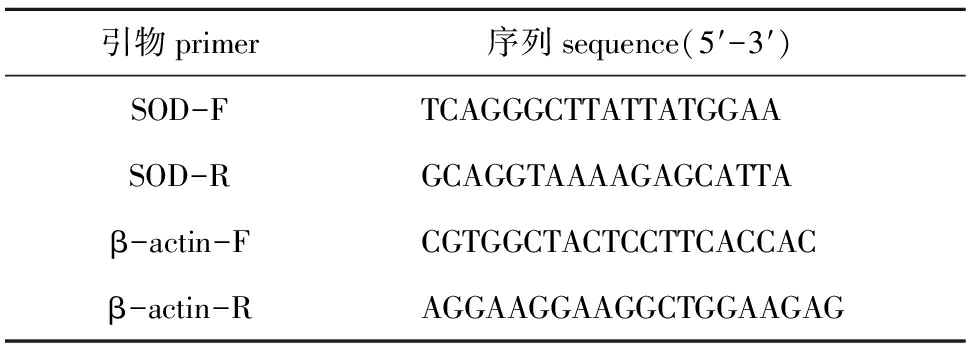
引物primer 序列sequence(5′-3′)SOD-FTCAGGGCTTATTATGGAASOD-RGCAGGTAAAAGAGCATTAβ-actin-FCGTGGCTACTCCTTCACCACβ-actin-RAGGAAGGAAGGCTGGAAGAG
反应体系为: 1 μL cDNA、0.5 μL正向引物、0.5 μL反向引物、2.5 μL 10×ExTaqBuffer(Mg2+Plus)、2 μL dNTP Mixture(2.5 mmol/L)、0.2 μL ExTaqDNA聚合酶(5 U/μL)、18.30 μL灭菌蒸馏水。Mn-SOD反应条件: 94 ℃下预变性4 min;94 ℃下变性30 s,退火1 min,退火温度分别为54、55、56、57、58、59 ℃,72 ℃下延伸5 min,共进行35个循环;最后在72 ℃下延伸10 min,于4 ℃下保温。β-actin的反应条件同上,退火温度分别为66、67、68、69、70、71 ℃。用琼脂糖凝胶电泳检测,条带最亮时的温度即为最佳退火温度。
1.2.4 Mn-SOD基因的定量表达分析 利用引物SOD-F和SOD-R对样品进行实时定量PCR扩增,用β-actin-F和β-actin-R作为内参引物。PCR反应条件为:94 ℃下预变性5 min;94 ℃下变性30 s,57 ℃下退火30 s,72 ℃下延伸60 s,共进行30个循环;最后在72 ℃下再延伸5 min,于4 ℃下保温。对于任意一个样品,目标基因(Mn-SOD)和内参基因(β-actin)扩增时加入等量的模板。每个样品设3个平行,试验过程重复3次,利用2-ΔΔCt法分析其定量表达结果。
1.3数据处理
采用ABI Real-Time软件进行分析。Mn-SOD基因表达的相对浓度计算公式为
y=(1+ExB)CtB/[(1+ExA)CtA]×100%。
其中:Ct为荧光信号达到设定域值时经历的循环数;CtA、CtB分别为目的基因、参照基因的Ct值;ExA、ExB分别为目的基因、参照基因的扩增效率。
基因表达量结果用SPSS软件进行显著性分析,显著性水平设为0.05,极显著水平设为0.01。
2.1口虾蛄的总RNA
从口虾蛄肌肉组织中提取总RNA,在紫外分光光度计上进行RNA浓度测定和质量检验,发现样品RNA的OD260 nm/OD280 nm值为1.9~2.1。利用10 g/L琼脂糖凝胶电泳进行检测,结果见图1,获得的总RNA质量较高,可以进行后续试验。
图1 口虾蛄总RNA的琼脂糖凝胶电泳图
Fig.1 The agarose gel electrophoretogram of mantis shrimp Oratosquilla oratoria
2.2引物和内参引物扩增的最佳退火温度
用RNA反转录得到的cDNA为模板,利用已设计好的特异性引物进行扩增,所得目的片段电泳结果如图2所示。根据条带亮度,得到引物β-actin的最佳退火温度是68 ℃,引物SOD的最佳退火温度为57 ℃。
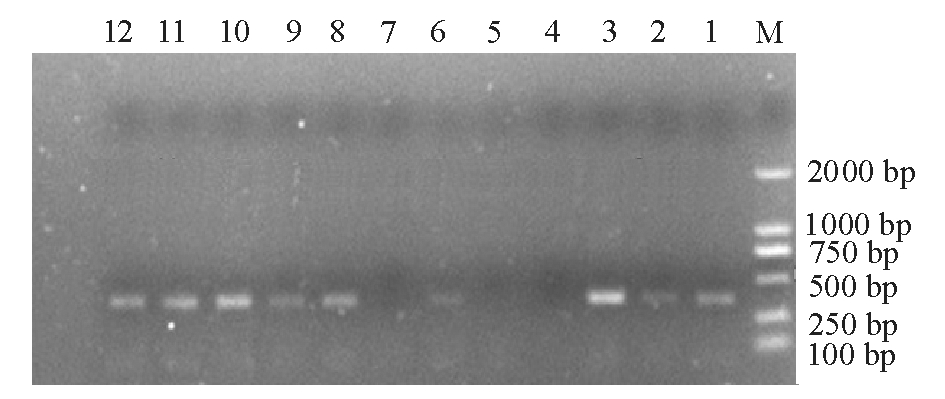
注:M为Marker DL2000;1~6分别为引物β-actin在退火温度为66、67、68、69、70、71 ℃时扩增的条带;7~12分别为引物SOD在退火温度为54、55、56、57、58、59 ℃时扩增的条带
Note:lane M, Marker DL2000; the bands in lanes 1-6 represent PCR of primer β-actin at 66,67,68,69,70,and 71 ℃; the bands in lanes 7-12 represent PCR of primer SOD at 54,55,56,57,58,and 59 ℃
图2 退火温度筛选的引物扩增图
Fig.2 The amplification bands of the primers in gradient annealing temperature
2.3口虾蛄肌肉组织中Mn-SOD基因的表达
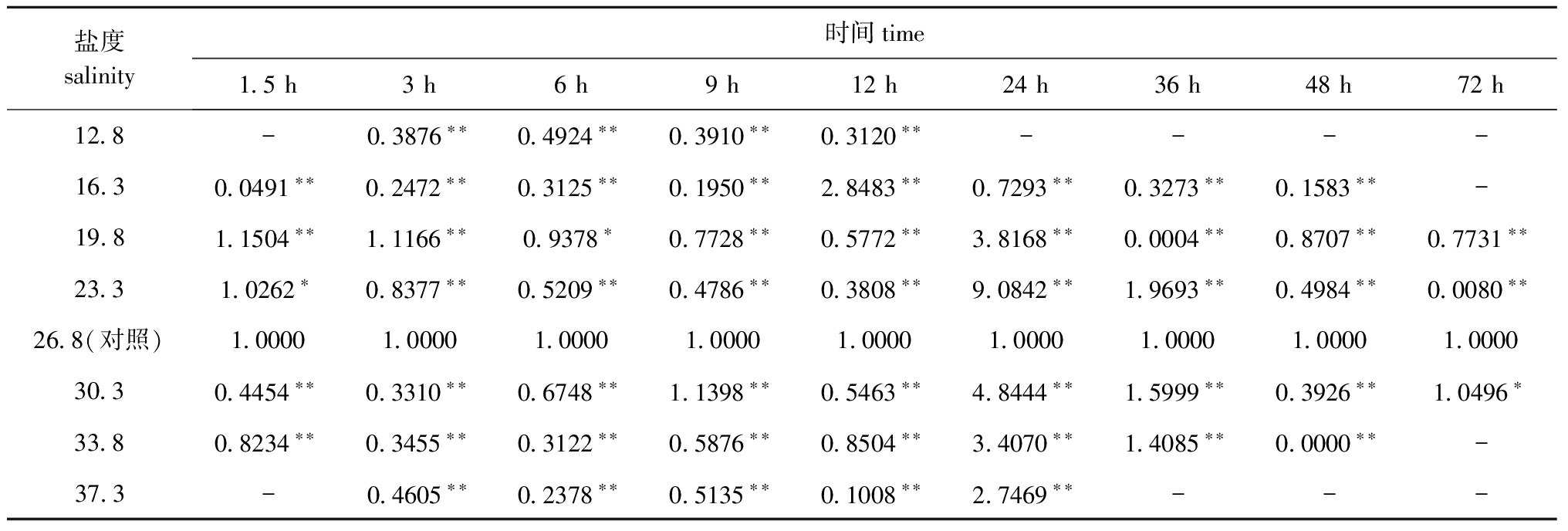
2.3.1 不同盐度胁迫对Mn-SOD基因表达的影响 不同盐度胁迫对口虾蛄Mn-SOD基因表达的影响显著。从表2可见:在相同胁迫时间下,各盐度组口虾蛄Mn-SOD基因的表达量均与对照组有显著或极显著性差异(P<0.05或P<0.01);在胁迫时间为12 h内,除盐度16.3组胁迫12 h、盐度19.8组胁迫1.5 h和3 h、盐度23.3组胁迫1.5 h、盐度30.3组胁迫9 h外,其余各试验组Mn-SOD基因的表达量均极显著低于对照组(P<0.01);当胁迫时间为24、36 h时,除两个低盐度12.8和16.3组以及盐度19.8组胁迫36 h、盐度37.3组胁迫36 h外,其余各试验组Mn-SOD基因的表达量均极显著高于对照组(P<0.01),在这个时间段中,与对照组盐度差值小的23.3、30.3盐度组,Mn-SOD基因的表达量均较高,其中盐度23.3组在胁迫时间为24、36 h时的Mn-SOD基因表达量分别为对照组的9.08倍和1.97倍;当胁迫时间达到48、72 h时,除极低盐度(12.8)和极高盐度(37.3)组以及盐度30.3组胁迫72 h外,其余各试验组Mn-SOD基因的表达量均极显著低于对照组(P<0.01)。
2.3.2 不同胁迫时间对Mn-SOD基因表达的影响 不同胁迫时间对口虾蛄Mn-SOD基因表达的影响显著。从表2可见:除极高和极低盐度组外,其余盐度组Mn-SOD基因的表达量均随着胁迫时间的延长总体上呈先降低再升高再逐步降低的变化趋势;盐度为19.8、23.3、30.3、33.8时,Mn-SOD基因最大表达量的时间点均为24 h,此时4个盐度组的Mn-SOD基因表达量分别为对照组的3.82、9.08、4.84、3.41倍;盐度为16.3时,不同胁迫时间对Mn-SOD基因表达有极显著性影响(P<0.01),并在12 h时Mn-SOD基因表达量最大,为对照组的2.85倍;盐度为37.3时,Mn-SOD基因表达量在24 h时最大,为对照组的2.75倍,而在其他胁迫时间点Mn-SOD基因表达量均很低。
表2不同盐度胁迫、相同处理时间下Mn-SOD基因的表达情况
Tab.2TheMn-SODgeneexpressioninmantisshrimpunderdifferentsalinitystress
盐度salinity时间time1 5h3h6h9h12h24h36h48h72h12 8-0 3876∗∗0 4924∗∗0 3910∗∗0 3120∗∗----16 30 0491∗∗0 2472∗∗0 3125∗∗0 1950∗∗2 8483∗∗0 7293∗∗0 3273∗∗0 1583∗∗-19 81 1504∗∗1 1166∗∗0 9378∗0 7728∗∗0 5772∗∗3 8168∗∗0 0004∗∗0 8707∗∗0 7731∗∗23 31 0262∗0 8377∗∗0 5209∗∗0 4786∗∗0 3808∗∗9 0842∗∗1 9693∗∗0 4984∗∗0 0080∗∗26 8(对照)1 00001 00001 00001 00001 00001 00001 00001 00001 000030 30 4454∗∗0 3310∗∗0 6748∗∗1 1398∗∗0 5463∗∗4 8444∗∗1 5999∗∗0 3926∗∗1 0496∗33 80 8234∗∗0 3455∗∗0 3122∗∗0 5876∗∗0 8504∗∗3 4070∗∗1 4085∗∗0 0000∗∗-37 3-0 4605∗∗0 2378∗∗0 5135∗∗0 1008∗∗2 7469∗∗---
注:*表示与对照组有显著性差异(P<0.05);**表示与对照组有极显著性差异(P<0.01)
Note: * means significant difference compared with the control (P<0.05);** means very significant difference compared with the control(P<0.01)
盐度是影响水产动物存活和生理反应的重要因素之一,直接影响生物的新陈代谢。研究表明,盐度对水生生物的呼吸、体质量、渗透压及其组织器官的功能等均有影响[17]。本试验结果表明,盐度对口虾蛄体内Mn-SOD基因表达量有显著影响,尤其在极高盐度37.3和低盐度12.8、16.3胁迫下,Mn-SOD基因表达量总体上均极显著低于对照组。这是由于试验所用Z9~Z11期口虾蛄的培养盐度为26.8,而极高和极低盐度与试验口虾蛄的培养盐度相差太大,盐度胁迫可能造成了口虾蛄生理机理紊乱、酶活性降低,从而导致Mn-SOD基因表达量降低。在胁迫时间为1.5 h时,各盐度组口虾蛄处于对周围盐度不适应阶段,相对于高盐度,低盐度对Mn-SOD基因表达量稍有促进作用。在胁迫时间为3、6 h时,各盐度组的Mn-SOD基因表达量均低于对照值(除盐度19.8组胁迫3 h外),推测此阶段口虾蛄对盐度表现为极不适应状态,所以基因表达量都很低。在胁迫时间为9、12 h时,各盐度组Mn-SOD基因表达量有所增加,在对照值或上或下有一个高峰,这时的口虾蛄正在逐渐适应周围的环境。在胁迫时间为24、36 h时,各盐度组Mn-SOD基因表达量在对照值上、下两侧各有一个高峰,且稍高、稍低的盐度变化均能刺激Mn-SOD基因的表达变化,此时的口虾蛄对周围环境已经适应,对外界盐度胁迫已做出反应。根据王瑞旋等[18]的研究,此时呼吸量的增加用于排出多余的盐分或多余的水分来调节渗透压,在这种渗透压主动调节过程中,还涉及到皮肤、肠道和肾脏等器官的参与,这时需要更多的SOD酶来减少氧自由基对机体造成的损害。在胁迫时间为48、72 h时,各盐度组Mn-SOD基因的表达量又降低,均极显著低于对照值(除盐度30.3组胁迫72 h外),说明此时的口虾蛄受盐度胁迫时间较长,机体已受到损害,较高和较低的盐度均不能刺激SOD酶的增加,这时的口虾蛄已不能再适应周围的环境。
本试验结果表明,盐度胁迫时间对口虾蛄体内Mn-SOD基因表达量也有显著影响。除极高和极低盐度组外,其余盐度组Mn-SOD基因的表达量均随着胁迫时间的延长总体上呈先降低再升高再逐步降低的变化趋势;各试验盐度组口虾蛄在72 h内对盐度胁迫的适应总趋势为不适应—最不适应—逐步适应—不适应;设置盐度与对照组差值小的组(23.3、30.3盐度组),在各个胁迫时间点其Mn-SOD基因表达量总体上高于极高和极低盐度组。李华等[6]研究表明,凡纳滨对虾的SOD酶等免疫生理指标呈先波动后稳定趋势。叶建生等[7]研究表明,盐度突变组SOD酶活性呈随时间延长先降低后升高的变化趋势,且盐度突变值越大,SOD酶活性越小。李庭古[19]也指出,盐度对虾蟹类动物的影响主要是渗透压的作用,可以通过改变自身的代谢状况来适应不同的盐度环境。本试验结果与上述研究结果相近。
水生生物的整个生长过程都受其水环境中盐度的影响。自然条件下,水环境中的盐度表现出明显的季节性和昼夜波动。此外,养殖生产中定期的换水、偶尔的降雨也会导致盐度的突然变化,这种急性盐度胁迫对水生生物存活的影响是巨大的。此外,当生物体受到其他环境胁迫时,自由基的量会增加,要么需要更多的SOD酶减轻毒性、维持机体氧化和抗氧化平衡,要么水生生物体不适应环境胁迫而使机体机能丧失、SOD酶的含量降低。不仅水中的总氨氮和亚硝酸盐氮含量会影响水生生物的SOD免疫酶指标,而且水的盐度对水生生物SOD酶表达量也有很大影响,因而水生生物体内SOD酶的含量也是水质量评价的一个指标。本试验结果可为进一步了解口虾蛄生理生态学特征提供资料,并为其养殖生产中的水质调控、疾病预防提供科学依据。
参考文献:
[1] McCord J M,Fridovich I.Superoxide dismutase:an enzymatic function for erythroeuprein (hemocuprein)[J].J Biol Chem,1969,244(22):6049-6055.
[2] 周霞.超氧化物歧化酶的功能和应用研究[J].中国中医药咨讯,2011,3(6):318.
[3] 孙娜,王宇佳,柳郁滨,等.Hg2+对水丝蚓的急性毒性及超氧化物歧化酶活性的影响[J].中国农学通报,2012,28(17):143-146.
[4] 吴一挺,王志铮,杨磊,等.pH对日本沼虾耗氧率及鳃组织CAT、SOD活力的影响[J].浙江海洋学院学报:自然科学版,2011,30(6):503-506,519.
[5] 赵艳民,王新华,秦延文,等.Hg2+对中华绒螯蟹肝胰腺抗氧化酶和脂质过氧化作用的影响[J].南开大学学报:自然科学版,2011,44(5):88-95.
[6] 李华,李强,曲健风,等.不同盐度下凡纳滨对虾血淋巴免疫生理指标比较[J].中国海洋大学学报:自然科学版,2007,37(6):927-930.
[7] 叶建生,王兴强,马甡,等.盐度突变对凡纳滨对虾非特异性免疫因子的影响[J].海洋水产研究,2008,29(1):38-43.
[8] 王春琳,梅文骧.口虾蛄的生物学基本特征[J].浙江水产学院学报,2008,29(1):38-43.
[9] 刘海映,王桂娥,王秀利.大连海域口虾蛄资源遗传多样性的分析[J].大连水产学院学报,2009,24(4):350-353.
[10] 林月娇,刘海映,徐海龙,等.大连近海口虾蛄形态参数关系的研究[J].大连水产学院学报,2008, 23(3):215-217.
[11] 顾帝水,孔霞,陈锦,等.口虾蛄提取物对体外人鼻咽癌细胞转移潜能的影响[J].时珍国医国药,2010,21(2):360-361.
[12] 张代臻,丁鸽,张华彬,等.渤海湾葫芦岛海域口虾蛄mtCOI基因序列多态性研究[J].江苏农业科学,2011(3):55-57.
[13] 刘海映,秦玉雪,姜玉声,等.口虾蛄胚胎发育的研究[J].大连海洋大学学报,2011,26(5):437- 441.
[14] 刘海映,徐海龙,林月娇.盐度对口虾蛄存活和生长的影响[J].大连水产学院学报,2006,21(2):180-183.
[15] 刘海映,王冬雪,姜玉声,等.盐度对口虾蛄假溞状幼体存活和摄食的影响[J].大连海洋大学学报,2012,27(4):311-314.
[16] Kodama K,Rahman M S,Horiguchi T,et al.Assessment of hypoxia-inducible factor-1α mRNA expression in mantis shrimp as a biomarker of environmental hypoxia exposure[J].Biology Letters,2012,8(2):278-281.
[17] 唐夏,黄国强,李洁,等.低盐度胁迫不同时间对褐牙鲆幼鱼生长的影响[J].南方水产科学, 2012,8(3):10-16.
[18] 王瑞旋,王江勇,徐力文,等.军曹鱼养殖水体及其肠道弧菌的耐药性研究[J].南方水产,2007,3(5):1-6.
[19] 李庭古.盐度对克氏原螯虾幼虾生长的影响[J].水产科学,2009,28(8):465-467.
Abstract:The expression of Mn-SOD gene was detected in pseudozoea (Z9-Z11) of mantis shrimpOratosquillaoratoriawhen the pseudozoea was exposed to a salinity of 12.8, 16.3, 19.8, 23.3, 26.8(control group), 30.3, 33.8, and 37.3 for 1.5, 3, 6, 9, 12, 24, 36, 48,and 72 h by real time PCR. The results showed that within the different salinity exposure of 6,9,12,48,and 72 h there was very significantlys and significantly lower Mn-SOD gene expression levels than that in the control group (P<0. 01 orP<0.05) and there was mostly higher Mn-SOD gene expression levels in salinity of 23.3,and 30.3 than that in the 37.3 or 12.8 groups (P<0. 01). In the salinity exposure from 24 h to 36 h, there was significantly higher Mn-SOD gene expression levels than that in the control group except salinity of 12.8, and 16.3 than that in the control group (P<0.01). The gene expressions in different salinity stress were found to be decrease firstly, then increased and finally decreased gradually during 72 hours except the maximal and minimal salinity. At a salinity of 12.8, 16.3, 19.8, 23.3, 30.3, 33.8,and 37.3, the maximum gene expression was observed in 1.5, 12, 24, 24, 24, 24,and 24 h salinity exposure,respectively. The mantis shrimp larvae had a salinity adaptation trend from unadaptation, via the most unadaptation, and gradual adaptation, to unadaptation.
Key words:Oratosquillaoratoria; Mn-SOD; salinity stress; gene expression
DOI:10.3969/J.ISSN.2095-1388.2014.01.004
文章编号:2095-1388(2014)01-0017-05
收稿日期:2013-05-23
基金项目:国家海洋公益性行业科研专项(200905019);辽宁省科学技术计划项目(2008203002);国家自然科学基金资助项目(41006079)
中图分类号:Q812
文献标志码::A