脉红螺早期发育的观察
郝振林, 于洋洋, 宋坚, 常亚青,肖登兵, 贲月
(大连海洋大学 农业部北方海水增养殖重点实验室,辽宁 大连 116023)
摘要:在实验室条件下对脉红螺Rapanavenosa早期个体发生及其发育过程进行了研究。结果表明:脉红螺的发育属间接发生型,其胚胎发育包括卵裂、囊胚、原肠胚、膜内担轮幼虫和膜内面盘幼虫;幼虫发育包括面盘幼虫、后期面盘幼虫和匍匐幼虫,匍匐幼虫经变态后发育为稚螺;在水温为21~22 ℃的条件下,受精卵需18~20 d发育至膜内面盘幼虫,经20~26 d后,面盘幼虫逐渐破膜而出;脉红螺面盘幼虫具有1对眼点和1对平衡囊,面盘呈双叶状,后期面盘幼虫的面盘中部开始凹陷,并逐步加深成4叶,呈蝶状,足发达,幼虫既能浮游又能爬行,随着进一步的生长发育,逐渐转入匍匐生活,成为稚螺。
关键词:脉红螺;受精卵;面盘幼虫;胚胎发育
脉红螺Rapanavenosa主要分布于中国的渤海、黄海、东海和南海,其中辽宁大连和山东青岛等地产量较高。脉红螺体型较大,成体壳高为110~140 mm,足部肥大,营养丰富,味道鲜美,是颇受欢迎的美味佳肴[1]。脉红螺系肉食性动物,主食双壳贝类,生长迅速,适合筏式笼养、网袋平养、底播增殖等多种养殖方式,是目前筏式养殖良好的替代品种和间养品种,也是池塘生态养殖中很好的混养品种[2]。目前,中国的脉红螺人工繁育技术尚未成熟,仍处于试验阶段。关于脉红螺的研究主要集中在繁殖力、繁殖方式、繁殖季节等繁殖生物学[3],以及遗传多样性[4]和工厂化人工育苗等方面[5],而关于脉红螺胚胎发育方面的图像资料却鲜见报道。本研究中,作者在实验室内观察了脉红螺的胚胎发育、孵化和幼体发育过程,以期为脉红螺的全人工繁育提供基础资料。
1材料与方法
1.1材料
研究用脉红螺亲螺于2011年7月13日采自大连大长山岛海域,壳高为100~130 mm,外形完整,无损伤。
1.2方法
将48个亲螺暂养于3个玻璃钢(1.2 m×1.0 m×0.8 m)水池内,暂养密度为16个/m3。每天清底,换水2次,每次换水1/2,连续充气增氧。过量投喂虾夷扇贝、菲律宾蛤仔、四角蛤蜊等饵料。每天定时从同一天产的卵囊中取样,观察受精卵在卵囊内的孵化、胚胎发育和幼体发育过程,并在显微镜下拍照。
2结果
2.1交配方式
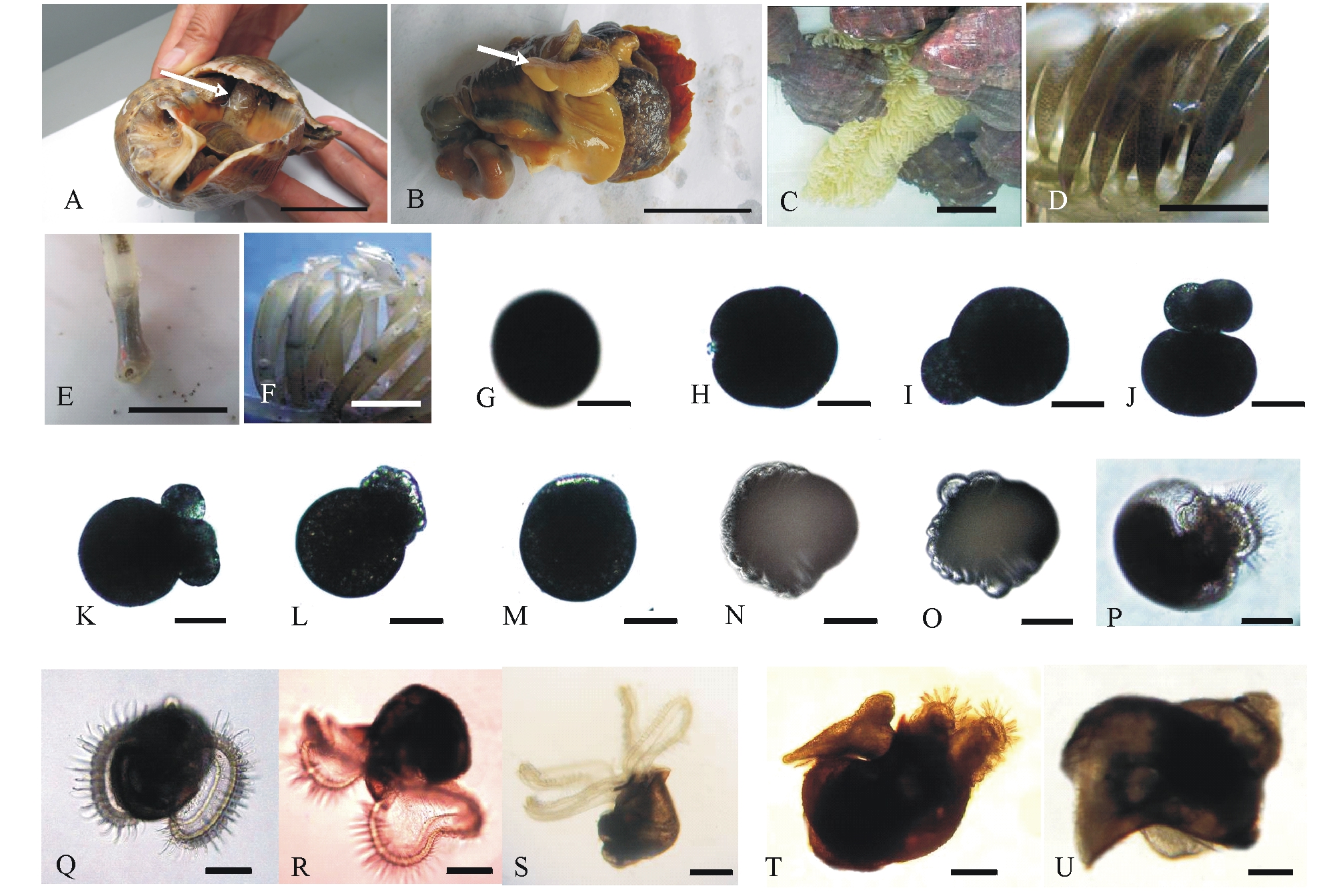
脉红螺属雌雄异体,交配时,雄性脉红螺与雌性脉红螺壳口呈约45°角相对,雄性脉红螺将其外套腔右侧的交接器伸入到雌性产卵孔内(图1-A),将精子送入储精囊。交接器较长,静止状态下长度为3~4 cm,交接器末端有一镰刀状弯钩(图1-B)。
2.2卵囊特征
受精后,雌性脉红螺便开始产卵囊,产卵前会对产卵基进行选择,一般会将卵囊产在养殖池壁、池底和其他一些质地较为坚硬的附着基上。卵囊表面较为光滑,呈菊花瓣状,外周被一层半透明且较厚的胶质膜所覆盖,具有保护卵囊内受精卵的作用(图1-C)。卵囊内含有许多受精卵和一种黏稠透明状的营养液,受精卵均匀悬浮于该液体中(图1-D)。
卵囊长短有差异,最短为15.68 mm,含受精卵1028粒左右;最长为25.83 mm,含受精卵3042粒左右;平均长度为17.33 mm,含受精卵1215粒左右。
2.3胚胎发育
2.3.1 卵裂期 在水温为21~22 ℃条件下解剖观察卵囊内受精卵的发育过程。脉红螺受精卵为圆形(图1-G),卵径为205 μm左右。受精后6 h放出第一极体,9 h放出第二极体,两个极体重叠于动物极(图1-H)。脉红螺卵裂方式为盘状卵裂,当极体排出后,动物极开始逐渐内陷、隆起,形成胚盘(图1-I)。受精后20 h形成2细胞期(图1-J),32 h形成4细胞期(图1-K),2~3 d后形成多细胞期(图1-L)。随着分裂球数量的增多,胚胎开始进入桑椹期。
2.3.2 囊胚期 受精后4 d,胚胎发育至囊胚期(图1-M)。此时胚胎略呈椭圆形,细胞外凸,植物极细胞大于动物极细胞。
2.3.3 原肠胚期 受精后5~6 d,胚胎发育至原肠胚期(图1-N)。此时原肠胚外层细胞自动物极向植物极包被整个胚胎的2/3以上,后逐渐下包,同时植物极细胞开始内陷,形成原口。原口附近出现少量的纤毛,胚体可以借助纤毛摆动在卵囊内较缓慢地转动。
2.3.4 膜内担轮幼虫期 胚胎约经11 d发育至担轮幼虫期(图1-O)。此时胚体两侧突起逐渐消失,胚体拉长,表面出现短而细的纤毛,随着生长纤毛的逐渐增多,胚体靠纤毛摆动在卵囊内做间歇性旋转,一般为逆时针方向旋转。此时卵囊呈浅灰色。
2.3.5 膜内面盘幼虫期 经18~20 d,胚体发育至膜内面盘幼虫期。此时胚胎体积明显增大,出现足原基,并在足基部出现无色透明的长圆形厣,胚壳薄而透明。头部形成面盘,面盘呈双瓣状,表面光滑、透明,外缘为2层,各生有一圈纤毛,外圈纤毛长于内圈纤毛,形成环绕面盘的食物沟。出膜后,幼体通过摆动纤毛,在面盘表面形成水流,借此将因纤毛摆动而搜集到的藻细胞输送到食物沟中。随着幼虫的发育,卵囊内胶状物质逐渐溶解不再黏稠,此时卵囊呈灰黑色(图1-D)。幼虫活动加强,在卵囊液中频繁摆动纤毛,做间歇性活动,有时收缩面盘与足,处于短暂的静止状态(图1-P)。此时如人为将卵囊弄破,放散出的幼虫亦能利用纤毛摆动而自由游泳。
2.3.6 孵化 在水温为21~22 ℃条件下,经20~26 d,面盘幼虫逐渐从卵囊顶孔中孵出,在水中营浮游生活,随着幼虫的孵出,卵囊逐渐由灰黑色变为白色(图1-E、F)。脉红螺受精卵在卵囊内的孵化时间与水温、水流有关,水温为23~24 ℃时只需16 d。
2.4幼虫发育
2.4.1 面盘幼虫 刚孵出的面盘幼虫平均壳高约340 μm,壳宽约290 μm,具有1对双叶形的面盘,面盘四周纤毛密集,浮游能力较强。具有平衡囊和眼点各1对,透过幼虫半透明的外壳可观察到幼虫心脏搏动,以及胃和肠等消化管道雏形。幼体纤毛的不停摆动可使养殖池内大量的幼体在水体中呈螺旋状快速游动,纤毛摆动又可使幼体摄食等鞭金藻Isochrysisgalbana和小球藻Chlorellasaccharophila等单细胞藻类 (图1-Q)。
2.4.2 后期面盘幼虫 孵出2~6 d后,幼虫形态发生明显变化,面盘下分化出足和厣,左右两叶面盘中部开始凹陷,并逐步加深成4叶,呈蝶状。孵出16 d后,幼虫出现2~3个螺层,贝壳形成前后沟,足发达呈靴状,能频繁伸出壳外做匍匐运动,足内平衡囊清晰可见,头部出现一对触角和基眼,幼虫进入附着变态期(图1-R、S)。
2.4.3 匍匐幼虫 面盘幼虫经过28~30 d的发育,平均壳宽达到1200 μm左右时,面盘萎缩退化(图1-T),失去游泳能力,附着变态为稚螺。稚螺有3~4个螺层,壳高为1.4~1.6 mm,壳宽为0.9~1.1 mm,足的蹠面宽广、发达,能翻身,头部有触角1对,眼1对,吻明显可见,主动舔食,喜群居(图1-U)。
3讨论
3.1脉红螺的卵群特征
大部分水生腹足类排出的卵子往往会黏集成群,称为“卵群”[6]。而卵群形状也随腹足类的种类不同出现多样化:蛎敌荔枝螺Thaisgradate的卵群呈瓶状,海兔Aplysiadactylomela的卵群为丝状,俗称“海挂面”,泥螺Bullactaexarata的卵群呈球状,香螺Neptuneaarthritica的卵群呈玉米芯状,俗称“海苞米”[6],而扁玉螺Neveritadidyma的卵群呈围领状[7]。螺类卵群形状的多样化可能与其各自不同的进化过程有关,其真正原因尚有待于进一步研究。另外,本研究中,单个卵囊呈菊花瓣状,通常会平列聚集很多(图1-C),这与黄口荔枝螺Thaisluteostoma的卵群相似[8],但卵囊规格却存在显著差异。黄口荔枝螺的卵囊最长为8.24 mm,最短为6.38 mm;而本研究中观察到的脉红螺卵囊规格与魏利平等[3]的观察结果相似,最长为25.83 mm,最短为15.68 mm。
3.2脉红螺的胚胎发育
脉红螺的卵裂为典型的不完全卵裂中的盘状卵裂。当极体排出后,动物极逐渐内陷、隆起,形成胚盘,胚盘经裂为2个大小相等的分裂球。这种卵裂方式与黄口荔枝螺的卵裂方式相同[8],而与扁玉螺[7]和斑玉螺[9]的不均等式螺旋卵裂存在差异。有学者报道[10-11],贝类幼虫的发育一般可分为卵黄营养、浮游营养和直接营养3种类型。卵黄营养型是指幼虫以自身的卵黄为营养,很少依赖或不依赖浮游生物,浮游生活较短;浮游营养型是指幼虫主要以浮游植物为食,浮游时间较长,一般达数周甚至几月;直接营养型是指整个胚胎和幼虫发育都在卵壳内进行。由此可见,脉红螺的幼虫发育属于浮游营养类型。对比发现,刚孵化的脉红螺面盘幼虫与扁玉螺的早期面盘幼虫在形态上并无显著差别,但随着幼虫的不断发育,其形态却会发生很大差异[7]。脉红螺和扁玉螺都是在后期面盘幼虫时期面盘中部开始凹陷,但脉红螺凹陷的程度比扁玉螺深得多,并在后期面盘幼虫的面盘出现明显的色素沉淀。这和乳玉螺属的Polinicespulchellus和P.lewisii面盘幼虫发育过程相类似[12-13]。因此,骨螺科动物不同种之间的胚胎发育既有差异,又有相似之处。柳敏海等[8]认为,种间差异反映了骨螺科动物不同种之间发育过程中的独自特点,而相似之处则说明他们在发育过程中其形态上的共性。
本研究中发现,在一定环境条件下,当卵囊内脉红螺胚胎幼体发育至面盘幼虫时,便开始破膜孵出,破膜而出的脉红螺幼虫经历3个发育阶段:浮游幼虫、匍匐幼虫和稚螺,属间接发生型。这与前鳃亚纲新腹足目的台湾东风螺[14]以及中腹足目的斑玉螺[9]和毛嵌线螺[15]等大多数种类相似,都属于胚胎发育至面盘幼虫从卵囊中孵化的间接发生型,而与属于直接发生型的新腹足目的香螺和管角螺截然不同[16]。从水产动物进化发生角度分析,脉红螺和扁玉螺等骨螺科动物的间接发生型较为低等。卵囊对于保护卵囊内胚胎起到了重要作用,破膜而出的浮游幼虫暂时避开了与成体竞争食物,降低了沉在海底的死亡率,同时也降低了下一次繁殖时近亲交配的可能,并且通过来自其他群体浮游幼虫的不断补充,会有利于种群进化,增加后代对环境条件的适应能力[7]。
参考文献:
[1] 于洋洋,郝振林,宋坚,等.脉红螺生物学及增养殖技术研究进展[J].河北渔业,2012,12:50-53.
[2] 常亚青.贝类增养殖学[M].北京:中国农业出版社,2007.
[3] 魏利平,邱盛尧,王宝钢,等.脉红螺繁殖生物学的研究[J].水产学报,1999,23(2):150-155.
[4] 杨建敏,郑小东,李琪,等.中国沿海脉红螺(Rapanavenosa)居群数量性状遗传多样性研究[J].海洋与湖沼,2006,37(5):385-392.
[5] 于瑞海,李琪,王昭萍.一种脉红螺人工育苗的方法:中国,201010290904.4.[P].2011.
[6] 蔡英亚,张英,魏若飞.贝类学概论[M].修订版.上海:上海科学技术出版社,1995:162-183.
[7] 刘庆,孙振兴.扁玉螺早期发育的实验观察[J].动物学杂志,2008,43(5):99-103.
[8] 柳敏海,彭志兰,傅荣兵,等.黄口荔枝螺早期发育的初步研究[J].大连水产学院学报,2010,25(1):24-28.
[9] 钟幼平,丁元录,陈小妮.斑玉螺生物学初步研究[J].厦门水产学院学报,1996,18(1):42-49.
[10] Thorson G.Reproductive and larval ecology of marine bottom invertebrates[J].Biological Reviews,1950,25:1-45.
[11] 谢淑瑾,周一兵,杨大佐,等.长蛸繁殖行为与胚胎发育的初步观察[J].大连海洋大学学报,2011,26(2):102-107.
[12] Smith K P R,Richardson C A,Seed R.Growth and development of veliger larva and juveniles ofPolinicespulchellus(Gastropoda:Naticidae) Risso 1826[J].Journal of the Marine Biological Association of the United Kingdom,2005,85(1):171-174.
[13] Pedersen R V K,Page L R.Development and metamorphosis of the planktotrophic larvae of the moon snail,Policicedlewisii(Gould,1847)(Caenogastropoda:Naticeidea)[J].The Veliger,2000,43(1):58-63.
[14] 吴进锋,张汉华,陈利雄,等.台湾东风螺人工繁殖及苗种生物学的初步研究[J].海洋科学,2006,30(9):92-95.
[15] 周永灿,陈国华,潘金培.毛嵌线螺的研究:Ⅱ.繁殖及幼虫发生特征[J].海洋学报,2000,22(3):97-104.
[16] 潘英,庞有萍,罗福广,等.管角螺的繁殖生物学[J].水产学报,2008,32(2):217-222.
ObservationonearlydevelopmentofsnailRapanavenosa
HAO Zhen-lin, YU Yang-yang, SONG Jian, CHANG Ya-qing, XIAO Deng-bing, BEN Yue
(Key Laboratory of Mariculture & Stock Enhancement in North China’s Sea, Ministry of Agriculture, Dalian Ocean University, Dalian 116023, China)
Abstract:The incubation, embryonic and larval development were observed in snailRapanavenosain a laboratory in this study. The indirect early development of the snail was divided into embryonic development including cleavage, blastula, gastrula, trochophore, and intra-membrane veliger, and larval development composed of veliger, late veliger and crawling larvae,which were metamorphosed into juveniles. It took about 18-20 d for the development from the fertilized egg to intra-membrane veliger and the veligers were hatched in 20-26 d at temperature of 21-22 ℃. The veligers had a pair of eyes, a pair of statoliths and bi-lobed velum, and the late veligers showed a velum with four-lobed like a butterfly, and the well-developed foot. The larvae swam and crept freely, and grew rapidly and gradually turned into crawing juveniles.
Key words:Rapanavenosa; zygote; veliger; embryonic development
DOI:10.3969/J.ISSN.2095-1388.2014.01.001
文章编号:2095-1388(2014)01-0001-04
收稿日期:2013-05-08
基金项目:辽宁省科技厅重大攻关项目(200803001);国家“863”计划重大项目(2012AA10A412);国家海洋公益项目(201205031)
作者简介:郝振林(1980—)男, 讲师,博士。E-mail:haozhenlin@dlou.edu.cn
通信作者:常亚青(1967—)男, 博士,教授。E-mail:yqchang@dlou.edu.cn
中图分类号:S966.28
文献标志码::A