摘要:以箭齿鲽Atheresthes stomias为原料,对其肌肉蛋白进行分离提取,并研究了蛋白质的功能特性。采用pH调节方法,分别提取得到酸分离蛋白和碱分离蛋白,同时以原料肌肉蛋白和传统漂洗鱼糜为对照。利用SDS-PAGE法对分离蛋白的分子量分布进行分析,结果表明,碱分离蛋白中肌原纤维蛋白分子保持完整,而酸分离蛋白有明显的肌球蛋白重链和肌动蛋白降解现象产生。对分离蛋白的功能特性包括溶解性、持水性、持油性、乳化性、起泡性、凝胶特性进行分析,结果表明,与原料鱼肉和漂洗鱼糜相比,酸分离蛋白和碱分离蛋白均表现出明显的乳化性能,碱分离蛋白具有最佳的凝胶强度,而在其他功能特性方面,分离蛋白则没有明显的优势。对分离蛋白的基本理化特性进行分析,结果表明,分离蛋白的脱脂效果比漂洗鱼糜更加明显,且与原料鱼肉 (13.00%)相比,碱分离蛋白脂肪含量最少 (1.23%),其次是酸分离蛋白 (1.96%)和漂洗鱼糜 (3.30%)。从分离前后的色度变化可以看出,分离蛋白的白度明显优于漂洗鱼糜和原料鱼肉。研究表明,箭齿鲽分离蛋白在食品加工中作为一种蛋白配料具有一定潜力。
关键词:箭齿鲽;分离鱼蛋白;蛋白质功能特性
箭齿鲽Atheresthes stomias是一种典型的低值白肉鱼,主要分布于阿拉斯加湾和白令海,其可利用生物量约为57.6万t,资源量十分丰富[1]。箭齿鲽在加热过程中常有肌肉软化成糊状的现象,因此,其商业价值一直未能被充分挖掘利用。关于箭齿鲽肌肉加热过程中软化的机理有很多研究报道,大致可归纳为两方面的原因:其一,源于鱼体内的组织蛋白酶L,它是一种半胱氨酸蛋白酶,其最适温度约为60℃,因此,在加热过程中很容易被激活致使肌肉蛋白自溶降解,从而失去食用价值[2];其二,箭齿鲽、太平洋牙鳕Merluccius productus、秘鲁无须鳕Merluccius gayi peruanus等肌肉中均含有黏孢子虫Kudoa thyrstis,这种寄生虫能够分泌致使肌肉降解的蛋白酶,从而使这些鱼类发生肌肉加热软化现象[3-6]。关于如何通过抑制蛋白酶活性使箭齿鲽肌肉加热固化有不少研究[7-8]。本研究中,作者以箭齿鲽肌肉为原料,利用pH调节法从箭齿鲽肌肉中提取分离蛋白,并对该分离蛋白的功能特性进行了系统研究,旨在开发新型功能性分离蛋白,以尝试开发高附加值箭齿鲽加工产品的新途径。
1.1 材料
进口冷冻箭齿鲽原料由大连融达海产公司提供;金龙鱼大豆油由嘉里粮油 (营口)有限公司生产;牛血清蛋白为北京索莱宝科技有限公司产品。所有化学试剂均为分析纯。
Sartorius普及型pH计 (PB-10)为赛多利斯科学仪器 (北京)有限公司产品;GL-21M高速冷冻离心机为湖南湘仪实验仪器开发有限公司产品;721型分光光度计为上海光谱仪器有限公司产品;BYY-6B型稳压稳流电泳仪为北京市六一仪器厂产品;色彩色差仪CR-410为柯尼卡美能达投资有限公司产品;TMS-Pro质构分析仪为美国Food Technology Corporation公司产品。
1.2 方法
1.2.1 分离蛋白的制备 取出冷冻保存的箭齿鲽鱼片,于室温下解冻,至半解冻时切碎,称取200 g碎鱼肉与去离子水按质量比为1∶10混合后均质2 min得到肌肉匀浆,整个处理过程中温度控制在4℃以下。将肌肉匀浆分成两份,一份用2 mol/L HCl调节pH值为1.5,另一份用2 mol/L的NaOH调节pH值为12.0,然后在4℃下以9 000 r/min离心20 min,并采用4层纱布过滤上清液,以去除上层脂肪层,即得到酸溶解蛋白和碱溶解蛋白。最后用2 mol/L NaOH或2 mol/L HCl调节上述溶解蛋白的pH值到等电点 (pH 5.5),并在4℃下以9 000 r/min离心20 min,分别得到酸分离蛋白(Acid protein isolate,AcPI)和碱分离蛋白 (Alkali protein isolate,AlPI)。
采用传统冷冻鱼糜技术,制备漂洗鱼糜,作为对照。取冷冻保存的箭齿鲽鱼片,于室温下解冻,至半解冻时切碎,称取碎鱼肉100 g,与去离子水按质量比为1∶4混合,搅拌3 min后放置15 min,然后使用4层纱布过滤,重复上述步骤两次,第3次用2 g/L的氯化钠溶液清洗脱水,整个处理过程中温度控制在4℃以下,即得到漂洗鱼糜。
1.2.2 分析测试 1)蛋白质的电泳分析。用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),定性分析箭齿鲽肌肉分离蛋白的蛋白质组成。分析样品包括箭齿鲽肌肉蛋白、酸分离蛋白和碱分离蛋白。样品与4×SDS缓冲液按体积比为3∶1混合后加入占总体积5%的β-巯基乙醇,在95℃下水浴10 min,用12%的分离胶、5%的浓缩胶配制胶板,用考马斯亮蓝R250染色,脱色。
2)蛋白质功能特性的检测。箭齿鲽分离蛋白的功能特性主要包括溶解性、持水性、持油性、乳化性、起泡性和凝胶性。
①蛋白质的溶解性。准确称取10 mg蛋白质样品于10 mL离心管中,加入5 mL离子强度分别为0、0.2、0.4、0.6、0.8、1.0 mol/L的氯化钠溶液,使样品的蛋白质浓度为2 mg/mL。将溶液在常温下使用振荡器缓慢振荡1 h,然后以3 000 r/min离心15 min。使用双缩脲法测定上清液中蛋白质的浓度[9-10]。
②蛋白质的持水性。根据Liu等[11]的方法进行测定,称取一定量的样品 (记为w,g)放入10 mL离心管 (离心管质量记为w1,g)中,分多次加入一定体积的蒸馏水,在室温下振荡均匀后放置20 min,使其充分吸收,以3 000 r/min离心15 min,去除分离水,再次称量离心管质量 (w2, g),根据下式计算持水性:
③蛋白质的持油性[11]。称取一定量的样品(记为w,g),置于10 mL离心管 (离心管质量记为w1,g)中,加入5 mL大豆油,混匀1 min后,在室温下静置30 min,以3 000 r/min离心15 min,弃去上清液,再次称量离心管质量 (w2,g),根据下式计算吸油能力:
④蛋白质的乳化性和乳化稳定性[12]。采用浊度法进行测定,配制0.01 g/mL的蛋白液,取5 mL大豆油与15 mL蛋白液于均质机中均质2 min,分别于0、10min时从底部取50μL,用0.1%SDS溶液稀释100倍后测定500 nm下的吸光值A0,根据下式计算乳化性 (EA):其中:EA为每克蛋白质所形成的乳化微粒的表面积 (m2/g);dil为稀释倍数;A0为均质后的乳化液在500 nm处的吸光值;φ为油相所占的比例,本试验中油相占1/4;C为0.01 g/mL,即蛋白质浓度。
乳化稳定性 (ES)的计算公式如下:式中:t为时间 (本试验中为10 min);A10为乳化液在静止10 min后的吸光值。
⑤蛋白质的起泡性和起泡稳定性[13]。取5 g蛋白质溶于50 mL蒸馏水 (蒸馏水在容器中的高度记为H)中,使蛋白终浓度为0.1 g/mL,于均质机中均质2 min,迅速将泡沫和液体转移至250 mL量筒中,记下0 min和30 min时的初始泡沫高度H0和终止高度H30,按下式计算起泡性和起泡稳定性:
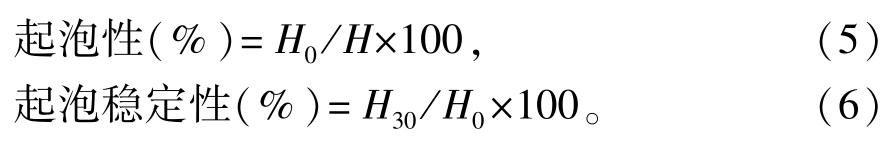
⑥蛋白的凝胶特性。分别称取120~130 g酸分离蛋白、碱分离蛋白和漂洗鱼糜,添加2.4~2.6 g的NaCl混合均匀,将糊状物填充到直径为43~45 mm的塑料肠衣中,置于90℃水浴中加热30 min,然后用流水冷却15 min,得到的凝胶置于冰箱 (4℃)中过夜。测定前,将样品置于室温下2 h,用质构仪 (直径为6 mm的平底柱形探头P/ 6)测定所得样品的凝胶强度,每组平行测定3个样品,样品高度约为12 mm。
3)一般化学组成的分析。原料鱼肉、漂洗鱼糜、酸分离蛋白和碱分离蛋白的一般化学成分采用GB/T5009.3~6-2003进行测定,即采用直接干燥法测定水分含量;采用灼烧称重法测定灰分含量;采用凯氏定氮法测定粗蛋白质含量;采用索氏抽提法测定粗脂肪含量。
4)色度分析[14]。使用CR-410色彩色差仪测定肌肉蛋白及凝胶的色度,每个样品测量3次,得出L*、a*和b*值,其中L*值表示产品的亮度,即从黑 (0)到白 (100)的颜色,a*值表示红度(+)或绿度 (-),b*值表示黄度 (+)或蓝度(-),并根据下式计算白度:
1.3 数据处理
试验数据均用平均值±标准差表示,用 SPSS 17.0软件进行单因素方差分析 (ANOVA),采用Student-Newman-Keuls法进行组间多重比较,显著性水平设为0.05。
2.1 分离蛋白的SDS-PAGE分析
利用SDS-PAGE对酸法和碱法得到的两种箭齿鲽肌肉分离蛋白进行分析比较,以箭齿鲽原料肌肉蛋白 (泳道1)作为对照 (图1)。由图1可见:酸法分离过程中 (泳道2),肌球蛋白重链 (相对分子量200 000附近)和肌动蛋白 (相对分子量42 000附近)均发生了明显的降解现象,并出现了相对分子量分别为110 000~140 000和34 000~36 000两条新条带;而碱法分离过程中 (泳道3),肌原纤维蛋白分子保持完整,其原因可能与箭齿鲽内源蛋白酶的性质有关。已有研究证实,箭齿鲽肌肉中存在的半胱氨酸蛋白酶最适 pH为5.5左右[3],在偏酸环境中易被激活。因此,在酸法提取过程中,由于内源蛋白酶活性较高,导致肌原纤维蛋白被降解。由此可以推断,碱法可以减少分离过程中蛋白质的自溶降解。
Marmon等[15]研究发现,从鲱Clupea harengus肌肉中提取的酸分离蛋白也发生了明显的肌原纤维蛋白降解现象,并出现了相对分子量分别为130 000~150 000和35 000~37 000的两条新条带。Kristinsson[16]也发现,大西洋鳕Gadusmorhua的肌原纤维蛋白在提取过程中发生了明显降解,同样也有这两条带出现,这与本研究结论一致。
2.2 分离蛋白的功能特性
2.2.1 溶解性 溶解性是所有功能特性的基础。溶解性的变化反映了蛋白质分子结构的变化,一般而言,蛋白质变性会造成溶解度降低。所以,溶解度也是衡量蛋白质变性程度的重要指标[17]。
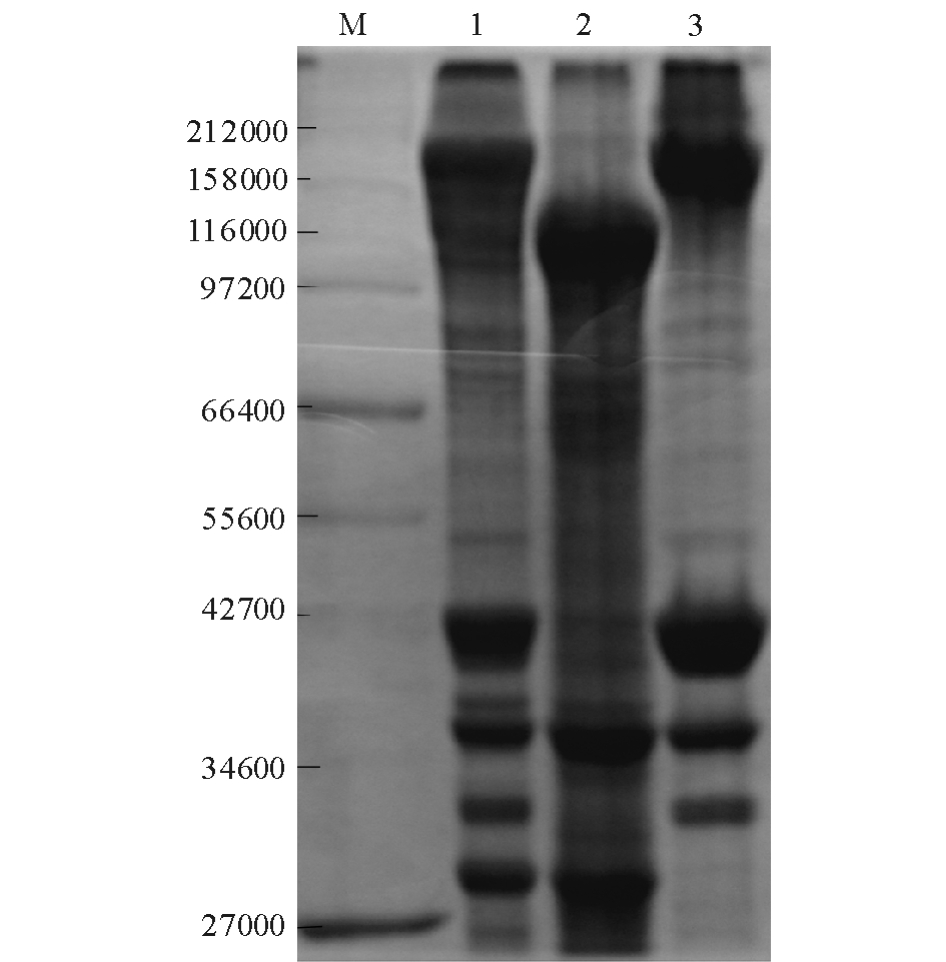
图1 箭齿鲽肌肉分离蛋白的SDS-PAGE分析
Fig.1 SDS-PAGE analysis of the protein isolates extracted from arrow tooth flounder muscle
注:M为高分子量标准蛋白;1为箭齿鲽肌肉蛋白;2为酸分离蛋白;3为碱分离蛋白。
Note:M,standard protein with high molecular weight;1,arrowtooth floundermuscle protein;2,acid-aided protein isolate;3 alkali-aided protein isolate.
从图2可见:随着NaCl溶液中离子强度的升高,4种样品均表现出溶解性增强的趋势,这是因为鱼肉蛋白质的主要成分是盐溶性的肌原纤维蛋白;其中经漂洗、酸和碱等分离处理后,与原料鱼肉相比其肌肉蛋白的溶解性均下降,这是因为在漂洗、酸和碱分离回收过程中,水溶性蛋白发生了不同程度的流失。漂洗鱼糜的溶解性明显低于碱分离蛋白,而高于酸分离蛋白,这可能是由于酸处理过程使蛋白质变性的程度更明显所致。

图2 不同离子强度对分离蛋白溶解性的影响
Fig.2 Effects of different ionic strength on the solubility of protein isolates
2.2.2 持水性和持油性 从图3可见:漂洗鱼糜的持水性最高,且显著高于其他样品的持水性(P<0.05),其次是原料碎肉,而分离蛋白的持水性均不高,且酸分离蛋白和碱分离蛋白的差异不大(P>0.05),这并不排除是由酸碱处理过程中使蛋白质变性所致;持油性是蛋白质与油结合吸附油的能力,本研究中漂洗鱼糜的持油性显著高于其他样品的持油性 (P<0.05),原料碎肉和碱分离蛋白的持油性次之,酸分离蛋白的持油性最差,这可能是由于酸处理过程使蛋白质变性,削弱了蛋白质与油的相互作用,使其持油性降低。
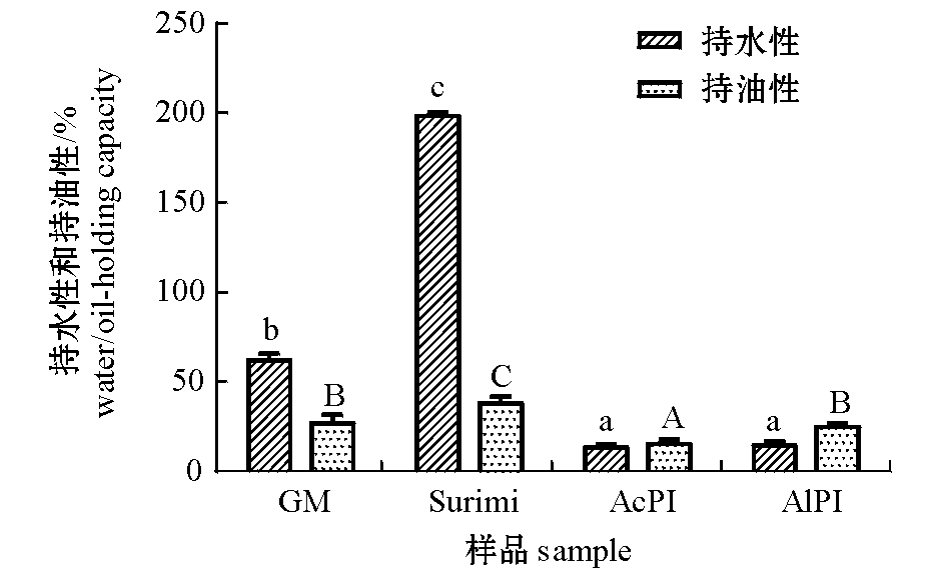
图3 分离蛋白的持水性和持油性分析
Fig.3 The water/oil-holding capacity of the protein isolates obtained by different extraction methods
注:不同小写字母表示组间蛋白质持水性存在显著性差异(P<0.05);不同大写字母表示组间蛋白质持油性存在显著性差异 (P<0.05)。
Note:Different letters on the top of data bars indicate significant difference in water-holding capacity(P<0.05);different capital letters on the top of data bars indicate significant difference in oilholing capacity(P<0.05).
2.2.3 乳化性和乳化稳定性 从图4可见:碱分离蛋白的乳化性最高,且显著高于其他样品的乳化性 (P<0.05),其次是酸分离蛋白,而原料碎肉和漂洗鱼糜的乳化性差异不大 (P>0.05),它们的乳化性都小于分离蛋白。由此可以看出,蛋白质的溶解性与其乳化性无明显相关性。从图4还可以看出,4种样品肌肉蛋白的乳化稳定性都很好,其中原料碎肉和漂洗鱼糜的乳化稳定性显著高于分离蛋白 (P<0.05)。
影响蛋白质乳化性的因素有很多,如蛋白质的变性程度、蛋白质种类、pH值、离子强度、温度、糖的存在等[18]。而影响箭齿鲽分离蛋白乳化性的具体因素还需要进一步研究探讨。
2.2.4 起泡性和起泡稳定性 从图5可见,漂洗鱼糜和酸分离蛋白的起泡性最好,其次是原料鱼肉,碱分离蛋白的起泡性最差,且显著低于其他样品肌肉蛋白(P<0.05)。这可能是由于箭齿鲽肌肉中存在组织蛋白酶L,其活性在pH 5.5时最强,酸处理过程中会激活蛋白酶活性使蛋白质降解[2],从而影响酸分离蛋白的起泡性。4个样品肌肉蛋白的起泡稳定性,同样也是酸分离蛋白的起泡稳定性高于碱分离蛋白,且存在显著性差异 (P<0.05)。
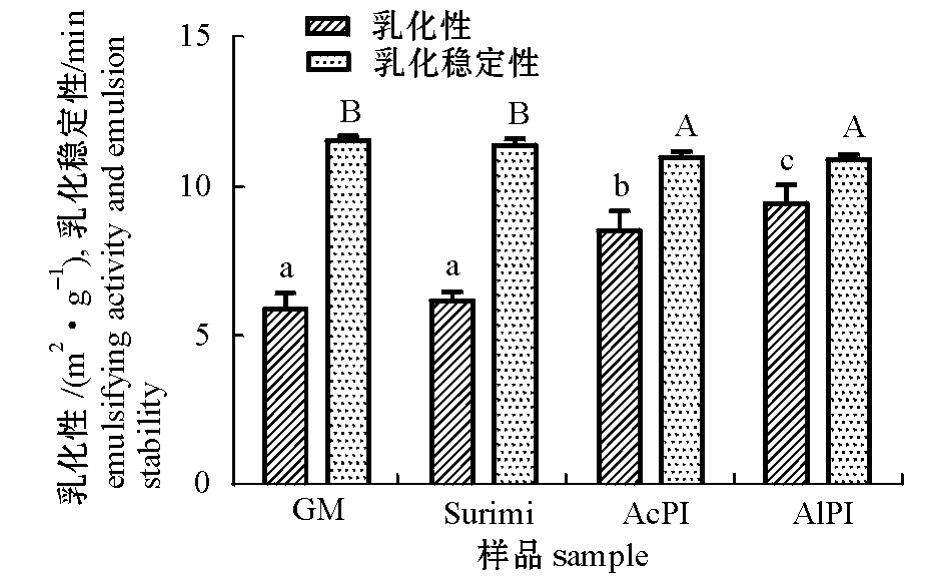
图4 分离蛋白的乳化性和乳化稳定性分析
Fig.4 The emulsifying activity and emulsion stability of the protein isolates extracted by different methods
注:不同小写字母表示组间蛋白质乳化性存在显著性差异(P<0.05);不同大写字母表示组间蛋白质乳化稳定性存在显著性差异 (P<0.05)。
Note:Different letters on the top of data bars indicate significant difference in emulsifying activity(P<0.05);different capital letters on the top of data bars indicate significant difference in emulsion stability(P<0.05).
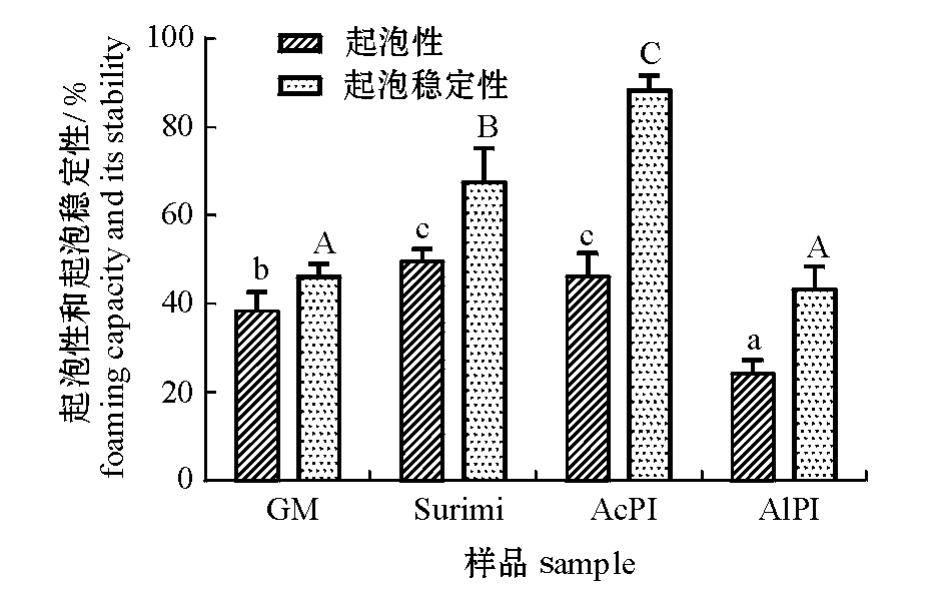
图5 分离蛋白的起泡性和起泡稳定性分析
Fig.5 The foam ing capacity and foam ing stability of the protein isolates extracted by different methods
注:不同小写字母表示组间蛋白质起泡性存在显著性差异(P<0.05);不同大写字母表示组间蛋白质起泡稳定性具有显著性差异 (P<0.05)。
Note:Different letters on the top of data bars indicate significant difference in foaming capacity(P<0.05);different capital letters on the top of data bars indicate significant difference in foaming stability (P<0.05).
2.2.5 凝胶性 凝胶强度是食品蛋白质配料的一个很重要的功能特性。从表1可见:碱分离蛋白凝胶的强度最高,且显著高于漂洗鱼糜凝胶和酸分离蛋白凝胶 (P<0.05);而酸分离蛋白的凝胶强度最差。这是由于箭齿鲽肌肉中存在组织蛋白酶L,而组织蛋白酶L的最适pH为5.5~6.0,所以,不排除在酸性处理过程中激活了蛋白酶活性,使蛋白质发生自溶降解而变性[2]。其他关于分离蛋白凝胶特性的研究还有很多,根据Marmon等[15]的分析结果可知,酸分离蛋白和碱分离蛋白凝胶的强度差异不大。根据Pérez-Mateos等[19]的分析结果,碱分离蛋白凝胶强度最好,其次是漂洗鱼糜凝胶,酸分离蛋白最差。以箭齿鲽作为原料,关于其酸碱分离蛋白凝胶的凝胶强度差异较大的研究,还没有相关报道。这也验证了箭齿鲽被利用的局限性。由表1还可知,酸分离蛋白凝胶的白度较高,这可能是由于其凝胶中水分含量较高所致。
表1 漂洗鱼糜和分离蛋白凝胶产品的特性分析
Tab.1 Characteristics of gels produced from surim i and protein isolates

注:同列中标有不同小写字母者表示组间有显著性差异 (P<0.05),下同。
Note:Themeanswith different letterswithin the same column are significant differences at the 0.05 probability level,et sequentia.
凝胶gel凝胶强度/ (N·cm-2) gel strength凝胶白度gel whiteness凝胶水分/% gelmoisture漂洗鱼糜Surimi 2.45±0.39b68.88±1.59a78.69±0.19b酸分离蛋白 AcPI 0.69±0.20a74.19±0.91c80.26±0.06c碱分离蛋白AlPI 7.55±0.59c71.33±1.28b73.88±0.25a
2.3 分离蛋白的一般化学组成和色度分析
2.3.1 一般化学组成 从表2可见:碱分离蛋白的粗脂肪含量为1.23%,酸分离蛋白的粗脂肪含量为1.96%,漂洗鱼糜的粗脂肪含量最高3.30%,与原料鱼肉的粗脂肪含量 (13.00%)相比,脱脂效果最好的是碱处理过程,其次是酸处理过程,最差的是传统漂洗过程,且它们之间都存在显著性差异 (P<0.05)。综合考虑,酸碱处理过程提取到的分离蛋白在一般化学组成上要优于漂洗鱼糜。
2.3.2 色度 作为食用性功能蛋白配料,除了必要的功能性以外,其白度往往也是重要的质量评价指标之一。从表3可见:原料蛋白和漂洗鱼糜的L*值都较低,相应的其白度也较低;而酸分离蛋白和碱分离蛋白表现出较高的L*值,分别为77.71和77.42,a*值反映的是红度 (+)或绿度(-),其中原料鱼肉显示了更多的红色,显然是由天然血红素蛋白所引起的,而漂洗鱼糜、酸分离蛋白和碱分离蛋白的a*值都低于原料鱼肉,且为负值,即显示绿度,这可能是由于漂洗或酸碱处理过程使大部分的天然血红素蛋白被分离出去。酸分离蛋白和碱分离蛋白相比,其b*值更低,且存在显著性差异 (P<0.05),它们与原料鱼肉和漂洗鱼糜相比有相对较低的黄度。根据Kristinsson等[20]的分析,红度值可能与血红素蛋白的共同沉淀有一定的关联,黄度应该与脂质的存在有一定的关联。
表2 箭齿鲽原料鱼肉和分离蛋白的一般化学组成(干基)
Tab.2 Proxim ate com position of ground muscle and p rotein isolates of arrow tooth flounder(dry basis)w/%
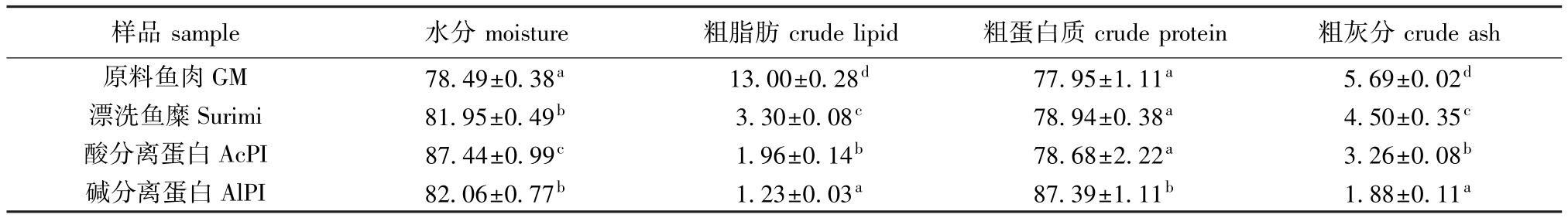
样品sample 水分moisture 粗脂肪crude lipid 粗蛋白质crude protein 粗灰分crude ash原料鱼肉GM 78.49±0.38a13.00±0.28d77.95±1.11a5.69±0.02d漂洗鱼糜Surimi 81.95±0.49b3.30±0.08c78.94±0.38a4.50±0.35c酸分离蛋白AcPI 87.44±0.99c1.96±0.14b78.68±2.22a3.26±0.08b碱分离蛋白AlPI 82.06±0.77b1.23±0.03a87.39±1.11b1.88±0.11a
表3 箭齿鲽原料鱼肉和分离蛋白的色度分析
Tab.3 Color analysis of ground muscle and protein isolates of arrow tooth flounder

样品sampleL*a*b*白度whiteness原料鱼肉GM 65.55±0.51a3.86±0.10b10.97±0.44d63.64±0.41a漂洗鱼糜Surimi 63.98±0.98a-1.74±0.57a10.17±0.23c62.53±1.02a酸分离蛋白AcPI 77.71±1.06b-2.18±0.18a7.19±0.31a76.48±0.95b碱分离蛋白AlPI 77.42±2.83b-1.85±0.15a9.38±0.28b75.45±2.50b
参考文献:
[1] Shaviklo G R,Thorkelsson G,Arason S.The influence of additives and frozen storage on functional properties and flow behaviour of fish protein isolated from haddock(Melanogrammus aeglefinus) [J].Turkish Journal of Fisheries and Aquatic Sciences,2010,10 (3):333-340.
[2] Visessanguan W,Benjakul S,An H.Purification and characterization of cathepsin L in arrowtooth flounder(Atheresthes stomias) muscle[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2003,134(3):477-487.
[3] Greene D H,Babbitt J K.Control of muscle softening and protease-parasite interactions in arrowtooth flounder(Atheresthes stomias)[J].Journal of Food Science,1990,55(2):579-580.
[4] Erickson M C,Gordon D T,Anglemier A F.Proteolytic activity in the sarcoplasmic fluids of parasitized Pacific whiting(Merluccius productus)and unparasitized true cod(Gadus macrocephalus) [J].Journal of Food Science,1983,48(4):1315-1319.
[5] Niki H,Deya E,Igarashi S.Peruvian hake meat having a lack of kamaboko forming property[J].Bulletin of the Japanese Society of Scientific Fisheries,1984,50(11):1917-1924.
[6] Niki H,Kato T,Igarashi S.Properties of Pperuvian hakemeat and preparation of purified surimi[J].Bulletin of the Japanese Society of Scientific Fisheries,1984,50(12):2043-2047.
[7] Kang I,Lanier T C.Inhibition of protease in intact fish fillets by soaking in or injection of recombinantsoy cystatin or bovine plasma [J].Journal of Agricultural and Food Chemistry,2005,53(25): 9795-9799.
[8] Uresti R M,Velazquez G,Vázquez M et al.Effect of sugars and polyols on the functional and mechanical properties of pressuretreated arrowtooth flounder(Atheresthes stomias)proteins[J]. Food Hydrocolloids,2005,19(6):964-973.
[9] 李芳,刘俊荣,梁姗姗,等.南极磷虾蛋白的分离特性及其组分分析[J].大连海洋大学学报,2013,28(2):191-194.
[10] 傅润泽,刘俊荣,王帅,等.采用酸碱提取法对鲢肌肉蛋白分离特性的影响[J].大连海洋大学学报,2011,26(6):539-543.
[11] Liu L H,Hung T V.Functional properties of acetylated chickpea proteins[J].Journal of Food Science,1998,63(2):331-337.
[12] Pearce K N,Kinsella J E.Emulsifying properties of proteins: evaluation ofa turbidimetric technique[J].Journalof Agricultural and Food Chemistry,1978,26(3):716-723.
[13] Miller R,Groninger H S.Functional properties of enzyme-modified acylated fish protein derivatives[J].Journal of Food Science, 1976,41(2):268-272.
[14] 张国琛,张倩,齐妍,等.变功率微波真空间歇干燥扇贝柱的研究[J].大连海洋大学学报,2012,27(4):350-354.
[15] Marmon S K,Undeland I.Protein isolation from gutted herring (Clupea harengus)using pH-shift processes[J].Journalof Agricultural and Food Chemistry,2010,58(19):10480-10486.
[16] Kristinsson H G.Evaluation of differentmethods to isolate cod (Gadusmorhua)musclemyosin[J].Journal of Food Biochemistry,2001,25(3):249-256.
[17] 盛彩虹,刘晔,刘大川,等.紫苏分离蛋白功能性研究[J].食品科学,2011(17):137-140.
[18] 黄友如,华欲飞,裘爱泳.醇洗豆粕对大豆分离蛋白功能性质的影响(Ⅱ)——乳化性能[J].中国油脂,2003(11):35-38.
[19] Pérez-Mateos M,Amato PM,Lanier T C.Gelling properties of Atlantic croaker surimiprocessed by acid or alkaline solubilization [J].Journal of Food Science,2004,69(4):328-333.
[20] Kristinsson H G,Liang Y.Effect of pH-shift processing and surimi processing on Atlantic croaker(Micropogonias undulates) muscle proteins[J].Journal of Food Science,2006,71(5): C304-C312.
Functional properties of protein isolates extracted from muscle of arrow tooth flounder Atheresthes stomias
Abstract:The functional fish protein isolates were extracted by pH-shift process,characterized and compared with surimi extracted by traditional process in arrowtooth flounderAtheresthes stomias.Molecular weight profiles of the fish protein isolates were analyzed with SDS-PAGE.The results showed that the alkali-aided protein isolates were composed of had intactmyofibril protein molecules,but the acid-aided isolate had a protein band possibly representing partial hydrolysis ofmyosin and actin.The analysis of solubility,water-holding capacity,oil-holding capacity,emulsifying activity,foaming capacity and gel properties of the fish protein isolates indicated that there was higher emulsifying properties in the acid protein isolate and alkaline protein isolate than that in the ground muscle and washed surimi.The protein isolates produced from alkali-aided process were found to have better gel-forming ability compared to the acid-aided and the surimi processes.There was no significant improvement in the water/ oil-holding capability and the other properties.The protein isolates were shown to have de-fatted effect,with the minimal lipid content in the alkali-aided protein isolate(1.23%),followed in acid-aided protein isolate (1.96%),and 3.30% in the conventional surimi.The colorimetric analysis revealed that protein isolates produced from pH-shift process had higher whiteness than surimi and ground muscle did.The findings suggest that the functional fish protein isolates extracted from arrowtooth flounder have the potential to be used as protein ingredients for food processing.
Keywords:Atheresthes stomias;fish protein isolate;protein functional property
中图分类号:TS254.9
文献标志码:A
文章编号:2095-1388(2013)05-0492-06
收稿日期:2013-01-21
基金项目:国家自然科学基金资助项目 (31271980)