北方沿海翡翠贻贝人工育苗技术研究
杨鹏1,闫喜武1,张跃环2,刘振1,梁健1,迟吉祥1,杨凤1,张国范3
(1.大连海洋大学水产与生命学院辽宁省贝类良种繁育工程技术研究中心,辽宁大连116023;2.中国科学院南海海洋研究所海洋生物资源可持续利用重点实验室,广东广州510301;3.中国科学院海洋研究所海洋生物技术研发中心,山东青岛266071)
摘要:于2011、2012年,在大连对翡翠贻贝Perna viridis室内人工育苗技术进行了初步研究,成功培育出壳长为4.5~10.0 mm的稚贝6 500万个。比较了不同培育密度 (5、10、15、20、30、50个/mL)和饵料种类 (小球藻、湛江等鞭金藻和小球藻与湛江等鞭金藻的混合饵料)对翡翠贻贝幼虫生长的影响,并分析了在4种附着基 (聚乙烯网片、波纹板、聚乙烯网衣、聚乙烯吊绳)和无附着基条件下的采苗效果。结果表明:随着培养密度的增大,幼虫生长速度下降,存活率减小,变态率降低,变态时间延迟;在室内幼虫培育期间,用小球藻与等鞭金藻的混合饵料比单一饵料的投喂效果理想,单一饵料投喂中等鞭金藻效果较好;在幼虫变态过程中,聚乙烯网片的采苗效果最理想,其次为波纹板,无附着基的采苗效果最差。
关键词:翡翠贻贝;人工育苗;培育密度;饵料种类;附着基
翡翠贻贝Perna viridis俗称青匙、菜恋,属暖水性海洋贝类,分布于中国的南海、东海南部和台湾海峡沿岸,以及印度洋东西岸、菲律宾、马来西亚和西北太平洋沿岸[1],具有雌雄异体、生长快、繁殖周期短等特点。翡翠贻贝蛋白质含量高达59%,含有8种人体必需氨基酸,其脂肪含量为7%,大多为不饱和脂肪酸,还含有丰富的钙、磷、铁、锌、维生素B、烟酸等。因此,翡翠贻贝的营养价值较高,其经济价值也远高于紫贻贝、厚壳贻贝等,在东南亚、印度和中国南方地区占有较高的市场份额[2]。
目前,全世界翡翠贻贝产量约25万t,中国约20万t,占世界产量的80%[3]。20世纪70年代以前,大部分翡翠贻贝资源来自野生采捕,但随着全球气候的变化,海区采苗不稳定性因素大幅度增加,采苗区面积逐渐萎缩,贻贝的苗种供应问题已成为制约产业发展的瓶颈[4]。自20世纪60年代以来,中国学者和印度学者先后开展了翡翠贻贝人工育苗研究[5-12],研究地点均在中国南方或印度,而在中国北方能否成功培育出翡翠贻贝苗种尚未见报道。为此,本课题组在大连市庄河地区进行了翡翠贻贝人工育苗试验,旨在解决苗种供应及资源恢复问题,为实现南贝北繁、北苗南养的生产模式提供理论依据。
1 材料与方法
1.1 材料
2011年5月底在深圳市鹅公湾采集到第一批亲贝,2012年6月下旬在湛江市乾塘镇三窝湾采集到第二批亲贝,两次共采集亲贝80 kg,亲贝壳长为9~12 cm。
1.2 方法
1.2.1 亲贝促熟 将采集到的亲贝随即空运至大连,用扇贝笼吊养于庄河市海洋村贝类育苗场生态虾池中,进行促熟。促熟期间,水温为 23.2~30.6℃,盐度为25~30,pH为7.86~8.72。
1.2.2 催产和孵化 用肉眼与显微镜观察亲贝性腺发育情况,2011年采集的亲贝性腺发育为Ⅱ期,经过在虾池中30余天的促熟,性腺发育饱满;而2012年采集的亲贝性腺发育很好,经过一周左右的促熟即产卵。待性腺充分发育成熟后,挑选壳形规整、无损伤的个体进行催产。将亲贝洗刷干净,阴干12 h,于次日早晨放入100 L白色聚乙烯桶中,充气,缓慢注入升温海水使水温达到29~30℃,不久,亲贝开始自然排放精卵。也可在阴干12 h后将亲贝在2~4℃下冷藏30 min后,再放入100 L白色聚乙烯桶中,不久亲贝亦可排放精卵。待亲贝排放精卵完毕,用150目筛绢网过滤掉亲贝排放的脏物,再将受精卵分桶孵化,密度为50~100粒/mL。孵化期间,微充气,观察受精卵在各个发育阶段的形态变化和所需时间。
1.2.3 幼虫和稚贝的培育 D形幼虫用300目筛绢网选优之后,一部分幼虫培育在100 L白色聚乙烯桶中进行试验,每天全量换水1次。前9 d投喂湛江等鞭金藻,之后投喂等鞭金藻与小球藻的混合饵料 (两者的体积比为1∶1,下同),饵料投喂量根据幼虫和稚贝的摄食情况适量增减。另一部分幼虫选优后,培育在水槽(2.4m×1.8 m×1.5m)中进行规模生产,培养密度为6~8个/mL,每天用对流法换水,换水量为30%~60%,至足面盘幼虫为止。变态期间,减少换水量和换水次数,投喂等鞭金藻与小球藻的混合饵料(4~12)×103个/mL。待完全变态后,逐步恢复饵料投喂量。当附着稚贝生长到壳长为1.5 mm左右时,移入海区进行中间培育。幼虫和稚贝培育期间,水温为24.8~29.6℃,盐度为24~30,pH为7.60~8.52。
1.2.4 不同培养密度对幼虫生长的影响试验 设置5、10、15、20、30、50个/mL 6个幼虫培育密度,每个培育密度设3个重复,在100 L白色聚乙烯桶中培育选优的D形幼虫。前9 d投喂湛江等鞭金藻,之后投喂等鞭金藻与小球藻的混合饵料。
1.2.5 不同饵料种类对幼虫生长的影响试验 设置3种饵料组合:湛江等鞭金藻组、小球藻组和等鞭金藻与小球藻混合组 (体积比为1∶1),每种饵料组合设3个重复,在100 L白色聚乙烯桶中培育选优的D形幼虫,培育密度为6~8个/mL。
1.2.6 不同附着基的采苗效果 设置4种附着基类型,分别为聚乙烯网片、聚乙烯网衣、波纹板、聚乙烯绳,同时设置无附着基作为对照。试验在100 L白色聚乙烯桶中进行,每组试验设3个重复,附着基均悬挂于桶中。试验幼虫来自于规模生产水槽中,当1/3幼虫出足后,优选幼虫并放入有不同附着基的试验桶中,培养密度为2个/mL,每桶放足面盘幼虫约20万个,进行附着基采苗试验。
1.2.7 指标的测定 孵化率为D形幼虫数与受精卵数的百分比;幼虫存活率为每次测量时存活个体数与D形幼虫数的比值;变态率为稚贝 (以出鳃原基、次生壳为标志)数与足面盘幼虫数的比值;稚贝存活率为每次测量时存活个体数与刚变态稚贝数的比值;浮游时间为从D形幼虫至足面盘幼虫全部附着的时间;变态时间为从D形幼虫至全部完成变态,转变为稚贝的时间[13-14]。幼虫和稚贝的壳长、壳高在40×目微尺下测量,后期稚贝用电子卡尺测量,测量时每次随机抽取30个个体。在附着基试验中,聚乙烯网片等附着基上的稚贝总数以单位面积附着基上的稚贝数进行计算;无附着基桶中稚贝总数通过单位面积稚贝数计算;出苗量为每立方水体中的平均稚贝数量。
1.3 数据处理
用SPSS 16.0统计软件对数据进行分析处理,利用单因素方差分析法 (ANOVA)进行差异显著性分析,采用LSD法进行组间比较,显著性水平设为0.05。
2 结果
2.1 胚胎和胚后发育
翡翠贻贝雌性卵为沉性卵,刚产出时为正规圆形卵,有个别为椭圆形,但是经过海水浸泡5~10 min后很快变圆;精子刚产出时活力很好,显微镜下不停跳跃。2011年,幼虫孵化和培育的水温为25.8~28.6℃,盐度为27~30,pH为 7.78~8.54。在此条件下,翡翠贻贝在19 h即到达D形幼虫,经过7 d到达壳顶中期幼虫,18 d到达足面盘幼虫,25 d完成变态,转变为稚贝。2012年,幼虫孵化和培育的水温为26.4~29.2℃,盐度为28~30,pH为7.62~8.80。在此条件下,翡翠贻贝在16 h即到达D形幼虫,经过6 d到达壳顶中期幼虫,16 d到达足面盘幼虫,21 d完成变态,转变为稚贝 (表1)。
2.2 孵化和存活
从表 2可见:翡翠贻贝的卵径为 50.46~52.67μm,其受精率均在90%以上;2012年的孵化率显著高于2011年 (P<0.05),均在80%以上;2012年幼虫存活率为59.43%,高于2011年的51.46%,但无显著性差异 (P>0.05);2012年的变态率为77.32%,显著高于2011年的65.79% (P<0.05)。一旦完成变态,两年间稚贝的存活率均在90%以上,且彼此间不存在显著性差异 (P>0.05)。
表1 翡翠贻贝的胚胎和胚后发育
Tab.1 The embryonic and post-embryonic development of green mussel Perna viridis

胚胎发育阶段development phase发育时间developmental duration 2011年 2012年受精卵fertilized eggs 5 min 5 min第一极体first pole body 17 min 15 min第二极体second pole body 22 min 20 min 2细胞2 cell stage 29 min 28 min 4细胞4 cell stage 40 min 37 min 8细胞6 cell stage 46 min 45 min 16细胞16 cell stage 52 min 50 min 32细胞32 cell stage 1 h 3 min 58 min桑椹期morula 1 h 15 min 1 h 5 min囊胚期blastula 2 h 55 min 2 h 32 min担轮幼虫trochophore 8 h 7 h 15 min D形态幼虫D-larva 19 h 16 h 10 min壳顶幼虫umbo larva 7 d 6 d足面盘幼虫foot veliger larva 18 d 16 d稚贝juvenile 25 d 21 d
表2 翡翠贻贝的孵化、变态和存活 (n=9)
Tab.2 Hatching rate,metamorphosis and survival rate of green mussel Perna viridis

注:同列中标有不同小写字母者表示组间有显著性差异 (P<0.05),标有相同小写字母者表示组间无显著性差异 (P>0.05),下同。
Note:Themeanswith different letterswithin the same column are significant differencesat the0.05 probability level,and themeanswith the same letters within the same column are not significant differences,et sequentia.
年份year卵径/μm diameter of an egg受精率/% fertilization孵化率/% hatching rate幼虫存活率/% larval survival变态率/% metamorphosis稚贝存活率/% spat survival 2011 50.46±3.62a90.08±4.12a84.00±5.08b51.46±4.47a65.79±6.99b94.58±2.39a2012 52.67±4.16a96.43±3.28a92.77±5.10a59.43±3.89a77.32±9.15a96.33±2.51a
2.3 幼虫和稚贝的生长
从表3可见:翡翠贻贝的 D形幼虫壳高为83.00~85.55μm,且两年试验中的个体间不存在显著性差异 (P>0.05);在整个浮游期,2011年幼虫的浮游时间比2012年长,幼虫生长相对缓慢,在15日龄时,两年间的生长存在显著性差异 (P<0.05);两年间幼虫的变态规格比较一致 (P>0.05),壳高为340~350μm;30~90日龄期间,稚贝生长较快,且2012年稚贝比2011年稚贝生长得快,彼此间存在显著性差异 (P<0.05),这可能与两年间温度差异有关。
2.4 培育密度对幼虫生长的影响
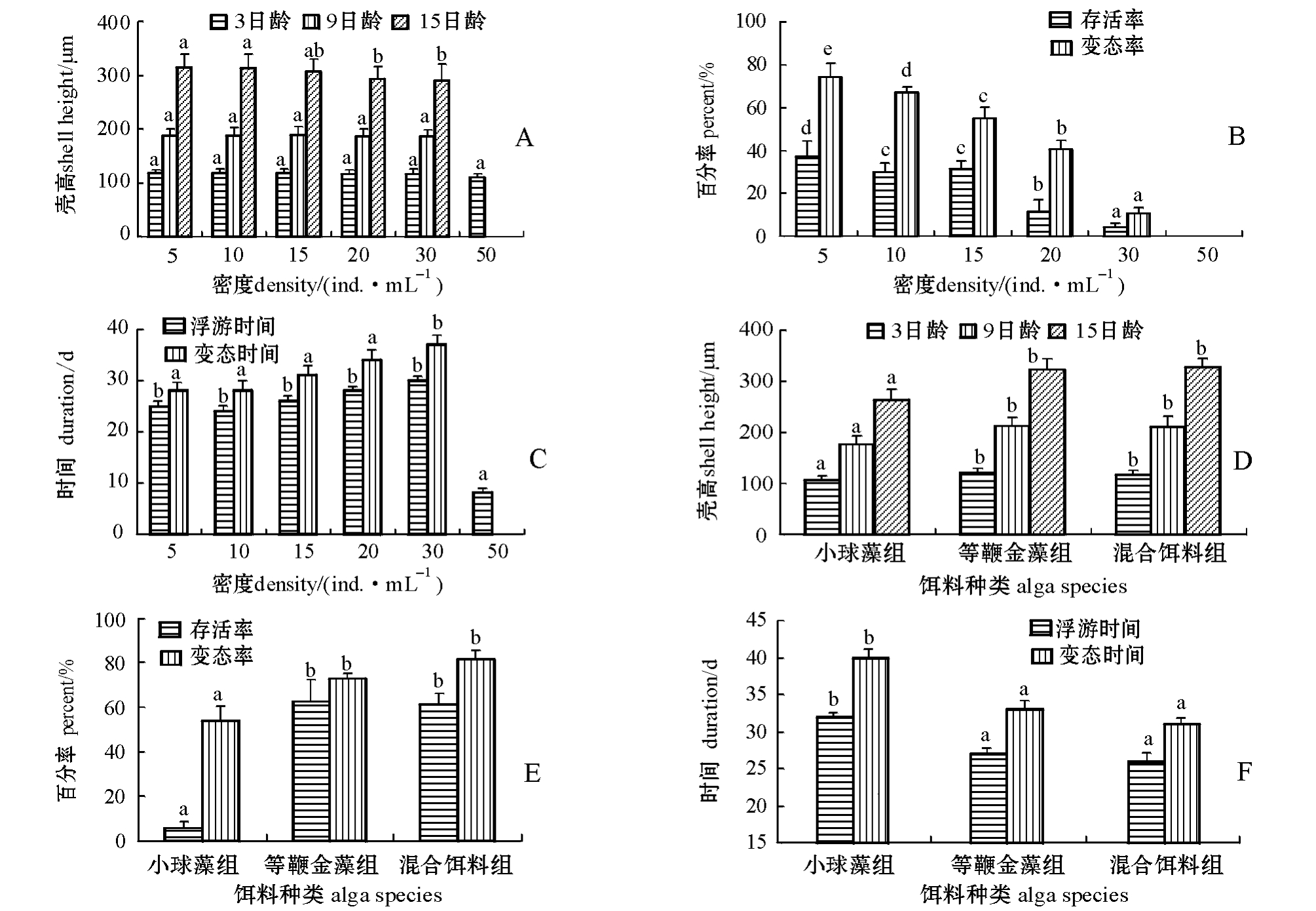
幼虫浮游期间,50个/mL密度组幼虫在7~8日内全部死亡;而15日龄时,5、10个/mL密度组幼虫的生长最快,显著快于20、30个/mL密度组 (P<0.05);3、9日龄时,各密度组间均无显著性差异 (P>0.05)(图1-A)。密度对幼虫存活率的影响较大,5~15个/mL密度组的存活率显著高于 20、30个/mL密度组 (P<0.05),除 50个/mL密度组外,密度对浮游时间无显著影响(P>0.05);密度对变态率有显著影响 (P<0.05),随密度的增加变态率呈线性下降,变态时间逐渐延长 (图1-B、C)。其中,30个/mL密度组幼虫几乎全部死亡,仅有少数幼虫发育至匍匐幼虫,完成变态。可见,本试验条件下,浮游期间幼虫的培养密度为5~15个/mL时较为适宜。
表3 幼虫和稚贝的生长 (n=9)
Tab.3 Grow th of larvae and spat in green mussel Perna viridis

年份year D形幼虫壳高/μm shell height of D larvae 15日龄时壳高/μm shell height at15 day old变态规格/μm metamorphic size 30日龄时壳长/mm shell length at30 day old 90日龄时壳长/mm shell length at90 day old 2011 83.00±4.35a274.67±18.46b350.25±27.14a1.21±0.29b7.08±1.03b2012 85.55±4.60a322.33±23.99a344.33±19.98a2.07±0.32a9.29±1.07a
2.5 饵料种类对幼虫生长的影响
幼虫阶段,同一日龄下,等鞭金藻和小球藻混合投喂组幼虫的生长速度最快,其次为等鞭金藻组,且两组间无显著性差异 (P>0.05),均显著快于小球藻投喂组 (P<0.05)(图1-D);等鞭金藻组幼虫的存活率最高,混合饵料组幼虫的变态率最高,两组间的存活率和变态率均无显著性差异(P>0.05),均显著高于小球藻组 (P<0.05) (图1-E);混合饵料组与等鞭金藻组幼虫的存活和变态时间相对较快,且两组间无显著性差异 (P>0.05),均显著快于小球藻组 (P<0.05) (图1-F)。可见,本试验条件下,混合饵料组幼虫的各项生长指标相对较好,等鞭金藻组次之,小球藻组相对较差。
2.6 附着基采苗效果的比较
当幼虫出现了鳃原基,足不停地向外伸展,初生壳缘颜色变深时,表明幼虫即由将原来的浮游生活逐渐转为附着生活,此时幼虫壳高为340~350 μm,当比例达到30% ~50%时,投放附着基采苗。从表4可见:附着基对幼虫的变态时间、变态率、附苗量,以及稚贝的大小和存活率影响较大。
其中,以聚乙烯网片为附着基的采苗效果最好,其次为波纹板,无附着基的采苗效果最差 (表4)。
表4 不同附着基采苗效果比较 (n=9)
Tab.4 The attachment com parison of different settlement substrates

附着基settlement substrate变态时间/d metamorphic time变态率/% metamorphosis附苗量/(个·cm-2) settlement rate稚贝存活率/% survival rate稚贝壳长/μm shell length聚乙烯网片 25 86.50±7.37a7.8 93.66±3.84a1777.42±333.38a波纹板 30 82.67±6.11a5.6 92.53±5.19a1758.07±391.28a聚乙烯网衣 34 70.13±6.25b2.3 90.11±2.83a1622.58±295.55b聚乙烯绳 33 70.33±4.51b5.7 89.33±5.51a1613.81±305.40b无附着基 36 55.67±8.02c1.0 81.22±5.93b1537.09±241.33c
2.7 产量
按照本研究中最优组合的试验结果,进行了翡翠贻贝健康苗种规模生产。2011年,利用8个试验水槽,共生产壳长为4.5~9.5 mm的稚贝3 000万个,平均单位水体出苗量为60万个/m3;2012年,利用6个试验水槽,共生产壳长为5.0~10.0 mm的苗种3 500万个,单位水体出苗量为90万个/m3。两年间,共生产健康苗种6 500万个,单位水体出苗量高达90万个/m3。
3 讨论
3.1 翡翠贻贝人工育苗背景
20世纪70年代以前,翡翠贻贝产量主要来自于野生贝,2000年以后其产量主要来自于养殖贝[3]。由于翡翠贻贝生长快、繁殖能力强,以往靠天然苗种可以保证养殖的需求。但是,随着全球气候变暖、海洋酸化、工业化加剧、海洋面积不断萎缩等影响,导致采苗区域不断减小,天然苗种很难再满足养殖产业的需要[4,12]。为了提供稳定的苗种来源,恢复资源,必须开展人工育苗。翡翠贻贝人工育苗技术主要由中国和印度学者完成,始于20世纪60年代,最早由中国学者在1965年进行了试验性苗种生产,成功获得一些稚贝;之后在70年代,印度学者也成功培育出稚贝[5,9]。
2005年欧盟启动了蓝色种子工程,主要研发紫贻贝Mytilus edulis与地中海贻贝Mytilus galloprovincialis的人工育苗技术,并制定相关生产标准; 2011年印度学者掌握了翡翠贻贝苗种大规模培育技术[12];中国学者在南方开展了翡翠贻贝的健康苗种培育及养成研究[5-8]。但是,这些研究均集中在暖温带或者亚热带,在中国北温带能否大规模培育出翡翠贻贝健康苗种,是一个新的课题。本课题组研究发现,在北温带可以培育出翡翠贻贝健康苗种,只是无法实现在北方越冬,这为翡翠贻贝苗种生产提供了一个新选择,即采用南贝北繁、北苗南养的生产模式。
3.2 翡翠贻贝人工育苗技术
亲贝性腺发育的质量,直接影响贝类苗种的生长与产量。决定贝类性腺发育质量的因素除自身先天条件以外,还包括饵料、亲贝培育密度和水环境等诸多因素。因此,亲贝培育是贝类育苗最基础和最重要的环节[15]。本研究中采用生态促熟的方法,这与菲律宾蛤仔[16]、 中国蛤蜊[17]、 四角蛤蜊[18]、薄片镜蛤[19]、宽壳全海笋[20-21]等方法一致,获得较为理想的效果。目前,研究者对水生动物胚胎发育的观察研究较多[22-23],对于海洋贝类,浮游幼虫能否完成变态对该种群的繁衍生息具有里程碑式的意义[24-25]。笔者主要研究了翡翠贻贝人工育苗中适宜的培育密度、饵料种类和附着基种类。合理的培育密度对于贝类苗种生产至关重要[26-27]。本研究中,幼虫的生长速度、存活率和变态率随着培育密度的增大均呈现降低的趋势;幼虫各阶段的发育时间随着密度的增大而延迟,表现出明显的延迟变态[28]。本试验结果表明,幼虫早期密度可在10个/mL左右,后随着幼虫的生长可逐渐调整密度。另外,30~50个/mL密度组的幼虫死亡率极高,且30个/mL密度组的幼虫仅有少量能发育至匍匐幼虫,这与对大部分滩涂贝类的研究结果一致。合适的饵料和充足的数量是幼虫生长发育的重要保证[27]。从其饵料种类上看,本试验中混合投喂效果要优于单独投喂,饵料混合投喂组 (小球藻与等鞭金藻的体积比为1∶1)幼虫的生长较快,其次为等鞭金藻组,两组之间无显著性差异。这可能与混投时幼虫获取的营养更加均衡有关。附着基种类也是影响贝类幼虫变态和稚贝生长的重要因素。本试验结果表明,聚乙烯网片附着基的采苗效果最好,波纹板采苗效果次之,无附着基的采苗效果最差,这可能与翡翠贻贝的附着特性有一定关系[19]。进行稚贝中间育成时,要放养在水流畅通、饵料丰富且海水盐度较稳定的海区。稚贝越冬需要移居室内,对于壳长平均为1.5 cm左右的稚贝,越冬水温要求在10℃以上,否则,就会全部死亡[12]。本试验中发现,可以在北方夏季高温时进行翡翠贻贝的大规模苗种培育,但是,获得的稚贝无法在自然海区完成越冬,这也说明该物种在北方海区天然状态下,不会对近缘种造成生态威胁。
3.3 翡翠贻贝人工育苗潜在价值
由于南方海区受台风、暴雨等自然灾害影响的频率远高于北方,所以北方沿海的人工育苗技术研发是非常有必要的。此外,人工育苗可以获得较高经济效益:在欧洲,人工培育的翡翠贻贝苗种价格为430.17欧元/kg,而半人工采苗的价格为1.35欧元/kg,野生苗种仅为0.31欧元/kg;在印度,野生苗种价格0.16~0.24欧元/kg,半人工苗种和人工苗种尚无定价标准[12];在中国,目前主要还是靠半人工采苗,其苗种价格尚无标准。总之,伴随着翡翠贻贝产业的可持续发展,天然苗种数量不断减小,相信大规模苗种培育技术可以为育苗场带来可观利润,为养殖产业发展提供更大发展空间。
参考文献:
[1] 罗有声.贻贝养殖技术[M].上海:上海科学技术出版社, 1983:1-16.
[2] 庆宁,林岳光,金启增.翡翠贻贝软体部营养成分的研究[J].热带海洋学报,2000,19(1):81-84.
[3] FAO.Perna viridis(Linnaeus,1758)[EB/OL].[2012-10-10]. http://www.fao.org/fishery/species/2691/en.
[4] Firth L B,Knights A M,Bell SS.Air temperature and wintermortality:Implications for the persistence of the invasivemussel,Perna viridisin the intertidal zone of the south-eastern United States [J].Journal of Experimental Marine Biology and Ecology,2011, 400(1/2):250-256.
[5] 广东省海丰县海水养殖站.翡翠贻贝人工育苗的初步报告[J].水产科技情报,1974,2(6):5-9.
[6] 丁勇,游克仁.翡翠贻贝人工育苗技术[J].水产科学,1993,12 (6):23-25.
[7] 吴松.翡翠贻贝人工育苗技术初探[J].齐鲁渔业,2007,24 (11):44-46.
[8] 董扬,王国福.翡翠贻贝室内人工育苗技术研究[J].科学养鱼,2012,27(1):43-44.
[9] Sivalingam PM.Aquaculture of the green mussel,Mytilus viridisLinnaeus,in Malaysia[J].Aquaculture,1977,11(4):297-312.
[10] Rivonker C U,Ansari Z A,Parulekar A H.Cultivation of green mussel,Perna viridisL.,on a floating raft in an estuary along the west coast of India[J].Aquaculture,1993,112(1):47-56.
[11] Rajagopal S,Venugopalan V P,Nair K V K,et al.Reproduction, growth rate and culture potential of the greenmussel,Perna viridisL.in Edaiyur backwaters,east coast of India[J].Aquaculture, 1998,162(3/4):187-202.
[12] Laxmilatha P,Rao G S,Patnaik P,et al.Potential for the hatchery production of spat of the green musselPerna viridisLinnaeus (1758)[J].Aquaculture,2012,312(1/4):88-94.
[13] Yan X,Zhang Y,Huo Z,et al.Effects of starvation on larval growth,survival and metamorphosis of Manila clamRuditapes philippinarum[J].Acta Ecologica Sinica,2009,29(6):327-334.
[14] 杨凤,张跃环,闫喜武,等.饥饿再投喂对青蛤幼虫生长、存活及变态的影响[J].生态学报,2008,32(5):2052-2059.
[15] 常亚青,宋坚,王国栋,等.硬壳蛤的人工育苗技术[J].中国水产科学,2002,9(1):43-47.
[16] 闫喜武.菲律宾蛤仔养殖生物学、养殖技术与品种选育[D].青岛:中国科学院海洋研究所,2005.
[17] 闫喜武,王琦,赵越,等.中国蛤蜊人工育苗技术的初步研究[J].大连水产学院学报,2010,25(1):41-44.
[18] 闫喜武,张跃环,左江鹏,等.北方沿海四角蛤蜊人工育苗技术的初步研究[J].大连水产学院学报,2008,23(5):348-352.
[19] 闫喜武,左江鹏,张跃环,等.薄片镜蛤人工育苗技术的初步研究[J].大连水产学院学报,2008,23(4):268-272.
[20] 闫喜武,张跃环,左江鹏,等.宽壳全海笋人工育苗的初步研究[J].渔业现代化,2007(2):18-21.
[21] 柴雪良,方军,张炯明,等.宽壳全海笋人工繁育技术[J].水产学报,2009,33(2):259-264.
[22] 谢淑瑾,周一兵,杨大佐,等.长蛸繁殖行为与胚胎发育的初步观察[J].大连海洋大学学报,2011,26(2):102-107.
[23] 刘海映,秦玉雪,姜玉声,等.口虾蛄胚胎发育的研究[J].大连海洋大学学报,2011,26(5):437-441.
[24] 柯才焕,李少蔷,李复雪,等.翡翠贻贝幼体附着和变态的离子控制[J].海洋与湖沼,1998,28(2):128-134.
[25] Zheng H P,Ke C H,Zhou SQ,et al.Effects of starvation on larval growth,survival and metamorphosis of ivory shellBabylonia formosae habeiAltena and Gittenberger etal.1981(Neogastropoda:Buccinidae)[J].Aquaculture,2005,243(1/4):357-366.
[26] 赵云龙,赵文,闫喜武,等.渤海辽东湾高家滩沿海滩涂贝类资源调查[J].大连海洋大学学报,2011,26(5):471-474.
[27] Yan X,Zhang G,Yang F.Effectsof diet,stocking density,and environmental factors on growth,survival,andmetamorphosisof Manila clamRuditapesphinarumlarvae[J].Aquaculture,2006,253 (1/4):350-358.
[28] 赵越,王金海,闫喜武,等.培育密度及饵料种类对四角蛤蜊幼虫生长、存活及变态的影响[J].水产科学,2011,30(3): 160-163.
Artificial breeding of green mussel Perna viridis in North China coast
YANG Peng1,YAN Xi-wu1,ZHANG Yue-huan2,LIU Zhen1,LIANG Jian1, CHI Ji-xiang1,YANG Feng1,ZHANG Guo-fan3
(1.Engineering Research Center of Shellfish Culture and Breeding in Liaoning Province,College of Fisheries and Life Science,Dalian Ocean University,Dalian 116023,China;2.Key Laboratory of Marine Bio-Resources Sustainable Utilization,South China Sea Institute of Oceanology,Chinese Academy of Sciences,Guangzhou 510301,China;3.Research and Development Center of Marine Biotechnology,Institute of Oceanology,Chinese Academy of Sciences,Qingdao 266071,China)
Abstract:Artificial breeding of green musselPerna viridiswas carried out in an indoor tank and 65 000 thousands of spatswith shell length of4.5-10.0 mm were produced during both 2011 and 2012,and the impacts of stocking density(5,10,15,20,30,and 50 ind./mL),alga species(Isochrysis zhanjiangensis,Chlorella saccharophila, and both mixture)and settlement substrates(polyethylene twine,rugged plastic plate,and polyethylene cable)on larval growth and attachmentwere studied.Results showed that the larva growth,survival,and metamorphic rate were found to be decreased,and postponed metamorphosis with the increase in breeding density.During the indoor rearing,the larvae fed themixture of both algae(Isochrysis zhanjiangensis∶Chlorella saccharophila=1∶1)showed better growth performance than the larvae fed the single larva did.In the single alga groups,Isochrysis zhanjiangensis had ideal effects.The maximal metamorphic rate was observed in the polyethylene twine settlement substrate, followed by rugged plastic plate,and the minimum in free settlement substrate as a control group during metamorphic period.
Keywords:Perna viridis;artificial breeding;rearing density;alga species;settlement substrate
中图分类号:S968.3
文献标志码:A
文章编号:2095-1388(2013)05-0456-06
收稿日期:2013-03-27
基金项目:国家现代农业产业技术体系建设专项 (CARS-48);国家 “863”计划项目 (2012AA10A400)
作者简介:杨鹏 (1986-),男,硕士研究生。E-mail:495326388@qq.com
通信作者:闫喜武 (1962-),男,博士,教授。E-mail:yanxiwu@dlou.edu.cn