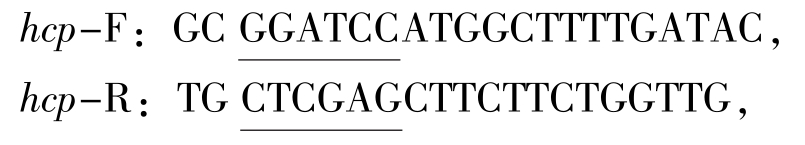
摘要:通过克隆获得鮰爱德华菌Edwardsiella ictaluriLH51溶血素共调节蛋白 (Hcp)编码基因hcp,该基因全长为489 bp,编码163个氨基酸,hcp编码蛋白的理论相对分子质量为17 800,等电点为5.21。氨基酸序列分析结果表明,鮰爱德华菌hcp基因与迟钝爱德华菌Edwardsiella tarda毒力蛋白EvpC(Hcp同源物)、发光杆菌Photorhabdus luminescens hcp基因等具有高度同源性。将鮰爱德华菌Hcp氨基酸序列连接至pGS-21a表达载体中,成功构建了pGS-21 a-hcp原核表达质粒;再将表达质粒转化至BL21(DE3)菌株后,经IPTG诱导、镍柱层析纯化获得大量携带GST和组氨酸双标签的融合蛋白。经SDS-PAGE和Western blot分析,确认获得了相对分子质量约为45 000的融合蛋白,并成功制备了具有较高效价的多克隆抗体。
关键词:鮰爱德华菌;hcp基因;基因克隆;原核表达
细菌的分泌系统能够将蛋白质释放到胞外或直接运输到宿主细胞中,参与细菌与细菌之间或细菌与宿主之间的相互作用。这种细胞间的相互作用在细菌的生存以及对宿主生物致病的过程中起着重要作用。目前,已发现至少有7种类型的细菌分泌系统 (T1SS~T7SS),它们各自拥有不同的结构特征和作用机制。Ⅵ型分泌系统 (T6SS)是由Pukatzki等[1]在霍乱弧菌Vibrio cholerae中首先证实并命名的。目前,在约25%已测序的革兰氏阴性细菌中发现了编码T6SS的基因[2]。自发现T6SS在霍乱弧菌感染宿主细胞的过程中发挥重要作用以来,有关T6SS与细菌毒力关系的报道较多[3-6]。研究表明,细菌T6SS不仅与细菌的毒力密切相关,还参与了细菌的群体感应信号调节,对于细菌在恶劣条件下的存活和在真核宿主细胞中的繁殖均具有重要意义。
细菌T6SS通常由15到25个蛋白组成,包括结构蛋白、调控蛋白、效应蛋白和伴侣蛋白等[7]。溶血素共调节蛋白 (hemolysin coregulated protein, Hcp)最早发现于霍乱弧菌[8],并在铜绿假单胞菌Pseudomonas aeruginosa中被再次确认[9]。Hcp是T6SS中高度保守的组分,存在于所有具有T6SS的细菌中。Hcp与T4噬菌体尾管蛋白gp19同源,可以在体外形成六聚环结构,是细菌T6SS输送装置的主要组成部分。此外,Hcp还可作为效应蛋白与VgrG一起被输送到胞外而发挥作用[1,10],如铜绿假单胞菌Hcp1蛋白就是由毒力相关基因座 (HSII)编码的蛋白分泌装置分泌到细胞外的[9]。Williams等[8]发现,小调节蛋白HlyU编码基因的导入(或插入失活)可同时显著促进 (或抑制)霍乱弧菌Hcp和溶血素HlyA的表达,而hcp1和hcp2基因双缺陷可明显减弱霍乱弧菌O37血清型菌株的毒力。此外,霍乱弧菌群体感应系统中的效应调节子LuxO可负向调控Hcp的表达,表明Hcp参与了细菌的群体感应调节[11]。同样,迟钝爱德华菌Edwardsiella tarda毒力相关蛋白EvpC(Hcp同源物)的基因缺失突变可导致细菌毒力显著降低[5]。尽管已有许多报道证实,Hcp与细菌毒力及群体感应调节关系密切,但Hcp的具体生物学功能目前尚不清楚,其在T6SS中如何行使其生物学功能以及在细菌致病中的具体作用机制已成为近年来的研究热点之一。
鮰爱德华菌Edwardsiella ictaluri为肠杆菌科、爱德华氏菌属的革兰氏阴性短杆状细菌[12]。它是重要的水生动物病原,可感染斑点叉尾鮰Ictalurus punctatus患肠型败血症,对斑点叉尾鮰养殖业危害最大。近年来,中国辽宁、湖北、四川、广东等地养殖的黄颡鱼频发的 “红头病”,也是由鮰爱德华菌感染所致[13]。有关鮰爱德华菌的致病机理是水产工作者关注的重点之一。Williams等[14]进行了鮰爱德华菌全基因组测序分析,结果表明,鮰爱德华菌拥有完整的T6SS编码基因。鮰爱德华菌T6SS编码蛋白及其生物学功能和作用机制目前尚不清楚。本研究中,通过克隆Hcp编码基因,获得了重组表达蛋白,并成功制备了具有高效价的多抗,为进一步研究鮰爱德华菌Hcp的生物学功能及其在T6SS中的作用机制奠定了基础,可为探寻鮰爱德华菌病的防控方法提供参考。
1.1 材料
鮰爱德华菌LH51取自大连海洋大学病害实验室。大肠杆菌DH5α、BL21(DE3)感受态细胞,以及质粒小提试剂盒、His-Tag单克隆抗体等均购自天根生物科技有限公司;限制性内切酶XhoI、BamHI和T4 DNA连接酶购自Fermenters公司;克隆载体pMD18-T和表达载体pGS-21a分别购自大连宝生物公司和金思特 (南京)科技有限公司;氨苄青霉素 (Amp)和异丙基-β-D-硫代半乳糖苷 (IPTG)购自上海生工生物工程技术服务有限公司;His-Bind Purification Kit购自德国 Novagen公司。
1.2 方法
1.2.1 目的基因的克隆 依据GenBank中公布的鮰爱德华菌(GeneBank登录号:YP_002934142.2)全基因组序列设计hcp克隆引物并于5'端分别引入酶切位点。引物序列为
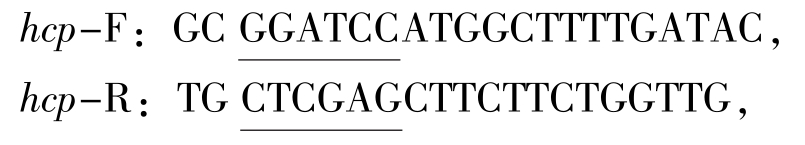
其中下划线处分别为引入的BamHI和XhoI酶切位点,扩增目标序列。
以鮰爱德华菌LH51菌液为模板进行PCR扩增。PCR扩增反应体系共25μL,包括模板1μL,Taq酶0.125μL,10×PCR Buffer(Mg2+Plus)2.5 μL,dNTP 2μL,引物hcp-F/R各0.5μL,以灭菌双蒸水补足25μL。反应条件:94℃下预变性5 min;94℃下变性30 s,52℃下退火30 s,72℃下延伸30 s,共进行30个循环;最后在72℃下延伸5 min。反应结束后,取5μL PCR产物,用10 g/L琼脂糖凝胶电泳进行鉴定。将 PCR产物与载体pMD-18T于16℃下连接30 min后,转化至DH5α感受态细胞中,在37℃下培养16 h后,挑取单菌落进行PCR验证,将阳性克隆送华大基因生物有限公司测序。
1.2.2 生物信息学分析 采用 Blast在线工具(http//www.ncbi.nlm.gov/blast)和 Clustal X 1.8软件进行序列比对和同源性分析;采用Mega 3.1软件构建进化树;在 Interproscan网站(http:// www.ebi.ac.uk/InterProScan)和EXPASY网站 (http://web.expasy.org/protparam)在线进行编码蛋白的功能域预测和理化性质分析。
1.2.3 表达菌株的构建及鉴定 参照孙志鹏等[15]原核表达方法。提取重组质粒pMD18T-hcp和表达载体pGS-21a并进行BamHI、XhoI双酶切。目的片段经切胶回收后,在22℃条件下用T4连接酶连接1.5 h。连接产物转化至感受态细胞DH5α中,在37℃下培养16 h后,挑取单菌落进行PCR验证,将阳性克隆 (含pGS-21a-hcp)送华大基因生物有限公司测序。
将测序正确的质粒pGS-21a-hcp转入大肠杆菌BL21(ED3)感受态细胞中。涂布于含氨苄青霉素 (Amp,100μg/mL)LB琼脂平板上,次日挑选单菌落于5 mL LB液体培养基 (Amp,100 μg/mL)中,37℃下震荡培养12 h,提取质粒pGS-21a-hcp并进行XhoI和BamHI双酶切鉴定。
1.2.4 诱导表达及Western blot分析 将表达菌株BL21(pGS-21a-hcp)接种于LB液体培养基中,培养至 OD600nm值为 0.5后,加入终浓度为 1 mmol/L的IPTG诱导6 h,以12 000 r/min离心1 min,收集菌体,进行SDS-PAGE分析。
参照王忠等[16]、 李强等[17]的方法, 稍加改动,进行免疫印迹分析。将表达产物进行 SDSPAGE后,电转移至硝酸纤维素 (NC)膜上。用质量分数为3%的牛血清白蛋白在4℃下封闭过夜,用PBST洗涤3次,每次5 min;置于抗GST单抗中 (用0.01 mol/L PBS稀释至终浓度为0.1 μg/mL),37℃下孵育1 h,再用PBST洗涤3次,每次5 min。将NC膜置于碱性磷酸酶 (AP)标记的羊抗鼠IgG抗体中 (用0.01 mol/L PBS按1∶3 000稀释),37℃下孵育1 h,用PBST缓冲液洗涤3次后,加入NBT/BCIP底物缓冲溶液显色5 min,观察结果。
1.2.5 蛋白纯化、多克隆抗体的制备、诱导表达和Western blot分析 将经诱导表达的菌株进行超声破碎,离心,收集上清。将培养的上清经0.45 μm微孔滤膜过滤后,采用His-Bind Purification Kit进行可溶性蛋白的洗脱纯化并分段收集洗脱液进行SDS-PAGE分析。纯化后的重组蛋白经定量后加入0.5 mmol/L PMSF,于-20℃下保存。
取100μL重组蛋白与等量的弗氏完全佐剂混合、乳化后,取100μL以腹腔注射方式免疫小鼠(共2只);两周后,取同样剂量的纯化蛋白与等量的弗氏不完全佐剂混合、乳化,进行加强免疫;再一周后进行二次加强免疫。7 d后,从小鼠眼眶取血,收集血清,按每管50μL分装,放入冰箱(-80℃)中保存备用。
采用Dot-ELISA方法测定多克隆抗体效价。确定多抗最高效价后,以该抗体为一抗,以AP标记的羊抗鼠IgG为二抗,用Western blot检测蛋白hcp,以确定多抗特异性。
1.2.6 鮰爱德华菌Hcp表达的检测 将鮰爱德华菌接种于营养肉汤 (NB)培养基中,于28℃下培养。分别取 OD600nm为 0.05、0.10、0.20、0.30、0.40的菌液1 mL,离心,分离菌体和培养上清,将培养的上清于-20℃下保存备用。菌体用1 mL灭菌的PBS重悬后超声破碎,离心,取上清于-20℃下保存。以上述培养的上清和菌体裂解产物为抗原,以抗Hcp多克隆抗体为一抗,用Western blot检测该蛋白在鮰爱德华菌中的表达和泌出情况。
2.1hcp基因的克隆
以鮰爱德华菌LH51菌液为模板,用引物hcp-F/R进行PCR扩增。PCR产物经10 g/L琼脂糖凝胶电泳后,在约490 bp处出现特异性条带 (图1),与预期结果一致。
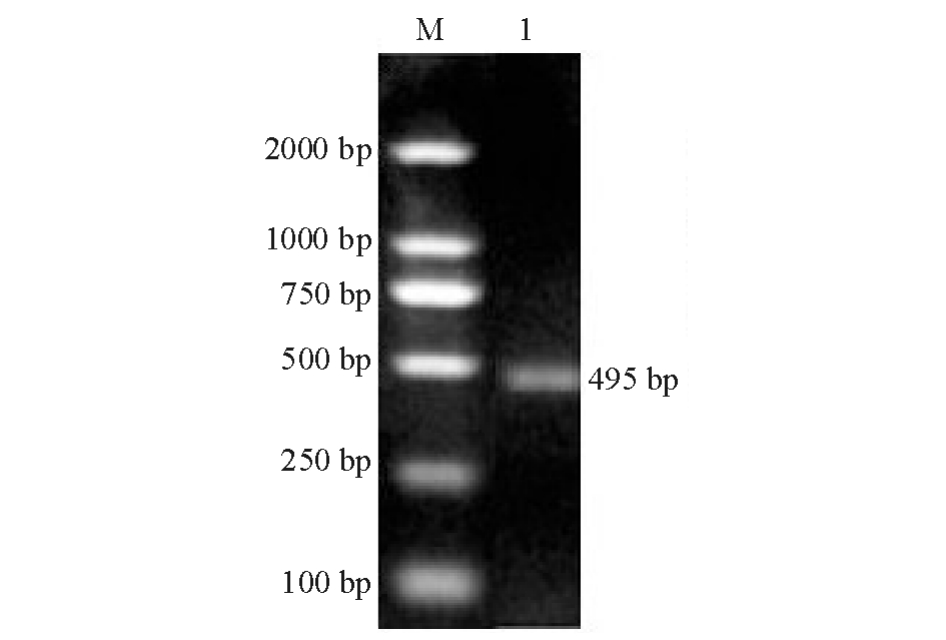
图1 hcp基因的RT-PCR扩增
Fig.1 The RT-PCR am p lification of hcp gene
注:M为DNA Marker;1为基因hcp。
Note:M,DNA Marker;1,hcpgene.
2.2hcp基因的生物信息学分析
2.2.1hcp及其编码氨基酸的序列结构分析hcp基因全长为489 bp,编码163个氨基酸,其核苷酸序列和编码氨基酸序列见图 2。hcp编码蛋白(GeneBank登录号:JX17440)的相对分子质量为17 800,等电点为5.21,蛋白脂溶指数为61.72,为疏水性蛋白;编码蛋白的稳定性指数为26.54,属稳定性蛋白。应用 Interproscan工具 (http:// www.ebi.ac.uk/InterProScan)对 Hcp功能进行预测,结果显示,该蛋白与已报道的多种细菌Hcp结构功能相似,均属于T6SS的一种毒力因子,同时也作为分泌装置发挥作用。

图2 hcp核苷酸序列与氨基酸序列分析
Fig.2 Nucleotide sequence and am ino acid sequence analysis of hcp
注:起始密码子ATG和终止密码子TAA用下划线标出。
Note:The initiation codon ATG and termination codon TAA were outlined.
2.2.2 Hcp氨基酸序列的同源性比较和系统进化树分析 Blsatx结果显示,Hcp氨基酸序列与已报道的T6SS相关基因序列有较高的一致性。选取部分GenBank中已经报道的T6SS相关基因序列,用Clustal X 1.8软件对氨基酸序列同源性进行比较分析,结果表明,该蛋白的氨基酸序列保守性较高,与迟钝爱德华T6SS的EvpC序列相似度为100%,一致性高达91%(表1、图3)。根据Hcp氨基酸序列相似性和同源性对比结果,构建Neighborhood-Joining进化树 (图4),结果显示,其与迟钝爱德华菌聚为一支,说明二者亲缘关系最近。
2.3 表达菌株BL21(pGS-21a-hcp)的构建
克隆载体经双酶切后回收目的片度hcp并与表达质粒pGS-21a连接,转入菌株BL21感受态细胞中,经测序验证正确。提取质粒pGS-21a-hcp进行双酶切鉴定,经10 g/L琼脂糖凝胶电泳检测,在约490 bp处出现目的条带 (图5),证明表达菌株构建成功。
表1 用于构建进化树的氨基酸序列与鮰爱德华菌Hcp氨基酸序列的相似度
Tab.1 Am ino acid sequences for construction of phylogenetic tree and the sim ilarity w ith Hcp %
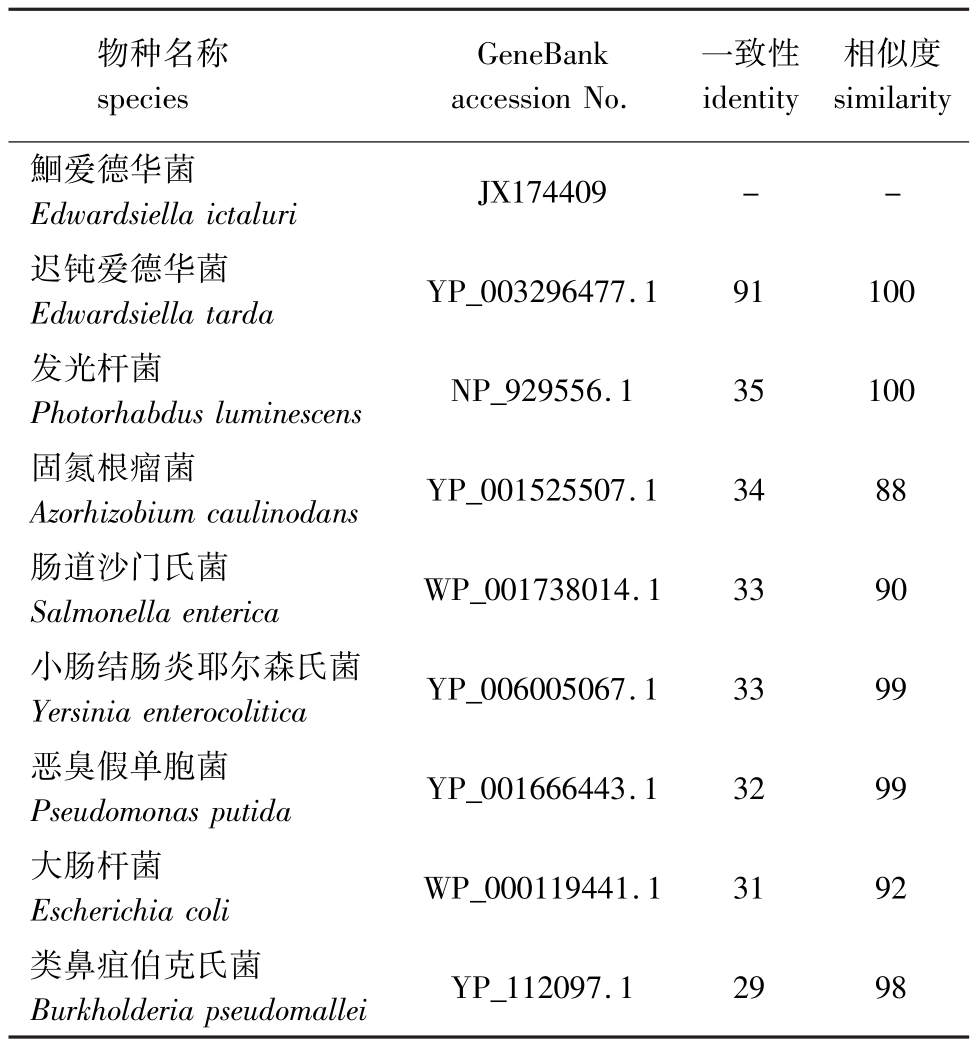
物种名称species GeneBank accession No.一致性identity相似度similarity鮰爱德华菌Edwardsiella ictaluriJX174409 - -迟钝爱德华菌Edwardsiella tardaYP_003296477.1 91 100发光杆菌Photorhabdus luminescensNP_929556.1 35 100固氮根瘤菌Azorhizobium caulinodansYP_001525507.1 34 88肠道沙门氏菌Salmonella entericaWP_001738014.1 33 90小肠结肠炎耶尔森氏菌Yersinia enterocoliticaYP_006005067.1 33 99恶臭假单胞菌Pseudomonas putidaYP_001666443.1 32 99大肠杆菌Escherichia coliWP_000119441.1 31 92类鼻疽伯克氏菌Burkholderia pseudomalleiYP_112097.1 29 98

图3 鮰爱德华菌与部分其他细菌Hcp氨基酸序列的比较分析
Fig.3 M ultiple am ino acid sequences alignments of Hcp between Edwardsiella ictaluri and other bacteria
注:用阴影表示保守氨基酸,黑色、灰色和浅灰色分别表示保守性为100%、[75%~100%)和 [50%~75%)的氨基酸。
Note:Conserved amino acids are highligthed with shade,black,grey and light-grey shades represent the amino acids conservation of 100%, [75% ~100%),and[50%~75%),respectively.
2.4 重组蛋白的表达与Westernblot分析
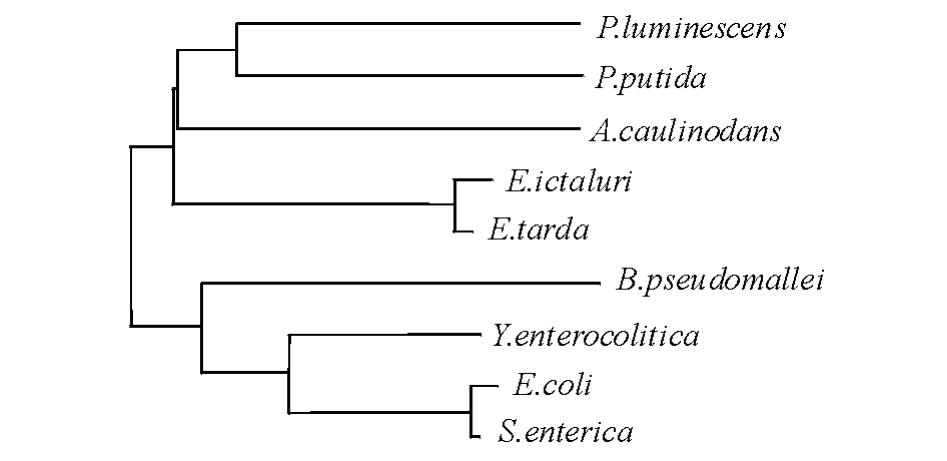
图4 Edwardsiella ictaluri Hcp系统发育分析
Fig.4 Phylogenetic tree of Edwardsiella ictaluri Hcp
表达菌株BL21(pGS-21a-hcp)经IPTG诱导表达后进行SDS-PAGE分析,以未诱导的表达菌株BL21为阴性对照,以含有空载体pGS-21a的BL21诱导菌株为阳性对照。结果显示,在相对分子质量为45 000处出现明显的蛋白条带 (图6-A),与预期大小一致。以Anti-His标签抗体为一抗,以碱性磷酸酶 (AP)标记的羊抗鼠IgG为二抗,进行Western blot分析,成功检测到该融合蛋白 (图6-B),进一步证明了该蛋白已成功表达。
2.5 蛋白的纯化及多克隆抗体的制备
经SDS-PAGE分析,亲和纯化产物在相对分子质量约45 000处出现一条蛋白条带 (图6-C),可明显观察到,收集的二号管样品蛋白含量最大。采用Dot-ELISA方法测定多克隆抗体效价 (图6-D),当抗体稀释163 840倍时,仍可观察到阳性反应 (图6编号15);当抗体稀释327 680倍时,未出现阳性信号反应(图6-D编号16),据此可判断制备的多克隆抗体效价为1∶163 840。以该多抗为一抗,以AP标记的羊抗鼠IgG为二抗,用Western blot检测Hcp,在相对分子质量约45 000处出现特异性条带,这表明制备的多抗可特异性地识别该蛋白 (图6-B)。应用制备的多抗,未能检测到泌出的鮰爱德华菌Hcp(图略)。
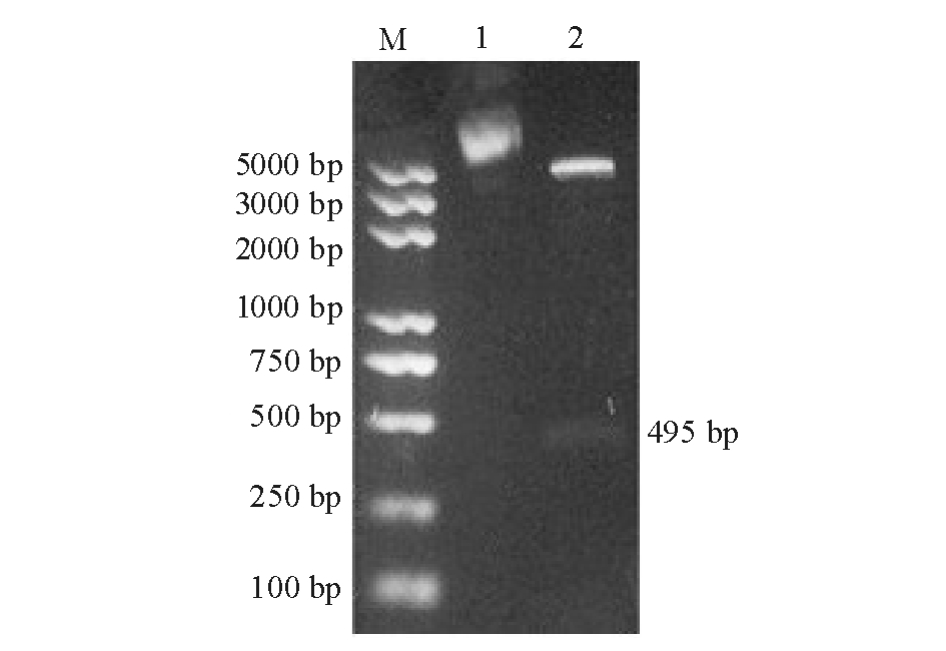
图5 重组质粒pGS-21a-hcp的双酶切
Fig.5 Identification of recombination plasm id pGS-21a-hcp by enzyme digestion
注:M为DNA Marker;1为质粒 pGS-21a-hcp;2为XhoI、BamHI双酶切。
Note:M,DNA Marker;1,plasmid pGS-21a-hcp;2,plasmid pGS-21a-hcpdigested withXhoIandBamHI.
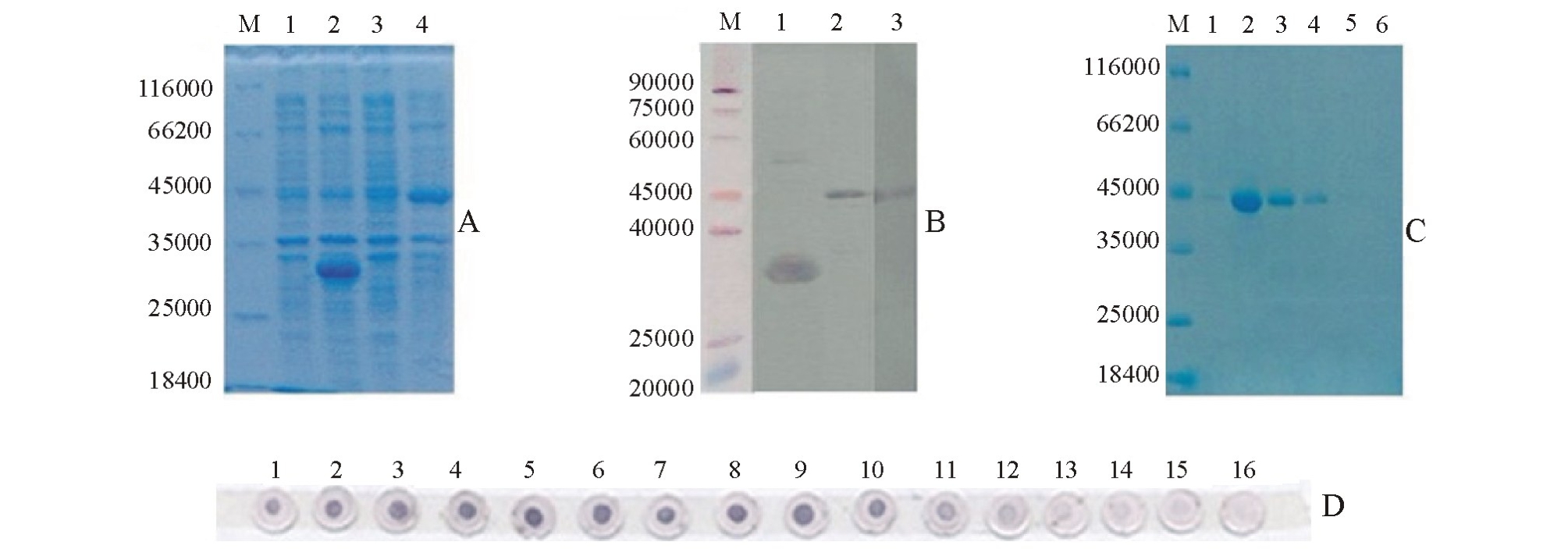
图6 蛋白纯化及多抗制备结果
Fig.6 Results of protein purification and antibody preparation
注:M为标准蛋白Marker;A图中,1、2分别为未诱导和诱导的空载体pGS-21a,3、4分别为未诱导和诱导的表达菌BL21(pGS-21ahcp);B图中,1为用Anti-His标签抗体检测诱导表达的空载体,2、3分别为用Anti-His标签抗体和多抗检测融合蛋白Hcp;C图中, 1~6为依次收集的6管纯化蛋白;D图中,用Dot-ELISA法测定抗体效价,多克隆抗体稀释倍数分别为1∶10、1∶20、1∶40、1∶80、1∶160、1∶320、1∶640、1∶1280、1∶2560、1∶5120、1∶10240、1∶20480、1∶40960、1∶81920、1∶163840、1∶327680(1~16)。
Note:M,protein Marker;in Fig.A,1,2,expression product of BL21(pGS-21a)without IPTG and with IPTG inducing,3,4,expression product of BL21(pGS-21a-hcp)with and without IPTG induction;in Fig.B,1,Detection of BL21(pGS-21a)induced with Anti-His Antibody, 2,3,detection of Hcp fusion protein with anti-His antibody and Hcp polyclonal antibody;in Fig.C,1-6,purified protein Hcp;in Fig.D,antibody titer tested by Dot-ElISA,dilution ratio of polyclonal antibody from 1 to 16 is 1∶10,1∶20,1∶40,1∶80,1∶160,1∶320,1∶640, 1∶1280,1∶2560,1∶5 120,1∶10240,1∶20480,1∶40960,1∶81920,1∶163840,and 1∶327680,respectively.
作为 T6SS的重要组成成员,Hcp是由 Williams等[8]在研究霍乱弧菌毒力基因表达调节时首先发现并命名的。现有研究表明,Hcp与细菌毒力及群体感应调节密切相关,在细菌存活及致病中发挥重要作用[1,5,8,11,18]。事实上,Hcp是 T6SS中高度保守的组分,含有T6SS的细菌只要条件适宜都会分泌Hcp,该蛋白已被作为确认T6SS的可靠指标[19]。Williams等[14]于2012年对鮰爱德华菌全基因组测序的结果表明,鮰爱德华菌拥有完整的T6SS的编码基因,但至今未见鮰爱德华菌hcp基因及其相关功能的研究报道。本研究中通过设计特异性引物,以鮰爱德华菌LH51为模板成功克隆到全长为489 bp、编码163个氨基酸的一个基因。对其氨基酸序列分析表明,该编码蛋白的理论相对分子质量为17 800,等电点为5.21。
对鮰爱德华菌Hcp氨基酸序列的分析发现,其编码蛋白的氨基酸序列与迟钝爱德华菌EvpC (Hcp同源物)氨基酸序列的一致性高达91%,与大肠杆菌、肠炎沙门菌的Hcp1氨基酸序列的一致性也均在30%以上。在系统发育树上,鮰爱德华菌Hcp氨基酸序列与迟钝爱德华菌EvpC聚为一支,同为细菌Hcp的同源物。通过序列分析和系统发育分析表明,本研究中获得了鮰爱德华菌Hcp的编码基因,命名为hcp(GenBank登录号为JX174409)。研究结果确认了鮰爱德华菌LH51拥有Hcp编码基因,这与Williams等[14]对鮰爱德华菌93~146的全基因组测序结果一致。同时,研究结果也证实了Hcp在T6SS中的保守性及其作为T6SS确认指标的可靠性。
在T6SS被证实不久,人们就发现其部分组分如Hcp与VgrG具有与噬菌体蛋白相似的二级结构[20]。随后的X-射线分析结果证实,铜绿假单胞菌和迟钝爱德华菌的Hcp同源物可通过 “头—头”或 “头—尾”相连的方式形成六聚环状结构,这与λ噬菌体gpV蛋白形成噬菌体尾管结构十分相似[9,21-22]。Hcp再与VgrG形成的尾钉样结构 (与T4噬菌体gp27/gp5复合物类似)组装在一起,并被TssB/TssC亚基形成的鞘状结构包裹起来形成噬菌体样结构[23-24]。更多的研究表明,与迟钝爱德华菌毒力相关的蛋白EvpC编码基因 (Hcp同源基因)的缺失,可阻碍EvpP向细菌培养上清中分泌[5]。由此推测,Hcp作为T6SS的装置蛋白参与了T6SS蛋白泌出通道的形成。T6SS通过 TssB/ TssC作用于Hcp,从而将目的蛋白输送到胞外或直接注入宿主细胞内。功能预测分析显示,hcp编码蛋白与其他细菌的Hcp同源物一样能形成六聚环状结构,可能拥有与其他Hcp同源物相同或相似的功能,参与鮰爱德华菌T6SS装置蛋白的形成。
为进一步研究鮰爱德华菌Hcp的生物学功能及其在T6SS中具体作用机制,本研究中克隆到鮰爱德华菌Hcp编码基因hcp,并在对其进行生物信息学分析的基础上,进行了鮰爱德华菌Hcp蛋白的重组表达,经纯化获得了较高纯度的融合蛋白并制备了高效价的多克隆抗体。经SDS-PAGE分析表明,获得的融合蛋白相对分子质量约为45 000,与预期大小基本一致。该研究结果与Williams等[8]1996年在霍乱弧菌Hcp重组表达结果和Rao等[25]对迟钝爱德华菌的研究结果一致。Ishikawa等[26]利用制备的多克隆抗体检测霍乱弧菌Hcp的表达情况,结果显示,不同培养时期细菌Hcp的表达情况有明显区别。同样,本研究中利用制备的多克隆抗体检测了鮰爱德华菌Hcp的表达情况,但结果未能检测到目的条带。这可能是由于在本研究条件下,鮰爱德华菌Hcp不表达或表达量过低造成的,其具体调节机制和影响因素仍需要进一步深入研究。该研究结果可为进一步研究鮰爱德华菌Hcp的生物学功能,深入探讨T6SS在鮰爱德华菌致病中的作用机制,寻找有效的防控方法奠定基础。
参考文献:
[1] Pukatzki S,Ma A T,Sturtevant D,et al.Identification of a conserved bacterial protein secretion system inVibrio choleraeusing the Dictyostelium hostmodel system[J].Proc Natl Acad SciUSA, 2006,103(5):1528-1533.
[2] Bingle L E H,Bailey C M,Pallen M J.Type VI secretion:a beginner's guide[J].Current Opinion in Microbiology,2008,11 (1):3-8.
[3] 张丽勍.VI型分泌系统在植物青枯菌致病和蛋白分泌中的作用研究[D].北京:中国农业科学院,2010.
[4] Blondel C J,Jiménez JC,Contreras I,et al.Comparative genomic analysis uncovers3 novel loci encoding type VI secretion systems differentially distributed inSalmonellaserotypes[J].BMCGenomics,2009,10(1):354-363.
[5] Zheng J,Leung K Y.Dissection of a type VI secretion system inEdwardsiella tarda[J].Molecular Microbiology,2007,66(5): 1192-1206.
[6] Galán JE,Wolf-Watz H.Protein delivery into eukaryotic cells by type IIIsecretion machines[J].Nature,2006,444:567-573.
[7] Leung K Y,Siame B A,Snowball H,et al.Type VIsecretion regu-lation:crosstalk and intracellular communication[J].Current Opinion in Microbiology,2011,14(1):9-15.
[8] Williams SG,Varcoe L T,Attridge SR,etal.Vibrio choleraeHcp, a secreted protein coregulated with HlyA[J].Infection and Immunity,1996,64(1):283-289.
[9] Mougous JD,Cuff M E,Raunser S,et al.A virulence locus ofPseudomonas aeruginosaencodes a protein secretion apparatus [J].Science,2006,312:1526-1530.
[10] Pukatzki S,Ma A T,Revel A T,et al.Type VI secretion system translocates a phage tail spike-like protein into target cellswhere it cross-links actin[J].Proc Natl Acad Sci USA,2007,104 (39):15508-15513.
[11] 霍赵璇,阚飙,崔志刚,等.霍乱弧菌密度感应系统研究进展[J].疾病监测,2012,27(2):158-164.
[12] 耿毅,汪开毓,陈德芳,等.鮰爱德华氏菌与鮰爱德华氏菌病[J].水产科技情报,2009,36(5):236-240.
[13] 郑善坚.黄颡鱼红头病病原研究[J].水产科学,2009,28 (12):757-759.
[14] Williams M L,Gillaspy A F,Dyer DW,et al.Genome sequence ofEdwardsiella ictaluri93-146,a strain associated with a natural channel catfish outbreak of enteric septicemia of catfish[J].Journal of Bacteriology,2012,194(3):740-741.
[15] 孙志鹏,徐翔,李强,等.真鲷虹彩病毒辽宁株跨膜蛋白(ORF049L)基因的克隆及表达[J].大连海洋大学学报, 2013,28(2):148-153.
[16] 王忠,邓灯,刘慧,等.两种致病性弧菌外膜蛋白抗原特性的分析[J].大连海洋大学学报,2011,26(2):184-187.
[17] 李强,齐楠,杨丽文,等.黄海希瓦氏菌多克隆抗体部分特性分析[J].大连海洋大学学报,2011,26(4):376-380.
[18] Mougous JD,Cuff M E,Raunser S,et al.A virulence locus ofPseudomonas aeruginosaencodes a protein secretion apparatus [J].Science,2006,312:1526-1530.
[19] 韩一凡.鳗弧菌(Vibrio anguillarum)M3菌株T6SS基因簇的克隆及其功能的初步研究[D].青岛:中国海洋大学,2009.
[20] Pell LG,Kanelis V,Donaldson LW,etal.The phageλmajor tail protein structure reveals a common evolution for long-tailed phages and the type VIbacterialsecretion system[J].Proc Natl Acad Sci USA,2009,106(11):4160-4165.
[21] Jobichen C,Chakraborty S,LiM,etal.Structural basis for the secretion of EvpC:a key type VIsecretion system protein fromEdwardsiella tarda[J/OL].PLoSOne,2010,5(9):e12910.
[22] Osipiuk J,Xu X,Cui H,et al.Crystal structure of secretory protein Hcp3 fromPseudomonasaeruginosa[J].Journal of Structural and Functional Genomics,2011,12(1):21-26.
[23] Cascales E,Cambillau C.Structural biology of type VI secretion systems[J].Philosophical Transactions of the Royal Society B: Biological Sciences,2012,367:1102-1111.
[24] Bönemann G,Pietrosiuk A,Diemand A,et al.Remodelling of VipA/VipB tubules by ClpV-mediated threading is crucial for type VIprotein secretion[J].The EMBO Journal,2009,28(4):315-325.
[25] Rao P S,Yamada Y,Tan Y P,et al.Use of proteomics to identify novel virulence determinants that are required forEdwardsiella tardapathogenesis[J].Molecular microbiology,2004,53(2): 573-586.
[26] Ishikawa T,Rompikuntal PK,Lindmark B,et al.Quorum sensing regulation of the twohcpalleles inVibrio choleraeO1 strains [J/OL].PLoSOne,2009,4(8):e6734.
Cloning and recombinant expression of pathogenic bacterium Edwardsiella ictaluri hcp gene
Abstract:Thehcpgene encoding hemolysin coregulated protein was sequenced from pathogenic bacteriumEdwardsiella ictaluri LH51 by cloning.It was found that the hcp gene contained the opening reading frame of 489 bp in length,encoding 163 amino acids with molecular weight of 17 800,and theoretical isoelectric point of 5.21. Multiple sequence alignment indicated that theE.ictalurihcpshared high homology with those from pathogenic bacteriaEdwardsiella tardaandPhotorhabdus luminescens.A recombinant plasmid pGS-21a-hcpcontaining the coding sequence ofhcpgene was constructed using pGS-21a as a fused expression vector.The SDS-PAGE and Western blot revealed that the recombined protein was expressed successfully inEscherichia coliBL21(ED3)induced by IPTG.Then a recombinant fusion protein about 45 000 was purified by Ni2+-NTA His-bind column chromatography,and the polyclonal antibody was prepared.
Keywords:Edwardsiella ictaluri;hcpgene;gene cloning;prokaryotic expression
中图分类号:S943
文献标志码:A
文章编号:2095-1388(2013)05-0424-07
收稿日期:2013-09-01
基金项目:国家 “十二五”科技支撑计划项目 (2011BAD13B03)