光棘球海胆CYP17基因的SNPs标记筛选及遗传分析
朱琳琳1、2,王秀利1、2,王洪迪2,郭晓黎2,常亚青1、2,刘洋1,仇雪梅1、2
(1.大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023;2.大连海洋大学水产与生命学院,辽宁大连116023)
摘要:采用聚合酶链式反应、单链构象多态性 (PCR-SSCP)技术和基因测序方法筛选光棘球海胆Strongylocentrotus nudus细胞色素17α羟化酶/17,20裂解酶 (17α-hydroxylase/17,20-lyase,CYP17)基因编码区单核苷酸多态性 (SNPs),并进行了基于SNPs的遗传分析。结果表明:在CYP17基因的270、417、666 nt处均发生了碱基的点突变,即G270A、A417G和C666T,前两个突变位点位于引物对BF/BR的扩增产物中,后一个突变位点位于引物对CF/CR的扩增产物中;引物对BF/BR的扩增产物可形成3种基因型,即AA、BB和AB基因型,A和B等位基因频率分别为0.54和0.46,AA、AB和BB基因型频率分别为0.30、0.48和0.22,该座位的杂合度 (He)、纯合度 (Ho)、多态性信息含量 (PIC)和有效等位基因数 (Na)分别为0.496 8、0.503 2、0.373 4和1.987 3;引物对CF/CR的扩增产物形成了两种基因型,即CC和CD基因型,C和D等位基因频率分别为0.68和0.32,CC和CD基因型频率分别为0.84和0.16,该座位的He、Ho、PIC和Na分别为0.268 8、0.731 2、0.232 7和1.367 6。遗传变异分析结果表明:两个座位均属于低度多态性,而且群体遗传杂合度较低,这反映了该群体的遗传一致性较高。本研究筛选的3个SNPs为今后CYP17基因在光棘球海胆性腺生长发育研究上提供了前期科研基础。
关键词:光棘球海胆;CYP17基因;单核苷酸多态性;遗传分析
海胆不仅是重要的模式生物,也是重要的海水养殖动物。光棘球海胆Strongylocentrotus nudus、虾夷马粪海胆 Strongylocentrotus intermedius等已成为中国北方沿海养殖的重要海珍品[1]。因海胆的主要产品为生殖腺,其生殖腺具有丰富的营养和药用价值,因此,部分学者开展了有关海胆生殖腺生长发育、基因克隆表达等方面的研究。如关于光棘球海胆生殖周期的研究[2],中间球海胆精子超低温冷冻损伤及冷冻保存方法的研究[3-4],海胆性腺氨基酸及脂肪酸的组成分析[5-6],虾夷马粪海胆性腺cDNA文库的构建以及不同家系和性别间性腺性状的比较[7-8],虾夷马粪海胆表型性状对性腺性状的影响效果分析[9],MYP基因在中间球海胆及杂交海胆生殖腺不同发育时期的转录表达[10]等。
CYP17是细胞色素P450家族的重要成员之一,该基因编码的细胞色素17α羟化酶/17,20裂解酶 (17α-hydroxylase/17,20-lyase,CYP17)是类固醇激素合成的关键酶之一,对生殖腺的生长和发育起关键的调节作用[11-15]。本研究中,作者对光棘球海胆 CYP17基因进行了单核苷酸多态性(SNPs)的筛选及遗传学分析,旨在为今后利用SNPs分子标记辅助培育光棘球海胆的优良品种提供参考。
1 材料与方法
1.1 材料
试验用光棘球海胆随机采自大连塔河湾海域自然群体,共100枚。活体解剖取出部分海胆性腺组织,于体积分数为70%的酒精中保存,备用于基因组DNA的提取。
引物由宝生物工程(大连)有限公司合成;rTaq DNA聚合酶、dNTPs、PMDT-19载体、DNA切胶回收试剂盒等均购自宝生物工程 (大连)有限公司;其他常规试剂来自大连海洋大学基因工程实验室。
1.2 方法
1.2.1 基因组DNA的提取 采用常规酚-氯仿法提取光棘球海胆基因组DNA[16],用TE缓冲液溶解并于4℃下保存。
1.2.2 引物设计 利用本课题组克隆的光棘球海胆CYP17基因 cDNA序列 (GenBank注册号: GU238422)[17],在其外显子部分设计了6对适于PCR-SSCP分析的引物,用于SNP分析。这6对引物序列如表1所示。.
表1 用于PCR-SSCP分析的CYP17基因的引物序列
Tab.1 Primer sequences of CYP17 gene used in PCRSSCP analysis

注:1)指光棘球海胆CYP17基因 (GenBank注册号为GU238422)的cDNA序列上的位置。
Note:1)the locations on the sequence of CYP17 cDNA in sea cucumber Strongylocentrotus nudus(GenBank registered number GU238422).
引物primer序列(5'-3') sequence位置1)location退火温度/℃annealing temp A F:GGTGGCTATTGAGTTGGT R:TTTGAGGGAGAAGACGCT 21~38 211~22857 B F:AAATACGGCAGCGTCTTCT R:GCCACGGATATTCTTGTGC 202~220 423~441 57 C F:CACAAGAATATCCGTGGCG R:CTTTAGAGCTGGGAACAC 424~442 682~699 53 D F:TCGTCTCGTCCAGGAACT R:GGTGATGGATGAGGAAAGC 720~737 964~982 55 E F:GTCCAAGCCAAAATTCAG R:TGTGTATCACACGTTGTC 998~1005 1137~1154 50 F F:GGTCAAAGGTTACGACG R:ACCGAACCTCTAGGCACA 1155~1171 1481~149853
1.2.3 PCR扩增 参照文献 [18]、[19]中的方法进行PCR扩增。PCR扩增体系为25 μL,其中包括模板DNA约50 ng,上、下游引物各1 μL(25 pmol/L),10×PCR缓冲液 (Mg2+plus)2.5 μL, dNTPs Mixture 2 μL,rTaq 1.5 U,加双蒸水补至25 μL。PCR反应条件为:95℃下预变性5 min;94℃下变性30 s,退火 (退火温度如表1所示)45 s,72℃下延伸30 s,共进行30个循环;最后在72℃下延伸7 min。用琼脂糖凝胶电泳检测PCR产物质量,以此决定下一步在单链构象多态性 (SSCP)分析中PCR产物的用量。
1.2.4 SSCP分析 参照文献 [18]、 [19]中的方法进行SSCP分析。在干净的PCR管中加入5 μL上样缓冲液 (98%去离子甲酰胺,0.025%溴酚蓝,0.025%二甲苯青,10 mml/L pH 8.0的EDTA,2%甘油)和1~2 μL PCR扩增产物,于98℃下变性10 min后,立即冰浴10 min。变性后的PCR产物用12%非变性聚丙烯酰胺凝胶 (PAGE 30%,Acr∶Bis=29∶1)电泳,在110 V下预电泳30 min,在120 V下电泳12~14 h,用硝酸银显色后,判别基因型并扫描保存。
1.2.5 PCR产物的回收和测序 对SSCP分析后的纯合基因型,各取其3个个体的PCR产物,经琼脂糖凝胶DNA回收试剂盒纯化回收后,连接到pMD19-T载体并转化至大肠杆菌DH5α感受态细胞中。经菌液PCR检测验证后,提取重组质粒,送上海生工生物工程技术服务有限公司进行测序。
1.2.6 序列分析 利用DNAStar软件对测序结果进行拼接与分析,并进一步确认SNPs位点。
1.3 数据处理
采用遗传信息多样性分析软件 (PopGene 32)和多态性信息含量计算软件 (PIC-Calc 0.6)计算群体遗传多样性指标。
2 结果与分析
2.1 PCR-SSCP分析
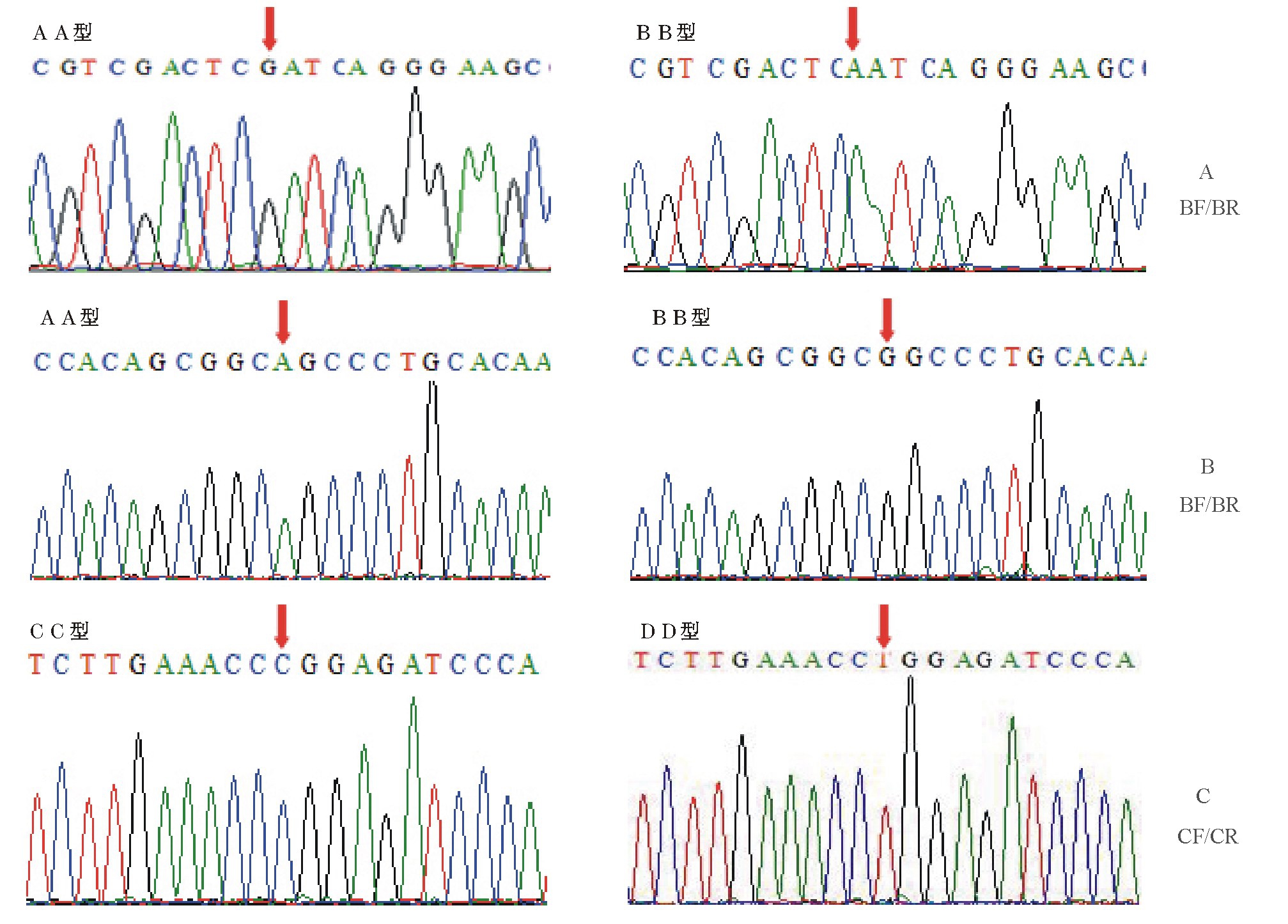
以光棘球海胆基因组DNA为模板,用表1所示的6对引物进行PCR-SSCP分析。6对引物全部获得清晰且与预期一致的PCR产物。其中引物对BF/BR的PCR产物的SSCP结果显示出3种基因型,AA、BB和AB;引物对CF/CR的PCR产物的SSCP结果显示出2种基因型,CC和CD(图1)。
2.2 克隆测序
将存在PCR-SSCP多态的两对引物BF/BR、CF/CR所得到的PCR片段经连接载体后进行测序。引物对BF/BR的PCR片段的测序峰见图2-A、B,存在2个SNPs,即光棘球海胆CYP17基因cDNA序列的第270个核苷酸G突变为A(图2-A),以及第417个核苷酸A突变为G(图2-B)。引物CF/CR的PCR片段的测序峰图见图2-C,存在1个SNP,即第666个核苷酸C突变为T。上述编码区中存在3个SNPs,但都在密码子的第三位,没有发生氨基酸的改变。
2.3 遗传与多样性分析
基于引物对BF/BR和CF/CR,对本试验所采集的光棘球海胆群体进行了遗传与多样性分析,结果见表2。由表2可知,基于引物对BF/BR,该群体的等位基因频率A和B分别为0.54和0.46, AA、AB和BB基因型频率分别为0.30、0.48和0.22;杂合个体的比例占48%,而纯合型个体比例较低,仅占22%;该群体的多态性信息含量较低,有效等位基因数较少,杂合度为0.496 8。基于引物对CF/CR,该群体的等位基因频率C和D分别为0.84和0.16,CC和CD基因型频率分别为0.68和0.32;在群体中没有出现DD基因型纯合个体,杂合个体的比例偏低;该群体的多态性信息含量很低 (0.232 7),有效等位基因数较少,杂合度为0.268 8。
3 讨论
SNPs分子标记的出现极大地促进了遗传学、基因组学和育种学等相关学科的发展。因SNPs与动植物的生长、发育、抗病等经济性状有直接或间接的相关性,选择与海胆生殖腺生长发育有关的功能基因或候选基因筛选和研究SNPs,并在今后育种和生产工作中利用SNPs,具有重要的理论意义和实际应用价值。近几年来,科研工作者开始发掘、研究与应用SNPs,在水产动物遗传育种方面取得了部分成果[18-26]。仇雪梅等[18]对虾夷马粪海胆CYP51基因的cDNA序列进行了克隆和SNPs分析,结果表明,在虾夷马粪海胆CYP51基因的开放阅读框第161个核苷酸处存在1个 SNP(即A161G),该SNP与虾夷马粪海胆的体质量、性腺质量两个生长性状之间存在显著相关性。郭晓黎等[19]克隆了虾夷马粪海胆的CYP17基因,并进行了表达差异分析,结果表明,CYP17基因在虾夷马粪海胆不同家系海胆雌、雄个体生殖腺转录水平上的表达差异明显,雄性的表达量明显比雌性高。本课题组已成功地克隆了光棘球海胆CYP17基因的cDNA序列[17],这为进一步开展光棘球海胆生殖腺生长发育候选基因CYP17的SNPs筛选与遗传多样性分析奠定了基础。
表2 基于引物BF/BR和CF/CR的遗传多样性分析
Tab.2 Analysis of genetic diversity on primer pairs BF/BR and CF/CR

引物对primer基因型频率genotypic frequency等位基因频率allele frequency杂合度He纯合度Ho多态性信息含量PIC有效等位基因数Na BF/BR AA AB BB 0.30 0.48 0.22 A B 0.54 0.460.4968 0.5032 0.3734 1.9873 CF/CR CC CD 0.68 0.32 C D 0.84 0.160.2688 0.7312 0.2327 1.3676
本研究中通过PCR-SSCP技术和DNA测序等方法筛选光棘球海胆CYP17基因的SNPs位点,发现在该基因270、417、666 nt处存在SNPs。三处的点突变虽然均未引起氨基酸的改变,为同义突变,但CYP17基因的这3个SNPs可能与光棘球海胆生殖腺的生长发育有关。今后可对这3个SNPs与光棘球海胆生殖腺的生长发育性状的相关性做进一步分析。3个基因分型显示,在BF/BR引物扩增产物中有AA、AB和BB 3种基因型,等位基因A和B的基因频率接近1∶1,杂合个体占48%。在CF/CR引物扩增产物中有CC和CD两种基因型,等位基因C的基因频率是D基因频率的5.25倍,纯合个体是杂合个体的2.125倍。在基于CF/ CR引物所进行的遗传分析中,未发现DD纯合型个体,究其原因,可能是试验样本数还不够大,以致未检测到另一种纯合型,今后可以通过扩大样本予以验证。
从群体遗传多态性角度进行分析,如果多态性信息含量 (PIC)高,等位基因数目多,杂合度大,表明该群体在该座位的遗传变异程度高。当PIC>0.5时,该座位为高度多态性;当0.5>PIC>0.25时,该座位为中度多态性;当PIC<0.25时,该座位为低度多态性。本研究中,基于BF/BR引物所获的SNPs来分析光棘球海胆群体的遗传多样性,发现该群体个体间属中度多样性;基于CF/ CR引物所获的SNPs来分析遗传多样性,发现该群体个体间属低度多样性,但两个突变位点都属于低度多态性,而且群体杂合度都较低,说明群体的遗传一致性较高。本研究中筛选的3个SNPs为今后CYP17基因在光棘球海胆性腺生长发育研究上提供了前期科研基础。
参考文献:
[1] 常亚青,丁君,宋坚,等.海参、海胆生物学研究与养殖[M].北京:海洋出版社,2004.
[2] 李世英,张明,高绪生,等.大连近海光棘球海胆生殖周期的初步研究[J].大连水产学院学报,2000,15(1):60-64.
[3] 李霞,刘志丹,秦艳杰,等.中间球海胆精子超低温冷冻损伤的研究[J].大连海洋大学学报,2012,27(2):105-109.
[4] 刘志丹,李霞,秦艳杰,等.中间球海胆精子超低温冷冻保存方法的研究[J].大连海洋大学学报,2012,27(1):53-57.
[5] 许伟定,何平,王丽梅,等.光棘球海胆性腺氨基酸组成的研究[J].大连水产学院学报,2009,24(6):583-586.
[6] 丁君,常亚青,郝振林,等.北方海区经济海胆性腺脂肪酸组成与β-胡萝卜素含量的比较研究[J].中国农业科技导报, 2011,13(3):122-128.
[7] 丁君,孙巍,常亚青.虾夷马粪海胆性腺cDNA文库构建及部分EST序列分析[J].中国水产科学,2011,18(1):222-229.
[8] 常亚青,张伟杰,丁君,等.虾夷马粪海胆不同家系和性别间性腺性状的比较[J].水产学报,2010,34(7):1080-1088.
[9] 张伟杰,常亚青,赵冲,等.虾夷马粪海胆表型性状对性腺性状的影响效果分析[J].渔业科学进展,2010,31(3):49-55.
[10] 周遵春,包振民,董颖,等.MYP基因在中间球海胆及杂交海胆生殖腺不同发育时期的转录表达差异[J].遗传,2008,30 (11):1453-1458.
[11] Wang Yajun,Ge Wei.Cloning of zebrafish ovarian P450c17 (CYP17,17α-hydroxylase/17,20-lyase)and characterization of its expression in gonadal and extra-gonadal tissues[J].Gen Comp Endocrinol,2004,135:241-249.
[12] 冷欣夫,邱星夫.细胞色素P450酶系的结构、功能与应用前景[M].北京:科学出版社,2001.
[13] Halm S,Kwon J Y,Rand-Weaver M,et al.Cloning and gene expression of P450 17α-hydroxylase,17,20-lyase cDNA in the gonads and brain of the fathead minnow Pimephales promelas[J].Gen Comp Endocrinol,2003,130:256-266.
[14] 陈彩芳,温海深,何峰,等.程序化设计的简并引物克隆半滑舌鳎CYP17基因[J].中国海洋大学学报,2009,39(6):1213-1218.
[15] Kazeto Y,Ijiri S,Todo T,et al.Molecular cloning and characterization of Japanese eel ovarian P450c17(CYP17)cDNA[J].Gen Comp Endocrinol,2000,118:123-133.
[16] 萨姆布鲁克,弗里奇E F,曼尼阿蒂斯 T.分子克隆实验指南[M].2版.金冬雁,黎孟枫,侯云德,等译.北京:科学出版社, 1998.
[17] Guo Xiaoli,Liu Yang,Qiu Xuemei,et al.Cloning and Sequence Analysis of a cDNA of P450 17α-hydroxylase/17,20-lyase (CYP17)from Strongylocentrotus nudus[C]//IEEE Proceedings of The 4th International Conference on Bioinformatics and Biomedical Engineering.Chengdu:IEEE.2010.IEEE Xplore:1-4.
[18] 仇雪梅,吴领知,郭晓黎,等.虾夷马粪海胆CYP51基因cDNA的克隆及其SNPs分析[J].大连海洋大学学报,2012,27(4): 294-299.
[19] 郭晓黎,仇雪梅,常亚青,等.虾夷马粪海胆CYP17基因的克隆及其表达差异[J].大连海洋大学学报,2013,28(1):1-6.
[20] 单雪,王秀利,仇雪梅.分子标记及其在海洋动物遗传研究中的应用[J].生物技术通讯,2005,16(4):463-466.
[21] 张丽,仇雪梅,王娟,等.红鳍东方鲀(Takifugu rubripes)MC4R基因的多态性分析[J].生物技术通报,2012,23(7):97-102.
[22] 葛辉,王秀利,仇雪梅,等.海胆Runk基因保守序列的克隆与初步分析[J].生物技术通报,2007,18(4):125-127.
[23] Wang Xiuli,Qiu Xuemei,Meng Xiangying,et al.Preliminary study on polymorphism analysis of SpRunt-1gene by PCR-SSCP in Strongylocentrotus intermedius and its association with growth traits[J].Molecular Biology Reports,2010,37(1):411-415.
[24] He C,Chen L,Simmons M,et al.Putative SNP discovery in interspecific hybrids of catfish by comparative EST analysis[J].Anim Genet,2003,34(6):445-448.
[25] Wang X L,Meng X Y,Song B,et al.SNPs in the myostatin gene of the mollusk Chlamys farreri:association with growth traits[J]. Comp Biochem Physiol B Biochem Mol Biol,2010,155(3):327-330.
[26] Li L,Zhao J,Wang L,et al.The polymorphism of lysozyme gene in Zhikong scallop(Chlamys farreri)and its association with susceptibility/resistance to Listonella anguillarum[J].Fish&Shellfish Immunol,2009,27(2):136-142.
SNPs screening and genetic analysis of CYP17 gene in sea urchin Strongylocentrotus nudus
ZHU Lin-lin1,2,WANG Xiu-li1,2,WANG Hong-di2,GUO Xiao-li2, CHANG Ya-qing1,2,LIU Yang2,QIU Xue-mei1,2
(1.Key Laboratory of Mariculture&Stock Enhancement in North China's Sea,Ministry of Agriculture,Dalian Ocean University,Dalian 116023, China;2.College of Fisheries and Life Science,Dalian Ocean University,Dalian 116023,China)
Abstract:SNPs of 17α-hydroxylase/17,20-lyase gene were detected by PCR-single strand conformation polymorphism and genetic diversity was analyzed based on the SNPs in sea urchin Strongylocentrotus nudus.The results showed that there were three SNPs in the 270 nt nucleotide,the 417 nt nucleotide and the 666 nt nucleotide of open reading frame of CYP17 cDNA,namely G270A,A417G and C666T.The first tow mutations were found in primer pairs BF/BR,and the last mutation was located in primer pairs CF/CR.The PCR production of primer pairs BF/ BR formed genotypic AA,BB and AB,with frequency of 0.54 in Allele A and 0.46 in Allele B.The frequencies were found 0.30 in genotypic AA,0.48 in genotypic BB and 0.22 in genotypic AB.The primer pairs BF/BR revealed that the heterozygosity was 0.496 8,homozygosity 0.503 2,polymorphism information content 0.373 4 and 1.987 3 allele number of the locus.Similarly,the PCR production of primer pairs CF/CR formed genotypic CC and CD with the frequencies of 0.68 in Allele C and 0.32 in Allele D.The genotypic CC had frequency of 0.84 and the CD showed requency of 0.16.By the primer pairs CF/CR,there were the heterozygosity of 0.268 8,homozygosity of 0.731 2,polymorphism information content of 0.232 7 and the locus allele number of 1.367 6.The genetic analysis indicated that the two loci belonged to lower PIC,and the population heterozygosity was lower,with higher genetic consistency.The three SNPs are the base for further study of CYP17 gene in the sea urchin growth and development in future.
Key words:Strongylocentrotus nudus;17α-hydroxylase/17,20-lyase gene;single nucleotide polymorphisms;genetic analysis
中图分类号:S917
文献标志码::A
文章编号:2095-1388(2013)04-0373-05
收稿日期:2013-05-14
基金项目:国家 “863”计划重大项目 (2012AA10A412);国家自然科学基金资助项目 (31101923);辽宁省自然科学基金资助项目(20102043);辽宁省百千万人才工程项目 (2010921093);大连海洋大学科研项目 (2012HYDX02)
作者简介:朱琳琳 (1987-),女,硕士研究生。E-mail:zhulinlinxuxu@163.com
通信作者:王秀利 (1964-),男,博士,教授。E-mail:xlwang@dlou.edu.cn