摘要:以2011年通过双列杂交方式建立的18个蛤仔Ruditapes philippinarum白斑马正反交家系为基础材料,从中筛选出5个具有优良性状的家系子一代,建立全同胞家系子二代近交家系A2、B2、C2、D2、E2,并设立对照组O2(混交家系),比较各近交家系的生长和存活情况,计算近交衰退率,并对各家系进行了综合评价。结果表明:幼虫期,除3日龄外,对照组O2蛤仔的壳长普遍略大于其他家系,但近交衰退现象不明显;A2家系的存活率最高,其他家系的近交衰退率为4.56% ~36.27%。稚贝期,各家系生长速度差异很大,各家系近交衰退明显,除C2家系外,各家系的近交衰退率为0.54% ~20.00%;A2家系存活率仍然最高,C2家系存活率略高于对照组O2,B2、D2和E2家系的近交衰退率分别为27.86%、12.18%和10.92%。综合分析表明,蛤仔白斑马近交家系中C2为生长快的家系,A2为存活率高的家系。
关键词:蛤仔;白斑马品系;家系选择;近交;近交衰退
家系选择是动植物遗传改良的有效方法。以家系为单位进行选择,将具有目标性状的家系选择出来,通过家系内连续的近交方式,最终选出理想的近交系 (即家系选择),然后可以利用这些纯系或近交系来组配出性状优良的杂交种[1]。这种方法在玉米、小麦和水稻的遗传改良中已经取得了显著效果[2]。海洋贝类遗传育种的研究起步较晚,目前,一些学者通过杂交育种和选择育种的方法对牡蛎 Crassostrea virginica[3]、扇贝 Agopecten irradians irradians[4]、硬壳贝 M.mercenaria进行遗传改良,旨在培育出性状优良的新品种[5]。而有关贝类近交系或纯系选育方面的研究还相对较少[6-8]。家系选择的实质是对基因型的选择[9],家系内近交使隐性有害基因纯合、暴露,引起近交衰退现象。另一方面,生活力及生长性状的显性基因也得到纯合机会,这是对育种有利的一面。
本研究中,作者采用家系选择的方法,从已建立的蛤仔Ruditapes philippinarum白斑马杂交家系中,选择生长快和存活率高的家系,建立全同胞家系子二代近交家系,比较了各近交家系的生长和存活情况,并计算了近交衰退率,以期为蛤仔养殖新品种的培育提供参考。
1.1 材料
以2011年建立的18个蛤仔白斑马正反交家系为基础材料,从中筛选出5个具有优良性状的家系子一代,记为A1、B1、C1、D1、E1。白斑马家系是以生长快的白蛤和抗逆性强的斑马蛤[10]为亲本建立的杂交家系。其子一代在大连海量水产食品有限公司的土池中进行生态促熟。由于土池中无涨潮、落潮等海况的剧烈变化,性腺始终保持成熟状态而不产卵[11],这样可以控制产卵时间,保证产卵质量。
1.2 方法
1.2.1 试验设计 全同胞近交系数的计算公式为
其中:Fx为近交系数;n1为共同祖先与该个体父本间的世代间隔数;n2是共同祖先与该个体母本间的世代间隔数;FA是共同祖先本身的近交系数。在全同胞家系子二代近交家系中,n1=1,n2=1,FA= 0,由公式得Fx=0.125。
2012年7月8日,性腺已发育成熟,从每个家系中随机抽取30个个体用以产卵,为了保证30个亲本都可以排精产卵,根据常见滩涂贝类家系建立方法[12],蛤仔繁殖群体数量越多,越有利于亲本的产卵排精,可将各家系亲本集中诱导产卵,在集中产卵排精时再将各家系的亲本分开产卵,以达到预期的效果。具体方法是将亲本阴干8 h,流水刺激0.5 h后,将各家系亲本分别放在网袋里,统一放到一个盛满新鲜海水的100 L大白塑料桶中,海水水温为26℃,盐度为28,pH为8.0。当有少量亲本产卵排精时,让其继续进行,以便对其他亲贝起性诱导作用。当发现大部分亲贝开始产卵排精时,将各家系从桶中取出,桶中留下的受精卵作为对照组。再将各家系亲贝用淡水洗净,分别放入准备好的盛满新鲜海水的大白桶中继续产卵排精,最终建立5个近交家系和1个混交家系,全同胞子二代近交家系与全同胞家系子一代相对应,分别命名为A2、B2、C2、D2、E2,混交家系作为对照组命名为O2。为了减小试验误差,每个家系设立3个重复。
1.2.2 幼虫和稚贝的培育 培育期间,试验用水为沙滤海水,水温为22~25℃,盐度为28~29, pH为7.8~8.0。幼虫和稚贝在80 L塑料桶中培育,幼虫密度为6~8个/mL,每2 d全量换水1次,为避免不同家系蛤仔的混杂,每组换水后将筛绢网用淡水冲洗。每天投饵2次,饵料前期为金藻,变态后投喂小球藻,根据幼虫和稚贝的摄食情况适当增减饵料量,保持水中有足量的饵料。为了消除培育密度的影响,在培育阶段每3 d对密度进行一次调整,使各个家系密度基本保持一致。各个家系分桶培育,严格隔离。30日龄后,分别将各家系蛤仔从80 L塑料桶中转入对角线长为500 μm的筛绢网袋,每袋数量为400~500粒,挂于生态池中进行中间育成。每7 d更换一次网袋,随着蛤仔的生长,逐渐更换为对角线长为1 mm的网袋,每袋蛤仔数量调整为100~150粒,继续在生态池中养成。
1.3 数据处理
使用单因素方差分析及多重比较检验 (LSD方法)法进行近交家系及混交家系的壳长、存活率比较;采用T检验法对近交家系做近交衰退比较。采用GLM法 (最小二乘法拟合广义线性模型)和均方TypeⅢ蛤仔对生长和存活的各原因组分进行分析。各原因组分包括:日龄,各家系间,重复组,日龄与各家系间的交互作用,各家系内日龄与各重复组的交互作用,随机误差。简化模型[13]为
其中:Yijkm为第i日龄、第j个全同胞家系、第k个重复的平均壳长或存活率;μ为固定效应;Ai为日龄原因组分(i=1,2,3);Ej为各家系间原因组分 (j=1,2,3);REk(j)为家系内重复组间原因组分 (k=1,2,3);AEij为日龄与各家系间的交互作用;Ai×Ek(j)为各家系内日龄与各重复组的交互作用;em(ijk)为随机误差 (m=1,…,30)。
根据各近交家系与对照组在不同日龄的壳长和存活率,估算近交家系 (Fx=0.125)幼虫期、稚贝期、养成期生长和存活的近交衰退率,计算公式如下:
ID(%)=1-Sx/Px×100,
其中:Sx、Px分别表示试验组、对照组的表型值。
幼虫期和稚贝期生长和存活的近交衰退率分别为幼虫期和稚贝期各日龄的平均近交衰退率。使用Excel作图。试验数据处理使用SPSS软件进行,显著性水平设为0.05。
2.1 近交家系蛤仔的生长
各近交家系蛤仔子二代在幼虫期、稚贝期的生长情况见表1。以不同家系混产所建立的对照组O2在各时期的生长数据,与张跃环等[14]所研究的大连群体的数据基本一致,说明对照组的建立方法是恰当的。幼虫期,3日龄各家系壳长大小顺序为A2>C2>B2>O2>E2>D2,仅A2家系与O2家系差异显著 (P<0.05),其余各家系与O2家系均无显著性差异 (P>0.05);6日龄各家系壳长大小顺序为C2>O2>A2>E2>D2>B2,仅B2家系与O2家系差异显著 (P<0.05),其余各家系与O2家系均无显著性差异 (P>0.05);9日龄各家系壳长大小顺序为A2>E2>D2>O2>C2>B2,仅B2家系与O2家系差异显著 (P<0.05),其余各家系与O2家系均无显著性差异 (P>0.05)。稚贝期,30日龄各家系壳长大小顺序为A2>C2>O2>B2>E2>D2,A2、D2、E2与O2家系差异显著 (P<0.05),其余各家系与O2家系均无显著性差异 (P>0.05);60日龄各家系壳长大小顺序为C2>O2>A2>B2>E2>D2,各家系均与O2家系差异显著 (P<0.05);90日龄各家系壳长大小顺序为C2>B2>O2>A2>E2>D2,D2、E2家系与O2家系差异显著 (P<0.05),其余家系与O2家系均无显著性差异 (P<0.05)。
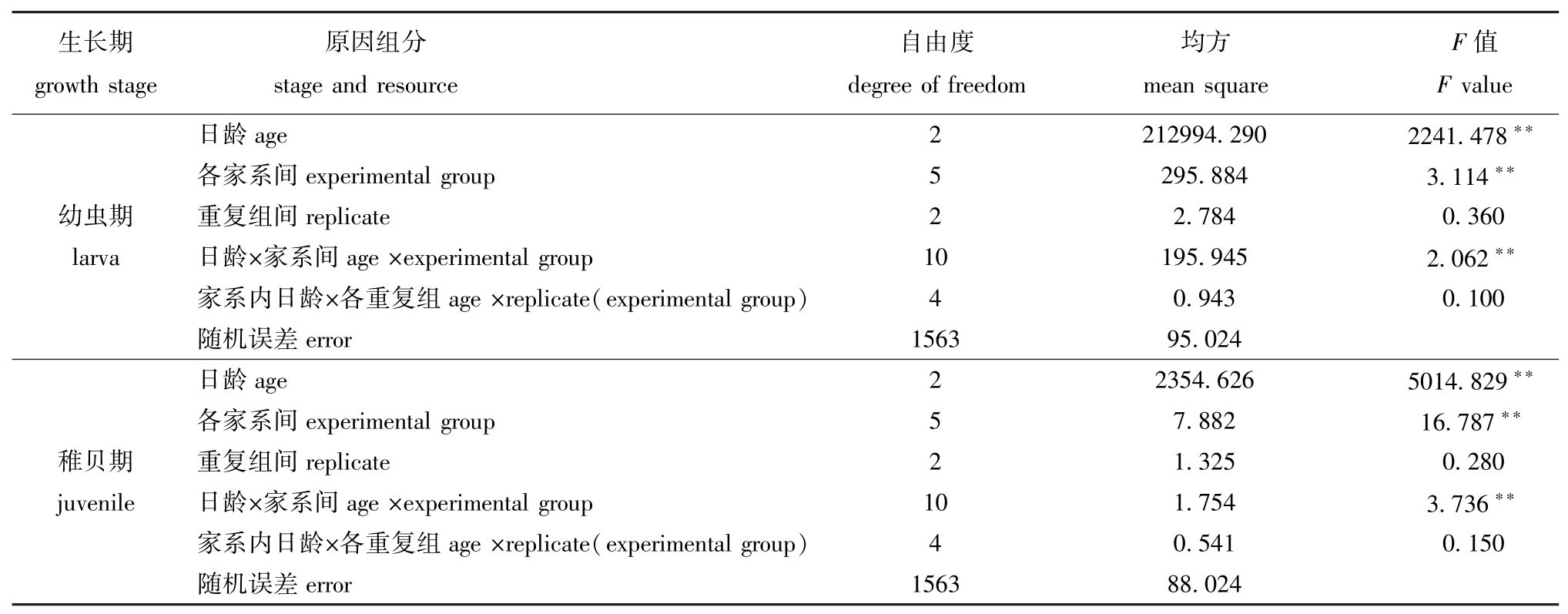
对蛤仔两个时期壳长的原因组分进行方差分析(表2),结果表明:在幼虫期和稚贝期,日龄、家系间以及二者的交互作用组分对蛤仔幼虫期及稚贝期的生长影响极显著 (P<0.01);但重复组及近交家系内重复组与日龄交互作用对蛤仔幼虫期及稚贝期的生长影响不显著 (P>0.05)。重复组对幼贝生长的影响不显著 (P>0.05)。
表1 近交家系不同阶段蛤仔个体的壳长
Tab.1 Shell length in the inbred families and mictic lines of the Manila clam during larval and juvenile period mm

注:同列中标有不同小写字母者表示组间有显著性差异 (P<0.05),标有相同小写字母者表示组间无显著性差异 (P>0.05),下同。
Note:The means with different letters within the same column are significant differences at the 0.05 probability level,and the means with the same letters within the same column are not significant differences,et sequentia.
家系family幼虫期larvae 3日龄day 3 6日龄day 6 9日龄day 9稚贝期juvenile 30日龄day 30 60日龄day 60 90日龄day 90 O2139.33±9.07bc193.00±11.19a207.33±7.40ab0.85±0.15bc4.19±0.15b8.16±1.09abA2145.00±7.92a192.33±10.40ab209.33±8.28a0.95±0.24a3.66±0.37c8.10±1.03abcB2140.67±7.63bc186.67±13.73b202.33±8.58c0.81±0.14cd3.63±0.36c8.20±1.45abC2143.00±6.51ab194.33±14.31a203.67±10.66bc0.91±0.25ab4.47±0.55a8.55±1.05aD2136.83±8.75c190.33±9.64ab207.67±9.71ab0.58±0.06e3.49±0.34c7.22±0.82dE2138.67±8.19c190.67±11.43ab208.00±8.05ab0.73±0.14d3.54±0.37c7.83±1.02cd
表2 6个近交家系子二代幼虫期、稚贝期蛤仔壳长原因组分的方差分析
Tab.2 Analysis of variance components for shell length in the inbred families of the Manila clam during larval and juvenile period
注:*表示有显著性差异 (P<0.05);**表示有极显著性差异 (P<0.01),下同。
Note:*means significant difference(P<0.05);**means very significant difference(P<0.01),et sequentia.
生长期growth stage原因组分stage and resource自由度degree of freedom均方mean square F值F value日龄age 2 212994.290 2241.478**各家系间experimental group 5 295.884 3.114**幼虫期 重复组间replicate 2 2.784 0.360 larva 日龄×家系间age×experimental group 10 195.945 2.062**家系内日龄×各重复组age×replicate(experimental group) 4 0.943 0.100随机误差error 1563 95.024日龄age 2 2354.626 5014.829**各家系间experimental group 5 7.882 16.787**稚贝期 重复组间replicate 2 1.325 0.280 juvenile 日龄×家系间age×experimental group 10 1.754 3.736**家系内日龄×各重复组age×replicate(experimental group) 4 0.541 0.150随机误差error 1563 88.024
2.2 近交家系蛤仔的存活率
各近交家系蛤仔在幼虫期3、6、9日龄,稚贝期30、60、90日龄的存活情况见表3。幼虫期, A2家系的存活率最高,其他家系的存活率普遍低于O2家系,3日龄时,B2、E2家系与O2家系差异显著 (P<0.05),6日龄时,除C2家系外,其他家系均与O2家系差异显著 (P<0.05)。稚贝期, A2家系存活率仍然最高,且与其他家系差异显著(P<0.05),C2家系略高于O2,但差异不显著 (P>0.05),其他家系均低于O2。
对蛤仔两个时期存活的原因组分进行方差分析(表4),结果表明:幼虫期和稚贝期,日龄、家系间以及二者的交互作用对蛤仔幼虫及稚贝存活的影响极显著 (P<0.01);重复组对幼虫及稚贝存活的影响不显著 (P>0.05)。幼虫期,日龄组分对存活性状的影响大于各家系间组分;稚贝期,各家系间组分对存活的影响大于日龄组分,重复组间、家系内重复组与日龄交互作用对蛤仔幼虫及稚贝存活的影响均不显著 (P>0.05)。
2.3 近交家系蛤仔生长和存活的衰退率
各近交家系蛤仔生长的衰退情况见图1。在幼虫期,各近交家系的生长并未表现出明显的衰退现象,仅B2、D2、E2家系表现出近交衰退,衰退率分别为1.58%、1.11%和0.4%。在稚贝期,各近交家系生长的衰退明显,除C2家系外,其余家系的近交衰退率为0.54%~20.00%。
表3 近交家系不同阶段蛤仔的存活率
Tab.3 Survival in the inbred families and mictic lines of the Manila clam during larval and juvenile period %
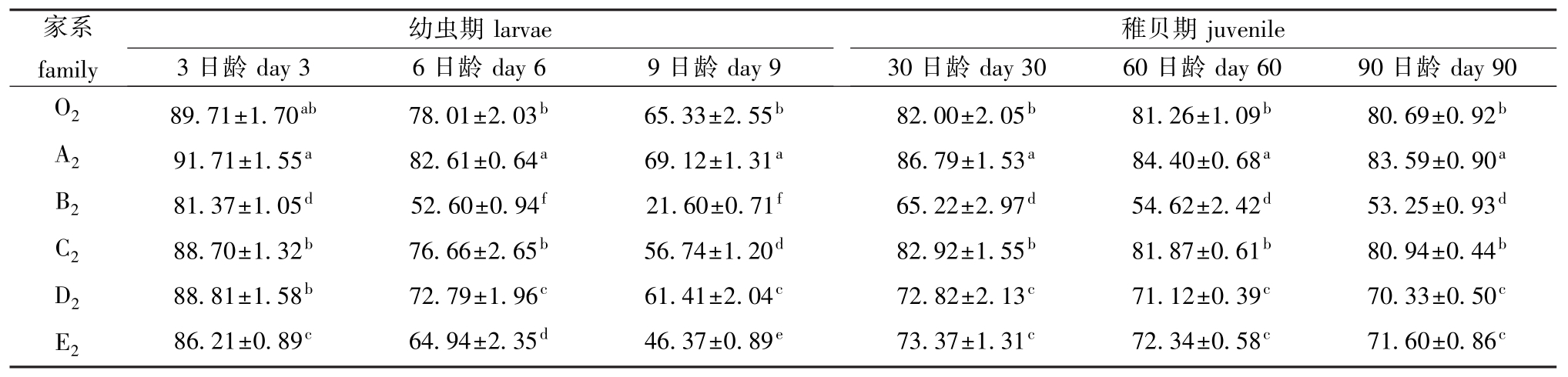
家系family幼虫期larvae 3日龄day 3 6日龄day 6 9日龄day 9稚贝期juvenile 30日龄day 30 60日龄day 60 90日龄day 90 O2 A2 B2 C2 D2 E2 89.71±1.70ab91.71±1.55a81.37±1.05d88.70±1.32b88.81±1.58b86.21±0.89c78.01±2.03b82.61±0.64a52.60±0.94f76.66±2.65b72.79±1.96c64.94±2.35d65.33±2.55b69.12±1.31a21.60±0.71f56.74±1.20d61.41±2.04c46.37±0.89e82.00±2.05b86.79±1.53a65.22±2.97d82.92±1.55b72.82±2.13c73.37±1.31c81.26±1.09b84.40±0.68a54.62±2.42d81.87±0.61b71.12±0.39c72.34±0.58c80.69±0.92b83.59±0.90a53.25±0.93d80.94±0.44b70.33±0.50c71.60±0.86c
表4 6个近交家系子二代幼虫期、稚贝期存活率原因组分的方差分析
Tab.4 Analysis of variance components for survival in the inbred families of the Manila clam during larval and juvenile period
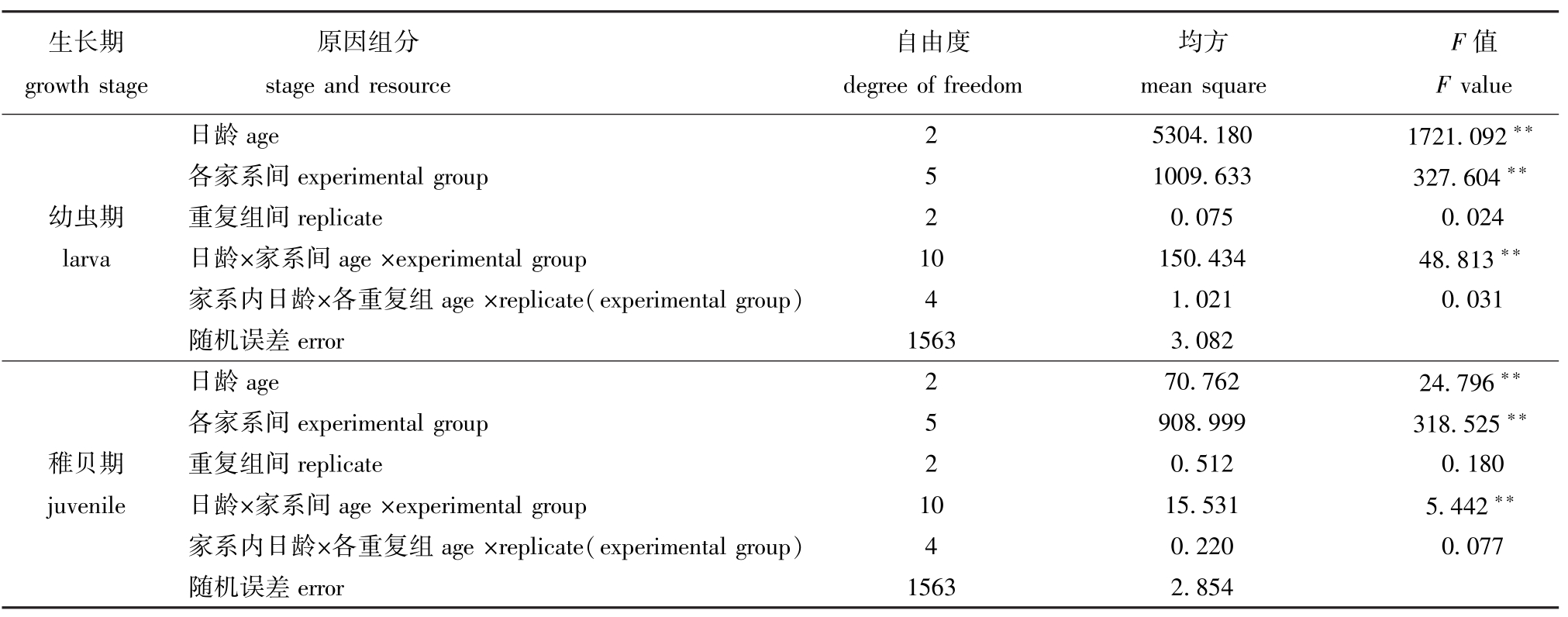
生长期growth stage原因组分stage and resource自由度degree of freedom均方mean square F值F value日龄age 2 5304.180 1721.092**各家系间experimental group 5 1009.633 327.604**幼虫期 重复组间replicate 2 0.075 0.024 larva 日龄×家系间age×experimental group 10 150.434 48.813**家系内日龄×各重复组age×replicate(experimental group) 4 1.021 0.031随机误差error 1563 3.082日龄age 2 70.762 24.796**各家系间experimental group 5 908.999 318.525**稚贝期 重复组间replicate 2 0.512 0.180 juvenile 日龄×家系间age×experimental group 10 15.531 5.442**家系内日龄×各重复组age×replicate(experimental group) 4 0.220 0.077随机误差error 1563 2.854

图1 各近交家系生长的衰退情况
Fig.1 Inbreeding depression for trait in shell length in each family
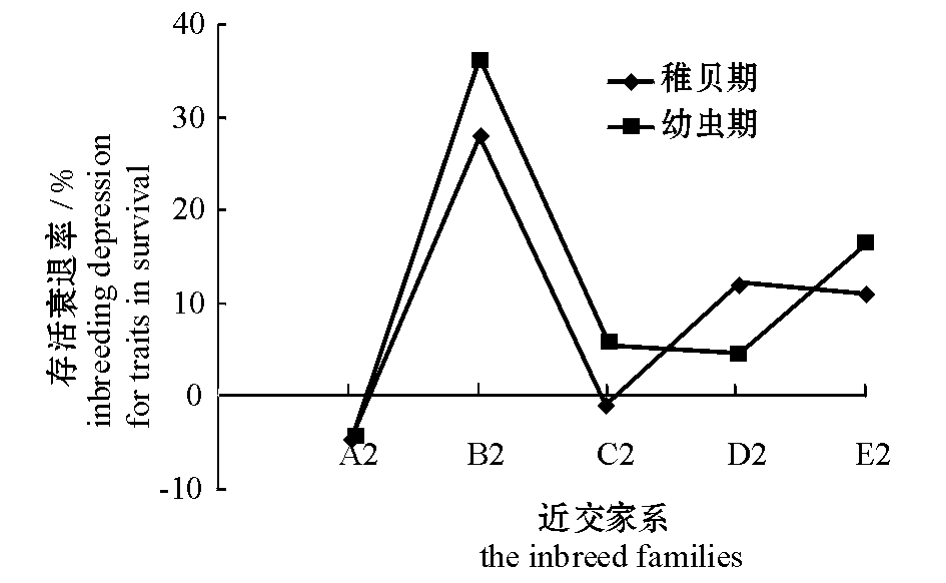
图2 各近交家系存活的衰退情况
Fig.2 Inbreeding depression for trait in survival in each family
各近交家系蛤仔存活的衰退情况见图2。在幼虫期,各近交家系蛤仔的存活普遍表现出一定的近交衰退,除A2家系外,其余家系的近交衰退率为4.56%~36.27%。在稚贝期,这种情况依然存在,但C2家系基本不衰退,B2、D2、E2的近交衰退率分别为27.86%、12.18%、10.92%。在幼虫期和稚贝期,A2家系一直没表现出衰退现象,B2家系衰退率一直最高。
家系选择及近交是水产育种工作中比较常见和有效的方法,该方法在牡蛎、贻贝、海湾扇贝、马氏珠母贝等品种的遗传改良上得到了应用[16-19],并取得了较好的效果。本研究中以2011年通过双列杂交方式建立的18个蛤仔白斑马正反交家系为基础材料,从中筛选出5个具有优良性状的家系子一代,并通过家系近交的方式获得了5个家系子二代。家系近交的后代在一定程度上会出现近交衰退现象 (近交衰退一般是指近交导致子代与繁殖或生理机能相关的性状平均值降低的现象)。利用雌雄同体的贝类建立自交家系研究近交衰退的结果都表明,自交后代的存活率和生长速度显著下降,表现出严重的近交衰退[7,19-21]。而利用全同胞家系研究近交衰退的结果并不一致,可能是选择对近交起了作用。Longwell等[22]报道了美洲牡蛎C.virginica全同胞交配 (F=0.25)后代的存活率和生长速度显著降低,而Mallet等[23]却发现这种牡蛎全同胞家系幼虫的存活率都大于对照组,幼虫和早期稚贝的生长没有差异,但稚贝的生长存在6%~10%的近交衰退。Lannan[24]发现,长牡蛎C.gigas全同胞家系幼虫的存活率并没有衰退,而这种动物的全同胞后代在壳的大小、肉的湿质量和干质量等方面都显著小于对照组,近交衰退显著。类似的结果也见于选择快速生长的硬壳蛤家系以及选择抗病的美洲牡蛎家系。本研究中的5个家系,幼虫期时,生长方面并未表现出明显的近交衰退,存活方面除A2家系外,近交衰退为4.56% ~36.27%。在稚贝期,C2家系的生长未表现出衰退,其他家系衰退率为0.54%~20.00%;存活率方面,A2家系存活率依然最高,没出现衰退,C2家系基本未衰退,剩余家系衰退比较明显。各近交家系在不同时期生长和存活的近交衰退并不一致,近交衰退率的变化依赖于近交水平、相关的遗传基础 (即显性与超显性)、有贡献基因位点数和这些位点上等位基因的变化[22]。近交衰退对不同物种及同种不同群体的影响存在一定差异,这可能是由于其不同的近交方式和不同的遗传负荷造成的。
关于近交衰退的解释,大部分学者支持部分显性假说[25]:近交后代较低的适合度是由于在杂合状态下它们被显性等位基因所掩盖了的有害隐性或部分隐性等位基因在纯合子中表达出来,并被自然选择所淘汰。绝大多数的试验证据都认为,近交衰退主要源自于部分隐性等位基因的纯合表达[26],杂合度低的群体有较低的近交衰退率,杂合度高的群体有较高的近交衰退率[27],这与部分显性假说一致。本试验中,幼虫期的各家系并未出现明显的衰退,也未表现出生长优势,说明控制生长的基因杂合度处于低的水平,但是控制存活的基因杂合度较高,表现出了较高的存活衰退。然而到了稚贝期,各家系的生长却出现了衰退,存活率方面也表现为衰退,这可能与外界环境有关,因为从稚贝开始,各家系蛤仔挂于虾池里的网袋中培育,环境变化比较激烈。由于近交增加了群体对环境的敏感性[28],这种敏感性的增强表明了有害突变基因在某些环境中表达的增强或更多的有害等位基因得到了表达,也反映出这些群体内的加性遗传变异减少,从而在自然选择的过程中使它们降低了适应环境变化的能力,由此导致生长速度和存活率的下降。C2家系在幼虫和稚贝期的生长一直未出现衰退,说明其自身生长性状纯合度较高,自然选择对其净化作用很小,由于其生长速度快,当移到室外培育时,对环境适应能力强,从而导致在稚贝期时,C2家系的存活也未出现衰退;A2家系一直表现出最高的存活率,经过两代的家系选择,控制存活的基因纯合度增加,杂合度很低,因此,对A2家系存活性状的选择是很成功的。
参考文献:
[1] 张国范,刘晓,阙华勇,等.贝类杂交及杂种优势理论和技术研究进展[J].海洋科学,2004,28(7):54-60.
[2] Jones D F.Dominance of linked factors as a means of accounting for heterosis[J].Genetics,1918,2:466-479.
[3] Newkirk G F.Interaction of genotype and salinity in larvae of the oyster Crassostrea virginica[J].Mar Biol,1978,48(3):227-234.
[4] Zheng H P,Zhang G F,Liu X,et al.Different responses to selection in two stocks of the bay scallop,Argopecten irradians irradians Lamarck(1819)[J].Exp Mar Biol Ecol,2004,313:213-223.
[5] Lionel D,Bruno E,Edouard B,et al.Summer mortality of hatchery-produced Pacific oyster spat(Crassostrea gigas):I.Estimation of genetic parameters for survival and growth[J].Aquaculture,2007,262:41-45.
[6] Hedgecock D,McGoldrick D J,Bayne B L.Hybrid vigor in Pacific oysters:an experimental approach using crosses among inbred lines [J].Aquaculture,1995,137:285-298.
[7] 张国范,刘述锡,刘晓,等.海湾扇贝自交家系的建立与自交效应[J].中国水产科学,2003,10(6):441-445.
[8] 高鑫,闫喜武,张辉,等.蛤仔南北方养殖群体杂交子代早期生长发育的研究[J].大连海洋大学学报,2013,28(1):39-43.
[9] 范兆廷.水产动物育种学[M].北京:中国农业出版社,2005: 72-74.
[10] 霍忠明,张跃环,金晶字,等.不同壳色菲律宾蛤仔生长发育比较[J].大连水产学院学报,2008,23(增刊):1-5.
[11] 闫喜武,张跃环,左江鹏,等.北方沿海四角蛤蜊人工育苗技术的初步研究[J].大连水产学院学报,2008,23(5):348-352.
[12] 闫喜武,张跃环,霍忠明,等.常见滩涂贝类的家系建立方法:中国.200810013220.2[P].2009-01-21.
[13] Ibarra A M,Ramirez J L,Ruiz C A,et al.Realized heritabilities and genetic correlation after dual selection for total weight and shell width in catarina scallop Argopecten circularis[J].Aquaculture, 1999,175:227-241.
[14] 张跃环,闫喜武,霍忠明,等.不同地理群体菲律宾蛤仔生长发育的比较[J].大连水产学院学报,2009,24(1):34-39.
[15] Beatie J H,Hershberger W K,Chew K K,et al.Breeding for resistance to summertime mortality in the Pacific oyster Crassostrea gigas[M].WSG:Washington Sea Grant Rep,1978:780-813.
[16] Innes D J,Halev L E.Inheritance of a shell-color polymorphism in the mussel[J].Journal of Heredity,1977,68(3):203-204.
[17] Zheng H P,Zhang G F,Liu X,et al.Establishment of different shell color lines of bay scallop Argopecten irradians irradians Lamarck(1819)and their development[J].Oceanologia et Limnologia Sinica,2003,34(6):632-638.
[18] He M X,Guan Y Y,Lin Y G,et al.Growth comparison between families of pearl oyster Pinctada martensii Dunker[J].Journal of Tropical Oceanography,2007,26(1):39-43.
[19] 张海滨.海湾扇贝近交生物学效应和遗传改良研究[D].青岛:中国科学院海洋研究所,2005.
[20] 郑怀平.海湾扇贝两个养殖群体数量性状及壳色遗传研究[D].青岛:中国科学院海洋研究所,2005.
[21] 郑怀平,许飞,张国范,等.海湾扇贝壳色与数量性状之间的关系[J].海洋与湖沼,2008,39(4):328-333.
[22] Longwell A C,Stiles S S.Gamete cross incompatlbility and inbreeding in the commercial American oyster,Crassostrea virginica Gmelin[J].Aquaculture,1973,38(3):521-533.
[23] Mallet A L,Haley L E.Growth rate and survival in pure population matings and crosses of the oyster Crassostrea virginica[J].Can J Fish Aquat Sci,1983,40:948-954.
[24] Lannan J E.Broodstock management of Crassostrea gigas:I.Genetic and environmental variation in survival in larval rearing system[J].Aquaculture,1980,21:323-336.
[25] Charlesworth D,Charlesworth B.Inbreeding depression and its evolutionary consequences[J].Annu Rev of Ecol and Systemat, 1987,18:237-268.
[26] Johnston M O,Schoen D J.On the measurement of inbreeding depression[J].Evolution,1994,48:1735-1741.
[27] Husband B,Schemske D W.Evolution of the magnitude and timing of inbreeding depression in plants[J].Evolution,1996,50: 1119-1126.
[28] 马大勇,胡红浪,孔杰.近交及其对水产养殖的影响[J].水产学报,2005,29(6):849-856.
The family selection and inbreeding effects of white zebra strains in Manila clam Ruditapes philippinarum
Abstract:The growth and survival were compared,and inbreeding depression rate were calculated in control group O2and full-sib family A2,B2,C2,D2,and E2of the second generation of Manila clam Ruditapes philippinarum screened from 18 white zebra strains reciprocal cross families by diallel crossing method in 2011.The results showed that there was larger shell length in larval stage(except in 3 day larvae)in the control group O2than that in the other families,without significant inbreeding depression on growth.The maximal survival was observed in family A2,and the inbreeding depression rate was ranged from 4.56%to 36.27%among each families.During the juvenile stage,however,the significantly different growth and inbreeding depression were found among each inbreeding family,except in C2,and with inbreeding depression rate from 0.54%to 20.00%.The maximal survival rate was observed in family A2during the juvenile stage,and there was higher survival rate in family C2than that in the control family,with inbreeding depression of 27.86%in family B2,12.18%in family D2,and 10.92%in family E2.It is concluded that the best grow family is of C2and high-survival family of A2.
Key words:Ruditapes philippinarum;white zebra strain;family selection;inbreeding;inbreeding depression
中图分类号:S968.31
文献标志码::A
文章编号:2095-1388(2013)04-0355-06
收稿日期:2012-12-23
基金项目:现代农业产业技术体系建设专项 (CARS-48);国家 “863”计划项目 (2012AA10A400)