低盐度下凡纳滨对虾饲料中蛋白质适宜含量的研究
陈思安,迟淑艳,梁才强,谢丽莉,郭淑珍,何艳婕,王文娟
(广东海洋大学水产学院,广东湛江524025)
摘要:研究了饲料中不同蛋白质水平对较低盐度 (20)下养殖的凡纳滨对虾Litopenaeus vannamei(平均体质量为0.35 g)生长性能和血液生化指标的影响,并探讨了该盐度下凡纳滨对虾饲料中适宜的蛋白质含量。试验设置25%、30%、35%、40%和45%(均为质量分数)5个饲料蛋白质水平,分别记为CP25、CP30、CP35、CP40、CP45组,每组设3个重复,每个重复放40尾虾。试验在300 L玻璃钢桶中进行,试验共进行56 d。结果表明:凡纳滨对虾的增重率和特定生长率随饲料蛋白质水平的增加均呈先升高后降低的趋势,其中CP40组对虾的增重率和特定生长率均最高,且CP35、CP40、CP45组的增重率和特定生长率均显著高于CP25组 (P<0.05);凡纳滨对虾血清总蛋白 (TP)、总胆固醇 (CHOL)和甘油三酯 (TG)含量随饲料蛋白质水平的增加呈先升高后降低的趋势,其中CP35组对虾的血清TP、CHOL和TG含量均最高,CP35组对虾的血清TP和CHOL含量均显著高于CP25组 (P<0.05);凡纳滨对虾鳃丝的Na+/K+-ATP酶活性随饲料蛋白质水平的增加呈先升高后降低的趋势,其中CP30、CP35组对虾鳃丝的Na+/K+-ATP酶活性最高,且显著高于其他3组 (P<0.05)。将饲料蛋白质水平与对虾增重率进行二次回归分析得出,在盐度为20的水体中养殖凡纳滨对虾获得最大增重率时,饲料中蛋白质的适宜含量为39.74%。
关键词:凡纳滨对虾;蛋白质水平;生长性能;血液生化指标;低盐度
凡纳滨对虾Litopenaeus vannamei是世界上养殖产量较高的三大优良虾品种之一。近年来,随着海洋养殖水域污染的日益严重以及对虾病害的流行,开展低盐度淡化养殖凡纳滨对虾被认为是较好的健康养殖方式。由于凡纳滨对虾具有广盐性,其淡化养殖也已成为内陆养殖的一个亮点。一些学者研究表明,凡纳滨对虾的养殖盐度分别为2~8[1]、4~8[2]、5和15[3]、 20[4-5]、 30[6]和33~40[7], 结合其生长状况考虑,适宜盐度主要集中在15~25。然而,李二超等[8]指出,内陆低盐度养殖凡纳滨对虾的中后期存在生长停滞、活力差、虾壳较薄、不易脱壳或脱壳不完全、虾体颜色较淡、体积大而质量轻、肌肉与壳之间有空隙、肌肉水分含量较高、蒸煮后易发生收缩、弹性和味道差、不耐运输和操作等问题,这主要与虾的渗透调控、免疫状况以及蛋白质利用率有关。
有研究表明,低盐度条件下凡纳滨对虾饲料中的蛋白质需要量在26.7% ~40.0%[9-10],差异较大。刘栋辉等[10]认为,饲料中蛋白质含量低于30%时会引起对虾的某些生理病变。因此,本试验中选择在水体盐度为20时,探讨饲料中不同蛋白质水平对凡纳滨对虾的生长性能和血液生化指标的影响,寻求低盐度水体养殖凡纳滨对虾时所需饲料的适宜蛋白质含量,以期为低盐度下养殖凡纳滨对虾的饲料开发提供营养方面的参考依据。
1 材料与方法
1.1 材料
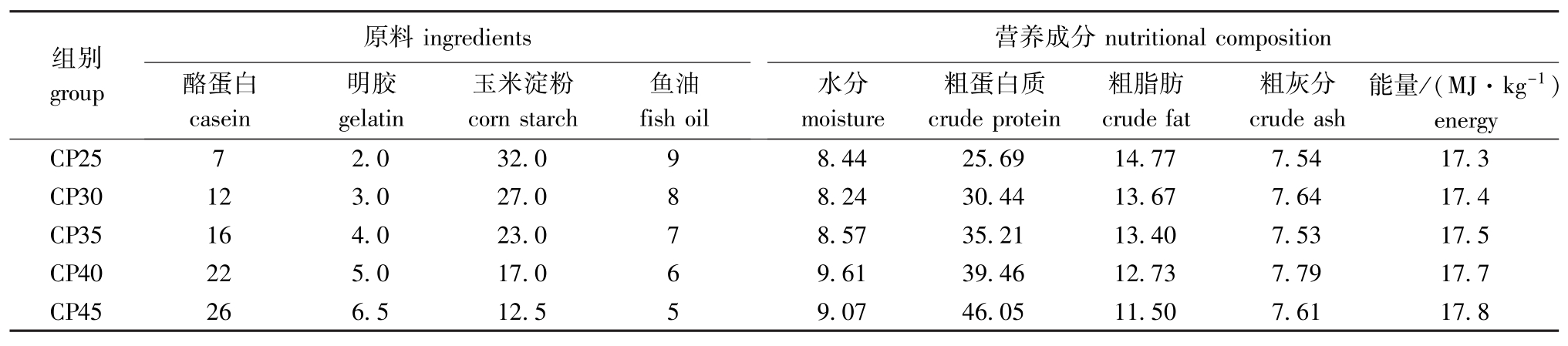
试验饲料以鱼粉、酪蛋白、明胶为主要蛋白源,配制蛋白质含量分别为25%、30%、35%、40%和45%的5种等能饲料,饲料原料经粉碎后过60目筛,采用逐渐扩大法混合均匀后制粒,然后风干,于-20℃下冷冻保存。饲料配方见表1。
1.2 方法
1.2.1 试验管理 试验用凡纳滨对虾购自茂名海兴农虾苗场,虾苗先在室内水泥池的海水中暂养一段时间,每天用经过充分曝气的自来水调低盐度2,直到盐度降至20,暂养期间投喂商业饲料。当凡纳滨对虾体质量达到0.35 g时,选择活泼健康的对虾进行试验。试验设5个处理组,分别记为CP25、CP30、CP35、CP40、CP45组,分别投喂5种不同的饲料,每组设3个重复,每个重复放40尾虾,分别在15个玻璃钢桶(300 L)中养殖。每天7:00、11:00、18:00、22:00饱食投喂试验饲料,根据天气和摄食情况调整投料量。养殖期间连续充气,水温为29~30℃,pH为7.5~8.5,溶氧为4~9 mg/L。每天记录死虾数量,及时称重。试验共进行8周,试验结束前24 h停止投喂。养殖试验在广东海洋大学东海岛海洋生物研究基地进行。
表1 饲料组成及营养成分
Tab.1 The ingredients and approximate composition of the test diets w/%
注:1)饲料 (均为质量分数,%)中还包括鱼粉28,磷脂2,纤维素14.45,胆固醇0.5,多维1,多矿2,磷酸二氢钙1.2,氯化胆碱0.3, VC(35%)0.05,褐藻酸钠0.2,食盐0.3; 2)复合维生素 (IU或mg/kg)中包括维生素A 15 000 IU,维生素D33 500 IU,维生素E 100.0,维生素K 10.0,维生素B150.0,维生素B260.0,维生素B6100.0,维生素B120.1,泛酸钙120.0,烟酸200.0,生物素1.0,肌醇300.0,叶酸10.0; 3)复合矿物质 (mg/kg)中包括七水硫酸镁409.4,七水硫酸亚铁301,七水硫酸锌442,五水硫酸铜100,一水硫酸锰63,碘化钾80,无水氯化钴500,亚硒酸钠40。
Note:1)The test diet(%):fishmeal 28,phospholipid 2,cellulose 14.45,cholesterol 0.5,vitamin premix 1,mineral premix 2,calcium dihydrogen phosphate 1.2,choline chloride 0.3,VC(35%)0.05,sodium alginate 0.2,and salt 0.3; 2)Vitamin premixture including(IU或mg/kg):vitamin A 15 000 IU,vitamin D33 500 IU,vitamin E 100.0,vitamin K 10.0,vitamin B150.0, vitamin B260.0,vitamin B6100.0,vitamin B120.1,Calcium pantothenate 120.0,niacin acid 200.0,biotin 1.0,inositol 300.0,folic acid 10.0; 3)Mineral premix including(mg/kg):MgSO4·7H2O 409.4,FeSO4·7H2O 301,ZnSO4·7H2O 442,CuSO4·5H2O 100,MnSO4·H2O 63, 80,CoCl2500,and Na2SeO340.
组别group原料ingredients酪蛋白casein明胶gelatin玉米淀粉corn starch鱼油fish oil营养成分nutritional composition水分moisture粗蛋白质crude protein粗脂肪crude fat粗灰分crude ash能量/(MJ·kg-1) energy CP25 7 2.0 32.0 9 8.44 25.69 14.77 7.54 17.3 CP30 12 3.0 27.0 8 8.24 30.44 13.67 7.64 17.4 CP35 16 4.0 23.0 7 8.57 35.21 13.40 7.53 17.5 CP40 22 5.0 17.0 6 9.61 39.46 12.73 7.79 17.7 CP45 26 6.5 12.5 5 9.07 46.05 11.50 7.61 17.8
1.2.2 样本的采集及测定
1)样品的采集。试验结束前24 h停止投喂。试验结束时,对每个重复的虾称重和计数,计算增重率和成活率。每桶选取6尾虾,用1 mL注射器从围心腔中抽血,将血液置于1.5 mL Eppendorf管中,于冰箱 (4℃)中静置过夜后离心,取上清液备用。
2)血清中生化指标的测定。采用蛋白定量(考马斯亮兰)试剂盒测定血清的总蛋白含量(mg/mL),采用甘油三酯 (TG)试剂盒测定甘油三酯的含量 (mmol/L),采用总胆固醇 (TC)试剂盒测定总胆固醇的含量 (mmol/L)。上述试剂盒均为南京建成生物工程研究所生产。
3)鳃丝Na+/K+-ATP酶活性的测定。试验结束后饥饿24 h,从每个桶中随机取5尾对虾,置于冰盘上解剖,取其鳃丝,用预冷双蒸水洗净,滤纸吸干后,置于无菌离心管中,于冰箱 (-20℃)内保存备用。将鳃丝样品加入9倍体积生理盐水制成100 mg/mL的组织匀浆,以1 500 r/min离心10 min,取上清液0.2 mL,加入0.8 mL生理盐水稀释成体积分数为20%的匀浆液待测。
按照南京建成生物公司生产的试剂盒说明书进行Na+/K+-ATP酶活性测定。并用考马斯亮兰法测定其组织蛋白质含量。以每小时每毫克鳃组织蛋白中ATP酶分解ATP产生1 μmol无机磷的量为一个ATP酶活力单位 [μmol/(mg·h)]。
4)生长指标的计算。
增重率(WG,%)=100×(Wt-W0)/W0,
成活率(SR,%)=100×Nt/N0,
特定生长率(SGR,%/d)=100×(ln Wt-ln W0)/t,
其中:Wt、W0分别为试验终末体质量和初始体质量 (g);Nt、N0分别为试验终末虾数和试验初始的虾数 (尾);t为试验时间 (d)。
1.3 数据处理
试验数据采用平均数±标准差表示,用 SPSS 11.5软件对数据进行单因素方差分析 (One-way ANOVA),采用Duncan氏法进行组间多重比较,显著性水平设为0.05。
2 结果
2.1 蛋白质水平对凡纳滨对虾生长性能的影响
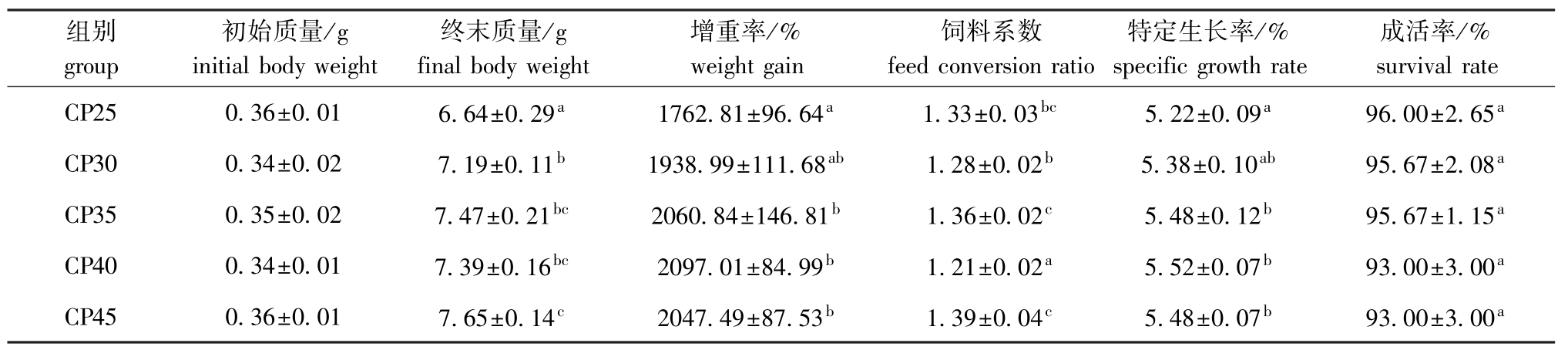
从表2可见:各处理组间对虾的成活率无显著性差异 (P>0.05);凡纳滨对虾的增重率和特定生长率随饲料蛋白质水平的增加均呈先升高后降低的趋势,其中CP40组对虾的增重率和特定生长率均最高,且CP35、CP40、CP45组的增重率和特定生长率均显著高于CP25组 (P<0.05),其余组间均无显著性差异 (P>0.05);饲料系数随饲料蛋白质水平的增加变化趋势不明显,其中CP40组饲料系数最低,显著低于其余各组 (P<0.05),CP30组显著低于CP35、CP45组 (P<0.05),其余组间均无显著性差异 (P>0.05)。将饲料蛋白质水平与对虾增重率进行二次回归分析得出,盐度为20的条件下,凡纳滨对虾获得最大增重时饲料的适宜蛋白质水平为39.74%(图1)。
表2 不同蛋白质水平饲料组凡纳滨对虾生长性能的变化 (盐度为20,平均值±标准差,n=3)
Tab.2 Effecs of dietary protein levels on growth performance of Pacific white leg shrimp Litopenaeus vannamei at salinity 20(mean±S.D.,n=3)
注:同列中标有不同小写字母者表示组间有显著性差异 (P<0.05),标有相同小写字母者表示组间无显著性差异 (P>0.05),下同。
Note:The means with different letters within the same column are significant differences at the 0.05 probability level,and the means with the same letters within the same column are not significant differences,et sequentia.
组别group初始质量/g initial body weight终末质量/g final body weight增重率/% weight gain饲料系数feed conversion ratio特定生长率/% specific growth rate成活率/% survival rate CP25 0.36±0.01 6.64±0.29a1762.81±96.64a1.33±0.03bc5.22±0.09a96.00±2.65aCP30 0.34±0.02 7.19±0.11b1938.99±111.68ab1.28±0.02b5.38±0.10ab95.67±2.08aCP35 0.35±0.02 7.47±0.21bc2060.84±146.81b1.36±0.02c5.48±0.12b95.67±1.15aCP40 0.34±0.01 7.39±0.16bc2097.01±84.99b1.21±0.02a5.52±0.07b93.00±3.00aCP45 0.36±0.01 7.65±0.14c2047.49±87.53b1.39±0.04c5.48±0.07b93.00±3.00a
2.2 蛋白质水平对凡纳滨对虾血清指标的影响
从表3可见:凡纳滨对虾血清总蛋白 (TP)、总胆固醇 (CHOL)和甘油三酯 (TG)含量随饲料蛋白质水平的增加呈先升高后降低的趋势,其中CP35组对虾的血清TP、CHOL和TG含量均最高, CP35组对虾的血清TP和CHOL含量均显著性高于CP25组 (P<0.05);CP30、CP35、CP40组对虾的血清CHOL含量均显著高于CP25、CP45组 (P<0.05),而CP25组CHOL含量显著高于CP45组(P<0.05);CP35组对虾血清TG含量显著高于CP45组 (P<0.05);其余组间均无显著性差异(P>0.05)。
2.3 饲料蛋白质水平对凡纳滨对虾鳃丝Na+/K+-ATP酶活性的影响
从图2可见:凡纳滨对虾鳃丝的Na+/K+-ATP酶活性随饲料蛋白质水平的增加呈先升高后降低的趋势,其中 CP30、CP35组对虾鳃丝的 Na+/K+-ATP酶活性最高,且显著高于其他 3组 (P<0.05),其余组间均无显著性差异 (P>0.05)。
表3 不同蛋白质水平饲料组凡纳滨对虾血液指标的变化(盐度为20)
Tab.3 Effecs of dietary protein levels on blood indexes in Pacific white leg shrimp Litopenaeus vannamei at salinity 20

组别group总蛋白TP/ (g·L-1)总胆固醇CHOL/ (mmol·L-1)甘油三酯TG/ (mmol·L-1) CP25 75.50±2.12a0.57±0.12b1.06±0.08abCP30 86.33±6.81ab0.83±0.15c1.19±0.20abCP35 96.50±3.54b0.93±0.12c1.25±0.09bCP40 93.50±12.02ab0.83±0.15c1.05±0.13abCP45 94.50±9.19b0.15±0.07a0.96±0.13a
3 讨论
3.1 蛋白质水平对凡纳滨对虾生长性能的影响
水体盐度的变化通过影响对虾的生理机制而影响其生长。许多研究表明,广盐性虾类可通过血淋巴的渗透调节和离子调节来适应外界环境盐度的变化。在此渗透压主动调节过程中,虾类需要消耗大量能量,因此,蛋白质的代谢可能要发生改变[11]。
在海水环境中,凡纳滨对虾饲料的最适蛋白质需要量为36% ~40%[12-13],在集约化生产中甚至可达到55%[14]。李二超等[15]认为,提高饵料蛋白质含量虽然在一定程度上能加快对虾的生长速度和增加肥满度,但并不能提高低盐度下凡纳滨对虾的成活率。饲料中蛋白质含量的不适宜,尤其是含量过低,会导致对虾肝胰腺的结构发生变化,甚至发生不同程度的病理变化,建议蛋白质添加量为30% ~40%。王兴强等[11]研究表明,随着饲料中蛋白质含量的提高,凡纳滨对虾的存活率呈下降趋势。然而,李二超等[15]指出,饲料蛋白质水平对各盐度下对虾成活率影响不显著,本试验中对虾的成活率随着饲料蛋白质含量的增加虽有下降趋势,但差异不显著。Robertson等[16]对高低两个盐度下养殖凡纳滨对虾的研究表明,盐度为46和12时,凡纳滨对虾的饲料蛋白质需要量分别为45%和35%。然而,Shiau等[17]对低盐度水体中养殖斑节对虾的研究表明,盐度影响蛋白质的消化率,因此,盐度在蛋白质利用上起着重要作用,饲喂于咸淡水 (盐度16)的斑节对虾对饲料蛋白质的最适需要量为44%。Lei等[18]认为,相比于高盐度,斑节对虾在低盐度下有较高的氨氮排出,饲养于低盐度下的虾类更倾向于利用蛋白质而不是脂肪作为能源,所以盐度会影响虾类对蛋白质的利用。本试验中的养殖水体盐度为20,参考凡纳滨对虾增重率指标,饲料的最适蛋白质水平为39.74%。孙燕君[19]指出,在盐度为12的半咸水中,45%蛋白质组的虾生长都没有35%和25%蛋白质组快,这也与本试验中得出的45%蛋白组增重率反而不如35%和40%蛋白组高的研究结果相类似。这可能是因为饲料中过高的蛋白质水平抑制了虾的生长[20],对虾将过剩的蛋白质作为能源代谢,但不能贮存用以生长,而且该过程中产生氨排放还会影响水质[21]。刘栋辉等[10]认为,极低盐度 (1~3)下凡纳滨对虾的适宜饲料蛋白质含量为40%,低于30%时会引起对虾的一些生理病变,凡纳滨对虾的摄食量、特定生长率和饲料效率随饲料蛋白质含量从20%增长到40%时而显著增加。而黄凯等[9]认为,盐度为2时,0.019 g对虾的最适蛋白质需求量为26.7%。这种蛋白质需要量上的差异表明,凡纳滨对虾的适宜饲料蛋白质含量受到众多因素的影响,如虾的规格、参考营养需求标准、饲料组成、蛋白质来源、投饲率、饲养系统、环境条件等。
3.2 蛋白质水平对凡纳滨对虾血液指标的影响
本试验中凡纳滨对虾血清总蛋白随着饲料蛋白质水平的增加呈现先升高后降低的趋势,提示机体在一定范围内为适应水体盐度条件耗氧量增加。骆作勇等[22]在研究罗非鱼时发现,生长良好的情况下,生命活动增强,各组织耗氧量急剧增加,对运输氧的需求增加,刺激合成更多的血红蛋白,导致血红蛋白含量增加。本试验条件下,血清总蛋白含量最高的35%蛋白质组,其成活率、特定生长率和增重率都有较佳的表现。血清总蛋白在一定程度上代表了日粮中蛋白质的营养水平及动物对蛋白质的消化吸收程度。随着饲料中粗蛋白质含量的增加,血清总蛋白含量升高,当蛋白质水平超过需要量时,机体不能对其有效利用,而血清总蛋白沉积率并不增高,多余的蛋白质被浪费掉。本试验条件下,45%蛋白质组的血清总蛋白水平低于35%蛋白质组,这也证明了过高的蛋白质水平不仅不能使血清总蛋白沉积,或者说被对虾有效吸收,反而会造成浪费。
本试验条件下,血清胆固醇在35%蛋白质水平时升至最高,从生长性能看该组增重率也较高,可能由于生长的加快,为合成体内类固醇激素(如脑激素、蜕皮激素)所必需,为新的细胞膜或细胞内细胞器膜的生成提供脂类[23]。向枭等[24]指出,甘油三酯一般随着胆固醇的升降而升降。本试验条件下,胆固醇和甘油三酯变化趋势一致,这也印证了上述观点。骆作勇等[23]指出,甘油三酯的增加表明体内能量的增加。能量的增加也通过对虾的增重率体现出来。本试验中凡纳滨对虾的甘油三酯与增重率都随着饲料蛋白质水平的增加呈现先升高后降低的趋势,从而也证明了上述观点。
3.3 饲料蛋白质水平对凡纳滨对虾鳃丝Na+/K+-ATP酶活性的影响
水生动物要消耗机体储备,适应水体盐度变化以调节其生长[25-26]。凡纳滨对虾在适应盐度变化的过程中,机体内的有机物质会有一定的损耗。虽然这些物质源于组织细胞内的合成,但这些物质归根到底仍需由外源饲料提供[27]。Claybrook[28]的研究表明,甲壳动物在低盐度条件下利用蛋白质作为氨基酸来源以维持渗透压的平衡,从而使对虾蛋白质的需求量相对增加。饲料蛋白质是对虾氨基酸的主要来源,且很多氨基酸被大量用于为调节渗透压提供能量[29]。而幼虾较之成虾需要更多的蛋白质来维持生长。在低渗透压下,凡纳滨对虾为了调节渗透压,激活Na+/K+-ATP酶,从而使得其活性升高,而Na+/K+-ATP酶活力升高,这必然要消耗机体的能量。
许多学者对甲壳动物生长于不同盐度环境中时鳃组织中的 Na+/K+-ATP酶活性进行了试验研究[30],该酶活性可随环境盐度变化而波动[31]。当蟹处于低盐环境中时,会通过鳃从外部环境中吸收Na+和Cl-来增加血淋巴中盐的浓度,对于盐分的流失加以补偿,鳃中Na+/K+-ATP酶活性增高;当其处于高盐环境中时Na+/K+-ATP酶活性降低[30]。本试验中养殖水体的盐度为20,海水养殖的凡纳滨对虾要适应这个盐度,致使其鳃丝中Na+/K+-ATP酶活性增高,鳃丝需要从外部环境中吸收Na+和Cl-并驱动细胞中糖和氨基酸的运送,以此增加血淋巴中盐分和渗透调节效应物的浓度。本试验中,凡纳滨对虾幼虾鳃丝的Na+/K+-ATP酶活性随着蛋白质水平的增加呈现先升高后降低的趋势,在饲料蛋白质含量为30%时,Na+/K+-ATP酶活性最高,提示该蛋白质水平下,氨基酸形式的渗透调节效应物浓度适宜,有利于凡纳滨对虾的渗透调节。
综上所述,养殖水体盐度为20的条件下,当饲料蛋白质的水平为39.74%时,凡纳滨对虾能获得最大的增重率。在摄食适宜蛋白质饲料的同时,凡纳滨对虾低盐度养殖还要结合水体离子含量等因素便于更好地满足其生长。
参考文献:
[1] Samocha T M,Lawrence A L,Poose D.Growth and survival of juvenile Penaeus vannamei in low salinity water in a semi-closed recirculating system[J].Isr J Aquac-Barnidgeh,1998,50(2):55-59.
[2] Ogle J T,Beaugez K,Lotz J M S.Effects of salinity on survival and growth of post larval Penaeus vannamei[J].Source Gult Research Reports,1992,8(4):415-422.
[3] Bray W A,Lawrence A L,Leung-Trujillo J R.The effect of salinity on growth and survival of Penaeus vannamei,with observation on the interaction of IHHN virus and salinity[J].Aquaculture,1994, 122:133-146.
[4] Huang H J.Factors affecting the successful culture of P.stylirostris and P.vannamei at an estuarine power plant site:temperature,salinity,inherent growth variability,damselfly nymph predation,population density and distribulation and polyculture[D].Commerce: Texas A&M University,1983.
[5] Li E C,Chen L Q,Zeng C,et al.Growth,body composition,respiration and ambient ammonia nitrogen tolerance of the juvenile white shrimp,Litopenaeus vannamei,at different salinities[J].Aquaculture,2007,265:385-390.
[6] Laramore S.Effect of low salinity on growth and survival of postlarvae and juvenile Litopenaeus vannamei[J].J World Aquacult Soc, 2001,32(4):385-392.
[7] Ponce-palafox J,Martinez-Palacios C A,Ross L G.The effects of salinity and temperature on the growth and survival rates of juvenile white shrimp,P.vannamei,Boone 1931[J].Aquaculture,1997, 157:107-115.
[8] 李二超,禹娜,熊泽泉,等.饲料蛋白质和维生素B6对低盐度下凡纳滨对虾生长和转氨酶活力的影响[J].动物营养学报, 2010,22(3):634-639.
[9] 黄凯,王武,卢洁,等.盐度对凡纳滨对虾的生长及生化成分的影响[J].海洋科学,2004,28(9):20-25.
[10] 刘栋辉,何建国,刘永坚,等.极低盐度下饲料蛋白质量分数对凡纳滨对虾生长表现和免疫状况的影响[J].中山大学学报,2005,13(S2):217-223.
[11] 王兴强,马甡,董双林.盐度和蛋白质水平对凡纳滨对虾存活、生长和能量转换的影响[J].中国海洋大学学报,2005,35 (1):33-37.
[12] 李广丽,朱春华,周歧存.不同蛋白水平饲料对凡纳滨对虾生长的影响[J].海洋科学,2001,25(4):1-4.
[13] Smith L L,Lawrence A,Strawn K.Growth and digestibility by three sizes of Penaeus vannamei Boone:effects of dietary protein level and protein source[J].Aquaculture,1985,46:85-96.
[14] Somocha T M,Lawrence A L,Bray W A.Design and operation ofan intensive nursery raceway system for peneid shrimp[C]//Mac Vey J P.Handbook of mariculture:Crystacean aquaculture.Boca Ration:CRC Press Inc,Boca Ration,Florida,USA,1993:173-210.
[15] 李二超,陈立侨,曾嶒,等.不同盐度下饵料蛋白质含量对凡纳滨对虾生长、体成分和肝胰腺组织结构的影响[J].水产学报,2008,32(3):425-433.
[16] Robertson L,Larence A L,Castile F.Interaction of salinity and feed protein level on growth of Penaeus vannamei[J].J Appl Aquac,1993,2(1):43-54.
[17] Shiau S Y,Kwok C C,Chou B S.Optimal dietary protein level of Penaeus monodon reared in seawater and brackish water[J].Nippon Suisan Gakkaishi,1991,57:711-716.
[18] Lei C,Alava R.The quantitative dietary protein requirements of Penaeus monodon juvenile in a controlled environment[J].Aquacultrue,1989,53:229-242.
[19] 孙燕君.南美白对虾营养需求的研究[J].北京水产,2004,13 (1):11-13.
[20] Lim C,Persyn A.Pratical feeding peneid shrimps[M]//Lovell. Nutrition and Feeding of Fish.New York:Van Nostrand Reinhold, 1989:205-222.
[21] Cho C Y,Hynes J D,Wood K R,et al.Development of high-nutrient-dense,low-pollution diets and prediction of aquaculture wastes using biological approaches[J].Aquaculture,1994,124: 293-305.
[22] 骆作勇,王雷,王宝杰,等.不同投喂模式对奥利亚罗非鱼血液生化指标与生长性能的影响[J].中国水产科学,2007,14 (5):743-748.
[23] 骆作勇,王雷,王宝杰,等.奥利亚罗非鱼饥饿后补偿生长对血液理化指标的影响[J].海洋科学进展,2007,25(3):340-345.
[24] 向枭,陈建,周兴华,等.5种脂肪源对齐口列腹鱼生长性能及血清生化指标的影响[J].动物营养学报,2010,22(2):498-504.
[25] 张华军,李卓佳,张家松,等.凡纳滨对虾免疫指标变化与其养殖环境理化因子的关系[J].大连海洋大学学报,2011,26 (4):356-361.
[26] 柳敏海,彭志兰,张凤萍,等.盐度对条石鲷摄食、生长和肌肉生化组成的影响[J].大连海洋大学学报,2012,27(5):392-397.
[27] Cuzon G,Lawrence A,Gaxiola G,et al.Nutrition of Litopenaeus vannamei reared in tanks or in ponds[J].Aquaculture,2004,235 (1/4):513-551.
[28] Claybrook D L.Nitrogen metabolism[M]//Mantel L H.The biology of Crustacean,integral anatomy and physiological regulation. New York:Academic Press,1983:163-213.
[29] Kureshy N,Davis D A.Protein requirement for maintenance and maximum weight gain for the Pacific white shrimp,Litopenaeus vannamei[J].Aquaculture,2002,204(1/2):125-143.
[30] Corotto F S,Holliday C W.Branchial Na+/K+-ATPase and osmoregulation in the purple shore crab(Hemigrapsus nudus)[J]. Comp Biochem Physiol,1996,113A:361-368.
[31] 潘鲁青,刘泓宇.甲壳动物渗透调节生理学研究进展[J].水产学报,2005,29(1):109-114.
The optimal requirement of Pacific white leg shrimp Litopenaeus vannamei for dietary protein at low salinity
CHEN Si-an,CHI Shu-yan,LIANG Cai-qiang,XIE Li-li,GUO Shu-zhen,HE Yan-jie,WANG Wen-juan
(College of Fisheries,Guangdong Ocean University,Zhanjiang 524025,China)
Abstract:A 56 day trial with triplication was conducted to evaluate the effects of five isoenergetic diets containing protein levels of 25%(CP25 group),30%(CP30 group),35%(CP35 group),40%(CP40 group)and 45% (CP45 group)on growth performance and blood parameters in Pacific white leg shrimp Litopenaeus vannamei with body weight of 0.35 g reared in a 300 L plastic farming system at a rate of 40 shrimp per tank at a salinity of 20. The results showed that the weight gain and specific growth rate were found first increase with the increase in dietary protein levels,and then decrease,the maximal weight gain and specific growth rate in CP40 group,and significantly higher in CP35,CP40 and CP45 groups than those in CP25 group(P<0.05).Total serum protein,CHOL and TG contents was shown to be increased with increase in dietary protein levels,and then decreased,with the maximum in CP35 group.There were significantly higher total protein contents and CHOL levels in the serum in CP35 and CP45 group than those in CP25 group(P<0.05),without significant difference in the other groups(P>0.05).Na+/K+-ATPase activities in the gills were elevated with increase in dietary protein levels and then decreased,the maximum in CP30 and CP35 groups,and significantly higher than those in the other groups(P<0.05).The quadratic regression between dietary protein levels and growth revealed that the optimal protein requirement was 39.74%for Pacific white leg shrimp at a salinity of 20.
Key words:Litopenaeus vannamei;protein level;growth performance;blood parameter;low salinity
中图分类号:S963
文献标志码::A
文章编号:2095-1388(2013)04-0334-06
收稿日期:2012-11-14
基金项目:广东省大学生创新实验项目(1056610001);广东海洋大学自然基金资助项目(1012170);湛江市科技攻关项目(2010C3113013)
作者简介:陈思安 (1989-)男,学士。E-mail:591881359@qq.com
通信作者:迟淑艳 (1977-),女,博士,副教授。E-mail:chishuyan77@163.com




