摘要:在基础饲料中添加0、0.8、1.2、1.6、2.0、2.4 g/kg(饲料)的香菇多糖,连续饲喂体质量为(40.0±0.5)g的建鲤Cyprinus carpio var.Jian 49 d后,检测香菇多糖对幼建鲤主要肠道菌群数量及部分非特异性免疫指标的影响。结果表明:饲喂各试验剂量的香菇多糖均能极显著地提高幼建鲤的白细胞杀菌活性和血清中溶菌酶活性 (P<0.01);饲喂1.6 g/kg(饲料)及以上剂量的香菇多糖,可使幼建鲤前、中、后肠中的乳酸杆菌、双歧杆菌数量较对照组极显著增加 (P<0.01),且以2.4 g/kg(饲料)剂量组的刺激效果较佳;饲喂1.2 g/kg(饲料)及以上剂量的香菇多糖,可使幼建鲤前、中、后肠中的大肠杆菌、嗜水气单胞菌数量较对照组极显著减少(P<0.01),分别以2.0、2.4 g/kg(饲料)剂量组的刺激效果较佳。
关键词:香菇多糖;建鲤;肠道菌群;非特异性免疫;白细胞杀菌活性;溶菌酶
香菇多糖 (lentinan,LNT)是从担子菌纲、伞菌科、真菌香菇Lentinus edodes子实体中提取的一种以β-D-(1,3)葡萄糖残基为主链,β-D-(1,6)葡萄糖残基或β-D-(1,3)葡萄糖残基为侧链构成的葡聚糖[1-2],具有抗病毒、抗肿瘤、调节免疫、促进干扰素生成等功能[3-4],被广泛应用于人类多种肿瘤疾病的治疗[5]。目前,香菇多糖的应用范围逐渐扩大,在畜禽[6-8]、水产[9-13]等领域的诸多研究结果表明,香菇多糖能有效地改善动物机体的免疫功能。
香菇多糖对鲤肠道菌群和非特异性免疫的影响研究目前尚未见报道,为此,作者探讨了饲喂添加香菇多糖的饲料对幼建鲤 Cyprinus carpio var.Jian肠道菌群和部分非特异性免疫指标的影响,旨在为香菇多糖在水生动物饲料中的应用提供参考。
1.1 材料
试验用建鲤为同一批次健康的建鲤幼鱼 (幼建鲤)900尾。试验用香菇多糖购自浙江方格药业有限公司,多糖含量为50%。
1.2 方法
1.2.1 试验设计与饲养管理 幼建鲤购回后驯化养殖30 d,体质量为 (40.0±0.5)g,驯化结束后开始正式试验。随机将 900尾幼建鲤分成 6组(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ和Ⅵ组),每组设3个重复,每个重复放50尾鱼,分别饲喂香菇多糖添加量为0、0.8、1.2、1.6、2.0、2.4 g/kg的饲料,试验共进行49 d。
将幼建鲤饲养于温室水族箱中,水源为曝气自来水。试验期间水温为 (25±1)℃,pH为7.0左右,溶解氧为6 mg/L以上。试验期间每天9:00和17:00定时投喂,并根据幼建鲤的摄食量、水温条件即时调整投喂量,以所有的鱼饱食为准。
1.2.2 肠道菌群数量的测定 试验结束后,从每组鱼中随机选取9尾体质量相近的建鲤,鱼体表用体积分数为75%的酒精消毒,解剖去除肠道周围脂肪组织,以无菌生理盐水淋洗肠壁,在无菌条件下分别取前、中、后肠内容物,将每3尾鱼的肠道内容物作为一个样本,将其放入带有玻璃珠的三角瓶中,称重后加入10倍质量的无菌生理盐水,置于摇床上,以230 r/min振荡10 min,再依次以10倍梯度稀释,选择合适的稀释度,分别滴加在双岐杆菌培养基 (BBL)、乳酸杆菌选择性培养基(MRS)、大肠杆菌伊红美蓝琼脂培养基 (EMB)、嗜水气单胞菌选择培养基 (RB)上,每个样品设3个重复,于28℃下培养,用乳酸杆菌和双歧杆菌厌氧培养72 h,其余需氧培养24 h后计算菌落数,细菌计数采用平板涂布法,并以lg[cfu/g(肠道内容物)]表示。
1.2.3 免疫相关指标的测定
1)白细胞悬液的制备。取1.0 mL抗凝血缓慢加入至1.5 mL相对质量密度为1.070的淋巴细胞分离液中,以2 500 r/min离心15 min,吸取白细胞层,以Hank's液重悬,并计数,调整细胞浓度至1.0×107个/mL[14]。用台盼蓝染色检测白细胞的存活率,活细胞数不少于90%[15]。
2)白细胞的杀菌活性。试验结束后,从每个处理组中随机选取建鲤5尾,尾静脉采血。血液经肝素钠抗凝处理,在离心管中加淋巴细胞分离液0.8 mL,向管中缓慢加入抗凝血液 (不能摇匀),以2 500 r/min离心15 min,用注射器于白细胞层取细胞液0.5 mL,加入至4 mL的离心管中,再加入0.1 mL浓度为1.0×108cfu/mL的金黄色葡萄球菌液,混匀后置于28℃水浴中孵育1 h,以2 000 r/min离心10 min,弃上清液,加入0.5 mL Hank's液重悬。在相同温度条件下继续孵育 80、100、120 min,定时从中吸取0.2 mL细胞悬液于另一试管中,加入1.0 mL体积分数为0.2%的Tween-20破碎白细胞,并加入0.5 mL MEM培养基培养16 h,再加入0.06 mL 5.0 mg/mL的MTT(四甲基偶氮唑盐),均匀摇动15 min,用分光光度计在600 nm波长处测定吸光度 (OD)[16]。按下列公式计算杀菌指数 (BI):
其中:tx为孵育时间;t0为孵育前时间。当 BI<1.0时,具有杀菌能力;当BI>1.0时,则无杀菌能力。即BI值升高,杀菌能力降低,反之亦然。
3)血清溶菌酶活性。从每个处理中随机选取5尾鱼,尾静脉采血。血液置于冰箱 (4℃)中静置过夜,次日低温下以3 000 r/min离心血清,并按照溶菌酶试剂盒 (浙江伊利康生物技术有限公司生产)说明书方法测定血清中的溶菌酶活性。
1.3 数据处理
试验数据采用平均值±标准差表示,用统计软件SPSS 11.0对数据进行方差分析,用Duncan氏法进行多重比较,显著性水平设为0.05。
2.1 饲喂香菇多糖对幼建鲤肠道主要菌群数量的影响
从表1可见:饲喂本试验剂量的香菇多糖对幼建鲤前、中、后肠中的乳酸杆菌和双歧杆菌数量均有不同程度的增加作用,饲喂1.6 g/kg(饲料)及以上剂量时,乳酸杆菌和双歧杆菌的数量较对照组均有极显著增加 (P<0.01),且均以2.0 g/kg (饲料)剂量组的刺激效果较佳。
从表2可见:饲喂本试验剂量的香菇多糖对幼建鲤前、中、后肠中的大肠杆菌和嗜水气单胞菌数量均有不同程度的降低作用,饲喂1.2 g/kg(饲料)及以上剂量时,大肠杆菌数量较对照组极显著降低 (P<0.01),饲喂2.4 g/kg(饲料)剂量时,嗜水气单胞菌数量较对照组极显著降低 (P<0.01),分别以2.0 g/kg(饲料)和2.4 g/kg(饲料)剂量组的刺激效果较佳。
2.2 饲喂香菇多糖对幼建鲤白细胞杀菌活性和血清中溶菌酶活性的影响
从表3可见:饲喂各试验剂量的香菇多糖均能极显著提高幼建鲤的白细胞杀菌活性和血清中的溶菌酶活性 (P<0.01)。其中,以2.0 g/kg(饲料)剂量 (Ⅴ组)的白细胞杀菌活性最高,与Ⅰ、Ⅱ、Ⅲ、Ⅵ组差异极显著 (P<0.01),且与Ⅳ组差异显著 (P<0.05);Ⅳ、Ⅴ和Ⅵ组的血清溶菌酶活性极显著高于Ⅰ、Ⅱ组 (P<0.01),与Ⅲ组差异显著(P<0.05),但Ⅳ、Ⅴ和Ⅵ组之间差异不显著 (P>0.05)。
研究表明,不同鱼类肠道微生物种类各异[17-19],而定植于鲤肠道中的大肠杆菌、乳酸杆菌、双岐杆菌和嗜水气单胞菌是鲤消化道内几种主要的微生物菌群[20-21]。乳酸杆菌和双歧杆菌作为鲤肠道中的益生菌,通过降低肠道pH值或通过在空间、营养上的屏蔽竞争作用来抑制有害菌在肠道中的定植和生长,并与其他正常菌群构成了阻止外源性病原菌入侵定植的屏障,维持了鲤消化道菌群结构的动态平衡,同时还可以产生细菌素以抵制有害菌的生长[22-23]。当外源性因素作用后,可改变乳酸杆菌和双歧杆菌的数量,从而达到提高鱼类免疫能力、预防疾病的目的。李云兰[24]研究发现,在饲料中添加不同剂量的甘露糖,能显著增加幼建鲤中、后肠双歧杆菌及前、中、后肠乳酸杆菌的数量,极大地提高鲤的免疫功能。Robertson等[25]将一株从大西洋鲑肠道中分离到的肉杆菌饲喂大西洋鲑幼鱼,肉杆菌能在幼鱼肠道内停止投喂后存活4~10 d,并能帮助幼鱼增强抵御病原菌侵蚀的能力。Do-Hyung等[26]给虹鳟投喂益生菌后,能显著增加试验组动物的细胞免疫和体液免疫功能。Wang等[27]在鲤饲料中添加芽孢杆菌后能明显提高试验组鱼的生长性能、饲料转化率和消化酶活性。而本研究中发现,当在饲料中添加香菇多糖后能明显提高幼建鲤前、中、后肠乳酸杆菌和双歧杆菌的数量。高浓度香菇多糖 (2.0 g/kg)更能明显地增
加前、中、后肠乳酸杆菌、双歧杆菌的数量,但增加量并不随香菇多糖的增加而进一步明显增多,试验结果表现为试验Ⅴ、Ⅵ组与Ⅰ、Ⅱ、Ⅲ差异极显著 (P<0.01),但Ⅴ、Ⅵ组间差异不显著 (P>0.05)。
表1 香菇多糖对幼建鲤肠道乳酸杆菌、双歧杆菌数量的影响 (n=3)
Tab.1 Effects of lentinan on Lactobacilli and Bifidobacterium amount in the intestinal tract of juvenile Jian common carp lg(cfu/g)

注:同列中标有不同大写字母者表示组间有极显著性差异 (P<0.01),标有不同小写字母者表示组间有显著性差异 (P<0.05),标有相同小写字母者表示组间无显著性差异 (P>0.05),下同。
Note:The means with different capital letters within the same column are very significantly different at the 0.01 probability level,the means with different letters being significantly different at the 0.05 probability level,and the means with the same letters within the same column are not significant differences,et sequentia.
组别group香菇多糖含量/ (g·kg-1) content of lentinan乳酸杆菌Lactobacilli前肠foregut 中肠midgut 后肠hindgut双歧杆菌Bifidobacterium前肠foregut 中肠midgut 后肠hindgutⅠ0 8.234±0.041Aa8.406±0.063Ab8.514±0.094Aa8.538±0.050Aa8.584±0.060Aa8.612±0.050AaⅡ0.8 8.272±0.042Aa8.478±0.061ABb8.666±0.061ABab8.582±0.062Aa8.600±0.040Aa8.800±0.020BbⅢ1.2 8.516±0.090BCb8.770±0.090ABc8.812±0.153ABCbc8.830±0.019Bc8.828±0.040ABb9.022±0.053CcⅣ1.6 8.606±0.114Bb8.700±0.056BCc9.016±0.062BCDcd8.882±0.029BCbc8.930±0.040Bb9.108±0.041CcⅤ2.0 8.934±0.052Cc9.084±0.100Dd9.268±0.055Dd9.022±0.053Cd9.232±0.040Dd9.310±0.046DdⅥ2.4 8.910±0.080Cc9.038±0.057DCd9.128±0.089Dd8.990±0.033BCbd9.014±0.040BDb9.150±0.060DCc
表2 香菇多糖对幼建鲤肠道大肠杆菌、嗜水气单胞菌数量的影响 (n=3)
Tab.2 Effects of lentinan on Escherichia coli and Aeromonas hydrophila amount in the intestinal tract of juvenile Jian common carp lg(cfu/g)
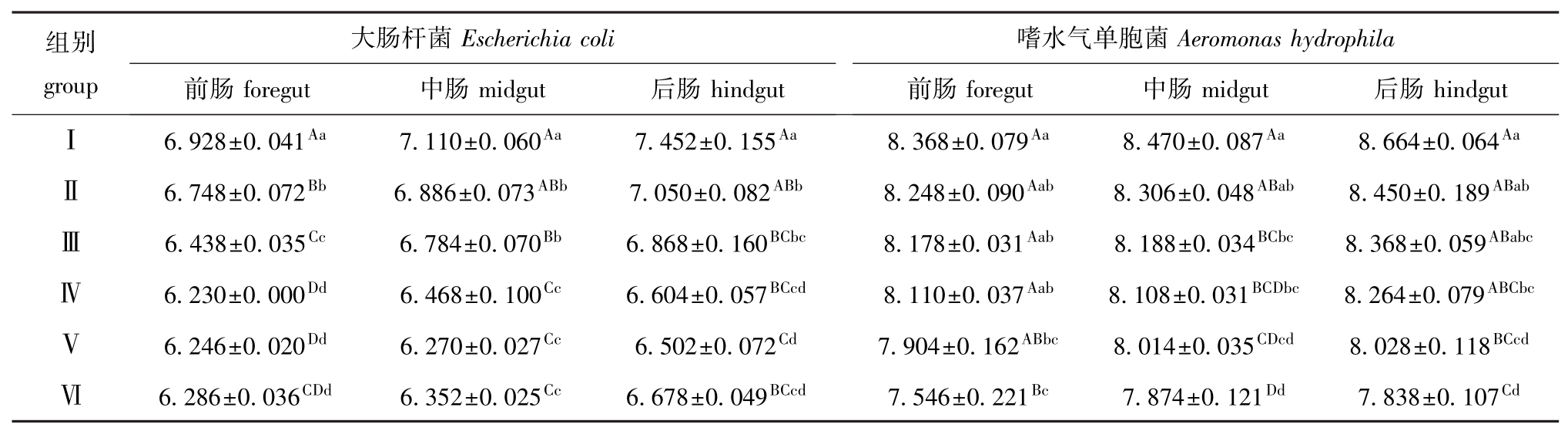
组别group大肠杆菌Escherichia coli前肠foregut 中肠midgut 后肠hindgut嗜水气单胞菌Aeromonas hydrophila前肠foregut 中肠midgut 后肠hindgutⅠ 6.928±0.041Aa7.110±0.060Aa7.452±0.155Aa8.368±0.079Aa8.470±0.087Aa8.664±0.064AaⅡ 6.748±0.072Bb6.886±0.073ABb7.050±0.082ABb8.248±0.090Aab8.306±0.048ABab8.450±0.189ABabⅢ 6.438±0.035Cc6.784±0.070Bb6.868±0.160BCbc8.178±0.031Aab8.188±0.034BCbc8.368±0.059ABabcⅣ 6.230±0.000Dd6.468±0.100Cc6.604±0.057BCcd8.110±0.037Aab8.108±0.031BCDbc8.264±0.079ABCbcⅤ 6.246±0.020Dd6.270±0.027Cc6.502±0.072Cd7.904±0.162ABbc8.014±0.035CDcd8.028±0.118BCcdⅥ 6.286±0.036CDd6.352±0.025Cc6.678±0.049BCcd7.546±0.221Bc7.874±0.121Dd7.838±0.107Cd
表3 香菇多糖对幼建鲤白细胞杀菌活性、血清溶菌酶活性的影响
Tab.3 Effects of lentinan on bactericidal activity of leucocyte and serum lysozyme activity in juvenile Jian common carp U/mL
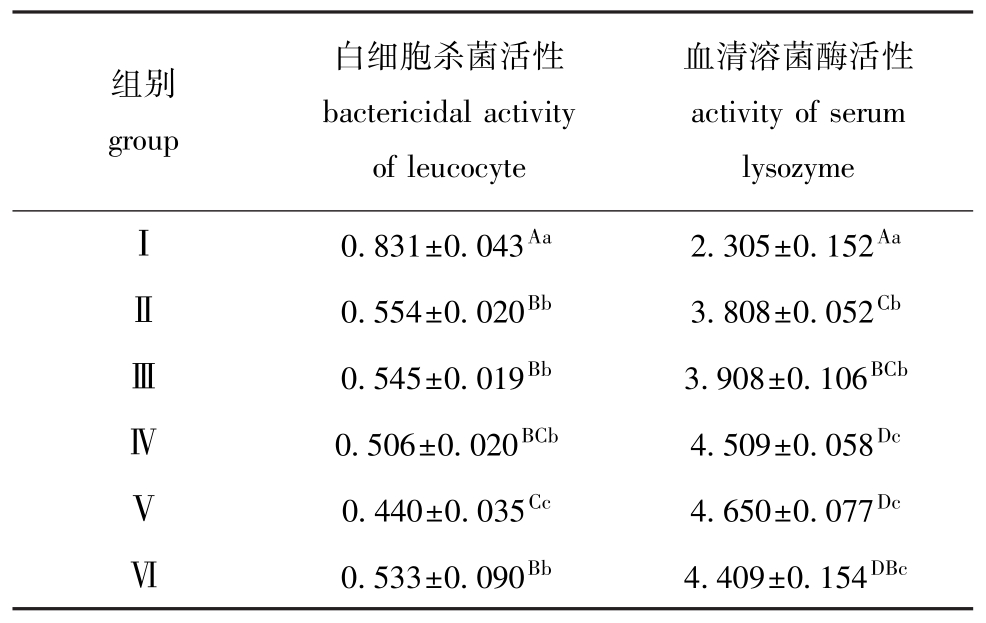
组别group白细胞杀菌活性bactericidal activity of leucocyte血清溶菌酶活性activity of serum lysozymeⅠ0.831±0.043Aa2.305±0.152AaⅡ0.554±0.020Bb3.808±0.052CbⅢ0.545±0.019Bb3.908±0.106BCbⅣ0.506±0.020BCb4.509±0.058DcⅤ0.440±0.035Cc4.650±0.077DcⅥ0.533±0.090Bb4.409±0.154DBc
大肠杆菌属于鲤肠道内的正常菌群之一,因可液化明胶,不产生吲哚而与陆生动物的大肠杆菌略有区别。一些外源性因素可破坏鲤消化道菌群结构的动态平衡,导致其数量大量增加,并对鲤的正常消化道环境造成严重破坏。嗜水气单胞菌属于条件致病菌,正常情况下在肠道定植的数量处于动态平衡,但外源性因素的作用可使其数量迅速增加,引起鱼类的消化道功能紊乱,增加鱼类患病几率。有研究表明,饲料中添加不同营养物质或药物,均能影响大肠杆菌和嗜水气单胞菌的数量[28-29]。Silva等[30]在饲料中添加羽扇豆和菜籽粉后,能明显增加金鲫肠道内嗜水气单胞菌的数量,引起肠道菌群紊乱。同时,乳酸杆菌和双歧杆菌数量的增加在一定程度上抑制了大肠杆菌和嗜水气单胞菌的生长。Sreekumar等[31]研究表明,乳酸杆菌不仅能在体外表现出明显的抑制大肠杆菌的作用,而且在给予试验小鼠乳酸杆菌后,能让大肠杆菌非感染鼠和感染鼠均出现肠道大肠杆菌数量降低,细菌生长受到明显抑制。而本试验在饲料中添加不同剂量香菇多糖后,在增加肠道内乳酸杆菌和双歧杆菌的同时,也能明显降低肠道内大肠杆菌和嗜水气单胞菌的数量。低剂量 (1.2 g/kg)的香菇多糖就能有效降低幼建鲤前、中肠大肠杆菌数量,但随着剂量的增加,对大肠杆菌数量的影响不显著 (P>0.05)。
香菇多糖通过激活宿主免疫细胞如 T细胞、自然杀伤细胞和巨噬细胞而起到延长生存期,辅助治疗癌症等抗癌作用[32]。在体外,香菇多糖能有效促进离体培养鲤免疫细胞的活性增殖[13],能提高黄颡鱼头肾巨噬细胞氮呼吸暴发活性,显著提高黄颡鱼外周血白细胞的增殖能力[12]。香菇多糖主要通过激活免疫细胞,使其释放细胞因子或刺激产生化学信使而增强机体免疫功能[33-34]。本研究中发现,香菇多糖能有效增强幼建鲤白细胞杀菌活性和血清溶菌酶吞噬活性,对鲤非特异性免疫指标影响明显,是一种具有较大应用潜力的渔用中草药免疫增强剂。相关的免疫刺激机理需进一步深入研究。
不同种类的水生动物饲料中香菇多糖的添加量略有不同。本试验中,香菇多糖在饲料中的添加量是在预试验的基础上确定的。而白东清等[12]在黄颡鱼饲料中各组香菇多糖的添加量分别为300、600、900、1 200、1 500 mg/kg,与本试验结果存在一定差异。
参考文献:
[1] 和玉丹,王敏奇.香菇多糖在家禽免疫中的应用[J].上海畜牧兽医通讯,2006(5):54-55.
[2] Zhang Y Y,Li S,Wang X H,et al.Advances in lentinan:isolation,structure,chain conformation and bioactivities[J].Food Hydrocolloids,2011,25(2):196-206.
[3] 周爱武,葛志东,梁君山,等.香菇多糖的免疫调节作用[J].中国药理学通报,1995(2):157-159.
[4] 王慧铭,夏明,夏道宗,等.香菇多糖抗肿瘤作用及其机制的研究[J].浙江中西医结合杂志,2006(5):291-292.
[5] 王万能,刘丹,杨颖,等.香菇多糖抗肿瘤活性的研究进展[J].重庆工学院学报:自然科学版,2008(1):161-163.
[6] 陈洪亮,徐龙涛,李德发,等.香菇多糖对肉鸡脾淋巴细胞功能及信息传导的影响[J].畜禽业,2002(5):4-6.
[7] 刘永杰,李庆章,郝艳红.黄芪多糖和香菇多糖对雏鸡IL-2活性和淋巴细胞增殖反应的影响[J].吉林农业大学学报,1999, 21(3):89-91.
[8] 钟丕,李庆章,高学军,等.黄芪多糖和香菇多糖对vMDV感染雏鸡淋巴细胞化学发光的影响[J].畜牧兽医学报,1997(6): 63-67.
[9] 宋文华,于翔,富丽静,等.黄芪多糖和香菇多糖对草鱼非特异性免疫功能的影响[J].安徽农业科学,2011(24):14893-14895,14930.
[10] 曹丽萍,丁炜东,张柳,等.香菇多糖和黄芪多糖对鲤免疫细胞的活性和IL-1β体外诱生表达的影响[J].水产学报,2008, 32(4):628-635.
[11] 万安韬,张林存,程星宇,等.香菇多糖对罗非鱼非特异性免疫力的影响[J].江苏农业科学,2012(4):225-227.
[12] 白东清,吴旋,朱国霞,等.香菇多糖对黄颡鱼免疫细胞活性的影响[J].湖北农业科学,2011(9):1855-1858.
[13] 曹丽萍,丁炜东,张柳,等.香菇多糖对鲤鱼(Cyprinus carpio)离体培养免疫细胞的活性调节作用[J].农业生物技术学报, 2008(4):616-621.
[14] 余贺.医学微生物学[M].北京:人民卫生出版社,1983.
[15] 司徒镇强,吴军正.细胞培养[M].西安:世界图书出版公司, 1996.
[16] 李静,陈昌福.草鱼白细胞对福建爱德华氏菌杀菌活性的研究[J].四川大学学报:自然科学版,1998,35(4):619-623.
[17] Ringø E,Strøm E,Tabachek J A.Intestinal microflora of salmonids:a review[J].Aquaculture Research,1995,26(10):773-789.
[18] Ringø E,Strøm E.Microflora of Arctic charr,Salvelinus alpinus (L.):gastrointestinal microflora of free-living fish and effect of diet and salinity on intestinal microflora[J].Aquaculture Research,1994,25(6):623-629.
[19] Grama B L.The microflora of rainbow trout intestine:a comparison of traditional and molecular identification[J].Aquaculture,2000,182(1):1-15.
[20] 王红宁,何明清,柳苹,等.鲤肠道正常菌群的研究[J].水生生物学报,1994,18(4):354-359.
[21] Sugita H,Tokuyama K,Deguchi Y.The intestinal microflora of carp Cyprinus carpio,grass carp Ctenopharyngodon idella and tilapia Sarotherodon niloticus[J].Bulletin of the Japanese Society of Scientific Fisheries,1985,51(8):1325-1329.
[22] Ringø E,Bendiksen H R,Wesmajervi M S,et al.Lactic acid bacteria associated with the digestive tract of Atlantic salmon(Salmo salar L.)[J].Journal of Applied Microbiology,2000,89(2): 317-322.
[23] Ringø E,Gatesoupe F J.Lactic acid bacteria in fish:a review[J]. Aquaculture,1998,160(3):177-203.
[24] 李云兰.甘露寡糖对幼建鲤(Cyprinus carpio var.Jian)肠道菌群和免疫功能的影响[D].雅安:四川农业大学,2004.
[25] Robertson P W,O'dowd C,Burrells C,et al.Use of Carnobacterium sp.as a probiotic for Atlantic salmon(Salmo salar L.)and rainbow trout(Oncorhynchus mykiss,Walbaum)[J].Aquaculture, 2000,185(3):235-243.
[26] Do-Hyung K,Brian A.Innate immune responses in rainbow trout (Oncorhynchus mykiss,Walbaum)induced by probiotics[J].Fish &Shellfish Immunology,2006,21(5):513-524.
[27] Wang Y G,Xu Z R.Effect of probiotics for common carp(Cyprinus carpio)based on growth performance and digestive enzyme activities[J].Animal Feed Science and Technology,2006,127(3/ 4):283-292.
[28] 李卫芬,沈涛,陈南南,等.饲料中添加枯草芽孢杆菌对草鱼消化酶活性和肠道菌群的影响[J].大连海洋大学学报,2012, 27(3):221-225.
[29] 王琨,孙云章,李富东,等.饲料中添加两种寡糖和一种芽孢杆菌对牙鲆肠道菌群的影响[J].大连海洋大学学报,2011,26 (4):299-305.
[30] Silva F C,Nicoli J R,Zambonino-Infante J L,et al.Influence of the diet on microbial diversity of faecal and gastrointestinal contents in gilthead sea bream(Sparus aurata)and intestinal contents in goldfish(Carassius auratus)[J].Microbiology Ecology,2011, 78(2):285-296.
[31] Sreekumar O,Hosono A.Immediate effect of Lactobacillus acidophilus on the intestinal flora and fecal enzymes of RATS and the in vitro inhibition of Escherichia coli in coculture[J].Journal of Dairy Science,2000,83(5):931-939.
[32] Nayak S K.Probiotics,immunity:A fish perspective[J].Fish& Shellfish Immunology,2010,29(1):2-14.
[33] Ladányi A,Tímár,Lapis K.Effect of lentinan on macrophage cytotoxicity against metastatic tumor cells[J].Cancer Immunology, Immunotheraphy,1993,36(2):123-126.
[34] Hou X J,Zhang N,Xiong S Y,et al.Extraction of BaChu mushroom polysaccharides and preparation of a compound beverage[J]. Carbohydrate Polymers,2008,73(2):289-294.
The influence of lentinan on intestinal microflora and nonspecific immunity of juvenile Jian common carp Cyprinus carpio var.Jian
Abstract:The intestinal microflora and nonspecific immune indexes were investigated in juvenile Jian common carp Cyprinus carpio var.Jian with body weight of(40.0±0.5)g fed diets containing various levels of lentinan(0, 0.8,1.2,1.6,2.0,and 2.4 g/kg diet)for 49 days.The results showed that the leukocyte bactericidal index and serum lysozyme activity were found very significant increase compared with the control group(P<0.01).There were significantly more Lactobacilli and Bifidobacterium in the foregut,midgut and hindgut in the fish fed the diet containing lentinan up to 1.6 g/kg diet compared with the fish in the control group,the maximum in the fish fed the diet containing lentinan at a dose of 2.4 g/kg diet.On the other hand,Escherichia coli and Aeromonas hydrophila in the foregut,midgut and hindgut was found to be significantly decreased(P<0.01)in number,with the optimal effective concentration of 2.0 g/kg,and 2.4 g/kg,respectively.
Key words:lentinan;Cyprinus carpio var.Jian;intestinal microflora;nonspecific immunity;leucocyte bactericidal activity;lysozyme
中图分类号:Q959.468
文献标志码::A
文章编号:2095-1388(2013)04-0329-05
收稿日期:2012-10-18
基金项目:四川省教育厅青年基金资助项目 (09ZB055)