摘要:通过测定3种壳色群体菲律宾蛤仔Ruditapesp hilippenarum(斑马蛤、珍珠白和对照组)在低盐度(15)海水中0、1.5、3、6、12、24、48 h时的死亡率、个体平均增重、血浆渗透压、Na+浓度、Cl-浓度、血浆总蛋白浓度、鳃组织三磷酸腺苷(ATP)酶活性及血细胞总数等指标,比较了3种壳色菲律宾蛤仔的低盐耐受能力。结果表明:斑马蛤的死亡率最低 (3.92%);3种壳色蛤仔的血浆渗透压均呈现逐渐降低的趋势,第24 h时,斑马蛤渗透压显著高于对照组(P<0.05),第48 h时,3种壳色蛤仔的血浆渗透压都与海水渗透压接近;3种壳色蛤仔血淋巴中Na+浓度均呈现升高过程,第24 h时,珍珠白和斑马蛤的Na+浓度达到最大值,显著高于对照组(P<0.05);对照组蛤仔Cl-浓度呈现先升高后恢复的过程,而斑马蛤和珍珠白Cl-浓度呈现先降低后恢复的过程,第24 h时,斑马蛤和珍珠白血淋巴Cl-浓度显著高于对照组(P<0.05); 3种壳色蛤仔的ATP酶活性呈现先升高后恢复的过程,第6 h和24 h时,珍珠白鳃组织ATP酶活性显著高于对照组(P<0.05);3种壳色蛤仔的血细胞总数也呈现先升高后恢复的过程,第1.5 h时,珍珠白和斑马蛤血细胞总数显著低于对照组(P<0.05),第48 h时,斑马蛤血细胞总数显著高于对照组(P<0.05)。
关键词:菲律宾蛤仔;壳色;低盐胁迫;渗透压;ATP酶活性
菲律宾蛤仔Ruditapesp hilippenarum隶属于双壳纲、帘蛤科、缀锦亚科、蛤仔属,是一种广温、广盐性海水养殖贝类,中国年产菲律宾蛤仔300万t左右,约占中国贝类产量的30%,占海水养殖总产量的20%,占世界菲律宾蛤仔总产量的90% 以上[1]。但目前蛤仔养殖中存在种质资源性状退化、品质下降等问题,而杂交育种是解决这些问题的一条有效途径。在贝类生长过程中,由于受自然条件和生理因素等影响,不同群体之间或同一群体中产生了壳色多态性。对马氏珠母贝 Pinctada fucata martensi[2]、海湾扇贝 Argopecten irradians[3]、虾夷扇贝Patinopecten yessoensis[4]和菲律宾蛤仔[5]的研究发现,这些海产经济贝类不同壳色个体的生长速度、成活率、免疫能力等指标差异显著,尤其重要的是多种贝类的壳色能够稳定遗传。因此,将壳色作为一个表型标记,应用于苗种培育具有广阔的应用前景。闫喜武等[6-8]对菲律宾蛤仔的研究发现,不同壳色群体蛤仔的生长速度、存活率等性状和表型存在显著差异。菲律宾蛤仔主要在潮间带分布,夏季大雨经常会导致其生存环境的盐度迅速降低,研究证实,盐度降低会影响蛤仔的免疫能力,与蛤仔疾病的爆发具有一定关联[9]。本研究中,作者对不同壳色群体蛤仔的低盐耐受能力进行了比较研究,旨在进一步探讨蛤仔壳色与盐度的关系,为其种质改良提供科学依据。
1.1 材料
试验用菲律宾蛤仔采自庄河海区,选取体质量为 (11.34±0.81)g、壳长为 (39.85±0.81)mm、具有鲜明壳色特征的健康菲律宾蛤仔个体为研究对象。试验分为3组,每组150只,其中斑马蛤群体,壳面具有斑马条状花纹;珍珠白群体,背景颜色为白色,左壳背部有一条深色放射条带;对照组,随机选取各种壳色个体组成。
1.2 方法
1.2.1 试验设计 将蛤仔置于水槽中暂养,暂养期间海水盐度为32,水温为 (22±1)℃,连续充气,每天更换海水1次,投喂螺旋藻粉1次。暂养7 d后,将蛤仔置于盐度为15的海水中,在第0、1.5、3、6、12、24、48 h时从每组随机抽取10枚样品进行试验处理,并记录死亡数。
1.2.2 个体增重的测定 分别选取各种壳色的个体30枚,称重后置于网袋中,放入盐度为15的海水中,在试验的第 0、1.5、3、6、12、24、48 h时取出,擦干表面后称重。
1.2.3 血淋巴细胞样品的制备 在试验的各时间点,从各组分别取10枚个体,使用1 mL无菌注射器从蛤仔围心腔中抽取血淋巴400 μL,加入到1.5 mL的样品管中并置于冰上。将每2枚蛤仔的样品混合后进行后续试验测定。
1.2.4 鳃组织上清液的制备 用无菌剪刀剪取蛤仔鳃组织,称重后加入10倍质量的冷却蒸馏水制成质量分数为10%的匀浆,取100 μL该匀浆,加入900 μL的生理盐水制成体积分数为10%的组织匀浆,用于三磷酸腺苷 (ATP)酶活性的检测。
1.2.5 血细胞总数的测定 取30 μL血淋巴样品加入到等量的 BFC固定液 (NaCl 2%,乙酸钙1%,甲醛4%,均为体积分数)中,混匀后吸取10 μL加到血球计数板上,在10倍光镜下观察并计数。
1.2.6 血浆蛋白浓度和血淋巴渗透压的测定 使用Bradford蛋白浓度测定试剂盒 (购于碧云天生物技术研究所)测定蛤仔血浆蛋白浓度,以小牛血清白蛋白作为标准蛋白。
取血淋巴样品50 μL,使用OSMOMAT®030渗透压仪 (Gonotec德国)测定血浆渗透压。
1.2.7 氯离子 (Cl-)和钠离子 (Na+)浓度的测定 分别使用氯化物测定试剂盒和Na+测定试剂盒(均为南京建成科技有限公司)测定血淋巴中Cl-和Na+的浓度,其计算公式为
其中:A样为样品的吸光度值;A标为标准品的吸光度值;C标为标准品中Cl-(Na+)的浓度(mmol/L)。1.2.8 ATP酶活性的测定 使用超微量ATP酶测试盒 (南京建成科技有限公司)测定鳃组织中ATP酶的活性。测定时使用上述制成的鳃组织上清液。酶活性定义:每小时每毫克组织蛋白的组织中ATP酶分解ATP产生1 μmol无机磷的量为一个ATP酶活力单位。
1.3 数据处理
试验结果均用平均值±标准差 (mean±S.D.)表示,使用SPSS 11.5软件进行单因素方差分析,显著性水平设为0.05。
2.1 3种壳色蛤仔死亡率和个体平均增重的比较
3种壳色蛤仔放入盐度为15的海水中48 h后,对照组死亡率最高 (18.18%),其次为珍珠白蛤仔 (8.08%),斑马蛤死亡率最低 (3.92%)。
从图1可见:将蛤仔放入低盐海水后,3种壳色蛤仔个体质量都表现出先增加后恢复的过程,其中对照组在第12 h时个体平均增重显著高于斑马蛤和珍珠白个体 (P<0.05)。
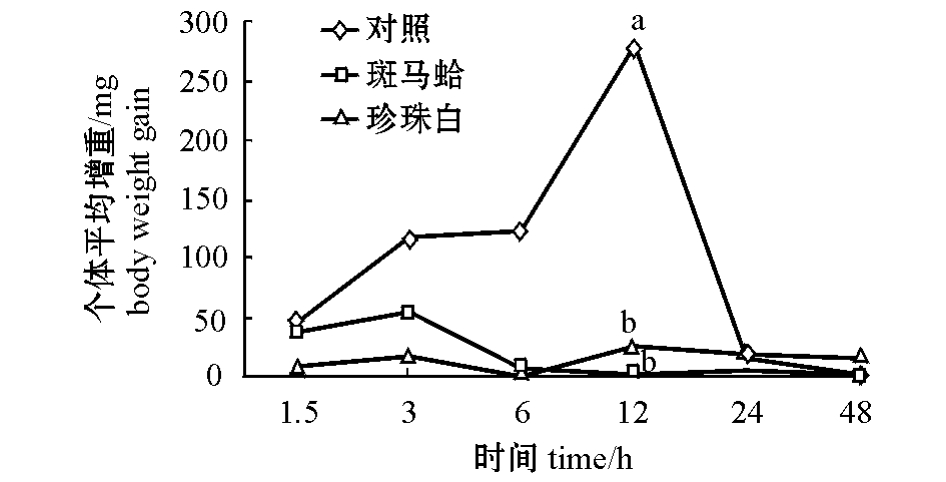
图1 3种壳色蛤仔个体平均增重的比较
Fig.1 Comparison of body weight gain in the clams with three shell colors
注:标有不同小写字母者表示不同壳色群体间有显著性差异(P<0.05),下同。
Note:The means with different letters indicate significant difference between different shell colour groups(P<0.05),et sequentia.
2.2 3种壳色蛤仔血浆渗透压变化的比较
从图2可见:3种壳色蛤仔血淋巴渗透压都表现出逐渐降低的趋势,第0、1.5、3、6、12 h时,珍珠白、斑马蛤血淋巴渗透压与对照组蛤仔无显著性差异 (P>0.05);第24 h时,斑马蛤血淋巴渗透压显著高于对照组 (P<0.05);第48 h时,斑马蛤血淋巴渗透压 (0.474 mOsm/mg)与海水(0.465 mOsm/mg)接近,而对照组蛤仔血淋巴渗透压 (0.549 mOsm/mg)和珍珠白蛤仔血淋巴渗透压 (0.602 mOsm/mg)略高于海水渗透压,但各组间无显著性差异 (P>0.05)。
2.3 3种壳色蛤仔血浆Na+和Cl-浓度的比较
从图2可见:第0、1.5、3、6、12 h时,各组蛤仔血淋巴Na+浓度变化较小,各组间无显著性差异 (P>0.05);之后各组都出现一个升高过程,第24 h时,珍珠白和斑马蛤血淋巴Na+浓度显著高于对照组 (P<0.05)。
从图2可见:对照组蛤仔血淋巴Cl-浓度呈先升高后降低的趋势,第3 h和第24 h时分别出现一个最高值和最低值;斑马蛤和珍珠白血淋巴Cl-浓度呈先降低后升高的趋势,斑马蛤在第6 h和第12 h时、珍珠白在第1.5 h和第24 h时分别出现一个最低值和最高值;第24 h时,斑马蛤和珍珠白血淋巴Cl-浓度均显著高于对照组 (P<0.05)。
2.4 蛤仔血浆蛋白和鳃组织ATP酶活性的比较
从图2可见:3种壳色蛤仔血浆蛋白浓度呈先升高后降低的趋势;第6 h时,珍珠白蛤仔血浆蛋白浓度显著高于斑马蛤 (P<0.05);第48 h时,斑马蛤血浆蛋白浓度显著高于珍珠白 (P<0.05),其余时间点各组间均无显著性差异 (P>0.05)。
从图2可见:3种壳色蛤仔鳃组织ATP酶活性都呈先升高后降低的趋势;第1.5、6、24 h时,珍珠白鳃组织ATP酶活性显著高于斑马蛤 (P<0.05);第6 h和第24 h时,珍珠白鳃组织ATP酶活性显著高于对照组 (P<0.05),其余时间点各组间均无显著性差异 (P>0.05)。
2.5 3种壳色蛤仔血细胞总数变化的比较
从图2可见:3种壳色蛤仔血细胞总数都呈先升高后降低的趋势;第1.5 h时,珍珠白和斑马蛤血细胞总数显著低于对照组 (P<0.05);第6 h时,珍珠白血细胞总数显著高于斑马蛤 (P<0.05);第12 h时,斑马蛤血细胞总数显著低于对照组 (P<0.05);而第48 h时,斑马蛤血细胞总数显著高于对照组 (P<0.05)。
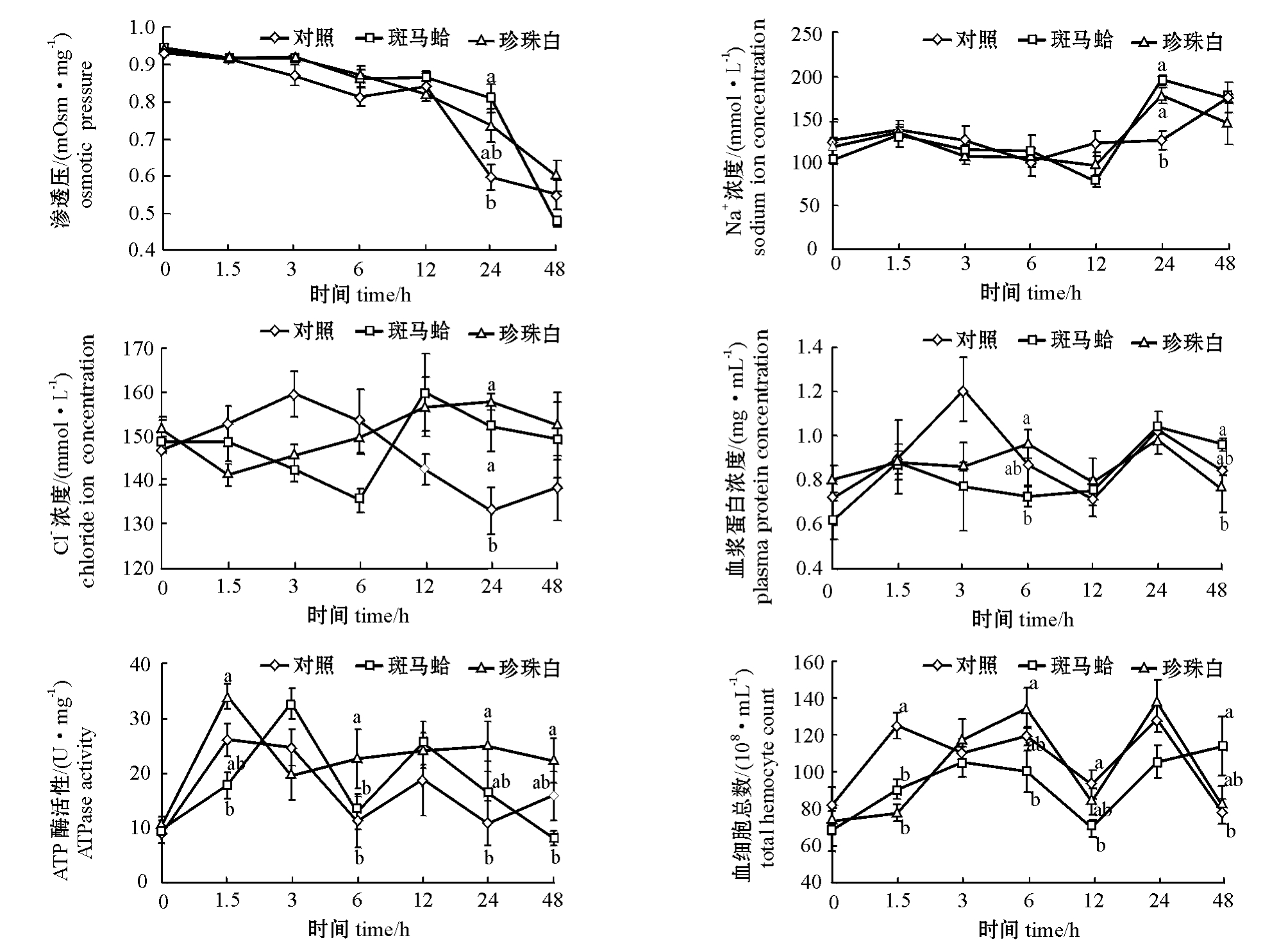
图2 3种壳色群体蛤仔血浆渗透压、Na+浓度、Cl-浓度、血淋巴蛋白浓度、ATP酶活性和血细胞总数变化的比较
Fig.2 Comparative changes in osmotic pressure,sodium and chloride ion concentrations,plasma protein concentra tions,ATPase activity and total hemocyte count in the clam with three shell colors
贝类壳色是可以遗传的,壳色及色素沉积模式由简单的孟德尔遗传基础控制,环境因素尤其是生长环境的盐度和温度对壳色选择有重要影响,是不同群体之间或同一群体中产生壳色多态性的重要原因之一[10]。如泥螺 Batillaria attramentaria壳色的多态性与潮汐和环境温度变化有关[11],而对滩栖螺Littorina obtusata和Littorina saxatilis的相关研究也表明,水环境温度和盐度对壳色显型的选择均具有较高的贡献[12-14]。贝类壳色是自然选择的结果,具有适应意义的性状在进化中才会被保留下来,因此,贝类的壳色与其盐度耐受能力之间可能具有某种相关性。
贝类主要通过其头部的触角、外套膜边缘和出水管表面上的两种感受器 (渗透压感受器和离子感受器)感受外界环境渗透压和离子浓度的变化。当外界环境盐度短时间降低时,贝类可以通过关闭贝壳,使机体与低盐环境隔离,减小低盐对自身的伤害。因此,贝壳的密闭性能够维持短期内其对盐度变化的耐受能力。Bauchau[15]的假说认为:贝类生长受神经调控,贝壳色素作为一种稳定的信号标记能够被神经末梢识别,并且神经系统对不同色素的识别能力不同,色素分布形状能够调节贝壳生长过程以获得最佳的结构 (如双壳类贝壳的对称性),而对称性良好的贝壳具有更好的密闭性,因此,壳色花纹可能会通过调节贝壳的对称性而对其低渗耐受能力产生影响。当低渗溶液进入到贝类体内后,一部分会进入细胞而使细胞体积增大,导致体质量增加[16]。本研究结果表明,将蛤仔转入低盐海水后,对照组体质量增加最多,其他两个壳色的个体增重不明显,同时对照组的死亡率最高,珍珠白壳色居中,斑马蛤最低,表明3种壳色蛤仔对低盐耐受能力不同,可能与壳色花纹有一定关系。
本研究中,在盐度为15的海水环境中,蛤仔血淋巴渗透压逐渐降低,48 h后斑马蛤渗透压与海水几乎相同,而对照组和珍珠白略高于海水,这与对贻贝 Mytilus edulis[17]和杂色鲍Haliotis diversicolor supertexta[18]的相关研究结果相一致。研究表明:当环境渗透压发生变化时,贝类体内的Na+和Cl-在渗透压调节过程中发挥重要作用,盐度降低时这些离子的通道被激活,离子从细胞内泵出,通过降低细胞内的离子浓度来保持细胞内外渗透压平衡[19]。本研究中,仅对照组血淋巴中Cl-浓度在3 h时出现一个短暂升高,随后恢复到原来的水平,其他两种壳色血淋巴中Cl-浓度在试验期内均未出现显著变化,而对照组的结果与Cheng等[18]在鲍中观察到的结果一致。3种壳色蛤仔血淋巴中Na+浓度在试验前期未出现较大波动,但对照组在第48 h时、两个试验组在第24 h时达到最大浓度, Na+浓度升高可能是细胞内Na+被转移到细胞外的结果。Cheng等[18]研究发现:鲍血淋巴中 Cl-和Na+对渗透压的贡献率分别为37.1% ~42.2% 和47.7%~51.6%。本研究中渗透压降低没有伴随离子浓度的降低,其原因可能有以下两个方面:1)蛤仔属于双壳贝类,在低盐环境中可以形成封闭空间,而鲍无法形成类似空间,因此,二者在渗透压调节方式上有所区别;2)贝类血淋巴中的蛋白质和游离脂肪酸如牛磺酸等在贝类短期渗透压调节中发挥了重要作用[20]。本研究中3种壳色蛤仔鳃组织ATP酶在试验初期都表现出升高趋势,表明蛤仔体内离子调节的途径可能发挥了作用。
研究发现,贝类在短期内能够通过提高细胞内蛋白质和RNA的合成速度以适应渗透压变化,其原因主要是低盐胁迫导致贝类体内一些参与调节渗透压的酶类被诱导表达,不过在较长时间的适应过程后 (几天或几周后)其合成速度会逐渐恢复正常[21]。这与本研究的结果相一致,对照组血浆蛋白在第3 h和第24 h时分别出现一个升高的过程,其他两种壳色在第24 h时达到最大值,随后都逐渐恢复到正常值。
本研究中,观察到盐度降低导致各种壳色蛤仔血细胞总数增多的现象,对照组在第1.5 h和24 h时、斑马蛤在第3 h和48 h时、珍珠白蛤在第6 h和24 h时分别达到一个峰值,这一结果与Matozzo等[9]对帘蛤Chamelea gallina的研究结果一致。盐度降低能够促使大量血细胞从组织进入血淋巴,以增强个体在环境胁迫下的防御能力,是动物对环境变化的一种适应性反应。
相关生理指标的测定结果表明,3种壳色的蛤仔对短期低盐胁迫的适应过程并未表现出显著的差异,但对照组在低盐条件下表现出最高的死亡率,而斑马蛤死亡率最低,其原因可能是由于贝类的密闭性不同所致,而壳密闭性主要与其对称性有关,壳对称性又与壳色花纹有关。因此,个体的低盐耐受能力可能与壳色有一定的相关性,不过,由于本试验仅使用1个低盐条件,选用的壳色群体相对较少,试验时间也相对较短,这一结论有待进一步研究证实。
参考文献:
[1]中国渔业协会.中国2008渔业年鉴[M].北京:中国农业出版社,2009:321.
[2]王庆恒,邓岳文,杜晓东,等.马氏珠母贝4个壳色选系 F1幼虫的生长比较[J].中国水产科学,2008,15(3):487-492.
[3]Huaiping Z,Guofan Z,Xiao L.Comparison of growth and survival of larvae among different shell color stocks of bay scallop Argopecten irradians irradians(Lamarck 1819)[J].Chinese Journal of O-ceanology and Limnology,2005,23(2):183-188.
[4]赵鹏,丁君,常亚青.两种壳色虾夷扇贝壳体尺性状对活体重影响效果的分析[J].大连海洋大学学报,2011,26(1):1-5.
[5]丁鉴锋,杨霏,闫喜武,等.不同壳色菲律宾蛤仔免疫机能的比较研究[J].大连海洋大学学报,2012,27(5):411-416.
[6]闫喜武,张国范,杨凤,等.菲律宾蛤仔莆田群体两个壳色品系生长发育的比较[J].大连水产学院学报,2005,20(4):266-269.
[7]闫喜武,张跃环,霍忠明,等.不同壳色菲律宾蛤仔品系F2的表型性状[J].水产学报,2010,34(6):881-889.
[8]闫喜武,张跃环,孙焕强,等.菲律宾蛤仔两道红与白斑马品系的三元杂交[J].水产学报,2010,34(8):1190-1197.
[9]Matozzo V,Monari M,Foschi J,et al.Effects of salinity on the clam Chamelea gallina.Part I:alterations in immune responses[J].Marine Biology,2007,151(3):1051-1058.
[10]管云雁,何毛贤.海产经济贝类壳色多态性的研究进展[J].海洋通报,2009,28(1):108-114.
[11]Miura O,Nishi S,Chiba S.Temperature-related diversity of shell colour in the intertidal gastropod Batillaria[J].Journal of Molluscan Studies,2007,73(3):235.
[12]Sergievsky S O,Berger V J.Physiological differences of principal shell-colour phenotypes of the gastropod mollusc Littorina obtusata [J].Biol Moria,1984,2:36-44.
[13]Phifer-Rixey M,Heckman M,Trussell G,et al.Maintenance of clinal variation for shell colour phenotype in the flat periwinkle Littorina obtusata[J].Journal of Evolutionary Biology,2008,21(4): 966-978.
[14]Sokolova I,Berger V J.Physiological variation related to shell colour polymorphism in White Sea Littorina saxatilis[J].Journal of Experimental Marine Biology and Ecology,2000,245(1):1-23.
[15]Bauchau V.Developmental stability as the primary function of the pigmentation patterns in bivalve shells?[J].Belgian Journal of Zoology,2001,131(Suppl.2):23-28.
[16]Burton R.Ionic regulation and water balance:volume 5[C]//The Mollusca.New York:Academic Press Inc,1983:291-352.
[17]Livingstone D,Widdows J,Fieth P.Aspects of nitrogen metabolism of the common mussel Mytilus edulis:adaptation to abrupt and fluctuating changes in salinity[J].Marine Biology,1979,53(1): 41-55.
[18]Cheng W,Yeh S P,Wang C S,et al.Osmotic and ionic changes in Taiwan abalone Haliotis diversicolor supertexta at different salinity levels[J].Aquaculture,2002,203(3/4):349-357.
[19]Natochin Y V,Berger V Y,Khlebovich V,et al.The participation of electrolytes in adaptation mechanisms of intertidal molluscs'cells to altered salinity[J].Comparative Biochemistry and Physiology Part A:Physiology,1979,63(1):115-119.
[20]Hosoi M,Takeuchi K,Sawada H,et al.Expression and functional analysis of mussel taurine transporter,as a key molecule in cellular osmoconforming[J].Journal of Experimental Biology,2005,208 (22):4203.
[21]Berger V J,Kharazova A.Mechanisms of salinity adaptations in marine molluscs[J].Hydrobiologia,1997,355(1):115-126.
Comparative tolerance to low salinity stress in Manila clam Ruditapes philippinarum with three shell colors
Abstract:The mortality rate,average body weight increment,the osmotic pressure,ATPase activity,total haemocyte count(THC),and sodium ion concentration,chloride ion concentration,and plasma protein concentration of haemolymph were monitored in Manila clam Ruditapes philippinarum with different shell colors exposed to low salinity of 15 for 0,1.5,3,6,12,24 and 48 h to evaluate the toleration of the clam with different shell colors to low salinity stress.The results showed the minimal mortality(3.92%)was observed in the zebra color clam which had significantly higher haemolymph osmotic pressure than in the control group at 24 h(P<0.05),all the three groups showing approximate haemolymph osmotic pressure to seawater at 48 h.The increasing haemolymph sodium concentrations was found in the three shell color groups,the peak level in the zebra group and pearl-white group clam, and significantly higher than in the control group at 24 h(P<0.05).There were increase first in chloride ion concentration in the control group clams,but the zebra group and pearl-white group clam showed a trend of initial decrease in chloride ion concentration in the zebra color group and pearl-white color group,even though significantly higher than in the control group at 24 h(P<0.05).The ATPase activity all had an increase process in gills of the three shell color groups,pearl-white clam showing significantly higher than the clam in the control group did at 6 h and 24 h(P<0.05).The total hemocyte count(THC)was also fluctuated in the experiment,and the zebra group and pearl-white group clams had significantly lower THC than the clams in the control group(P<0.05),but the zebra group had significantly higher than the clam in the control did at 48 h(P<0.05).
Key words:Ruditapes philippinarum;shell color;low salinity stress;osmotic pressure;ATPase activity
中图分类号:S968.31
文献标志码:A
收稿日期:2012-07-02
基金项目:国家 “863”计划项目 (2012AA10A410-2);国家现代农业产业技术体系建设专项经费资助项目 (CARS-48);大连海洋大学博士启动基金资助项目 (SYBS201201)
文章编号:2095-1388(2013)03-0264-05