摘要:以鱼肠道弧菌Vibrio ichthyoenteri为抗原免疫小鼠,用PEG法将小鼠脾细胞与SP2/0骨髓瘤细胞融合,分别采用酶联免疫吸附 (ELISA)技术和间接免疫荧光抗体 (EFAT)技术筛选强阳性杂交瘤细胞株,亚克隆阳性细胞株,获得5株抗鱼肠道弧菌单克隆抗体 (1C6、1D8、2D7、2D10、2E3)。Western blotting分析结果显示,单抗2D10与相对分子质量为44 200、36 700的鱼肠道弧菌蛋白发生特异性结合;用流式细胞术 (FCM)检测单抗强度,结果显示阳性荧光比例为13.63%,阴性对照荧光比例不足1%;人工感染牙鲆试验结果表明,运用该单抗能够建立鱼肠道弧菌的快速诊断方法。
关键词:鱼肠道弧菌;单克隆抗体;制备
鱼肠道弧菌Vibrio ichthyoenteri是日本学者Ishimaru等[1]首次发现并命名的一种新弧菌,Kim等[2]从患病牙鲆体内分离到该菌。近年来,由鱼肠道弧菌引起的疾病尤为严重,表现出较高的死亡率和较广的流行面积,给水产养殖业造成了巨大的经济损失[3-5]。目前已有对鱼肠道弧菌生物学特性、病原性及外膜蛋白等的研究报道[4-5]。单克隆抗体具有与抗原结合特异性强、生物活性单一、理化性质相对稳定等优点,在水生动物细菌性疾病研究中广泛应用[6],已制备了爱德华氏菌Edwardsiella tarda、副溶血弧菌Vibrio parahaemolyticus、嗜麦芽寡养单胞菌Stenotrophomonas maltophilia、黄海希瓦氏菌Shewanella smarisflavi等的单克隆抗体[7-10]。本研究中,作者以鱼肠道弧菌为抗原免疫小鼠,利用细胞融合技术,获得了抗鱼肠道弧菌单克隆抗体,并进行初步应用,旨在为建立鱼肠道弧菌的快速诊断方法提供基础数据。
1.1 材料
本研究中所用菌株均由江苏省海洋生物技术重点建设实验室提供;Balb/C小鼠购于山东大学实验动物中心;健康牙鲆取自山东日照某牙鲆养殖场。
弗氏完全佐剂 (Comeplete adjuvant)、弗氏不完全佐剂 (Incomplete adjuvant)、碱性磷酸酶(Alkaline phosphatase,AP)标记羊抗小鼠IgG、对硝基苯磷酸盐 (pNPP-Na)、异硫氰酸荧光素(Fluorescein isothiocyanate,FITC)标记羊抗小鼠IgG、5-溴-4-氯-3-吲哚-磷酸BCIP、氯化硝基四氮唑蓝 NBT、聚乙二醇 (Polyethylene glycol, PEG)均购自Sigma公司。
1.2 方法
1.2.1 抗原的制备 将鱼肠道弧菌接种于液体培养基中,收集细菌并调整浓度为9×109CFU/mL,然后用体积分数为0.5%的福尔马林溶液灭活,涂板,观察无活菌即可。
1.2.2 小鼠免疫及细胞融合 将抗原与弗氏完全佐剂按等体积混合后,给Balb/C小鼠腹腔注射0.1 mL,2周后将抗原与弗式不完全佐剂等体积混合后再给Balb/C小鼠腹腔注射0.1 mL,而后每隔1周加强免疫一次,尾静脉注射抗原0.1 mL,共两次。最后一次免疫后3 d,取免疫小鼠脾细胞与SP2/0瘤细胞融合。以HAT选择性培养基为培养液,将融合后的细胞于体积分数为5%的CO2培养箱 (37℃)中培养。
1.2.3 用酶联免疫吸附 (ELISA)法筛选杂交瘤细胞株 调整细菌浓度为1×108CFU/mL,包被酶标板,用戊二醛固定;用质量分数为2%的牛血清白蛋白BSA封闭;滴加细胞上清液,以免疫小鼠血清为阳性对照,骨髓瘤细胞上清为阴性对照,于37℃下孵育1 h,用PBS-T(含0.05%Tween-20)洗涤3次,每次5 min;加AP酶标记羊抗小鼠IgG (1∶3 000),于37℃下孵育1 h,再用PBS-T洗涤3次,每次5 min;加入pNPP-Na反应20 min,加入NaOH终止反应;用酶标仪进行测定。
1.2.4 用间接免疫荧光 (IFAT)法筛选杂交瘤细胞株 将浓度为1×108CFU/mL的菌悬液滴片用丙酮固定;加入细胞上清液,于37℃下温育1 h,用PBS-T洗涤3次,每次5 min;加入FITC标记羊抗小鼠IgG(1∶256),于37℃下温育1 h,再用PBS-T洗涤3次,每次5 min;封片,在荧光显微镜下观察。
1.2.5 阳性细胞株的亚克隆 采用有限稀释法进行阳性细胞株的亚克隆。打散杂交瘤细胞株,计数,取100个阳性杂交瘤细胞置于10 mL培养液中,混匀,滴入96孔培养板中,每孔100 μL,于37℃下用体积分数为5%的CO2培养,用IFAT法检测。
1.2.6 特异性试验 以浓度为1×108CFU/mL的鱼肠道弧菌、鳗弧菌Vibrio anguillarum、副溶血弧菌、溶藻胶弧菌 V.alginolyticus、 哈维氏弧菌V.harveyi、嗜水气单胞菌Aeromonas hydrophila和迟钝爱德华氏菌包被酶标板,以鱼肠道弧菌单克隆抗体为一抗,以AP酶标记羊抗小鼠IgG(1∶3 000)作为二抗,参照上述ELISA方法进行特异性试验。
1.2.7 Western blotting分析抗原决定簇分子量
电泳凝胶由12%的分离胶和5%的浓缩胶两部分组成。将浓度为9×109CFU/mL的鱼肠道弧菌与电泳样品缓冲液 (0.5 mol/L Tris-HCl pH 6.8,1% SDS,1%疏基乙醇,10%甘油,0.02%溴酚蓝)等体积混合,用Tris甘氨酸 (Gly)为电泳缓冲液(0.025 mol/L Tris,0.25 mol/L Gly,0.1%SDS, pH 8.3),电泳完成后,转移到电泳转移槽中,恒流200 mA转移4 h。将硝酸纤维素膜 (NC膜)用2%的BSA溶液封闭,于4℃下过夜,用PBS洗涤3次,每次5 min;加入单抗后,于37℃下孵育45 min,用PBS-T洗涤3次,每次5 min;加入AP酶标记羊抗小鼠IgG(1∶500)后,于37℃下孵育45 min,用PBS-T洗涤3次,每次5 min;加入NBT/BCIP后,于室温下显色。
1.2.8 用流式细胞术 (Flow cytometry,FCM)检测单抗强度 培养细菌,收集并调整细菌悬液至合适浓度,取菌悬液100 μL,加入抗鱼肠道弧菌单克隆抗体100 μL(阴性对照为SP2/0骨髓瘤细胞上清液),于37℃下温育1 h,用PBS-T离心洗涤3次;加入FITC标记的羊抗小鼠IgG(1∶256)后,于37℃下温育1 h,用PBS-T离心洗涤3次;用流式细胞仪检测,用WinMDI 2.9软件进行分析。1.2.9 人工感染试验的检测 将健康牙鲆 (体长为15 cm左右)养殖于隔离的循环水箱内,水温为18~20℃,暂养1周后取健康鱼进行感染试验。试验组牙鲆腹腔注射浓度为5×108CFU/mL鱼肠道弧菌悬液0.1 mL,对照组注射同剂量无菌生理盐水,每组注射10尾。感染鱼呈现明显症状后解剖,观察鳃、皮肤、肌肉、肝、肾等组织的病变情况,取病变组织进行细菌分离,取优势菌落纯化,用PBS重悬,采用上述ELISA法进行检测。
2.1 杂交瘤细胞株的建立
以鱼肠道弧菌免疫Balb/C小鼠,将小鼠脾细胞与SP2/0骨髓瘤细胞融合,用2%的HAT选择性培养基培养,两周后采用ELISA法和IFAT法检测,筛选分泌抗鱼肠道弧菌抗体的强阳性杂交瘤细胞,经3次有限稀释法克隆,获得5株能稳定分泌抗鱼肠道弧菌单克隆抗体的杂交瘤细胞,编号分别为1C6、1D8、2D7、2D10、2E3。
2.2 用ELISA法检测强阳性杂交瘤
用间接ELISA法检测融合细胞上清液中的抗体,以OD492nm≈1.0,P/N≥2.1判为阳性,其中P/N[11]的计算公式为筛选出5株强阳性杂交瘤细胞 (1C6、1D8、2D7、2D10、2E3),其OD492nm值和P/N值见表1。
2.3 用IFAT法检测强阳性杂交瘤
荧光显微镜下观察发现,阴性对照 (图1-A)背景为黑色,不显示绿色荧光信号;而单抗1C6、1D8、2D7、2D10、2E3视野中可见绿色荧光信号覆盖菌体,清晰,明亮,荧光信号呈现绿色长弧形,且两端钝圆,与鱼肠道弧菌形状一致 (图1-B)。
2.4 特异性试验结果
单克隆抗体与鱼肠道弧菌、鳗弧菌、副溶血弧菌、溶藻胶弧菌、哈维氏弧菌、嗜水气单胞菌、迟钝爱德华氏菌7种菌株的特异性反应结果见表2。从表2可见:5株单抗中只有2D10与鱼肠道弧菌发生反应,与其他参考菌株无交叉反应,具有较好的特异性;其他4株单抗与参考菌株均有不同程度的交叉反应。
表1 用ELISA法筛选单克隆抗体的结果
Tab.1 ELISA reactivity of MAbs against Vibrio ichthyoenteri
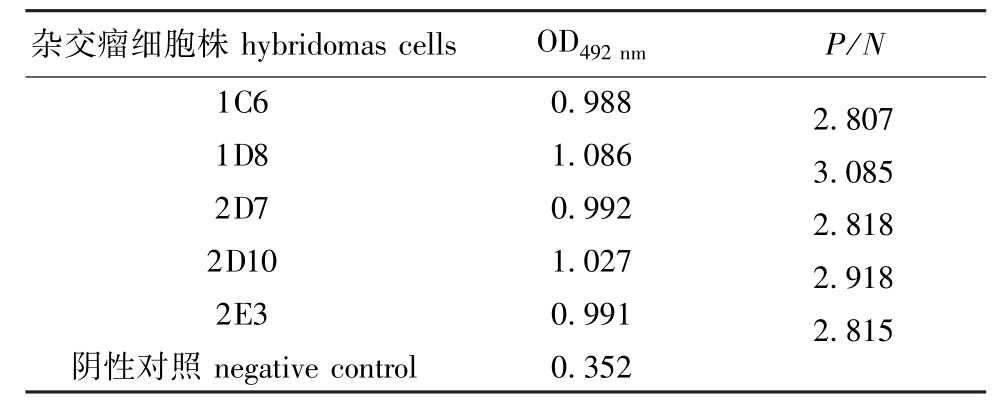
杂交瘤细胞株 hybridomas cells OD492nmP/N 1C6 1D8 2D7 2D10 2E3阴性对照 negative control 0.988 1.086 0.992 1.027 0.991 0.352 2.807 3.085 2.818 2.918 2.815
表2 单克隆抗体特异性的ELISA检测结果(数值为P/N值)
Tab.2 The reaction of the MAbs against various bacterial species(value for P/N)
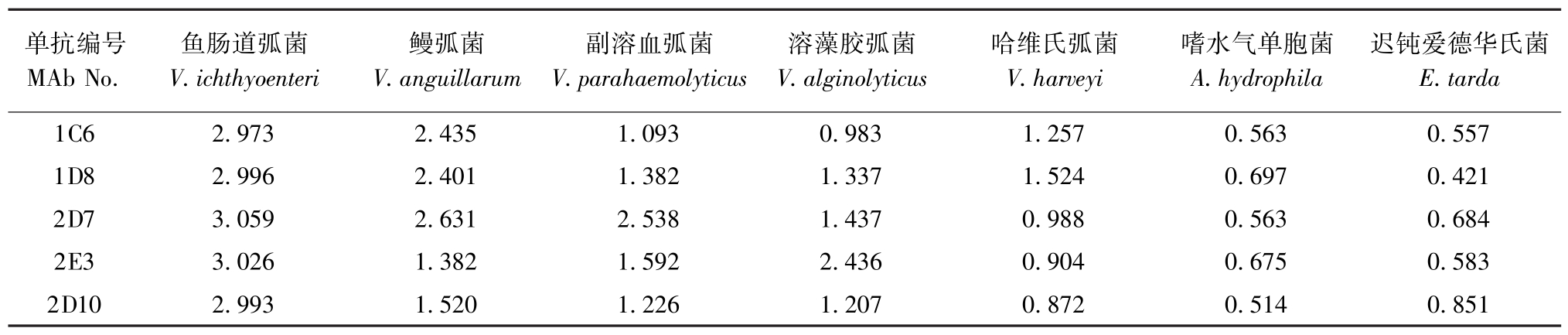
单抗编号MAb No.鱼肠道弧菌V.ichthyoenteri鳗弧菌V.anguillarum副溶血弧菌V.parahaemolyticus溶藻胶弧菌V.alginolyticus哈维氏弧菌V.harveyi嗜水气单胞菌A.hydrophila迟钝爱德华氏菌E.tarda 1C6 2.973 2.435 1.093 0.983 1.257 0.563 0.557 1D8 2.996 2.401 1.382 1.337 1.524 0.697 0.421 2D7 3.059 2.631 2.538 1.437 0.988 0.563 0.684 2E3 3.026 1.382 1.592 2.436 0.904 0.675 0.583 2D10 2.993 1.520 1.226 1.207 0.872 0.514 0.851
2.5 抗原决定簇分子量的分析
经SDS-PAGE电泳后,凝胶采用考马斯亮蓝染色,结果如图2-A所示:共显示21条带,染色相对较深的有6条蛋白带。单抗2D10的Western blotting结果可见2条清晰蛋白条带 (图2-C),其相对分子质量分别为44 200和36 700。
2.6 用FCM法检测单抗强度
利用FCM法验证单抗与抗原特异性结合时,参照林海英等[12]的方法设置1×105、1×106、1× 107、1×108CFU/mL 4个菌液浓度,结果发现菌液浓度为1×106CFU/mL时效果最佳。以荧光强度的对数 (Fluorescence,FL1-H)为横坐标,以相对菌体的数量 (Counts)为纵坐标,在直方图上以标尺(Marker)划定区域分析比例,图3-A为阴性对照结果,M1=99%,即阴性对照中未被荧光标记的细菌比例高达99%;图3-B为阳性结果,M1= 86.37%,M2=13.63%,表明加入单克隆抗体的试验组中被荧光标记的阳性细菌比例为13.63%。
2.7 人工感染牙鲆组织中鱼肠道弧菌的检测
人工感染牙鲆第4天,感染组牙鲆出现发病症状,牙鲆腹部有充血现象,剖检发现肝脏充血、肾脏肿胀、有少量腹水,对照组牙鲆无任何症状。取发病牙鲆肝脏、脾、肾、心脏、鳃等组织分离细菌并进行ELISA检测,发现其肝脏、脾、肾、鳃及腹水组织的检测结果均为阳性,对照组为阴性。
本研究中,以鱼肠道弧菌为抗原免疫小鼠,制备该菌的单克隆抗体,针对杂交瘤细胞克隆筛选时样品多、时间紧等要求,结合ELISA技术处理简便、检测量大的特点[11,13],首先采用该法检测,判定5株杂交瘤细胞株 (1C6、1D8、2D7、2D10、2E3)为阳性;随后又采用可直观判定结果的IFAT方法再次确认[14],镜检发现菌体呈现明亮的绿色荧光信号,而阴性对照无荧光信号,该结果再次证实5株杂交瘤细胞株为阳性。
为了解获得的单克隆抗体特性,进行了特异性试验[9],除采用弧菌属细菌进行特异性筛选外,另选用部分水生生物常见致病菌株如嗜水气单胞菌、迟钝爱德华氏菌等,结果显示单抗1C6、1D8、2D7、2E3等与鳗弧菌、副溶血弧菌、溶藻胶弧菌等弧菌属参考菌株有不同程度的交叉反应,与迟钝爱德华氏菌、嗜水气单胞菌等反应均为阴性。分析认为,可能是由于弧菌属不同菌株间具有共同抗原决定簇[15-16],而与单抗1C6、1D8、2D7、2E3结合的抗原决定簇为构象表位或线性表位,以及编码这些共同抗原表位的基因组是否存有差异,有待今后进一步研究。本试验中,只有单抗2D10与弧菌属其他菌株及嗜水气单胞菌、迟钝爱德华氏菌等反应均为阴性,因此,仅对单抗2D10进行了Western blotting和FCM分析。
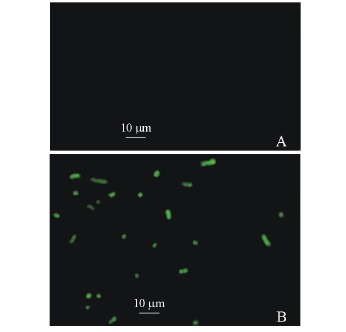
图1 免疫荧光法筛选阳性抗鱼肠道弧菌单抗试验结果
Fig.1 The positive hybridomas reaction with MAbs by immunofluorescence assay screening
注:A为阴性对照;B为阳性结果。
Note:A,Negative control;B,Positive result.
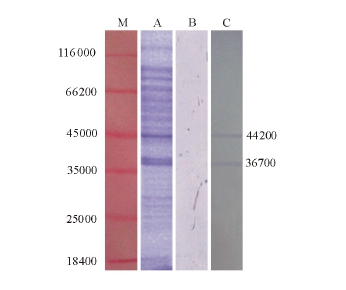
图2 鱼肠道弧菌电泳图谱和单抗2D10免疫印迹反应
Fig.2 Analysis of MAb 2D10 against V.ichthyoenteri by Western blotting
注:M为标准蛋白;A为鱼肠道弧菌电泳图谱;B为阴性对照;C为单抗2D10。
Note:M,Marker;A,Protein profile of V.ichthyoenteri by SDS PAGE;B,Negative control;C,MAb 2D10.
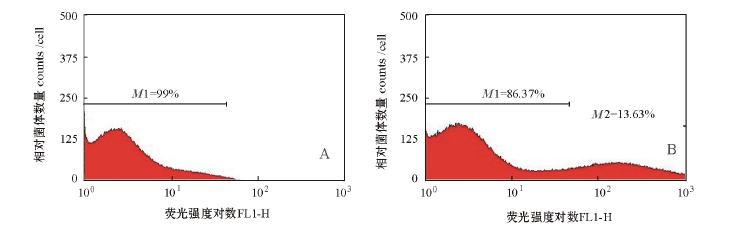
图3 流式分析单抗2D10荧光强度直方图
Fig.3 Detection of MAb 2D10 reaction to V.ichthyoenteri using Flowing Cytometry
注:A为阴性对照;B为阳性结果。
Note:A,Negative control;B,Positive result.
一般来讲,单抗只与某一特定抗原决定簇结合,即 Western blotting结果应该出现 1条蛋白带[17],本研究中单抗2D10经反应后,显示2条蛋白带,类似结果也出现在Sithigorngul等[18]的试验中。Xing等[19]认为,该类现象是由于抗原决定簇的多态性,即多个蛋白具有一段相同或相似的氨基酸序列,携带共同的抗原决定簇,或者是小分子量反应蛋白是大分子量反应蛋白的一部分,导致免疫印迹过程中显示多条蛋白带。
流式细胞术作为一种新技术,能够快速、准确、客观地对特定群体特征进行分析,同时可避免试验过程中人为造成的不确定性和试验假象[20],本试验中FCM显示荧光比例为13.63%,该结果直接证明制备的单克隆抗体与鱼肠道弧菌发生特异性结合反应,但是对照 Tang等[21]和林海英等[12]的试验,发现荧光比例不是很高。推测原因可能有两方面:一是采用杂交瘤细胞培养上清进行检测,其效价远低于小鼠腹水,结合细菌抗原较少[13];二是抗原制备和间接荧光标记试验过程中操作步骤较多,细胞破碎几率增大,部分抗体未能与抗原表位发生特异性结合,导致FCM检测结果中荧光比例不是很高[12,20]。
目前,鱼肠道弧菌检测主要通过对细菌生理生化指标测定等传统方法,其耗时长、工作量大[3-4],本研究中利用单克隆抗体对人工感染鱼肠道弧菌的牙鲆进行了初步ELISA检测,该结果对建立鱼肠道弧菌快速诊断技术具有一定的实际应用意义,但并未进行大范围使用,开发可应用于生产实践中的ELISA商品检测试剂盒等还有待于进一步研究。
参考文献:
[1]Ishimaru K,Matsushita M,Muroga K.Vibrio ichthyoenteri a pathogen of Japanese flounder(Paralichthys olivaceus)larvae[J].International Journal of Systematic Bacteriology,1996,46:155-159.
[2]Kim D H,Han H J,Kim S M,et al.Bacterial enteritis and the development of the larval digestive tract in olive flounder,Paralichthys olivaceus(Temminck&Schlege)[J].Journal of Fish Disease,2004,27(9):497-505.
[3]陈翠珍,房海,张晓君,等.牙鲆鱼肠道弧菌感染症及病原特性研究[J].热带海洋学报,2006,25(5):80-86.
[4]张晓君,陈翠珍,阎斌伦,等.红鳍东方鲀原鱼肠道弧菌的生物学特性研究[J].水生生物学报,2009,33(6):1118-1125.
[5]张新明,程顺峰.鱼肠道弧菌外膜蛋白疫苗对牙鲆免疫效果的初步研究[J].水产科技情报,2011,38(2):106-108.
[6]黄华,杜天舒,李强,等.单克隆抗体在水产病原微生物检测中的应用[J].中国农业科技导报,2012,14(2):145-150.
[7]金晓航,黄威权,夏永娟,等.迟缓爱德华菌抗独特性单克隆抗体的制备及鉴定[J].水生生物学报,2005,29(3):340-343.
[8]Ballamoole K K,Pendru R,Indrani K,et al.Development of monoclonal antibody based sandwich ELISA for the rapid detection of pathogenic Vibrio parahaemolyticus in seafood[J].International Journal of Food Microbiology,2011,145:244-249.
[9]黄艺丹,汪开毓,郑建,等.抗鱼类致病性嗜麦芽寡糖单胞菌单克隆抗体的制备及其生物学特性鉴定[J].中国兽医科学, 2010,40(9):907-912.
[10]景宏丽,李强,吴秋仙,等.黄海希瓦氏菌单抗介导间接ELISA快速检测技术的建立[J].大连海洋大学学报,2010,25(6): 547-550.
[11]樊景凤,梁玉波,宋立超,等.凡纳滨对虾红体病病原菌间接ELISA快速检测方法的研究[J].水产学报,2006,30(1):113-117.
[12]林海英,马振宁,郑允权,等.基于单克隆抗体的多元弧菌流式细胞术检测技术的研究[J].微生物学通报,2012,39(8): 1190-1196.
[13]郝贵杰,沈锦玉,曹铮,等.抗哈维氏弧菌单克隆抗体杂交瘤细胞系的建立及其特性鉴定[J].细胞与分子免疫学杂志, 2007,23(9):838-840.
[14]余俊红,姚斐,俞勇,等.应用间接荧光抗体技术快速检测花鲈病原菌——鳗弧菌[J].海洋水产研究,2002,23(2):38-44.
[15]张伟妮,周丽,邢婧,等.水产动物主要弧菌外膜蛋白结构的比较分析[J].海洋水产研究,2008,29(2):23-27.
[16]王忠,邓灯,刘慧,等.两种致病性弧菌外膜蛋白抗原特性的分析[J].大连海洋大学学报,2011,26(2):184-187.
[17]柳忠辉,吕昌龙.免疫学常用实验技术[M].北京:科学出版社,2002:68-76.
[18]Sithigorngul W,Rengpipat S,Tansirisittikul A,et al.Development of monoclonal antibodies for simple identification of Vibrio alginolyticus[J].Letters in Applied Microbiology,2006,43:436-442.
[19]Xing J,Zhan W B.Characterisation of monoclonal antibodies to haemocyte types of scallop(Chlamys farreri)[J].Fish&Shellfish Immunology,2005,19:17-25.
[20]贾永蕊.流式细胞术[M].北京:化学工业出版社,2009.
[21]Tang X Q,Zhan W B,Sheng X Z,et al.Immune response of Japanese flounder Paralichthys olivaceus to outer membrane protein of Edwardsiella tarda[J].Fish&Shellfish Immunology,2010,28: 333-343.
Preparation and characterization of monoclonal antibodies against Vibrio ichthyoenteri
Abstract:Five monoclonal antibodies(MAbs)(1C6,1D8,2D7,2D10,2E3)against Vibrio ichthyoenteri as a pathogen in marine animals were produced from hybridoma cells through Enzyme Linked Immunosorbent Assay (ELISA)and Indirect Immunofluorescence Assay Test(IFAT)by immunised Balb/C mice.The western blotting revealed that the protein of V.ichthyoenteri was shown to have molecular weight of 44 200 and 36 700,and the flowing cytometry(FCM)analysis showed that the MAb 2D10 reacted with positive cells had positive percent of 13.63%,and negative percent of less than 1%.Artificial infection experiment proved that the application of monoclonal antibody provided a method for the early diagnosis of V.ichthyoenteri.
Key words:Vibrio ichthyoenteri;monoclonal antibody;preparation
中图分类号:S948
文献标志码:A
收稿日期:2013-04-18
基金项目:国家自然科学基金资助项目 (30901106);江苏省水产三项工程项目 (PJ2010-58,DY2012-3-7);连云港市科技攻关项目(CG1134);青岛农业大学高层次人才科研基金资助项目 (630701)
文章编号:2095-1388(2013)03-0259-05