传染性造血器官坏死病毒糖蛋白的原核表达及多克隆抗体的制备
刘学光1,郑怀东1,郭欣硕1,罗靳1,蔺翠翠1,王秋雨2
(1.辽宁省水产品质量安全检验检测局,辽宁沈阳110031;2.辽宁大学生命科学院,辽宁沈阳110036)
摘要:通过人工合成方法得到传染性造血器官坏死病毒 (IHNV)糖蛋白 (G蛋白)基因,将该基因克隆到表达载体pET-30a,构建重组表达质粒pET-30a/IHNV-G,并转化至大肠杆菌BL21(DE3)plySs中。经SDS-PAGE电泳及Western blotting分析表明,在1 mmol/L IPTG(诱导剂)、37℃条件下诱导4 h后,G蛋白在大肠杆菌中成功表达,得到了相对分子质量约为57 000的G蛋白。采用直接切胶免疫小鼠的方法制备多克隆抗体,ELISA分析结果显示,血清效价可达到1∶10 000。本试验中得到的G蛋白和多抗血清可为IHNV疫苗的研制以及胶体金试纸条快速检测方法的建立提供理论基础。
关键词:病毒;原核表达;包涵体;G蛋白;抗体
传染性造血器官坏死病病毒 (Infectious hematopoietic necrosis virus,IHNV)被归类为诺拉弹状病毒属 Novirhabdovirus[1],属于负股 RNA 病毒[2-3]。IHNV囊膜表面有一个糖蛋白突起,即糖蛋白,又称为囊膜蛋白 (简称G蛋白)。在细胞受体与病毒的识别和结合等过程中,IHNV的G蛋白起着非常重要的作用,并直接关系到病毒的毒力。G蛋白还是病毒的主要抗原,可以诱导产生特异性免疫中和抗体,刺激细胞免疫[4-5]。因此,G蛋白是IHNV中非常重要的结构蛋白,对其进行基础性研究具有重要意义。
由IHNV引发的传染性造血器官坏死病 (Infectious hematopoietic necrosis,IHN)主要的感染宿主为鲑科鱼类,据研究表明,它能使受感染鱼苗(含幼鱼)的死亡率达到70%~90%。IHNV对世界范围内的鲑鱼养殖业造成了巨大的经济损失[6]。20世纪90年代,中国第一例IHN在辽宁省本溪的某养殖场被报道[7]。IHN被中国列为二类疫病,是口岸鱼类的第一类检疫对象。目前,国内外对IHN病的研究尚不成熟,还处在基础性研究阶段。IHNV病毒的检测技术主要有两类:一类是免疫学技术,如免疫荧光技术[8]、中和试验[9]、酶联免疫吸附试验[10-11]等;另一类是分子生物技术,如核酸杂交技术[12]和核酸扩增技术 (PCR、Real-time RT-PCR和等温扩增技术)等[13-15]。免疫学检测方法操作较繁琐,试验周期长;荧光定量PCR技术具有高特异性、高灵敏性、线性范围宽、操作简单等特点[16],但有其局限性,如样品的前处理复杂、分析耗时且需要特殊的仪器设备,从而不易推广。本研究中,作者从合成抗原入手,对G蛋白基因进行了原核表达,利用纯化的IHNV-G免疫小鼠制备多克隆抗体,以期为胶体金试纸条快速检测方法的建立奠定基础。
1 材料与方法
1.1 材料
克隆载体pMD18-T Simple、大肠杆菌宿主菌Escherichia coli JM109购自宝生物工程 (大连)有限公司;表达载体pET-30a由辽宁大学生命科学院细胞生物学实验室保存;大肠杆菌BL21(DE3) plySs感受态细胞购自天根生化科技 (北京)有限公司。Taq DNA聚合酶、限制性核酸内切酶 (KpnI和SalI)、T4DNA连接酶购自TaKaRa公司;质粒提取试剂盒、胶回收试剂盒均购自天根生化科技(北京)有限公司;弗氏完全佐剂(Freund's com-plete adjuvant,FCA)购自Sigma公司。
1.2 方法
1.2.1 目的基因的克隆及pET-30a/IHNV-G表达载体的构建 通过GeneBank检索IHNV-G蛋白基因序列,经优化后添加KpnI和SalI酶切位点、His标签,确定总长为1 545 bp的IHNV-G蛋白基因序列,并由宝生物工程 (大连)有限公司合成。将该基因连接到pMD18-T Simple载体,转化至E.coli JM109中,经PCR扩增,检测质粒中插入片段的长度,选取阳性克隆的菌落进行保存。
分别用KpnI和SalI将IHNV-G蛋白基因和pET-30a载体进行双酶切,酶切后用胶回收试剂盒回收产物。回收后的基因片段和回收后的pET-30a载体片段用T4DNA连接酶连接过夜,构建成pET-30a/IHNV-G重组表达质粒。将重组质粒转化至大肠杆菌BL21(DE3)plySs感受态细胞中,用氨苄青霉素抗性筛选,挑单菌落进行培养。用PCR方法筛选阳性克隆,用双酶切法鉴定是否重组成功,将鉴定为阳性的重组质粒送TaKaRa公司测序。
1.2.2 G蛋白的诱导表达及鉴定 将重组质粒转化至E.coli BL21(DE3)plySs感受态细胞中,挑取单个菌落接种于LB培养基中培养过夜,次日以1∶10的比例接种于LB培养基中,于37℃下振荡培养3 h,加入终浓度为1 mmol/L的IPTG(诱导剂)进行诱导表达,同时做阴性对照 (不加IPTG),表达时间分别为1、2、3、4、5 h。诱导后终止培养,离心收集菌体,用超声波破碎,于100℃下变性5 min,分别上样进行SDS-PAGE电泳分析,用考马斯亮蓝R-250染色并观察。
1.2.3 G蛋白的Western blotting分析 将G蛋白用1 mmol/L IPTG诱导4 h后,超声破碎菌液,常规制样后取10 μL上样至SDS-PAGE(12%分离胶)进行电泳,按照常规方法进行转膜。为了检测蛋白是否电转成功,采用丽春红染色,然后用蒸馏水洗涤数次至无色为止,用5 g/L脱脂牛奶在室温封闭2 h,加入抗His标签单克隆抗体,室温下结合1 h,4℃下孵育过夜,用TBST洗膜3次 (10 min/次),加入辣根过氧化物酶 (HRP)标记的羊抗鼠IgG抗体结合1 h,再用TBST洗膜3次 (10 min/次),用化学发光法显色并观察。
1.2.4 G蛋白包涵体的制备及纯化 取重组菌于37℃下振荡培养3 h,加入终浓度为1 mmol/L的IPTG,于37℃下诱导4 h。大量诱导表达的菌液经1×PBS重悬离心后收获菌体沉淀。加入超声缓
冲液重悬菌体,在液氮中反复冻融后超声破碎(400 W下工作5 s,间隔5 s),收集沉淀。用清洗缓冲液超声清洗包涵体沉淀,然后溶解包涵体,离心后将上清稀释至0.1~1.0 mg/mL,装入透析袋并置于梯度复性缓冲液中,于4℃下缓慢透析24~36 h。再于纯化缓冲液中透析后,进行SDS-PAGE电泳分析。
1.2.5 多克隆抗体的制备与鉴定 将包涵体洗涤后,经SDS-PAGE分离目的蛋白,在KCl溶液中染色,2~3 min后出现乳白色的目的条带,切下目的蛋白带,用PBS缓冲液洗去残留的KCl溶液,共洗涤2次,于-70℃下保存。初次免疫,将切下的蛋白凝胶磨碎,与弗氏完全佐剂按等体积比震荡混匀,给每只小鼠背部皮下多点注射,对照组小鼠用灭菌的PBS缓冲液和弗氏佐剂等体积比混匀后进行注射,注射量与试验组相同。3周后,第1次对小鼠加强免疫,将蛋白凝胶与弗氏不完全佐剂以等体积比混匀后给小鼠注射。每隔2周,使用上述方法进行第2次和第3次加强免疫。第3次加强免疫后1周,从小鼠尾部采血,将血液置于离心管中,在37℃下放置1 h,然后置于冰箱 (4℃)中过夜,待血清析出后提取血清。用酶联免疫吸附法(ELISA)检测效价:用纯化后的蛋白包被酶联反应板,稀释抗血清,第一个孔以1∶2 500的比例稀释,其余孔以1∶2的梯度倍比稀释,同时做阴性对照。用辣根酶标记的羊抗鼠IgG作为二抗,TMB显色,用酶标仪测定450 nm处的吸光值。
2 结果
2.1 pET-30a/IHNV-G表达载体的构建
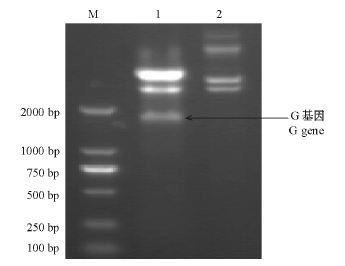
重组质粒经内切酶KpnI和SalI酶切后得到的酶切片段见图1,鉴定结果表明,目的基因插入到表达载体中并且其读码框正确,表明 pET-30a/ IHNV-G重组质粒成功构建。
2.2 G蛋白的诱导表达及SDS-PAGE分析
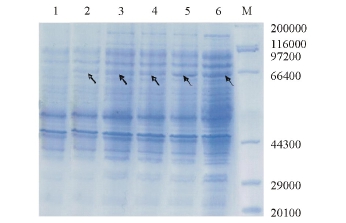
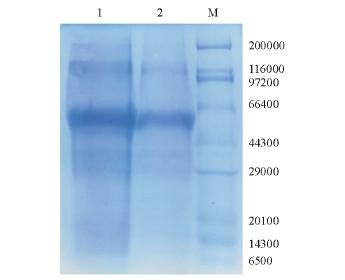
在IPTG浓度为1 mmol/L、温度为37℃,诱导表达4 h的条件下,G蛋白的表达量趋于稳定,在相对分子质量约57 000处有明显的表达条带(图2),与预计的理论值相符,表明目的基因得到了表达。超声破碎细菌后,对上清液和沉淀进行SDS-PAGE(12%分离胶)电泳,可见目的蛋白在上清液中的表达量很少,而在沉淀中有大量表达(图3),表明目的蛋白主要以包涵体的形式存在。
2.3 G蛋白的Western blotting分析
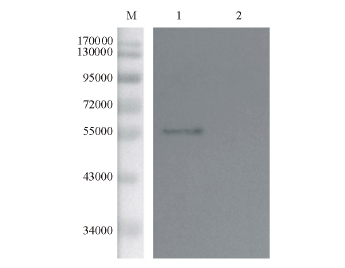
对G蛋白进行纯化处理后,采用Western blotting方法进一步进行验证。从图4可见,未经IPTG诱导的蛋白无条带,经IPTG诱导4 h后出现约57 000的特异性条带。结果表明,重组菌在37℃下经IPTG诱导4 h后,G蛋白在大肠杆菌中成功表达。
2.4 G蛋白包涵体的制备及纯化
G蛋白的表达产物基本上以包涵体形式存在于沉淀中。蛋白上样量为10 μL时分析得到明显蛋白条带,相对分子质量约为57 000(图3)。
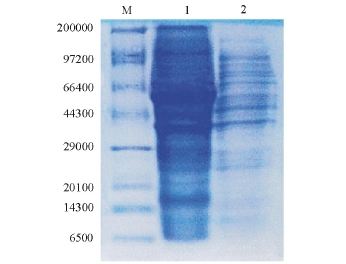
超声清洗后分离沉淀,收集用尿素充分洗涤后的包涵体,经梯度透析后,取纯化的目的蛋白进行SDS-PAGE电泳分析 (图5)。结果表明,目的条带相比透析前亮度有所减弱,但杂带明显减少,起到了纯化的目的。
2.5 多克隆抗体的制备与鉴定
以纯化的G蛋白包板,对制得的多克隆抗体血清稀释后进行ELISA检测。结果表明,多抗血清效价可达到1∶10 000(图6)。
3 讨论
IHNV的不同株系在核苷酸水平上具有较高的相似性,而在蛋白质水平上相似性较低。IHNV-G蛋白是IHN非常重要的蛋白,在诱导产生抗体及免疫保护机制中起着重要的作用。据文献报道,G蛋白基因可以诱导鲑鳟鱼类产生约75%的免疫保护率[17]。因此,G蛋白是重要的靶蛋白,在疫苗研制和诊断方法研究中起着非常重要的作用。
本研究中对G蛋白基因的原核表达及免疫反应性进行了研究。在原核表达系统中,pET表达系统在试验中经常被使用,很多种类的异源蛋白在大肠杆菌中都能够成功表达[18-21]。但是在大肠杆菌中表达的异源蛋白经常发生错误的折叠,并聚集成为包涵体。为了更好地得到表达的蛋白,许多科研工作者通过降低诱导温度,改变IPTG浓度及诱导时间等方法得到可溶性蛋白。本研究中对重组蛋白进行了可溶性分析,结果表明,重组蛋白的存在形式主要为包涵体,其内的重组蛋白质量分数普遍高于50%,其余的成分主要为内毒素、外膜蛋白、质粒DNA和多糖等[18]。
重组蛋白在表达的过程中,由于某些决定蛋白折叠的辅助因子缺乏,不能形成次级键,形成了包涵体,然而包涵体的形成是目的蛋白表达量很高的表现。作者认为,G蛋白基因在原核表达系统中成功表达的关键是有合适的受体菌,并且外源蛋白在细胞中以融合蛋白的形式存在。G蛋白包涵体的纯化方法简便 (采用破碎包涵体的方法纯化目的蛋白),将其经PBS悬浮和适当的佐剂乳化处理后,就可以直接用于注射免疫,制备抗体。
本研究中合成并克隆了IHNV的G蛋白基因序列,总长为1 545 bp,包含IHNV-G的全长基因,编码515个氨基酸。成功构建了大肠杆菌重组表达系统pET-30a/IHNV-G,能够在较短的时间内获得大量表达。得到了预期相对分子质量约为57 000的目的蛋白。切胶免疫小鼠制备多克隆抗体,经ELISA法检验,抗体效价达1∶10 000以上。重组蛋白具有纯度高、易于得到、实用性强等优点,本研究中采用重组G蛋白作为抗原来制备抗体,在一定程度上降低了病毒传播的风险,但重组抗原在抗原决定簇上与天然蛋白相比可能存在差异。
综上所述,IHNV-G蛋白及多克隆抗体的获得为进一步研究G蛋白基因提供了有利的技术支持,也为胶体金试纸条快速检测方法的研究和试剂盒的开发应用奠定了基础。
参考文献:
[1]Walder P J,Benmansour A,Calisher C H,et al.Family rhabdoviridae[C]//Van-Regenmortel M H,Bishop D H,Fauquet C M.The seventh report of the International Committee on Taxonomy of Viruses.San Diego:Academic Press,2000:563-583.
[2]吴金炉,曾志南.鱼类病毒病与鱼类病毒疫苗[J].海洋科学, 1999,23(4):7-42.
[3]Wolf K.Fish viruses and fish viral diseases[M].New York:Cornell University Press,1988:476-493.
[4]Boudinot P,Blanco M,de Kinkelin P,et al.Combined DNA immunization with the glycoprotein gene of viral hemorrhagic septicemia virus and infectious hematopoietic necrosis virus induces doublespecific protective immunity and nonspecific response in rainbow trout[J].Virology,1998,249(2):297-306.
[5]Corbeil S,Lapatra S E,Anderson E D,et al.Evaluation of the protective immunogenicity of the N,P,M,NV and G proteins of infectious hematopoietic necrosis virus in rainbow trout Oncorhynchus mykiss using DNA vaccines[J].Diseases of Aquatic Organisms, 1999(1):29-36.
[6]St-Hillarie S,Ribble C S,Siephen C,et al.Epidemiological investigation of infectious hematopoietic necrosis virus in salt water netpen reared Atlantic salmon in British Columbia,Canada[J].Aquaculture,2002,212:49-67.
[7]赵志壮,牛鲁祺.中国本溪虹鳟一株弹状病毒的分离及初步研究[J].水生生物学报,1994,18(4):348-353.
[8]LaPatra S E,Roberti K A,Rohovec J S,et al.Fluorescent antibody test for the rapid diagnosis of infectious hematopoietic necrosis[J]. Aquat Anim Health,1989,1:29-36.
[9]世界动物卫生组织(OIE).水生动物疫病诊断手册[M].3版.北京:中国农业出版社,2000:45.
[10]Dixon P R,Hill B J.Rapid detection of fish rhabdoviruses by the enzyme-linked immunosorbent assay(ELISA)[J].Aquaculture, 1984,42:1-12.
[11]Medina D,Chang P,Bradley T,et al.Diagnosis of infectious hematopoietic necrosis in Atlantic salmon Salmo salar by enzymelinked immunosorbent assay[J].Dis Aquat Org,1992,13:147-150.
[12]González M P,Sánchez X,Ganga M A,et al.Detection of the infectious hematopoietic necrosis virus directly from infected fish tissues by dot blot hybridization with a non-radioactive probe[J].J Virol Methods,1997,65:273-279.
[13]Overturf K,Lapatra S,Powell M.Real-time PCR for the detection and quantitative analysis of IHNV in salmonids[J].J Fish Dis, 2001,24:325-333.
[14]Chiou P P,Drolet B S,Leong J C.Polymerase chain amplification of infectious hematopoietic necrosis virus RNA extracted from fixed and embeded fish tissue[J].J Aquat Anim Health,1995,7:9-l5.
[15]Malta A,Sylvia R,Sara L,et al.Nested PCR improves detection of infectious hematopoietic necrosis virus in cells coinfected with infectious pancreatic necrosis virus[J].J Virol Methods,1999,81: 1-9.
[16]Heid C A,Stevens J,Livak K J,et al.Real time quantitative PCR [J].Genome Res,1996,6:986-989.
[17]Lorenzen N,Lorenzen E,Einer-Jensen K,et al.DNA vaccines as a tool for analysing the protective immune response against rhabdoviruses in rainbow trout[J].Fish&Shellfish Immunology,2002, 12(5):439-453.
[18]韩硕,赵前程,吴斌,等.传染性造血器官坏死病毒毒株核蛋白基因片段的克隆及序列分析[J].大连海洋大学学报,2011, 26(3):44-49.
[19]陶然,刘瑞,王晴,等.哈维氏弧菌硫氧还蛋白还原酶在大肠杆菌中的表达及对大菱鲆的免疫保护作用[J].大连海洋大学学报,2012,27(2):45-50.
[20]方珍珍,景宏丽,江育林,等.草鱼呼肠孤病毒VP5蛋白的表达与纯化[J].大连海洋大学学报,2012,27(6):24-28.
[21]Gu Z Y,Weidenhaupt M,Ivanova N,et al.Chromatographic methods for the isolation of,and refolding of proteins from,Escherichia coli inclusion bodies[J].Protein Expre Purif,2002,25(1):174-179.
Prokaryotic expression and polyclonal antibody preparation of glycoprotein gene in infectious hematopoietic necrosis virus
LIU Xue-guang1,ZHENG Huai-dong1,GUO Xin-shuo1,LUO Jin1,LIN Cui-cui1,WANG Qiu-yu2
(1.Bureau of Testing on Aquatic Products Quality Safety of Liaoning Province,Shenyang 110031,China;2.College of Life Sciences,Liaoning University,Shenyang 110036,China)
Abstract:Glycoprotein gene(G)in infectious hematopoietic necrosis virus(IHNV-G)was gained in infectious hematopoietic tissue through a synthetic method.The full length sequence of IHNV-G gene was synthesized and cloned to prokaryotic expression system pET-30a vector.The plasmid pET-30a/IHNV-G was transformed into BL21(DE3)plySs in bacterium Escherichia coli.SDS-PAGE and Western blotting showed that the protein was expressed highly as inclusion body,fusion G protein with molecular weight of 57 000.The serum in rabbits four hours immunized with the fusion G protein was then used for ELISA analyses which showed that the serum had titer of 1∶10 000,indicating that the G protein and anti-serum could be used in research of IHNV detection method, vaccination and protein function.
Key words:IHNV;prokaryotic expression;inclusion body;G protein;antibody
中图分类号:S941.41
文献标志码:A
收稿日期:2013-05-01
基金项目:辽宁省海洋与渔业厅项目 (2011014)
作者简介:刘学光 (1973-),男,高级工程师。E-mail:lxueguang@163.com
文章编号:2095-1388(2013)03-0254-05